Улащик B.C. Физиотерапия. Универсальная медицинская энциклопедия
Подождите немного. Документ загружается.

ЭЛЕКТРОАЭРОЗОЛЬТЕРАПИЯ
частиц в медицинских аэрозольных генера-
торах осуществляется за счет электростати-
ческой индукции. Генераторы электроаэро-
золей бывают камерными и индивидуальны-
ми. Наиболее известны следующие аппара-
ты: «Электроаэрозоль-1», ГЭК-1, ГЭГ-2 и др.
Электроаэрозоли в медицине использу-
ются с лечебно-профилактическими целями
как в виде общих процедур, так и в виде мест-
ных воздействий (см. Электроаэрозолыпе-
рапия).
ЭЛЕКТРОАЭРОЗОЛЬТЕРАПИЯ - ле-
чебно-профилактическое применение аэро-
золей, частицы которых имеют преимущест-
венно отрицательный заряд. В медицинской
практике до последнего времени положи-
тельно заряженные аэрозоли не использова-
лись. Электроаэрозольтерапия имеет неко-
торые преимущества перед аэрозольтерапи-
ей, обусловленные дополнительным дейст-
вием на организм униполярного электричес-
кого заряда и приобретением электроаэро-
золем некоторых положительных свойств
(см. Электроаэрозоли).
Для электроаэрозольтерапии применя-
ются аппараты индивидуального и общего
пользования: «Электроаэрозоль», ГЭИ-1,
ГЭК-1, ГЭГ-2 и др.
Электроаэрозольтерапию проводят как
общую процедуру (электроаэрозольингаля-
ция) и как местное воздействие. Вводимые
ингаляционным путем электроаэрозоли ока-
зывают на организм более выраженное об-
щее действие, активнее влияют на деятель-
ность ЦНС, функции мерцательного эпите-
лия и внешнего дыхания, быстрее проника-
ют в кровь и оказывают системное действие,
обладают десенсибилизирующим и гипотен-
зивным эффектом, сильнее потенцируют
действие ингалируемых веществ.
Методика проведения электроаэрозоль-
ингаляции аналогична методике общей аэро-
зольтерапии. Процедуры проводят ежеднев-
но или через день. На курс лечения назнача-
ют от 5-6 до 12-16 процедур.
Общая аэрозольтерапия применяет-
с я для лечения и профилактики пневмоко-
ниозов, отравлений свинцом и других проф-
заболеваний. Показаниями для электроаэро-
зольингаляции являются также пневмонии
(особенно постгриппозные), бронхиальная
астма, неспецифические заболевания верх-
них дыхательных путей, артериальная ги-
пертензия, атеросклероз на ранних стадиях,
ревматизм и др.
Показаниями для местной электроаэро-
зольтераиии являются ожоги, незаживаю-
щие раны и язвы. После туалета раны про-
водится воздействие электроаэрозолем с
расстояния в 15-20 см. Продолжительность
процедуры в зависимости от площади ране-
вой поверхности от 5 до 15 мин. На курс ле-
чения используют 10-20 процедур. После
процедуры на рану накладывают стериль-
ную повязку. Местная электроаэрозольтера-
пия может быть самостоятельным методом
лечения, в то время как ингаляционная элек-
троаэрозольтерапия обычно является ком-
понентом комплексного лечения больных.
Противопоказания для электро-
аэрозольтерапии те же, что и для аэроионо-
терапии (см.).
ЭЛЕКТРОБЕЗОПАСНОСТЬ ФИЗИО-
ТЕРАПЕВТИЧЕСКОЙ АППАРАТУРЫ -
комплексная система мероприятий, осуще-
ствляемых при разработке, промышленном
выпуске и эксплуатации физиотерапевтиче-
ской аппаратуры и направленных на обеспе-
чение полной электробезопасности для об-
служивающего персонала и пациентов. Не-
обходимость их обусловлена возможностью
поражающего действия электрического то-
ка (см. Электротравма), используемого в
физиотерапевтических аппаратах либо для
лечебного воздействия, либо для обеспече-
ния их энергией.
574
ЭЛЕКТРОГРЯЗЕЛЕЧЕНИЕ
Обеспечение электробезопасности вклю-
чает три основные группы мероприятий: за-
щита от прикосновения к находящимся под
напряжением частям, защита от напряжения
прикосновения, защита пациента.
1. Одно из основных требований электро-
безопасности - исключить возможность слу-
чайного прикосновения к находящимся под
напряжением частям. Поэтому части, нахо-
дящиеся под напряжением, не должны стано-
виться доступными после снятия кожухов,
крышек, задвижек. Исключение делается
для патронов ламп накаливания и предохра-
нителей. В аппаратах обязательно должен
быть обеспечен автоматический разряд кон-
денсаторов после отключения аппарата от
сети. При наличии в аппарате частей, нахо-
дящихся под напряжением, превышающим
1000 В переменного или 1500 В постоянного
тока, на этих частях или рядом с ними дол-
жен быть знак высокого напряжения - крас-
ная стрела молнии. При наличии в аппарате
высоких напряжений следует использовать
блокировки, автоматически отключающие
аппарат от сети при снятии его кожуха или
крышки. Защите от прикосновения к нахо-
дящимся под напряжением частям содейст-
вует и ограничение диаметра (до 12 мм) от-
верстий в корпусе аппарата.
2. Для защиты от напряжения прикосно-
вения применяют различные способы. В за-
висимости от способа защиты физиотера-
певтические аппараты, как и все электроме-
дицинские аппараты с внешним питанием,
делятся на четыре класса. Классы 0I и I пре-
дусматривают защитное заземление или за-
нуление; класс II - защитную изоляцию; класс
III - питание от цепи низкого напряжения (ни-
же 24 В). Класс 0, при котором нет каких-ли-
бо дополнительных мер защиты от напряже-
ния прикосновения, кроме основной изоля-
ции, в изделиях медицинской техники недо-
пустим.
3. Защита пациента в физиотерапевтиче-
ских аппаратах обеспечивается: выполнени-
ем корпусов аппаратов из изолирующего ма-
териала; использованием в них различных
элементов сигнализации; введением в аппа-
раты автоматических процедурных часов;
применением средств контроля за контак-
том электродов и др.
В зависимости от степени защиты от по-
ражения электрическим током изделия меди-
цинской техники, включая и физиотерапев-
тические аппараты, подразделяются на сле-
дующие типы: Н - с нормальной степенью за-
щиты (например, стерилизаторы, лаборатор-
ное оборудование), не находящееся в преде-
лах досягаемости пациента; В - с повышен-
ной степенью защиты (электрокардиографы,
ультразвуковые аппараты и др.); BF - с повы-
шенной степенью защиты и изолированной
рабочей частью (низкочастотная электроле-
чебная аппаратура, стимуляторы и др.); CF -
с наивысшей степенью защиты и изолиро-
ванной рабочей частью (электрокардиости-
муляторы). Конечно, различные виды элек-
тромедицинской аппаратуры отличаются
особенностями обеспечения электробезо-
пасности. Поэтому при эксплуатации прибо-
ров и аппаратов необходимо строго руко-
водствоваться правилами (инструкциями),
изложенными в документации, прилагаемой
к изделиям заводом-изготовителем.
ЭЛЕКТРОГРЯЗЕЛЕЧЕНИЕ - одна из
разновидностей грязелечения, при которой
на организм одновременно воздействуют ле-
чебной грязью и каким-либо электрическим
фактором (электрическим током или по-
лем). Электрогрязелечение имеет ряд досто-
инств и преимуществ перед традиционным
грязелечением. Они могут быть сведены к
следующему:
1) при электрогрязелечении, особенно
при использовании постоянных токов, за-
метно усиливается действие химического
575
ЭЛЕКТРОДИАГНОСТИКА
фактора. Грязь содержит большое количест-
во органических и неорганических ионов,
обладает хорошей электропроводностью и
при прохождении через нее тока происходит
активное введение в организм ряда химичес-
ких веществ. Имеются данные о том, что при
электрогрязелечении в организм вводятся
ионы кальция, калия, натрия, железа, мар-
ганца, хлора, серы, йода и брома, гуминовые
кислоты и некоторые другие высокоактив-
ные органические соединения;
2) при сочетанном использовании пелои-
дов и электротерапевтических факторов
усиливается противовоспалительное, мета-
болическое, трофико-регенераторное дейст-
вие грязелечения, что значительно расширя-
ет возможности его лечебного применения;
3) электрогрязелечение проводится с ис-
пользованием грязей в меньших количествах
и при более низких температурах, а поэтому
оно менее нагрузочно для больных и легче
ими переносится. В этой связи электрогрязе-
лечение может шире использоваться у боль-
ных пожилого возраста и с сопутствующими
заболеваниями, прежде всего с заболеваниями
сердечно-сосудистой и эндокринной систем;
4) электрогрязелечение требует значи-
тельно меньших количеств грязи, а поэтому
оно может быть организовано даже (при от-
сутствии грязелечебницы или грязелечебно-
го отделения) в условиях электротерапевти-
ческого кабинета.
Из методов электрогрязелечения наи-
большее распространение получили гальва-
ногрязелечение (см.), пелоэлектрофорез
(см. Электрофорез грязевого раствора), ди-
адинамогрязелечение (см.), амплипульспе-
лоидотерапия (см. Амплипульсгрязелече-
ние), грязьиндуктотермия (см.).
Показания к применению методов
электрогрязелечения: хронические воспали-
тельные и дегенеративно-дистрофические
заболевания костно-мышечной системы (ар-
триты и полиартриты, деформирующий ос-
теохондроз, спондилоартриты, болезнь Бех-
терева, остеохондроз позвоночника с невро-
логическими проявлениями и др.), хроничес-
кие заболевания периферической и цент-
ральной нервной системы (радикулит, плек-
сит, остаточные явления энцефалита, миели-
та, арахноидита и др.), последствия травм ко-
стно-мышечной и нервной систем, хроничес-
кие воспалительные заболевания органов
пищеварения, дыхания и женских половых
органов, некоторые болезни кожи (экзема,
нейродермит, чешуйчатый лишай, склеро-
дермия и др.), рубцово-спаечные процессы
различной локализации.
Противопоказания к электрогря-
зелечению складываются из общих противо-
показаний к назначению физических факто-
ров и частных противопоказаний к примене-
нию грязелечения и электротерапевтических
методов, входящих в сочетанное воздействие.
ЭЛЕКТРОДИАГНОСТИКА исследо-
вание возбудимости нервно-мышечного аппа-
рата с помощью различных видов электриче-
ских токов, позволяющее при патологии оп-
ределить топику и характер поражения, оце-
нить степень его тяжести, судить о прогнозе и
эффективности проводимого лечения.
Наиболее простой и доступной является
классическая электродиагностика, при про-
ведении которой используются ритмический
постоянный (гальванический) и тетанизиру-
ющий токи. Под тетанизирующим понима-
ют импульсный ток треугольной формы ча-
стотой 100 Гц и длительностью 1 мс. Иссле-
дование проводят в так называемых элект-
родвигательных точках нервов и мышц, или
точках Эрба (см. Тонки двигательные).
Двигательная точка нерва представляет со-
бой тот участок кожи, где нерв расположен
наиболее поверхностно и поэтому доступен
для исследования. Двигательная точка
мышцы - место проекции внедрения нерв-
576
ЭЛЕКТРОДИАГНОСТИКА
ных волокон в мышцу. В норме при раздра-
жении нервов и мышц в момент замыкания
и размыкания гальванического тока возни-
кает двигательная реакция - молниеносное
одиночное сокращение. На тетанизирую-
щий ток двигательный нерв и мышца отве-
чают слитным сокращением, длящимся в
течение всего времени прохождения тока.
Пороговая сила гальванического тока (рео-
база), при которой наступает сокращение
мышц, колеблется в пределах 1,5-6 мА. При
одинаковой пороговой силе тока сокраще-
ние сильнее на катоде. О сохранности нерв-
но-мышечного аппарата свидетельствует
полярная формула Бреннера - Пфлюгера:
КЗС > АЗС > АРС > КРС (катодзамыка-
тельное сокращение больше анодзамыка-
тельного, больше анодразмыкательного,
больше катодразмыкательного). Для тета-
низирующего тока пороговая сила состав-
ляет 4-8 мА, а мышечное сокращение носит
тетанический характер. Исследование тета-
низирующим током проводят только на ка-
тоде, гальваническим - с двух полюсов.
Нарушение проводимости по перифери-
ческим нервам или поражение мотонейро-
нов передних рогов спинного мозга, приводя-
щее к дегенеративному перерождению
мышц, так называемому вялому (перифери-
ческому) парезу (параличу), характеризует-
ся определенными электродиагностически-
ми признаками. Различают количественные
(понижение или повышение) и качествен-
ные (точнее, количественно-качественные)
изменения электровозбудимости. При коли-
чественном понижении возбудимости на-
блюдаются увеличение реобазы, повышен-
ная утомляемость мышц и постепенное ос-
лабление силы сокращений при ритмичес-
ком замыкании тока. Оно отмечается при
повреждениях периферического мотонейро-
на в легкой степени, миопатиях, мышечной
гипотрофии, связанной с длительной иммо-
билизацией конечностей, и др. Количествен-
ное повышение возбудимости характеризу-
ется понижением реобазы в исследуемых
точках на стороне поражения, а также ирра-
диацией возбуждения на соседние группы
мышц, или синкинезиями. Этот тип наруше-
ния электровозбудимости характерен для ге-
миспазма, блефароспазма, писчего спазма,
спазмофилии, столбняка.
Качественные нарушения электровозбу-
димости проявляются изменением характера
мышечных сокращений. Последние стано-
вятся вялыми, червеобразными, может вы-
падать одна из фаз движения. К грубым ка-
чественным изменениям относится полная
невозбудимость мышц, которая при отсутст-
вии лечения развивается спустя 3-6 месяцев
после полной денервации.
В зависимости от выраженности качест-
венных и количественных изменений элект-
ровозбудимости различают частичную и
полную реакцию перерождения. Частичная
реакция перерождения (ЧРП) условно де-
лится на два типа - А и Б. ЧРП типа А обна-
руживается при поражении более легкой
степени. В этом случае сохраняется ответная
реакция с нерва и мышцы на постоянный и
тетанизирующий токи, но вследствие нару-
шения проводимости нервов сокращения
мышц вялые. Реобаза повышена незначи-
тельно. Полярная формула сокращений
обычно не изменена. ЧРП типа Б соответст-
вует более грубым нарушениям электровоз-
будимости. Двигательная реакция с нерва и
мышцы сохранена только на постоянный
ток, а на тетанизирующий - отсутствует. Со-
кращения вялые, червеобразные, неполные по
объему. Может изменяться полярная формула
сокращения: КЗС = АЗС или КЗС < АЗС. Ча-
ще отмечается количественное снижение
электровозбудимости.
Полная реакция перерождения (ПРП) ха-
рактеризуется отсутствием двигательной ре-
577
ЭЛЕКТРОДИАГНОСТИКА
акции на раздражение нерва постоянным и
тетанизирующим токами. В течение первых
нескольких месяцев денервированная мыш-
ца способна отвечать вялым, червеобразным
сокращением только на постоянный ток, за-
тем перестает реагировать даже на ток боль-
шой силы, т.е. наступает полная утрата воз-
будимости.
Обнаружение качественных изменений
электровозбудимости свидетельствует о гру-
бом поражении перифериферического мо-
тонейрона. Они встречаются при тяжелых
травматических, воспалительных и токсиче-
ских поражениях периферических нервов,
миелополирадикулоневритах, боковом амио-
трофическом склерозе, интрамедуллярных
опухолях и др.
При центральном парезе со спазмирован-
ных мышц выявляются следующие электро-
диагностические признаки: тонический ха-
рактер сокращений, постепенное нарастание
их силы при ритмическом замыкании тока,
появление во время исследования патологи-
ческих и защитных рефлексов.
При поражении периферического двига-
тельного нейрона первое электродиагности-
ческое исследование выполняют не ранее
чем через 10-14 дней от начала заболевания.
Классическую электродиагностику прово-
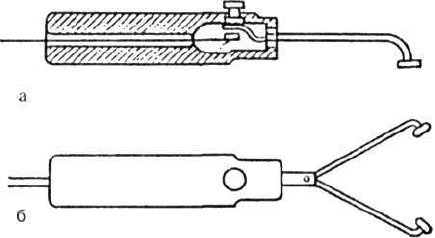
дят по моно- или биполярной методике. При
монополярном воздействии активный точеч-
ный электрод площадью 1 см
2
с кнопочным
прерывателем располагают на двигательной
точке, индифферентный (площадью 200 см
2
) -
на соответствующей сегментарной зоне или
на противоположной конечности. Исследо-
вание биполярным точечным электродом
(рис.) проводят в основном при атрофии
мышц. Используют ручной точечный элект-
род с двумя разводными равновеликими
браншами, которые располагают по направ-
лению хода мышцы. При этом катод поме-
щают на двигательной точке мышцы, анод -
в месте перехода мышцы в сухожилие. Рео-
базу на постоянный ток определяют на като-
де и аноде, на тетанизирующий ток - на ка-
тоде. Далее оценивают полярную формулу и
характер мышечных сокращений. В качест-
ве нормальных показателей используют ре-
зультаты исследования, предварительно
проведенного на здоровой стороне. При дву-
стороннем поражении используют специаль-
ные таблицы электровозбудимости двига-
тельных точек различных нервов (таблицы
Штинцинга). Для лучшей визуализации ре-
акций на исследуемые участки направляют
свет от лампы-соллюкс.
Определенное диагностическое значение
имеет исследование миотонической и миа-
стенической реакций. При положительной
миотонической реакции мышца быстро со-
кращается, длительно находится в состоянии
тонического сокращения и медленно, в тече-
ние 3-8 с и более, расслабляется после пре-
кращения подачи тетанизирующего тока.
Исследование проводят со сгибательных
групп мышц конечности (см. Миотоничес-
кая реакция).
При миастении равномерное ритмичес-
кое замыкание тетанизирующего тока
(40-60 замыканий) в области двигательной
точки мышцы приводит к тому, что ее со-
кращения вначале ослабевают, а затем пре-
кращаются. После отдыха двигательная ре-
акция восстанавливается. Исследование про-
водят (на разгибателях конечности, круго-
Электроды для электродиагностики: а - однополюс-
ный; б - двухполюсный
578
ЭЛЕКТРОЛИЗ
вой мышце глаза, мышце, сморщивающей
бровь) в два этапа: без применения антихо-
линэстеразных веществ и через 30-40 мин
после введения прозерина. При наличии по-
ложительной миастенической реакции после
введения прозерина патологическая утомля-
емость мышц уменьшается или исчезает (см.
Миастеническая реакция),
В последние годы в физиотерапевтичес-
кой практике широко используются и дру-
гие, более сложные методы оценки состоя-
ния нервно-мышечного аппарата (расширен-
ная электродиагностика, определение кри-
вой «сила - длительность», хронаксиметрия,
электродиагностика с помощью синусои-
дальных модулированных токов и др.), кото-
рые позволяют с большей точностью опре-
делить глубину поражения и судить об эф-
фективности проводимых лечебных меро-
приятий.
ЭЛЕКТРОДЫ - различные по конструк-
ции и назначению проводники, используе-
мые во всех электротехнических аппаратах,
приборах и устройствах. Широко применя-
ются в медико-биологических исследованиях
для измерения биоэлектрических потенциа-
лов, изучения электропроводности биологи-
ческих систем и проводимости нервной тка-
ни, измерения рН и концентрации (активно-
сти) ионов в растворах. Различные по уст-
ройству электроды используются в электро-
лечении.
Электроды, в т.ч. и используемые в ме-
дицине, разнообразны по устройству, раз-
мерам, форме и материалу, из которого они
изготовлены. При электрокардиографии,
электроэнцефалографии и других электро-
диагностических методах обычно использу-
ют относительно большие по размерам пла-
стинчатые поверхностные электроды из не-
коррозирующих металлов. При электроми-
ографии применяют игольчатые электроды
из химически инертных материалов. В фи-
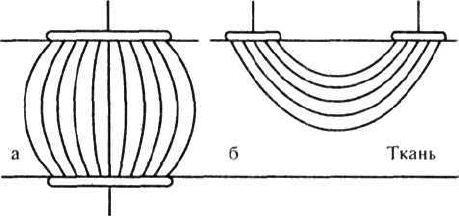
Схема поперечного (а) и продольного (б) расположе-
ния электродов при гальванизации
зиологических экспериментах чаще исполь-
зуют микроэлектроды, металлический ко-
нец которых имеет диаметр в несколько ми-
крометров, или стеклянные капилляры, за-
полненные солевым раствором. При изуче-
нии электропроводности биологических си-
стем и кондуктометрических измерениях
применяют платиновые электроды, покры-
тые платиновой чернью с губчатой структу-
рой, что значительно увеличивает площадь
их поверхности. В физиотерапии пользуют-
ся электродами различной формы и устрой-
ствами, изготавливаемыми из нержавею-
щей стали, свинца, углеродистой ткани, уг-
ля, токопроводящей резины и других мате-
риалов. На теле пациента они могут распо-
лагаться продольно или поперечно (рис.).
ЭЛЕКТРОЛИЗ - совокупность процес-
сов, происходящих в растворах (расплавах)
при прохождении через них постоянного
электрического тока. Количественные соот-
ношения между электрической энергией и
вызванными ею химическими превращения-
ми впервые были установлены М. Фарадеем
(см. Фарадей М.) в 1833-1834 гг. Он сформу-
лировал основные законы электролиза (за-
коны Фарадея): 1) количества веществ, вы-
деленных или растворенных на электродах,
прямо пропорциональны их химическим эк-
вивалентам, а также количеству электриче-
ства, прошедшего через электролит; 2) для
выделения грамм-эквивалента любого веще-
ства всегда требуется одно и то же количест-
579
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
во электричества, равное 96500 кулон (число
Фарадея).
При электролизе на аноде ионы и моле-
кулы электролита или материала электро-
да отдают электроны (окисляются), а на ка-
тоде - принимают электроны (восстанавли-
ваются). На катоде обычно происходит раз-
ряд ионов металлов и водорода (например,
Сu
2+
+ 2 e -> Сu; 2Н
+
+ 2 е -> Н
2
). Характер
анодных процессов зависит от материала
анода. В случае растворимых анодов, изго-
товленных из серебра, меди, цинка, кадмия,
атомы металла отдают электроны во внеш-
нюю электрическую цепь и становятся кати-
онами, т.е. происходит растворение анода:
Ag -> e + Ag
+
. На нерастворимых анодах, из-
готовленных из иридия, платины, графита,
чаще всего отмечают разряд анионов: 2С1
-
+
+ 2 e -> С1
2
. Некоторые материалы (железо,
никель, кобальт, золото, хром, алюминий,
олово) могут быть при различных условиях
как растворимыми, так и нерастворимыми
электродами.
Для выделения какого-либо иона в виде
свободного вещества необходимо прило-
жить к электроду потенциал, хотя бы незна-
чительно превышающий собственную элек-
тродвижущую силу гальванической пары,
образуемой в результате электролиза. Это
так называемые потенциалы разложения,
разряда или выделения. Рассмотренные про-
цессы называют первичными, и по своей
природе они являются окислительно-восста-
новительными. За первичными электрод-
ными процессами нередко протекают вто-
ричные, чисто химические реакции: образо-
вание молекул из атомов газов, выделяю-
щихся на электродах; образование и рост
кристаллов металлов и образование сплош-
ных металлических осадков; взаимодейст-
вие продуктов электролиза друг с другом, с
электролитом, растворителем или примеся-
ми и т.д.
Электролиз с целью получения опреде-
ленных продуктов проводят в специальных
аппаратах - электролизерах, электролити-
ческих ваннах, ячейках. Для исключения вза-
имодействия продуктов электролиза, обра-
зующихся на электродах, электролизер де-
лят на две (и более) части пористой диафраг-
мой из асбеста, керамики, ионообменных
мембран, проницаемых только для ионов
электролита. В этом случае раствор в анод-
ном пространстве называют анолитом, в ка-
тодном - католитом.
Количества катионов и анионов, разря-
жающихся на электродах, эквивалентны.
Однако на пути к электродам скорости кати-
онов и анионов неодинаковы, т.к. эти ионы
обладают различными подвижностями.
Вследствие этого вблизи каждого электрода
происходит изменение концентрации элект-
ролита. Ион, движущийся с большей скоро-
стью, переносит большее количество элект-
ричества. Если через электролит пропуска-
ют определенное количество электричества,
например F кулонов, то доли количества
электричества, переносимого катионами и
анионами, можно вычислить из выражения:
F = Fn
+
+ Fn
-
(где n - числа переноса иона).
Электролиз сопутствует многим элект-
ротерапевтическим процедурам (гальвани-
зация, лекарственный электрофорез), хотя и
имеет свои особенности (B.C. Улащик, 1963-
1976). В промышленности электролиз ис-
пользуют для получения многих металлов,
газов и органических соединений, нанесения
различных покрытий (гальванотехника), в
аналитической химии.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИ-
АЦИЯ - распад молекул растворенных ве-
ществ на ионы в результате взаимодействия
с растворителем (например, водой). Обус-
ловливает ионную проводимость растворов.
Количественной мерой электролитической
диссоциации является степень диссоциации,
580
ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ
которая может изменяться от 0 до 1. Теория
электролитической диссоциации предложе-
на в 1887 г. Сванте Аррениусом (см. Аррени-
ус С.А.). Согласно Аррениусу при растворе-
нии в воде молекулы электролитов разлага-
ются на ионы, т.е. диссоциируют по обрати-
мой реакции, например: NaCl <-> Na
+
+ Cl
-
.
Наличие в растворах ионов является причиной
прохождения через них электрического тока.
Электролитическая диссоциация являет-
ся источником ионов и в биологических тка-
нях; она во многом определяет электричес-
кие свойства их, а также закономерности
взаимодействия с электрическими фактора-
ми. Теория электролитической диссоциации
положила начало научному этапу развития
лекарственного электрофореза (см. Элект-
рофорез лекарственных веществ), уточне-
нию полярности введения в организм лекар-
ственных веществ электрическим током.
ЭЛЕКТРОЛИТЫ - вещества, способные
в твердом, расплавленном или жидком со-
стоянии благодаря наличию ионов прово-
дить электрический ток. Электролиты явля-
ются непременными составными частями
растительных и животных организмов, где
они участвуют в функционировании боль-
шинства жизненно важных систем. Концент-
рация отдельных электролитов в сыворотке
крови, моче и других биологических жидкос-
тях служит важным диагностическим тестом
при ряде заболеваний сердца и сосудов, эндо-
кринных органов, почек и др., поскольку об-
мен воды и электролитов играет в патогене-
зе и клинических проявлениях многих болез-
ней важную роль.
К электролитам, распадающимся на ионы
в растворах, относятся низкомолекулярные
соли, кислоты и основания, высокомолеку-
лярные соединения, или полиэлектролиты
(белки, нуклеиновые кислоты, фосфатиды и
др.), а также вещества, при растворении да-
ющие коллоидные растворы.
Распад электролитов на ионы происхо-
дит вследствие взаимодействия растворен-
ного вещества с растворителем и называет-
ся электролитической диссоциацией (см.).
Для ее количественной характеристики ис-
пользуется степень диссоциации - отноше-
ние числа диссоциированных молекул к ис-
ходному числу недиссоциированных моле-
кул. Динамическое равновесие между недис-
социированными молекулами и ионами опи-
сывается законом действующих масс. Сте-
пень диссоциации зависит от концентрации
и природы вещества, растворителя и темпе-
ратуры.
Степень диссоциации является важным
фактором, определяющим эффективность
физиологического действия биологически
активных веществ и лекарств.
По степени диссоциации электролиты ус-
ловно делят на слабые и сильные. Группа
слабых электролитов включает почти все
органические соли, кислоты и основания, а
также вещества, образующие многозаряд-
ные ионы. К сильным электролитам относят
вещества, полностью диссоциирующие на
ионы и не образующие ассоциатов (мине-
ральные соли щелочных и щелочно-земель-
ных металлов, галогениды и др.).
ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ - осо-
бая форма материи, посредством которой
осуществляется взаимодействие между элек-
трически заряженными частицами.
В вакууме электромагнитное поле ха-
рактеризуется вектором напряженности
электрического поля (Е) и магнитной ин-
дукцией (В), которые соответственно опре-
деляют силы, действующие со стороны поля
на неподвижные и(или) движущиеся заря-
женные частицы; в среде, например в тка-
нях, - дополнительно магнитными величи-
нами: напряженностью магнитного поля (Н)
и электрической индукцией (Д). При уско-
ренном движении заряженных частиц элект-
581
ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ
ромагнитное поле излучается в виде кван-
тов (фотонов) и существует в виде электро-
магнитных волн, которые представляют со-
бой взаимосвязанные изменения напряжен-
ности электрических и магнитных полей.
Основными параметрами электромагнит-
ной волны (электромагнитного излучения)
являются: длина волны (А.) - расстояние, на
которое распространяется волна за один пе-
риод (Т); частота колебаний (f) - число ко-
лебаний за одну секунду; скорость (С) рас-
пространения электромагнитной волны,
равная λ/Т.
По источнику возникновения электро-
магнитные излучения подразделяются на из-
лучения искусственного и естественного
(земные, солнечные, галактические) проис-
хождения. К последним должны быть отне-
сены также электромагнитные колебания,
возникновение которых связано с протека-
нием процессов жизнедеятельности на раз-
личных уровнях организации живых систем.
Особенностью искусственных электромаг-
нитных излучений является их высокая вре-
менная и пространственная когерентность,
обусловливающая возможность концентра-
ции энергии в узких областях спектра, тогда
как для естественных характерен широкий
спектр частот.
При гигиенической оценке электромаг-
нитных полей ближней (зона индукции) и
промежуточной зон учитывают напряжен-
ность электрической (В/м) и магнитной
(А/м) составляющих. В дальней (волновой)
зоне электромагнитное поле оценивают по
плотности потока мощности (энергии), ко-
торая выражается в Вт/м
2
или кратных вели-
чинах (мВт/см
2
, мкВт/см
2
).
При воздействии электромагнитного по-
ля на организм основным действующим
фактором является наведенный ток или на-
веденное внутреннее поле. Их параметры и
распределение в теле человека зависят от
частоты электромагнитных колебаний,
формы и размеров тела и его ориентации
относительно векторов напряженности эле-
ктрического и магнитного полей, а особен-
но электрических свойств тканей. Одними
из основных показателей, характеризующих
электрические свойства биологических тка-
ней, являются их диэлектрическая постоян-
ная и магнитная проницаемость (см.). В ос-
нове действия электромагнитных полей на
организм лежит их влияние на электрически
заряженные частицы веществ, из которых
состоят живые ткани. Поглощение их энер-
гии в тканях преимущественно определяет-
ся двумя процессами: колебанием свобод-
ных зарядов и колебанием дипольных моле-
кул с частотой действующего поля. Первый
процесс приводит к потерям энергии за счет
электрического сопротивления среды, вто-
рой - за счет трения дипольных молекул в
вязкой среде. Оба процесса ведут к образо-
ванию тепла и обеспечивают в основном не-
специфический тепловой компонент дейст-
вия электромагнитных полей. Специфичес-
кий компонент действия, преимущественно
присущий электромагнитным полям ульт-
равысокой и сверхвысокой частот, заклю-
чается в различных внутримолекулярных
физико-химических процессах или струк-
турных перестройках, которые могут изме-
нять функциональное состояние клеток и
тканей. В основе специфических эффектов
электромагнитных полей преимущественно
лежит резонансный механизм их поглоще-
ния. Названные первичные сдвиги, вызван-
ные поглощением энергии электромагнит-
ных полей, приводят к разветвленной цепи
закономерных изменений в различных ор-
ганах и тканях, что и определяет возмож-
ность применения этого фактора в лечебно-
профилактических целях. Энергия электро-
магнитных полей широко используется в
радиосвязи, телевидении, радиолокации;
582
ЭЛЕКТРОПРОВОДНОСТЬ
для осуществления различных технологиче-
ских процессов и операций (нагрева, сварки,
напыления металлов, сушки различных ма-
териалов, диэлектрической обработки
пластмасс), для таких видов термообработ-
ки пищевых продуктов, как разморажива-
ние, стерилизация, сублимация, а также в
научных исследованиях. В физиотерапии
энергия электромагнитных полей широко и
эффективно используется в различных ме-
тодах (см. Высокочастотная электроте-
рапия) с лечебными, профилактическими и
реабилитационными целями.
ЭЛЕКТРОН (e) - стабильная отрица-
тельно заряженная элементарная частица.
Открыт в 1897 г. английским физиком Джо-
зефом Томпсоном (1856-1940). Заряд одного
электрона является наименьшим возмож-
ным электрическим зарядом - элементар-
ным электрическим зарядом. Он равен
4,802 • 10
-10
электростатистических единиц,
или 1,602 • 10
-19
кулон. Электрон имеет мас-
су, которая приблизительно в 1840 раз мень-
ше массы атома водорода и равна 9,1 • 10
-28
г.
Диаметр электрона равен 10
-12
- 10
-13
см.
Электрон является одним из основных
структурных элементов вещества. В про-
стейшем виде атом любого вещества может
быть представлен в виде центрального ядра,
в котором сосредоточены все положитель-
ные заряды и почти вся масса атома, и вра-
щающихся вокруг него по круговым или эл-
липтическим орбитам электронов (как пла-
неты вокруг Солнца). Число электронов в
атоме соответствует его порядковому номе-
ру в периодической системе химических эле-
ментов Д.И. Менделеева и равно числу поло-
жительно заряженных частиц-протонов.
Электроны могут легко покидать атомы под
действием небольших энергий (нагревание,
облучение ультразвуковыми лучами и др.).
Когда атом отдает часть своих электронов,
он превращается в ион, несущий положи-
тельный заряд, равный числу отданных эле-
ктронов. Максимальное число положитель-
ных зарядов, которое может приобрести
атом таким путем, естественно, не может
превышать число содержащихся в нем элек-
тронов. Присоединяя электроны, атом пре-
вращается в отрицательно заряженный ион,
заряд которого равен числу принятых элек-
тронов. Электроны атомов, расположенные
определенным образом по электронным
оболочкам, определяют оптические, элект-
рические, магнитные, химические и иные
свойства атомов и молекул. Изменение этих
свойств под влиянием физических факторов
во многом определяет первичное (физико-
химическое) действие многих физиотерапев-
тических методов.
ЭЛЕКТРОПРОВОДНОСТЬ способ-
ность веществ проводить электрический
ток, обусловленная наличием в них подвиж-
ных заряженных частиц (электронов, ионов
и др.). Электропроводность (L) является ве-
личиной, обратной электрическому сопро-
тивлению (R).
При подаче на объект разности потенци-
алов (U) через него потечет электрический
ток силой (I), величина которой пропорцио-
нальна электропроводности (L):
I = L
•
U или I = U / R.
Величина электропроводности зависит
от количества электрических зарядов и их
подвижности. Чем больше количество заря-
дов и их подвижность, тем больше электро-
проводность.
Вещества по отношению к постоянному
току делят на проводники и диэлектрики.
Проводники электрические - вещества, хо-
рошо проводящие электрический ток благо-
даря наличию в них большого количества
подвижных заряженных частиц. Они делятся
на электронные (металлы), ионные (элект-
ролиты) и смешанные, где имеет место дви-
жение как электронов, так и ионов (напри-
583
