Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 381
прочно
связывающийся конкурентный ингибитор L-бензилсук-
цинат.
Этот ингибитор не вытеснял из фермента циннамоильный
остаток, указывая на то, что последний связан ковалентно.
Имеются
данные, что это ковалентное промежуточное соедине-
ние
является ангидридом кислоты: при частичной денатурации
ацилфермента мочевиной происходит деацилирование с кон-
стантой скорости, отвечающей гидролизу ангидрида кислоты.
Результаты
другого
недавно проведенного эксперимента, в
котором исследовался изотопный обмен [124], свидетельствова-
ли
против образования ацилфермента. Если гидролиз протекает
по
схеме
(12.25)
(с образованием ангидрида), то для синтеза
пептида в
ходе
обратной реакции необходимо предварительное
образование ангидрида из фермента и RCOJ. Следовательно,
фермент должен обладать способностью катализировать обмен
18
О
между
субстратом и водой [схема (12.27)]. Однако без
RC
18
O
2
+E—COJ
~Y Е—CO
2
18
OCR т— RCO
18
CT + Е—COJ
н
2
'«о
н
2
о
(1227)
добавления свободной аминокислоты
ЫНЗСН(Д')СОГ
обмена не
происходит, он имеет место лишь в ее присутствии в
результате
синтеза пептида в
ходе
обратной реакции. Обмен не стимулиру-
ется аналогом указанной кислотыHOCH(R')CO2. Все эти дан-
ные
исключают возможность протекания реакции через образо-
вание ангидрида, если только не предположить, что добавляе-
мая
аминокислота (но не ее гидроксилсодержащий аналог)
является активатором реакции обмена или высвобождающаяся
в
ходе
реакции
(12.27)
Нг
8
О не обменивается со средой, оста-
ваясь связанной с ферментом. Все сказанное выше вместе с
данными
о том, что метанол не может заменить
воду
в реакции
сольватации, привели к механизму, представленному на стр. 382
[124].
Этот механизм объясняет неспособность метанола заменить
воду,
поскольку промежуточное соединение III имеет два отри-
цательно заряженных атома кислорода. Гидроксильная группа
Туг-248,
вероятно, выступает в роли «мостика» при переносе
протона от гидроксильной группы тетраэдрического промежу-
точного соединения II на атом азота.
Возможно, результаты описанных экспериментов и не проти-
воречат
друг
другу.
Имея в виду упоминавшиеся ранее данные
о
том, что химическая модификация фермента или вытеснение
иона
металла по-разному сказываются на активности эстеразы
и
пептидазы, можно предположить, что гидролиз эфира корич-
ной
кислоты протекает через образование ацилфермента,
тогда
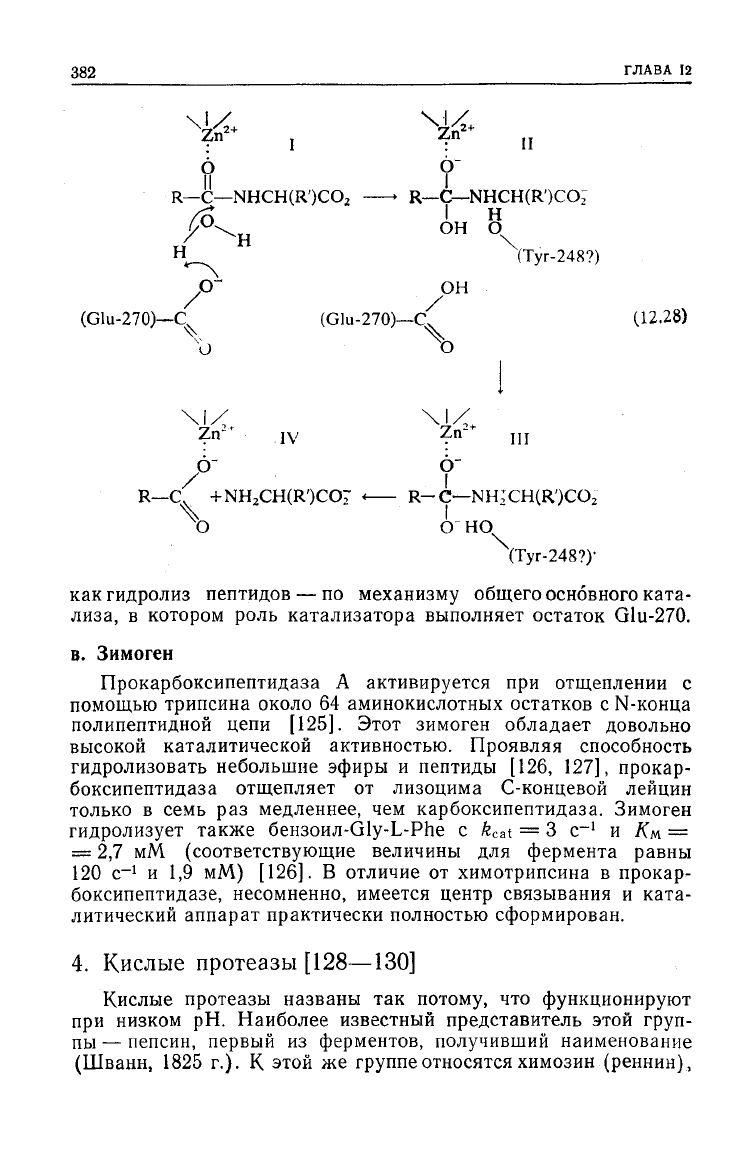
382
ГЛАВА
12
О"
R—С—NHCH(R')CO
2
•
R—С—NHCH(R')CO2
Н
(Tyr-248?)
О"
ОН
(Glu-270)—С. (Glu-270)—С
ч
(12.28)
?n
iv 4
n
III
6" 6"
R—С
+NH
2
CH(R')COT
<
R-C—NH;CH(R')CO
2
О О" НО
(Tyr-248?)-
как
гидролиз пептидов
— по
механизму общего основного ката-
лиза,
в
котором роль катализатора выполняет остаток Glu-270.
в.
Зимоген
Прокарбоксипептидаза
А
активируется
при
отщеплении
с
помощью трипсина около
64
аминокислотных остатков
с
N-конца
полипептидной цепи [125]. Этот зимоген
обладает
довольно
высокой каталитической активностью. Проявляя способность
гидролизовать небольшие эфиры
и
пептиды
[126, 127],
прокар-
боксипептидаза отщепляет
от
лизоцима С-концевой лейцин
только
в
семь
раз
медленнее,
чем
карбоксипептидаза. Зимоген
гидролизует
также бензоил-Gly-L-Phe
с
A
C
at
= 3 c
-1
и Км =
=
2,7 мМ
(соответствующие величины
для
фермента равны
120
с"
1
и 1,9 мМ)
[126].
В
отличие
от
химотрипсина
в
прокар-
боксипептидазе, несомненно, имеется центр связывания
и
ката-
литический аппарат практически полностью сформирован.
4. Кислые протеазы
[128—130]
Кислые протеазы названы
так
потому,
что
функционируют
при
низком
рН.
Наиболее известный представитель этой
груп-
пы
—
пепсин, первый
из
ферментов, получивший наименование
(Шванн,
1825 г.). К
этой
же
группе относятся химозин (реннин),

СТРУКТУРА И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 383
катепсин D,
Rhizopus-пепсш
(выделенный из
Rhizopus
chinensis)
и пенициллопепсин (выделенный из
Penicillium
janthinellum).
Гомологичны
между
собой пепсин, химозин и
пенициллопепсин [131, 132]. Определена
структура
нескольких
ферментов, но лишь при низком разрешении [133, 134]. Правда,
недавно
структура
пепсина уточнена с разрешением 2,7 А
[135], а
структура
пенициллопепсина [136] —с разрешением
2,8 А. О механизме действия пепсина и пенициллопепсина из-
вестно гораздо меньше, чем о механизме действия любой дру-
гой кислой протеазы; нет
даже
никакой простой химической
модели, которая могла бы
служить
руководством при исследо-
вании.
Рассмотренные ниже данные относятся к обоим фер-
ментам, близким по
структуре
и по своим кинетическим свой-
ствам.
а.
Пепсин
Пепсин,
мол. вес которого равен 34 644, состоит из един-
ственной полипептидной цепи, содержащей 327 аминокислотных
остатков [137, 138].
Ser-68
фосфорилирован, однако удаление
фосфата не приводит к существенным изменениям каталитиче-
ских свойств фермента [139]. Как и у
других
кислых протеаз,
активный центр пепсина занимает обширную область, в которую
может поместиться по крайней мере четыре-пять, а возможно, и
до семи остатков молекулы
субстрата
[140, 141]. Наиболее
благоприятной для функционирования пепсина является такая
ситуация, когда по обе стороны от расщепляемой связи нахо-
дятся гидрофобные аминокислоты. Статистический анализ про-
цесса расщепления связей в белках показывает, что подцентр
Si специфичен к лейцину, фенилаланину, триптофану и
глутама-
ту (!), а подцентр Si — к триптофану, тирозину, изолейцину и
фенилаланину [141]. Пепсин, как правило, негидролизует эфи-
ры;
исключение составляют эфиры L-p-фенилмолочной кислоты
и
некоторые эфиры сернистой кислоты.
1.
Механизм
действия
пепсина.
Пепсин имеет два катали-
тически активных остатка —
Asp-32
и
Asp-215.
Их ионизацию
можно исследовать, воспользовавшись рН-зависимостью актив-
ности фермента, оптимум которой находится при рН 2—3 и
определяется ионизацией кислой формы группы с рК
я
~ 4,5 и
основной формы группы с р/Са — 1,1 [142, 143]. Значения рКа
идентифицированы с помощью опытов по связыванию необрати-
мых ингибиторов, способных специфически взаимодействовать с
ионизированными
или неионизированными карбоксильными
группами. Диазосоединения типа метилового эфира N-диазоа-
цетил-Ь-фенилаланина, взаимодействующие с неионизирован-
ными
карбоксильными группами, специфически
реагируют
с
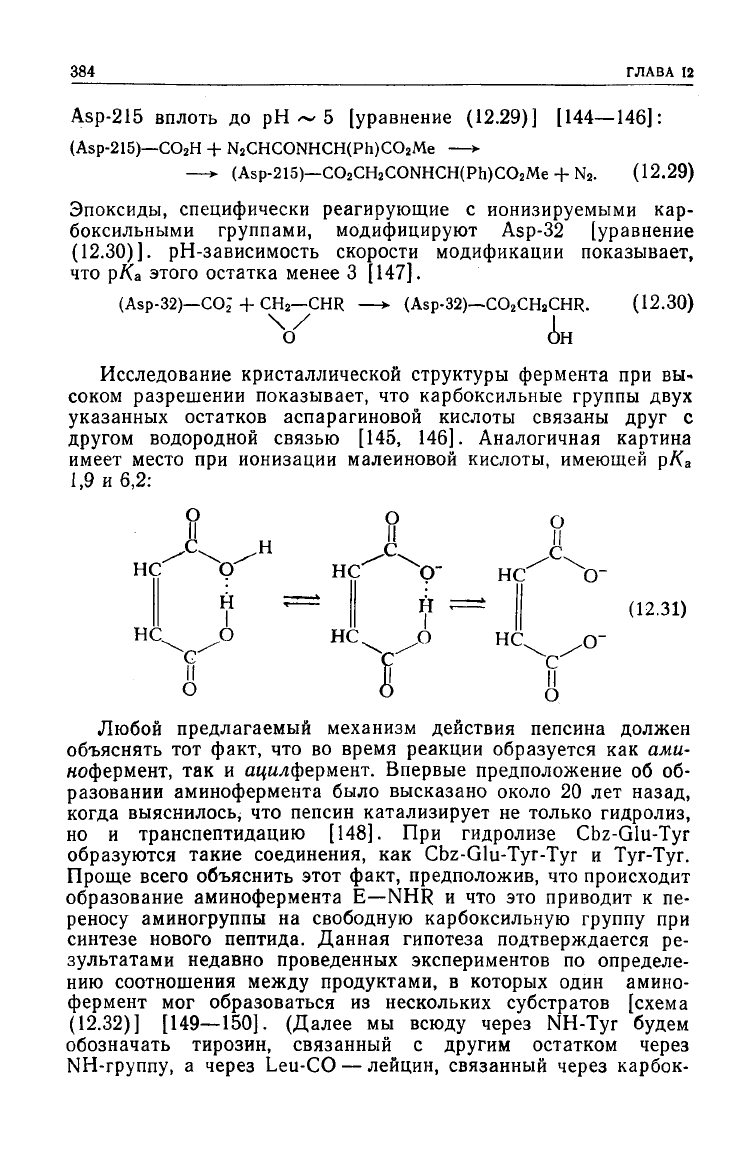
384
ГЛАВА
12
Asp-215
вплоть до рН ~ 5 [уравнение
(12.29)]
[144—146]:
(Asp-215)—CO
2
H +
N
2
CHCONHCH(Ph)CO
2
Me
—•
—>
(Asp-215)—CO
2
CH
2
CONHCH(Ph)CO
2
Me + N».
(12.29)
Эпоксиды,
специфически реагирующие с ионизируемыми кар-
боксильными
группами, модифицируют
Asp-32
[уравнение
(12.30)]. рН-зависимость скорости модификации показывает,
что рКа этого остатка менее 3 [147].
(Asp-32)—СО," +
СН
2
—CHR
—• (Asp-32)—CO
2
CH
2
CHR.
(12.30)
\/ 1
О ОН
Исследование кристаллической структуры фермента при вы-
соком
разрешении показывает, что карбоксильные группы
двух
указанных остатков аспарагиновой кислоты связаны
друг
с
другом
водородной связью [145, 146]. Аналогичная картина
имеет место при ионизации малеиновой кислоты, имеющей рК
а
1,9 и 6,2:
НС
Н(
i
Г
О
,н
Q"
н
о
НС
НС.
О"
н
о
л.
НС
О"
(12.31)
не
с
II
о
Любой предлагаемый механизм действия пепсина должен
объяснять тот факт, что во время реакции образуется как ами-
«офермент, так и
ацилфермент.
Впервые предположение об об-
разовании
аминофермента было высказано около 20 лет назад,
когда выяснилось, что пепсин катализирует не только гидролиз,
но
и транспептидацию [148]. При гидролизе Cbz-Glu-Tyr
образуются такие соединения, как Cbz-Glu-Tyr-Tyr и
Туг-Туг.
Проще
всего объяснить этот факт, предположив, что происходит
образование аминофермента
Е—NHR
и что это приводит к пе-
реносу аминогруппы на свободную карбоксильную группу при
синтезе нового пептида. Данная гипотеза подтверждается ре-
зультатами недавно проведенных экспериментов по определе-
нию
соотношения
между
продуктами, в которых один амино-
фермент мог образоваться из нескольких субстратов [схема
(12.32)]
[149—150]. (Далее мы
всюду
через NH-Tyr
будем
обозначать тирозин, связанный с другим остатком через
NH-rpynny,
а через Leu-CO — лейцин, связанный через карбок-

СТРУКТУРА
И
МЕХАНИЗМ
ДЕЙСТВИЯ
ОТДЕЛЬНЫХ
ФЕРМЕНТОВ
386
сильную группу.
Е—ОН + RCO—(NH-Tyr) —>
R'CO
2
H
Е—ОН + R'CO— (NH-Tyr)
Е—(NH-Tyr) — н
2
о
(12.32)
Е—ОН + NH
2
-Tyr
R'CO
2
H
Предположение об образовании ацилфермента как проме-
жуточного соединения было высказано в 1962 г., когда выясни-
лось, что пепсин катализирует обмен
18
О между Нг
18
О и карбок-
сильными группами Cbz-L-Phe и Cbz-L-Tyr. Эта гипотеза, как
правило, не рассматривалась всерьез до тех пор, пока не было
показано,
что при гидролизе Leu-Tyr-Leu образуется Leu-Leu,
что может быть обусловлено следующим переносом ацильной
группы [152, 153]:
, »
Leu-Tyr-Leu
Е—ОН +
Leu-Tyr-Leu
—> (Leu-CO)—О—Е »-
—у
Leu-Leu-Tyr-Leu
+ Е—ОН
(12.33)
Leu-Leu
+
Tyr-Leu
Этот эксперимент был повторен с использованием субстрата с
двойной меткой [
14
С] Leu-Туг- [
3
Н] Leu, чтобы показать, что в
ходе
реакции происходит одновременный перенос амино- и
ацильной групп. Было установлено, что образуется как
1
3
Н] Leu-[
3
H] Leu, так и [
14
C]Leu-[
14
C]Leu [154]. Продукт, ме-
ченный
14
С (его в три-четыре раза больше), образуется в ре-
зультате
переноса ацильной группы, а продукт, меченный
3
Н, —
из
[
14
С] Leu-Туг- [
3
Н] Leu- [
3
H] Leu, который образуется из ами-
нофермента согласно схеме (12.32).
Следует иметь в виду, что прямых данных в пользу суще-
ствования промежуточных соединений с ковалентными связями
нет. Возможно, аминогруппа в аминоферменте связана не кова-
лентно,
а просто «активирована». Перенос ацильной группы в
ходе
реакции
(12.33)
может происходить и путем прямой атаки
Leu-Tyr-Leu связанного с ферментом Leu-Tyr-Leu. Кроме того,
исследования ферментативной реакции в предстационарных ус-
ловиях не выявили ни одного промежуточного соединения.
Если они и образуются, то не накапливаются.
Прежде чем попытаться делать какие-то предположения о
механизме реакции, обсудим следующий момент. Если бы обра-
зовался аминофермент, в котором аминогруппа связана в фер-
менте амидной связью с одной из карбоксильных групп, то при
гидролизе в воде, обогащенной Н
2
18
О, изотоп
18
О должен был
бы включаться в фермент:
Н
2
"О
Е—(Asp-СО)—NHR >
Е—(Asp-CO
18
OH).
(12.34)
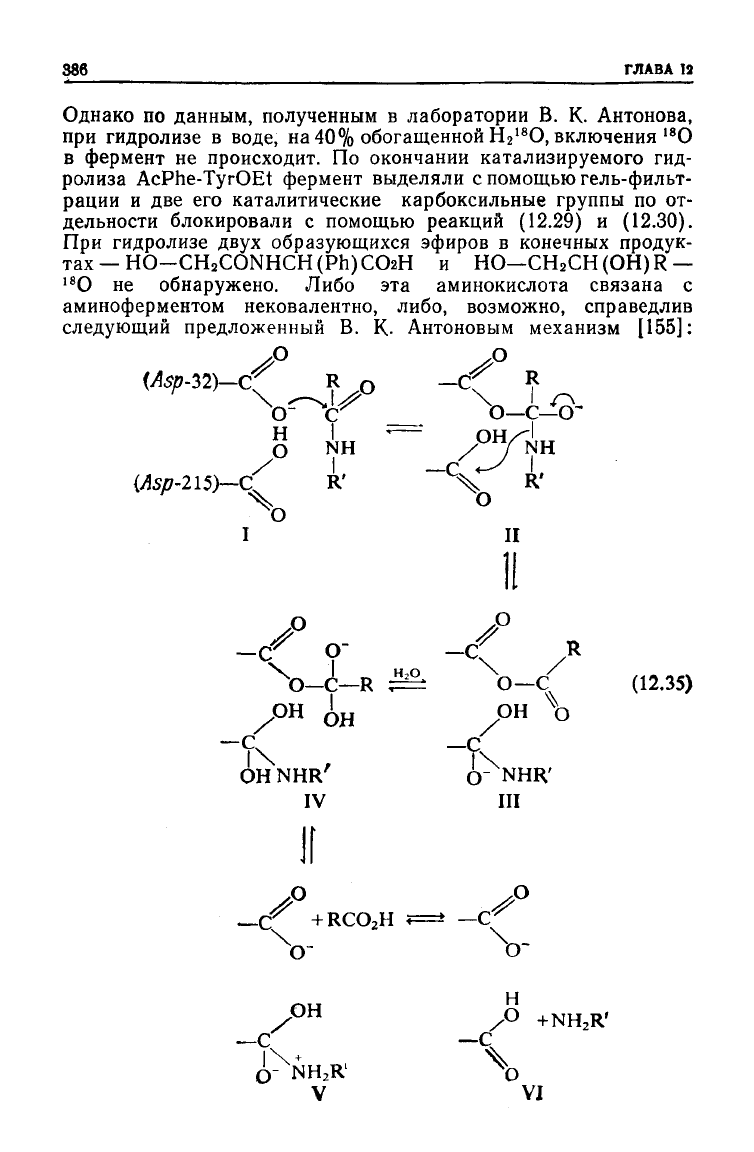
386
ГЛАВА
И
Однако по данным, полученным в лаборатории В. К. Антонова,
при
гидролизе в воде, на 40% обогащенной Н
2
18
О, включения
18
О
в
фермент не происходит. По окончании катализируемого гид-
ролиза AcPhe-TyrOEt фермент выделяли с помощью гель-фильт-
рации
и две его каталитические карбоксильные группы по от-
дельности блокировали с помощью реакций
(12.29)
и (12.30).
При
гидролизе
двух
образующихся эфиров в конечных продук-
тах—
HO-CH
2
CONHCH(Ph)CO2H
и НО—CH
2
CH(OH)R—
18
О не обнаружено. Либо эта аминокислота связана с
аминоферментом
нековалентно, либо, возможно, справедлив
следующий предложенный В. К. Антоновым механизм [155]:
С
О—С—О"
О"
С
§
А
R' Ч
II
II
O-/
(12.35)
он i
H
он Ъ
ОН
NHR' i
IV III
If
JO
JO
—c
y
+RCO
2
H
*=± -£.'
1 I
/
ОН
/О
+NH
2
R'
—С
—С
^'
\
VI

СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 387
Согласно этому механизму, транспептидация путем переноса
аминогруппы осуществляется просто обращением стадии,
веду-
щей
от IV к V. Однако для переноса ацильной группы необхо-
димо,
чтобы соединение III могло распадаться с отщеплением
R'NH
2
и образованием ацилфермента
[(Asp-32)
—
—CO
2
COR
:(Asp-215)—СО
2
Н]. Не исключено, что возможность
распада соединения III с высвобождением либо
R'NH
2
,
либо
RCO
2
H
объясняет те необычные результаты, которые были по-
лучены в экспериментах по определению соотношения
между
продуктами, в
ходе
которых изучали превращения серии суб-
стратов, протекающие с образованием общего аминофермента,
Е-Тгр, в присутствии акцептора — AcPhe [156]. Соотношение
между
AcPheTrp и Тгр, образующимися при гидролизе серии
пептидов XPheTrp в присутствии AcPhe, изменяется в зависимо-
сти от природы X (X = AcGly и т. д.). Обычно этот факт
рассматривается как довод против образования общего проме-
жуточного соединения (гл. 7, разд. Б.2.6). Однако относитель-
ные
скорости отщепления
R'NH
2
(например, Тгр) и RCO2H (на-
пример,
XPhe) должны зависеть от природы фрагмента RCO
2
H,
и,
следовательно, доля образующегося аминофермента
будет
изменяться.
Таким образом, соотношение
между
продуктами
реакции
в
случае
механизма
(12.35)
не должно быть постоян-
ным.
Рассмотренный
механизм значительно сложнее, чем в
случае
других
протеаз. Тем не менее все его стадии вполне приемлемы с
точки зрения химии, хотя подобных аналогий в простых хими-
ческих системах не обнаружено.
2.
Зимоген.
Пепсин образуется из пепсиногена при отщеп-
лении
от N-конца 44 аминокислотных остатков. При нейтральном
рН
зимоген устойчив, а при рН < 5 быстро и самопроизвольно
активируется. Активация осуществляется либо в процессе, ката-
лизируемом пепсином, либо с помощью внутримолекулярного
катализа. Имеется много данных, свидетельствующих о том, что
пепсиноген
самоактивируется в
ходе
мономолекулярного про-
цесса, при котором активный центр расщепляет свою собствен-
ную полипептидную цепь с N-конца [157—163]. Пожалуй, на-
иболее изящным образом это было продемонстрировано при
автоактивации пепсиногена, ковалентно присоединенного к се-
фарозе [159]. Молекулы зимогена иммобилизованы и не
могут
контактировать
друг
с другом. Тем не менее при рН 2 пепсиноген
самопроизвольно активируется. Между двумя путями активации
существует
конкуренция: бимолекулярная активация преобла-
дает
при более высоких концентрациях зимогена и при рН выше
2,5, а внутримолекулярная — при низком рН. Результатом са-
мопроизвольной
активации чистого зимогена является то, что
388
ГЛАВА
12
большинство молекул пепсиногена становится активным уже
через 10 с после смешивания с соляной кислотой в
желудке.
В.
Рибонуклеаза
[164, 165]
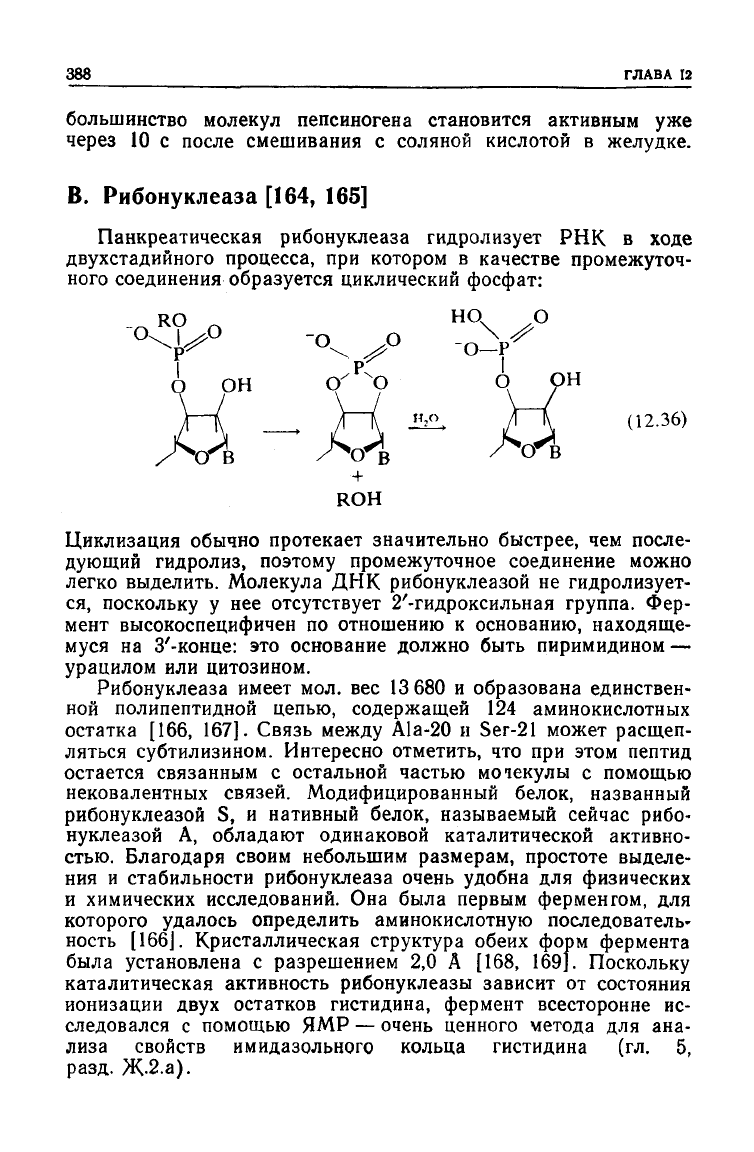
Панкреатическая рибонуклеаза
гидролизует
РНК в
ходе
двухстадийного
процесса, при котором в качестве промежуточ-
ного соединения образуется циклический фосфат:
RO
л
НО О
У
он оГ% °\?
И
„ ) ( Jh^ /~\
(12.36)
АН ^
ROH
Циклизация
обычно протекает значительно быстрее, чем после-
дующий гидролиз, поэтому промежуточное соединение можно
легко выделить. Молекула ДНК рибонуклеазой не гидролизует-
ся,
поскольку у нее
отсутствует
2'-гидроксильная группа. Фер-
мент высокоспецифичен по отношению к основанию, находяще-
муся на З'-конце: это основание должно быть пиримидином —
урацилом или цитозином.
Рибонуклеаза имеет мол. вес 13 680 и образована единствен-
ной
полипептидной цепью, содержащей 124 аминокислотных
остатка [166, 167]. Связь
между
А1а-20
и
Ser-21
может расщеп-
ляться субтилизином. Интересно отметить, что при этом пептид
остается связанным с остальной
частью
мочекулы с помощью
нековалентных связей. Модифицированный белок, названный
рибонуклеазой S, и нативный белок, называемый сейчас рибо-
нуклеазой А,
обладают
одинаковой каталитической активно-
стью. Благодаря своим небольшим размерам, простоте выделе-
ния
и стабильности рибонуклеаза очень
удобна
для физических
и
химических исследований. Она была первым ферментом, для
которого
удалось
определить аминокислотную последователь-
ность [166]. Кристаллическая
структура
обеих форм фермента
была установлена с разрешением 2,0 А [168, 169]. Поскольку
каталитическая активность рибонуклеазы зависит от состояния
ионизации
двух
остатков гистидина, фермент всесторонне ис-
следовался с помощью ЯМР — очень ценного
метода
для ана-
лиза свойств имидазольного кольца гистидина (гл. 5,
разд. Ж-2.а).
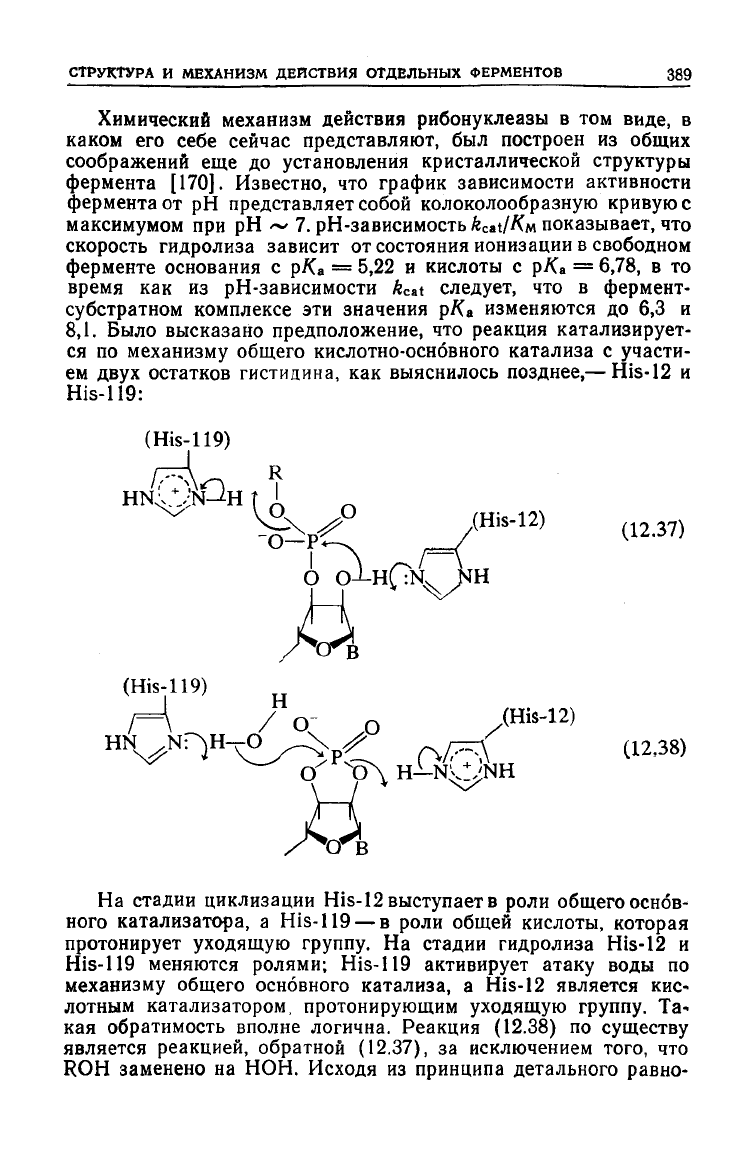
СТРУКТУРА
И МЕХАНИЗМ ДЕЙСТВИЯ ОТДЕЛЬНЫХ ФЕРМЕНТОВ 389
Химический механизм действия рибонуклеазы в том виде, в
каком
его себе сейчас представляют, был построен из общих
соображений еще до установления кристаллической структуры
фермента [170]. Известно, что график зависимости активности
фермента от рН представляет собой колоколообразную кривую с
максимумом при рН ~ 7. рН-зависимость kat/Kn показывает, что
скорость гидролиза зависит от состояния ионизации в свободном
ферменте основания с р/Са = 5,22 и кислоты с рКа = 6,78, в то
время как из рН-зависимости ftcat
следует,
что в фермент-
субстратном комплексе эти значения рКл изменяются до 6,3 и
8,1. Было высказано предположение, что реакция катализирует-
ся
по механизму общего кислотно-оснбвного катализа с участи-
ем
двух
остатков гистидина, как выяснилось позднее,— His-12 и
His-119:
(His-119)
(12.37)
(12
'
38)
На
стадии циклизации His-12 выступает в роли общего основ-
ного катализатора, a
His-119
— в роли общей кислоты, которая
протонирует
уходящую
группу.
На стадии гидролиза His-12 и
His-119
меняются ролями;
His-119
активирует атаку воды по
механизму общего основного катализа, a His-12 является кис-
лотным катализатором, протонирующим
уходящую
группу.
Та-
кая
обратимость вполне логична. Реакция
(12.38)
по
существу
является реакцией, обратной (12.37), за исключением того, что
ROH
заменено на НОН. Исходя из принципа детального равно-
390
ГЛАВА
12
весия,
можно ожидать, что группа, выступающая в прямой
реакции
в роли общей кислоты, в обратной реакции
будет
играть
роль общего основания.
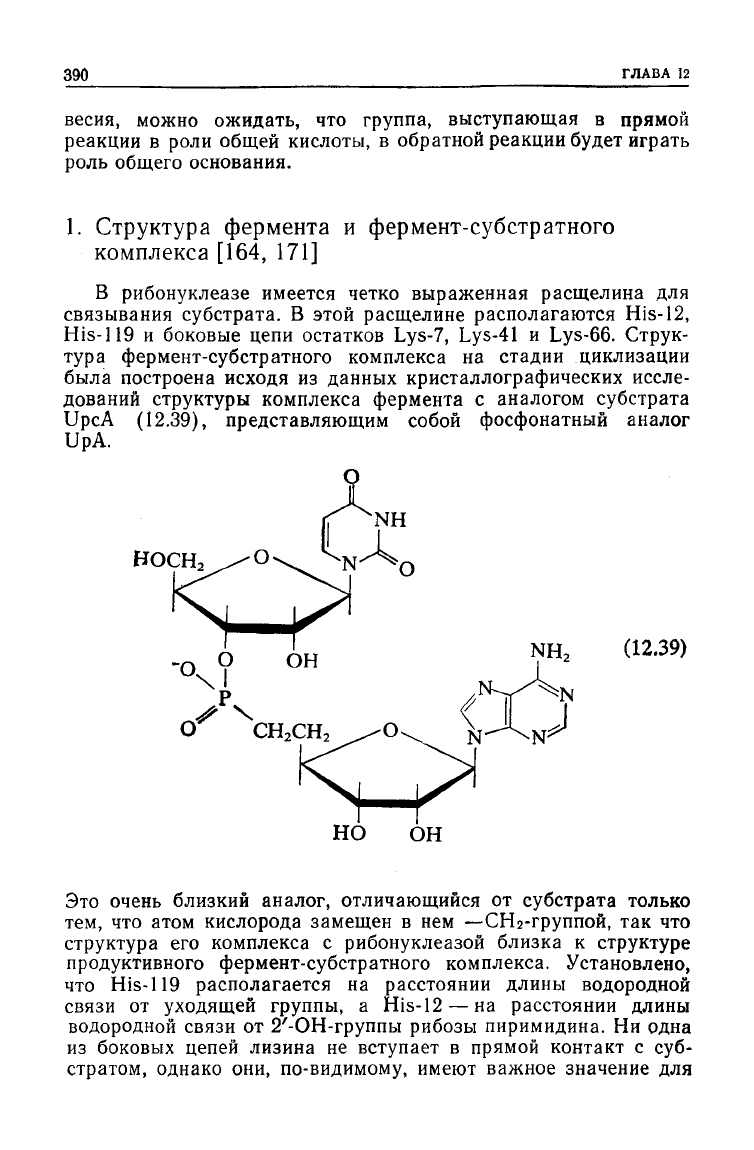
1. Структура фермента и фермент-субстратного
комплекса
[164, 171]
В рибонуклеазе имеется четко выраженная расщелина для
связывания
субстрата. В этой расщелине располагаются His-12,
His-119
и боковые цепи остатков
Lys-7,
Lys-41
и
Lys-66.
Струк-
тура
фермент-субстратного комплекса на стадии циклизации
была построена исходя из данных кристаллографических иссле-
дований структуры комплекса фермента с аналогом субстрата
UpcA (12.39), представляющим собой фосфонатный аналог
UpA.
нгосн
(12.39)
NH,
НО
ОН
Это очень близкий аналог, отличающийся от субстрата только
тем, что атом кислорода замещен в нем —СН
2
-группой, так что
структура
его комплекса с рибонуклеазой близка к
структуре
продуктивного фермент-субстратного комплекса. Установлено,
что
His-119
располагается на расстоянии длины водородной
связи
от уходящей группы, a His-12— на расстоянии длины
водородной связи от 2'-ОН-группы рибозы пиримидина. Ни одна
из
боковых цепей лизина не вступает в прямой контакт с суб-
стратом, однако они, по-видимому, имеют важное значение для
