Филимошкин А.Г. Введение в науку о полимерах (Макромолекула, Физика полимерного тела, Физическая химия полимеров)
Подождите немного. Документ загружается.


А.Г. ФИЛИМОШКИН
ВВЕДЕНИЕ В НАУКУ О ПОЛИМЕРАХ
МАКРОМОЛЕКУЛА
ФИЗИКА ПОЛИМЕРНОГО ТЕЛА
ФИЗИЧЕСКАЯ ХИМИЯ ПОЛИМЕРОВ
УЧЕБНОЕ ПОСОБИЕ ДЛЯ СТУДЕНТОВ 3 И 4 КУРСОВ ХФ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ПО
ОБЩЕМУ КУРСУ ≤ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ≤
(часть I)
Данное учебное пособие предназначено для студентов
химических факультетов университетов по специальности 011000
«Химия» в рамках трехуровневой системы образования. Для
усвоения курса «Высокомолекулярные соединения» в полном объеме
программы необходимо знакомство с университетскими курсами для
химиков «Органическая химия», «Физическая химия», «Физика» и
основами математического анализа.
В учебном пособии рассмотрены современные представления
о макромолекулах как структурных физических единицах,
участвующих в формировании макроскопических полимерных тел –
твердых и жидких, аморфных и кристаллических. В разделах
«Физика полимерного тела» и «Физическая химия полимеров» даны
основы этих наук как разделов общей учебной дисциплины
«Высокомолекулярные соединения».
ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Х
ИМИЧЕСКИЙ ФАКУЛЬТЕТ
К
АФЕДРА ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ И НЕФТЕХИМИИ
ТОМСК 2004
2
МАКРОМОЛЕКУЛА
1. Общие сведения.
Макромолекула – гигантская молекула, то есть это химический ансамбль,
содержащий большое число атомов и атомных групп. А какое это число – 100, 1000,
10000, m·10
n
? Вот первый и один из главных вопросов, на который можно будет
ответить, познакомившись с понятиями гибкости макромолекул, средних
молекулярных масс (ММ) полимеров, молекулярно-массового распределения (ММР),
изучив три физических состояния аморфных полимерных тел и их физико-
механические свойства, например высокоэластичность, как свойство, присущее
только аморфным полимерным телам.
Ярким примером формирования полимерного вещества из низкомолекулярного
является превращение при нагревании ромбической или моноклинной серы. При 113 ºС
она плавится, превращаясь сначала в желтую легкоподвижную, затем в красновато-
бурую жидкость. При 250 ºС расплавленная сера становится настолько вязкой, что не
выливается из опрокинутого стакана. Выше 300 ºС эта масса снова становится
подвижной. На одной из стадий нагревания происходит превращение
низкомолекулярного тела в полимерное, структурными единицами которого уже
являются не кольцевые молекулы серы S
8
, а очень длинные линейные макромолекулы
–[S]
n
–. Дело в том, что при 150 ºС и выше молекулы S
8
разрываются с образованием
гигантского числа коротких цепочек бирадикальной серы, например,
.
S-S-S-S
.
или
.
S-S
.
,
которые рекомбинируют с образованием длинных линейных макромолекул
….–S-S-S-S-S–….
Следствием этого превращения является сильное возрастание вязкости.
Высокая вязкость присуща растворам и расплавам высокомолекулярных соединений.
Если расплавленную серу, нагретую до 440 ºС, вылить тонкой струей в холодную воду,
то образуются высокоэластичные коричневые нити, растяжение (деформация)
которых может достигать сотни процентов. Эта высокоэластическая модификация серы
называется пластической, она термодинамически не устойчива и через несколько часов
самопроизвольно переходит в ромбическую кристаллическую фазу, и тело снова
становится хрупким.
Таким образом, мы познакомились с простейшей макромолекулой, каркас
(хребет) которой состоит из множества атомов серы, соединенных ковалентными
связями. Тело, построенное из таких макромолекул, проявляет высокоэластические
свойства точно так же, как каучук или резина. Это вещество (пластическая сера)

3
находится в полимерном (высокомолекулярном) состоянии. Ромбическая сера как
вещество находится в низкомолекулярном состоянии.
Простым примером макромолекулы органического соединения является
макромолекула полиэтилена, представленная формулой повторяющегося (или
мономерного) n раз звена –[СH
2
-CH
2
]
n
–, состоящего из двух метиленовых групп,
которые образовались при разрыве π-связи в молекуле этилена CH
2
=CH
2
(мономер).
Макромолекула получила название путем подстановки префикса поли- к названию
мономера – полиэтилен. Так сформировалась большая группа винильных полимеров
как представителей гомологического ряда этана (полиолефины, если R–алкильные
заместители), так и различных его производных, содержащих функциональные группы
Hal, OH, COOH, OCOR, OR, CN, CONH
2
и т.д. Следует заметить, что названия
винильных полимеров получены в большинстве своем на базе тривиальных или
рациональных названий исходных мономеров с префиксом поли-, например:
полиакриловая кислота –[CH
2
-CHCOOH]
n
–, полиакрилонитрил –[CH
2
-CHCN]
n
–,
поливиниловый спирт –[CH
2
-CHOH]
n
– и т.д. Все они идентифицируются в
соответствии с номенклатурой и классификацией органической химии –
галоидпроизводные, спирты, карбоновые кислоты и их производные (сложные и
простые эфиры, нитрилы, амиды), амины и их соли и т.д.
CH
2
CH
R
n ,
Вернемся к макромолекуле полиэтилена. Очевидно, что полиэтилен завершает
гомологический ряд предельных углеводородов (табл.1). Анализ температур плавления
и кипения представителей этого ряда уже может дать некоторое представление о
переходе вещества, находящегося в низкомолекулярном состоянии, в "более или менее"
высокомолекулярное. По мере роста ММ растет как температура плавления от –183
(этан, n=1) до 66 ºС (триаконтан, n=14), так и температура кипения – от –89 до 446 ºС,
соответственно. Все эти вещества еще не являются высокомолекулярными. Члены
гомологического ряда, завершающие таблицу 1, например гектан, могут быть условно
отнесены к олигомерам, являющимися промежуточными веществами между низко- и
высокомолекулярными. Из сопоставления температур плавления и кипения видно, что
с ростом коэффициента n растут межмолекулярные (ван-дер-ваальсовы)
взаимодействия, которые и играют одну из главных ролей при переходе вещества в
полимерное состояние. Сила межмолекулярных взаимодействий растет с появлением в
макромолекулах полярных групп и с образованием межмолекулярных водородных
связей, что отражается на температурах кипения и плавления, например:
4
Название Формула Т
пл
Т
кип
Этан
Полиэтилен
H
3
C–CH
3
–[СH
2
–CH
2
]
n
–
– 183
105-130
*
–89
–
Хлористый этил
Поливинилхлорид
H
3
C–CH
2
Cl
CH
2
CH
Cl
n
– 141
180-220
**
12
–
Этиловый спирт
Поливиниловый спирт
H
3
C–CH
2
OH
CH
2
CH
OH
n
– 114
200
**
78
–
*
Температура текучести;
**
Температура размягчения с разложением
Итак, макромолекулы вступают в интенсивную ассоциацию за счет работы
межмолекулярных сил, образуя макроскопические полимерные тела, которые могут
находиться в двух агрегатных состояниях: твердом и жидком (то же относится и к двум
фазовым состояниям). Высокомолекулярные соединения не могут образовать газовую
фазу (см. колонку Т
кип
). Попытка перевода в газовую фазу путем нагревания
олигомеров (тем более высокомолекулярных соединений) приводит к их разложению –
протекают реакции крекинга или пиролиза. Следует отметить, что такое объяснение
агрегатных превращений в полной мере справедливо только для низкомолекулярных
веществ и олигомеров. При анализе фазовых и агрегатных переходов
высокомолекулярных веществ следует учитывать особое свойство макромолекул – их
гибкость. Для феноменологического описания линейной макромолекулы как
физической материальной частицы, имеющей некоторые геометрические очертания, и
занимающей в пространстве какой-то объем, ее можно представить как закономерную
или случайную последовательность атомов или групп атомов, соединенных
химическими (чаще всего σ- и π-) связями.
Способ заполнение этого микроскопического объема за счет реализации
макромолекулой такого свойства как гибкость, ведет к принятию ею различных форм,
а именно: стержня, деформированного стержня, спирали, рыхлого клубка, плотного
клубка, глобулы.
Выше речь шла только о линейных макромолекулах типа –А– А– А– А– А– ,
где А – это повторяющиеся звенья. Геометрически такую макромолекулу в вытянутом
состоянии можно представить в виде стержня или палочки:
(гибкость как свойство вообще не реализуется).

5
Таблица 1
Зависимость температур плавления и кипения
линейных низкомолекулярных гомологов полиэтилена от длины цепи
Название,
агрегатное состояние
Формула Т
кип
ºС Т
пл
ºС
Метан
газ
СН
4
–162 –182.5
Этан
газ
СН
3
–СН
3
–89 –183
Пропан
газ
СН
3
–СН
2
–СН
3
–42 –188
н-Бутан
газ
СН
3
–СН
2
–СН
2
–СН
3
–0.5 –138
н-Пентан
жидк
СН
3
–СН
2
–СН
2
– СН
2
–СН
3
36 –130
н-Гексан
жидк
СН
3
–(СН
2
–СН
2
)
2
–СН
3
69 –95
н-Гептан
жидк
СН
3
–(СН
2
–СН
2
)
2
–СН
2
–СН
3
98 –91
н-Октан
жидк
СН
3
–(СН
2
–СН
2
)
3
–СН
3
126 –57
Нонан
жидк
СН
3
–(СН
2
–СН
2
)
3
–СН
2
–СН
3
151 –53.5
Декан
жидк
СН
3
–(СН
2
–СН
2
)
4
–СН
3
174 –30
Ундекан
жидк
СН
3
–(СН
2
–СН
2
)
4
–СН
2
–СН
3
196 –26
Додекан
жидк
СН
3
–(СН
2
–СН
2
)
5
–СН
3
216 –10
Тридекан
жидк
СН
3
–(СН
2
–СН
2
)
5
–СН
2
–СН
3
235 –5
Тетрадекан
жидк
СН
3
–(СН
2
–СН
2
)
6
–СН
3
254 6
Пентадекан
жидк
СН
3
–(СН
2
–СН
2
)
6
–СН
2
–СН
3
271 10
Гексадекан (Цетан)
тверд
СН
3
–(СН
2
–СН
2
)
7
–СН
3
287 18
Гептадекан
тверд
СН
3
–(СН
2
–СН
2
)
7
–СН
2
–СН
3
302 22
Октадекан
тверд
СН
3
–(СН
2
–СН
2
)
8
–СН
3
316 28
Нонадекан
тверд
СН
3
–(СН
2
–СН
2
)
8
–СН
2
–СН
3
330 32
Эйкозан
тверд
СН
3
–(СН
2
–СН
2
)
9
–СН
3
343 37
Тетракозан
тверд
СН
3
–(СН
2
–СН
2
)
11
–СН
3
389 51
Триаконтан
тверд
СН
3
–(СН
2
–СН
2
)
14
–СН
3
446 66
Гектан
тверд
СН
3
–(СН
2
–СН
2
)
49
–СН
3
Разлаг. 115
Полиэтилен, n~650
тверд
–[CH
2
–CH
2
]
n
– – 105-110
*
Полиэтилен, n~18000
тверд
–[CH
2
–CH
2
]
n
– – 130
*
Полипропилен,
n~360-5900
тверд
–[CH
2
–CH]
n
–
СН
3
– 170
*
Полиизобутилен,
n~1500
тверд
СН
3
–[CH
2
–C]
n
–
СН
3
–
~100
*
*
Температура размягчения
При определенных условиях синтеза реакция образования макромолекул
может приводить к образованию разветвленных макромолекул, причем ветвления
могут быть короткоцепными или длинноцепными:
Примерами молекул с короткими ответвлениями могут служить молекулы изобутана,
изо- и неопентанов, 2,2,3-триметилпентана, причем роль ответвлений в них играют
метильные группы. Чем большее число атомов углерода образует алкильный
заместитель, тем длиннее ответвление:
Макромолекулы по очертанию могут быть гребневидными или напоминать лестницу
(лестничные полимеры), другие смежносочлененные геометрические фигуры
(паркетные); наконец, макромолекулы могут быть пространственно сшитыми:
CH
2
CH
(CH
2
)
m
n
CH
3
CH
2
CH
CH
3
n
Сшитые макромолекулы образуются при протекании побочных реакций или при
участии специально введенных веществ (сшивающих агентов), ионизирующего
излучения и других факторов. По мере развития процесса сшивания на определенном
этапе исчезает грань между макромолекулой как микроскопическим образованием и
полимерным макроскопическим телом. Так классифицируют макромолекулы по типу
(виду).
7
2. Конфигурации макромолекулярной цепи.
Макромолекулы полиолефинов образуются путем
полимеризации олефинов,
причем
один из атомов углерода повторяющегося звена в результате
перегибридизации
становится хиральным (S- или R-хиральный атом С
23
sp sp
CC→
*
):
nCH
2
=CHY → –[CH
2
–C
*
HY]
n
– (1)
В макромолекуле появляется возможность нескольких вариантов расположения
хиральных атомов углерода, а именно: только S, только R или строгое чередование по
типу S R S R S R и т.д. Может иметь место и различное сочетание типов хиральных
атомов углерода, что часто встречается на практике. Причем сочетания повторяющихся
звеньев различны не только в качественном, но и в количественном отношении.
Поясним это на примерах в символах
SR (позже дадим развернутые описания
стереорегулярных макромолекул и способов их изображения с помощью проекций
Фишера):
1.
SSSSSSSSSSSSSSSSSSSSSSSS и т.д.
2.
RRRRRRRRRRRRRRRRRRRRR и т.д.
3.
SRSRSRSRSRSRSRSRSRSR и т.д.
4.
SSRRSSRRSSRRSSRR и т.д.
5.
SSSRRRSSSRRRSSSRRRSSSRRR и т.д.
6.
SSSSSRRRRRSSSSSRRRRRSSSSSRRRRRSSSSSRRRRR и т.д.
7.
SRRSSSSRSRRRSSRRSSSSRRRRRRRSS и т.д
Опишем словами макромолекулу полипропилена, полученного по реакции (1) в
примере 7, Y=CH
3
. Под символом S в этом и всех других примерах подразумевается
целое повторяющееся звено –[CH
2
–C
*
HY]
n
–, в котором содержится S-хиральный атом
C
*
, а под символом R – такое же повторяющееся звено, в котором атом C
*
R-хирален. В
отличие от всех остальных, в этом примере отсутствует закономерность в
расположении хиральных атомов C
*
. Так, макромолекулы в примерах 1 и 2 состоят из
повторяющихся звеньев, в которых атомы C
*
только S- или R-хиральны
соответственно. Макромолекулы в примере 3 состоят из повторяющихся звеньев, в
которых хиральные атомы C
*
строго чередуются. Макромолекулы в примерах 4,5 и 6
состоят из чередующихся
S- и R-диад (№ 4), S- и R-триад (№ 5) и S- и R-пентад
(№ 6).

8
Макромолекулы, построенные из повторяющихся звеньев с S- или R- атомами
C
*
, называются изотактическими. Если в макромолекулах имеет место строгое
чередование S- и R- атомов C
*
, то их относят к синдиотактическим. Полимеры,
состоящие из изотактических и синдиотактических макромолекул, составляют группу
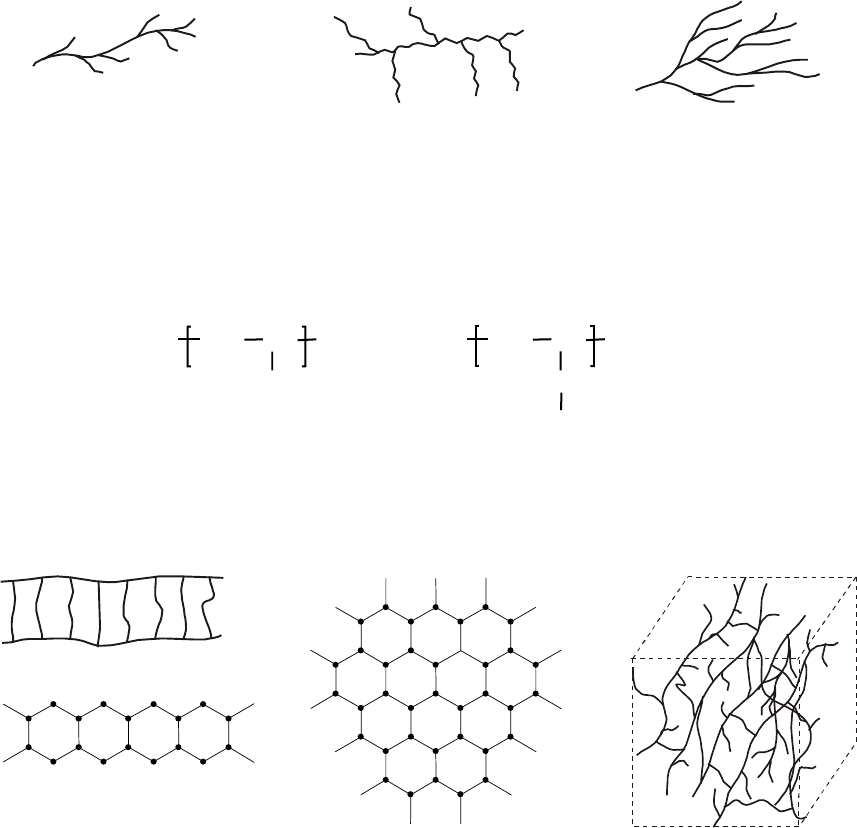
стереорегулярных полимеров. На рис.1 приведены стереоформулы изотактических и
синдиотактических макромолекул, а также их проекции, называемые проекциями
Фишера. Последние используются для наглядности и удобства написания формул.
Центральная метиленовая группа изотактического расположения называется
мезо-
метиленовой, или
m-единицей. Аналогичная СН
2
группа в синдиотактическом отрезке
называется рацемической или
r-единицей:
m
R
m
R
R
rRr
R
R
rRmR
R
Изотактическая триада,
последовательность mm
Синдиотактическая триада,
последовательность rr
Гетеротактическая триада,
последовательность rm
Макромолекулы в примере 7 называются
атактическими
(гетеротактическими). Другими словами, они являются макромолекулами с различной
микротактичностью как по типу (наличие изо- или синдиотактических диад, триад,
тетрад, пентад, …, n-ад – в общем случае), так и по степени тактичности (
ξ). Для
оценки степени тактичности образца полимера сначала определяют по каким n-адам
можно оценивать
ξ, которая является простым отношением числа изо- (или
синдиотактических) n-ад к общему числу n-ад в макромолекуле:
ξ=(число изотактических n-ад/общее число n-ад)·100%,
где
ξ- степень изотактичности в процентах.
Пример.
Оценим степень изотактичности образца полистирола, стереохимия
макромолекул которого представлена усредненной проекцией Фишера
mmmrmr r r rm r r
R
R
R
RR
R R
R mr mmmr m
RRR
RR RRRR
R
RR
Общее число диад – 10, число изотактических диад, в которых –CH
2
R– выделены
жирным шрифтом, – 6;
ξ=60 %.
Таким образом, для описания линейной макромолекулы как физической
материальной частицы, имеющей вполне определенные геометрические очертания, и
занимающей в пространстве вполне определенный объем следует исследовать, во-
первых, ее
конфигурационное состояние (рис. 1) и ее способность к
конформационным превращениям (рис. 2 и 3), – во-вторых. Эти пространственные

9
характеристики чрезвычайно важны, поскольку они определяют фазовые и агрегатные
состояния полимерных тел с теми или иными физико-механическими свойствами.
Очевидно, что поэтап
Фишеровская Гипотетическая вытянутая
ное
образов мак
х микр
м м
движения) отрезки макромолекул, называемы
3. Конформации макромолекулярной цепи.
Для получения представления о сегментах макромолекул обратимся к вопросу
о так н
в
Е,
кка ль
Галоген-
Е,
ккал ль
Гетеро-
ные
Е,
ккал ль
ание из ромолекул
упорядоченны оскопических
структур (
надмолекулярных), затем
макроскопических объемов происходит
по законам физической химии с
фор ирование ближнего или дальнего
порядка в расположении структурных
единиц данной термодинамической фазы.
Структурными единицами в полимерных
телах являются как макромолекулы, так и
отдельные кинетически независимые (в
смысле внутримолекулярного теплового
е
сегментами.
азываемом "свободном" вращении вокруг
σ-связей в молекулах насыщенных
органических соединений. В соответствии с принципом "свободного" вращения в
молекуле происходит вращение одних молекулярных ансамблей относительно других.
В курсе органической химии энергетические барьеры вращения (
Е) для соединений
типа СН
3
–Х иллюстрируют на примерах алканов, галогенэтанов и гетерозамещенных,
которые являются низкомолекулярными аналогами соответствующих классов
полимеро – полиолефинов, галогенпроизводных (ПВХ), полиамидов и полиэфиров,
соответственно:
Алканы
л/мо
этаны
/мо
замещен
/мо
СН –СН
3 3 2
2.88 СН
3
–СН F 3.3 СН
3
–NH
2
1.98
СН
3
–СН
2
СН
3
3
3.62 3.4 СН
3
–СН
2
Cl 3.7 СН
3
–NHСН
СН
3
–СН(СН
3
)
2
3.9 СН
3
–СН
2
Br 3.7 СН
3
–OH 1.07
СН
3
–С(СН
3
)
3
4.7 СН
3
–СН
2
I 3.2 СН
3
–OСН
3
2.7
Полная энергия молекулы непосредственно связана с ее геометрией. Молекула
стремится принять геометрию с минимальной энергией, что и может произойти за счет
проекция зигзагообразная цепь
HR
HH
HR
HH
HR
HH
HR
HH
CC
CC
CC
R
H
R
H
H
H
H
H
H
H
H
H
H
CC
R
H
R
а
HR
HH
RH
HH
HR
HH
RH
HH
CC
CC
CC
CC
R
H
H
R
R
H
H
R
H
H
H
H
H
H
H
H
б
Рис. 1. Различные конфигурации полимерных
а – изотактическая; б – цепей:
синдиотактическая.
10
вращени
д и м
Н
у л
я вокруг простых связей с преодолением так называемых барьеров вращения
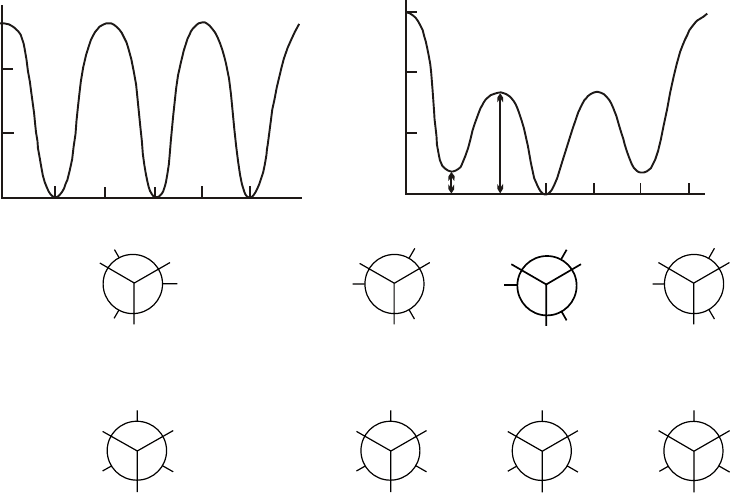
(см. соответствующий раздел курса «Органическая химия»). Картину изменения
потенциальной энергии (
Е) молекулы легко проследить с помощью формул Ньюмена.
Для наглядности сравним диаграммы изменения
Е этана и н-бутана как
низкомолекулярных аналогов полиолефинов на фоне формул их конформеров (рис.2).
Обе иаграммы похожи в том смысле, что меют по три энергетических максиму а и
по три минимума. Диаграмма изменения
Е н-бутана отличается тем, что один из
минимумов имеет меньшую энергию, чем два других, и один максимум имеет более
высокую энергию, чем два других. Минимумы соответствуют заторможенным
конформациям, из которых трансоидная имеет меньшую энергию, чем две скошенные в
н-бутане, причем ∆Е =0.88 ккал/моль. аибольшую энергию имеет конформация с
заслоненным расположением двух СН
3
групп. Ее энергия на 2.6 ккал/моль выше, чем
для конформации с заслоненными СН
3
и Н и на 6 ккал/моль выше, чем энергия
заторможенной трансоидной конформации. Столь подробное знакомство с
конформационной изомерией низкомолекулярных соединений необходимо для
понимания специфического свойства макромолек л – гибкости и формы макромолеку ,
о которых речь пойдет позже.
я эн ия
ль
2
3
и
я
6
Потенциальна ерг
, ккал/моE
Торсионный угол,
ϕ
0
1
60 120 180 240 300 360
По
т
е
н
ц
и
а
л
ь
н
ая э
н
ерг
, ккал/мольE
0
2
4
Торсионный угол,
ϕ
60 120 180 240 300 360
0.8
3.4
Заслоненные
(четные)
конформации,
H
H
H
H
H
H
H
H
CH
3
H
CH
3
H
H
H
CH
3
H
H
CH
3
H
3
C
H
CH
3
H
H
H
Торсионный
угол
Соответствуют торсионным углам
0°, 120°, 240°
0° (цисоидная,
син-)
120°
240°
ые (нечетные)
конф ции
Заторможенн
орма
H
H
H
H
H
H
CH
3
H
H
H
CH
3
H
CH
3
H
H
H
CH
3
H
CH
3
H
H
H
H
H
3
C
Торсионный
угол
Соответствуют торсионным углам
60°, 180°, 360°
60°
(скошенная)
180°
(трансоидная,
анти-)
360°
(скошенная)
. За ии этан -бутана от поворота
кает вопрос: за счет работы каких сил происходит изменение
потенциальной энергии молекул в процессе их конформационных превращений? Ответ
Рис. 2
висимость потенциальной энерг а и н угла ϕ.
Возни
