Графит и его соединения включения
Подождите немного. Документ загружается.

ГОУ ВПО «Кемеровский государственный университет»
Кафедра неорганической химии
(Реферат по дисциплине: «Строение вещества»)
Работу выполнила:
студентка 4 курса Х – 062
Савосина Анастасия
Викторовна
Работу принял
к.х.н., доцент
кафедры неорганической химии
Якубик Денис
Геннадьевич
Кемерово 2009
2
Содержание
1. Содержание………………………………………………………………2
2. Введение………………………………………………………………….3
3. Понятие «соединения включения»……………………………………..4
4. Клатратные соединения включения……………………………………5
5. Применение соединений включения…………………………………...8
6. Графит и его соединения включенния…………………………………9
6.1. Основные характеристики графита……………………………..9
6.1.1. Свойства……………………………………………………....11
6.1.2. Структура……………………………………………………..13
6.1.3. Условия нахождения в природе……………………………..14
6.1.4. Искусственный синтез……………………………………….14
6.2. Соединения включения графита………………………………..14
6.2.1. Разновидность соединений включения графита…………...16
6.2.2. Свойства………………………………………………………18
6.2.3. Получение…………………………………………………….19
6.2.4. Применение…………………………………………………...20
7. Заключение……………………………………………………………...21
8. Список используемой литературы…………………………………….23
3
Введение
Несмотря на весьма продолжительную историю соединений включения
(в том числе клатратных соединений) и созвездие выдающихся ученых, их
исследовавших, эти соединения долгое время оставались загадкой для
химиков и определенная доля экзотичности сохраняется за ними и в
настоящее время.
На заре развития химии, когда причины образования соединений не
были ясны, соединения включения рассматривались химиками на общих
основаниях. Но развитие теорий химической связи, все лучше и лучше
описывающих подавляющее большинство разнообразных химических
веществ, поставило как бы вне закона рассматриваемые соединения,
поскольку ни одно из них не подчинялось хорошо проверенным законам.
Ореол загадочности был снят с них английским кристаллохимиком
Г.Пауэллом в 1947-1948 годах. Пауэлл обнаружил, понял и описал
принципиально новую, более высокого уровня организацию химической
материи. Были обнаружены соединения, в которых между гостевыми и
хозяйскими молекулами существует химическое взаимодействие.
В 1973 году французский химик Жан-Мари Лен, подчеркивая важную
роль, которую играют невалентные взаимодействия в формировании
подобных соединений, и обсуждая их свойства, ввел термин
"супрамолекулярная (надмолекулярная) химия", а в 1987 году ему,
американцам Чарлзу Педерсену и Доналду Крэму была вручена Нобелевская
премия по химии за достигнутые успехи в этой области знаний.
4
Понятие «соединения включения»
СОЕДИНЕНИЯ ВКЛЮЧЕНИЯ – вещества, занимающие
промежуточное положение между твёрдыми растворами внедрения и
истинными соединениями химическими.
Термин "соединение включения" ввел В. Шленк в 1949 году.
Соединения включения — особый вид комплексных соединений.
Соединения включения образуются в результате внедрения молекул одного
вида в полости кристаллической решётки или молекул другого вида. Первые
молекулы получили название «гостей», вторые — «хозяев».
Способность вещества образовывать соединения включения
определяется наличием в нём полостей молекулярных размеров. Молекулы
включаемого вещества должны обладать конфигурацией, соответствующей
форме полости. Включенные молекулы удерживаются в соединениях
включения силами межмолекулярного взаимодействия.
Так как в соединения включения связываются друг с другом не
отдельные молекулы, а группы молекул, то целочисленного соотношения
между включаемым и включающими веществами, как правило, не
существует.
Высокомолекулярные вещества позволяют получать соединения
включения за счёт полостей между цепями макромолекул. Часто соединения
включения образуются уже при смешении компонентов, иногда при
растирании. Они нестойки, в растворах обычно распадаются на исходные
вещества.
5
Различают молекулярные соединения включения, которые образуются
при наличии полостей в единичных молекулах («хозяевах») относительно
небольшой молекулярной массы. И различают решётчатые соединения
включения, в которых полости возникают при образовании кристаллической
решётки, иногда только в присутствии включаемого вещества; такие
соединения могут быть канальными (полости в форме канала) или
клатратными (полости в форме клетки).
Клатратные соединения включения
КЛАТРАТЫ (от лат. clathratus - защищенный решеткой) – соединения
включения. Термин "клатрат" ввел Г. Пауэлл в 1948году.
Различают решетчатые клатраты и молекулярные клатраты.
Решетчатые клатраты образованы включением молекул, называемых
"гостями", в полости кристаллического каркаса, состоящего из молекул
другого сорта, называемых "хозяевами".
Среди решетчатых клатратов в зависимости от формы полости
различают:
клеточные (криптатоклатраты), например клатраты гидрохинона,
газовые гидраты;
канальные (тубулатоклатраты), например клатраты мочевины,
тиомочевины;
слоистые (интеркалаты), например графита соединения.
Молекулярные клатраты образованы включением молекул-гостей в
полость одной большой молекулы-хозяина.
6
Молекулярные клатраты подразделяются на:
кавитаты, имеющие полость в виде канала или клетки (например
соединения циклодекстрина с I
2
или амилазы с I
2
);
адикулаты, у которых полость напоминает корзину.
Между молекулами гостя и хозяина может не быть никаких
взаимодействий, кроме ван-дер-ваальсовых (как, например, в газовых
гидратах). Но часто между гостями и хозяином, кроме ван-дер-ваальсова
взаимодействий, имеются слабые связи типа водородных (например,
клатратная молекула гексагидрата уротропина связана с каркасом клатрата
тремя водородными связями).
Соединения с координационной связью между гостем и хозяином
называются клатратокомплексами (например комплексы краун-эфиров и
криптандов).
Соотношение между количествами молекул гостей и хозяев в общем
случае нецелочисленное. А также часто не все полости хозяина заполнены
молекулами гостя.
Решетчатые клатраты существуют только в кристаллическом состоянии,
молекулярные - также и в растворе.
Термодинамическая стабильность клатратов обеспечивается
благоприятным расположением молекул в полостях каркаса, вследствие чего
слабые межмолекулярные взаимодействия приводят к выигрышу энергии в
20-50 кДж/моль при образовании клатратов по сравнению с энергией
компонентов в свободном состоянии.
Наиболее благоприятные для образования клатратов характеристики
хозяина:
7
объемная молекула (например, гидрохинон, три-о-тимотид, или
циклический тример 2-гидрокси-6-метил-3-изопропилбензойной
кислоты)
направленные связи при малых координационных числах атомов,
их образующих, (например, в каркасах из тетраэдрических
группировок (вода, SiO
2
, Ge)).
Поскольку длины связей Si—О—Si и О—Н—О приблизительно
одинаковы, гости в клатратном гидрате и клатрате на основе SiO
2
(клатрасил)
могут быть одни и те же. Но эти соединения имеют различную термическую
устойчивость. Клатраты аналогичных структур образуют Ge и Si со
щелочными металлами. Известны клатраты на основе комплексных
соединений, например, соединение Шеффера
[Cd(4-CH
3
C
3
H
4
N)
4
(NCS)
2
]
.
0,67(4-CH
3
C
5
H
4
N)
.
0,33H
2
O,
где 4-метилпиридин - одновременно и лиганд, и гость.
Способность гостя к клатратообразованию в основном определяется
размером и формой его молекул, а не их химической природой.
Гостями могут быть как молекулы, так и ионы. Например, в клатратном
гидрате (изо-C
5
H
11
)
4
NF
.
38H
2
O гость-катион, а хозяин - каркас, построенный
из молекул воды и анионов F
-
. В гидрате HPF
6
.
6H
2
O гость - анион PF
-
6
.
Если каркас хозяина имеет полости разного типа, то возможно
включение двух или нескольких типов гостей одновременно. Частичное или
полное заполнение полостей гостями подходящего размера приводит к
дополнительной стабилизации клатратного каркаса. Например, температура
плавления клатратного гидрата ТГФ
.
17Н
2
О – 5.1 °С, а двойного гидрата
ТГФ
.
Н
2
S
.
17Н
2
О – 21.3
o
С.
8

Возможны и более сложные виды клатратообразования, когда
молекулярные клатраты, сами являясь гостями, заполняют полости или слои
в решетке другого хозяина.
Образование клатратов может быть использовано:
при синтезе стереорегулярных полимеров (полимеризация в
каналах клатратов);
в хроматографии;
для хранения газов и высокотоксичных веществв,
для защиты легкоокисляющихся на воздухе соединений,
для опреснения морской воды,
для разделения соединений, близких по свойствам, но
отличающихся геометрией молекул (включая оптические
изомеры), и др.
Так, нормальные углеводороды, спирты, карбоновые кислоты,
образующие клатраты с мочевиной (диаметр каналов ~0,5 нм), могут быть
отделены от их разветвленных изомеров, диаметры молекул которых
превышают ~0,5 нм.
Применение соединений включения
Соединения включения применяются для разделения смесей. Мочевина,
например, позволяет выделить углеводороды нормального строения, которые
она связывает в виде соединений включения, а тиомочевина —
углеводороды, имеющие разветвленные цепи.
9

Цеолиты, получаемые с различными заданными размерами полостей,
находят промышленное применение для сушки газов, разделения веществ, в
ионообменных процессах.
На способности многих газов и легкокипящих жидкостей образовывать
соединения включения (клатраты) с водой основаны удобные способы их
хранения и разделения.
Включение — метод защиты от окисления на воздухе некоторых
нестойких молекул.
Соединения включения используются и в аналитических целях: в
адсорбционной и распределительной хроматографии для разделения
нитрофенолов, нитроаминов иkт.п.
ГРАФИТ И ЕГО СОЕДИНЕНИЯ
ВКЛЮЧЕНИЯ
Основные характеристики графита
Углерод имеет несколько аллотропных модификаций, из которых
наиболее известны графит и алмаз. Можно упомянуть также карбин -
линейные полимерные цепочки (=С=С=С=)n , фуллерены - сферические и
эллипсоидальные молекулы (например, С60 и С70), аморфный углерод
(сажу, например).
10
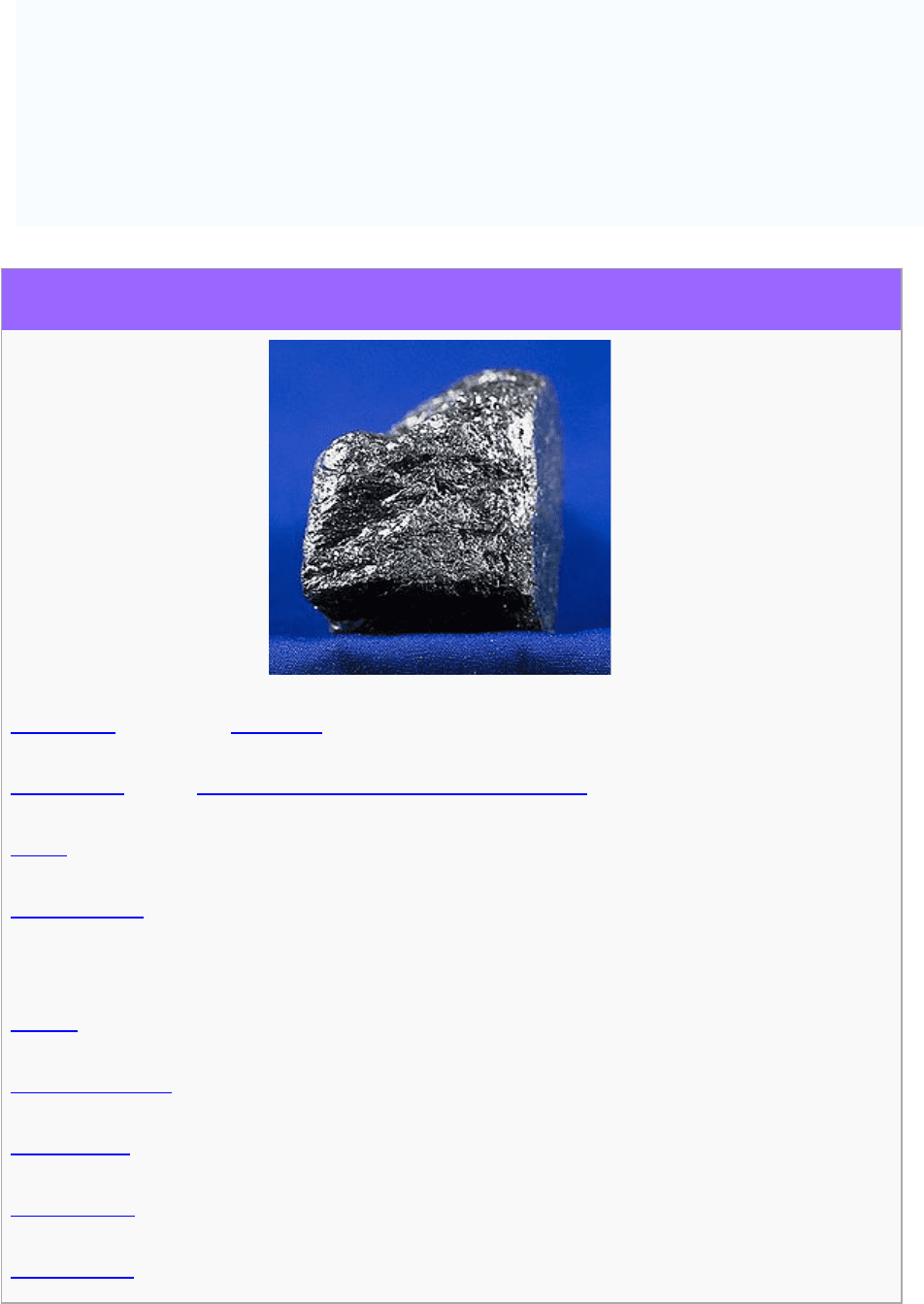
Графит (от греч. γραφειν — пишу) — минерал из класса самородных элементов, одна из
аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут
по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией
от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной
(дитригонально-скаленоэдрический). Слои слабоволнистые почти плоские, состоят из
шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые.
Графит
Формула C (углерод)
Сингония Гексагональная (планаксиальная)
Цвет Серый, чёрный стальной
Цвет черты Чёрная
Блеск Металловидный
Прозрачность Непрозрачный
Твёрдость 1 — 2
Спайность Совершенная по {0001}
Плотность 2,09 — 2,23 г/см³
11
