Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.

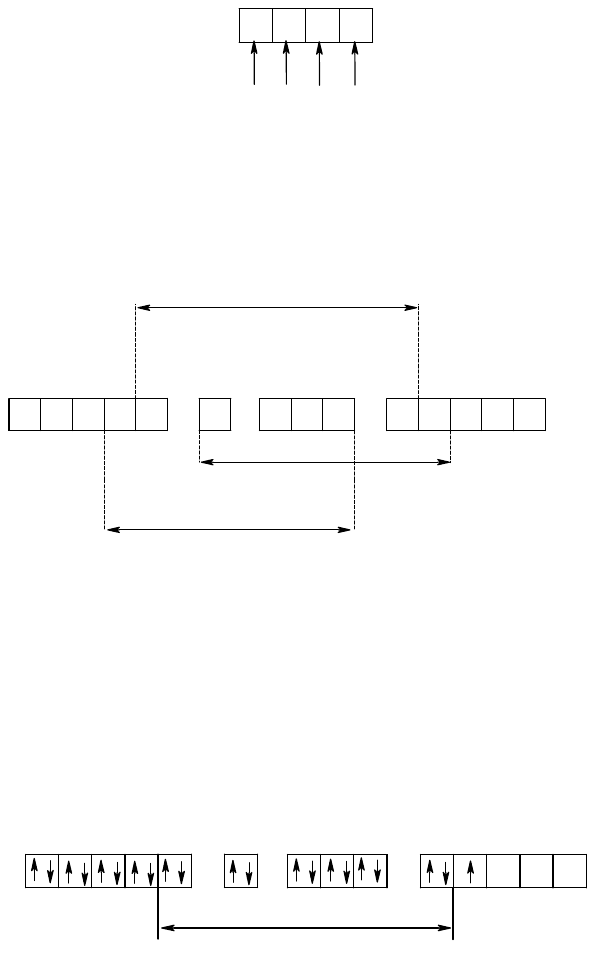
комплексных соединений такая связь называется координационной. Обычно в функции донора электронной
пары при образовании координационной связи выступает лиганд, а в функции акцептора - центральный атом. В
этом случае формирование связи происходит по схеме М:L, а результатом чаще всего является -связь.
Упрочнению связи способствует соответствующая гибридизация электронных орбиталей. Например, при
образовании тетрафторобериллат-иона по уравнению
Be
2+
+ 4F
-
= [BeF
4
]
2-
(6-1)
в роли акцептора выступает ион бериллия с электронной конфигурацией 1s
2
2s
0
2p
0
(четыре вакантных орбитали
валентного уровня). Эти орбитали подвергаются sp
3
-гибридизации. В качестве доноров в реакции (6-1)
выступают ионы фтора, имеющие четыре неподеленные пары. В результате образуется тетраэдрический ион
[BeF
4
]
2-
:
sp
3
- гибридизация
F
..
..
:
:
F
..
..
:
:
F
..
..
:
:
F
..
..
:
:
Координационная связь может формироваться также за счет неподеленной электронной пары центрального
атома и вакантных орбиталей (обычно разрыхляющих) лиганда по схеме М:L. Такая разновидность
координационной связи называется дативной связью. Образование дативных связей упрочняет молекулу, так как
способствует перетеканию электронной плотности с центрального атома на лиганд и повышению эффективного
заряда центрального атома.
В зависимости от того, какие орбитали ЦА участвуют в гибридизации, последняя может быть внутренней,
внешней и смешанной (рис. 34, см также раздел 5.2.3.).
(n - 1)d ns np nd
sp
3
d
2
d
2
sp
3
dsp
3
d
смешанная гибридизация
внутренняя я гибридизацияяяя
внешняя я гибридизацияяяя
Рис. 34. Внутренняя, внешняя и смешанная гибридизация
Из рассмотренных типов гибридизации s-, трех p- и двух d-орбиталей энергетически наиболее выгодной
является внутренняя гибридизация, так как в этом случае в гибридизацию вовлекаются (n-1)d-орбитали, энергия
которых ниже энергии ns-, np- и nd-орбиталей. Поэтому у центральных атомов, содержащих в данной степени
окисления не более трех электронов и, следовательно, не менее двух вакантных орбиталей на (n-1)d-орбиталях
всегда наблюдается внутренняя гибридизация. Так, например, для центрального атома Cr
3+
, имеющего
конфигурацию d
3
, всегда имеет место
d
2
sp
3
-гибридизация. Смешанная гибридизация реализуется тогда, когда
благодаря ей (n-1)d-орбиталь занимает электронная пара, а nd-орбиталь - неспаренный электрон. Так, для
комплекса [Cu(H
2
O)
6
]
2+
конфигурация
dsp
3
d
3d 4s 4p 4d
энергетически выгоднее конфигурации
91
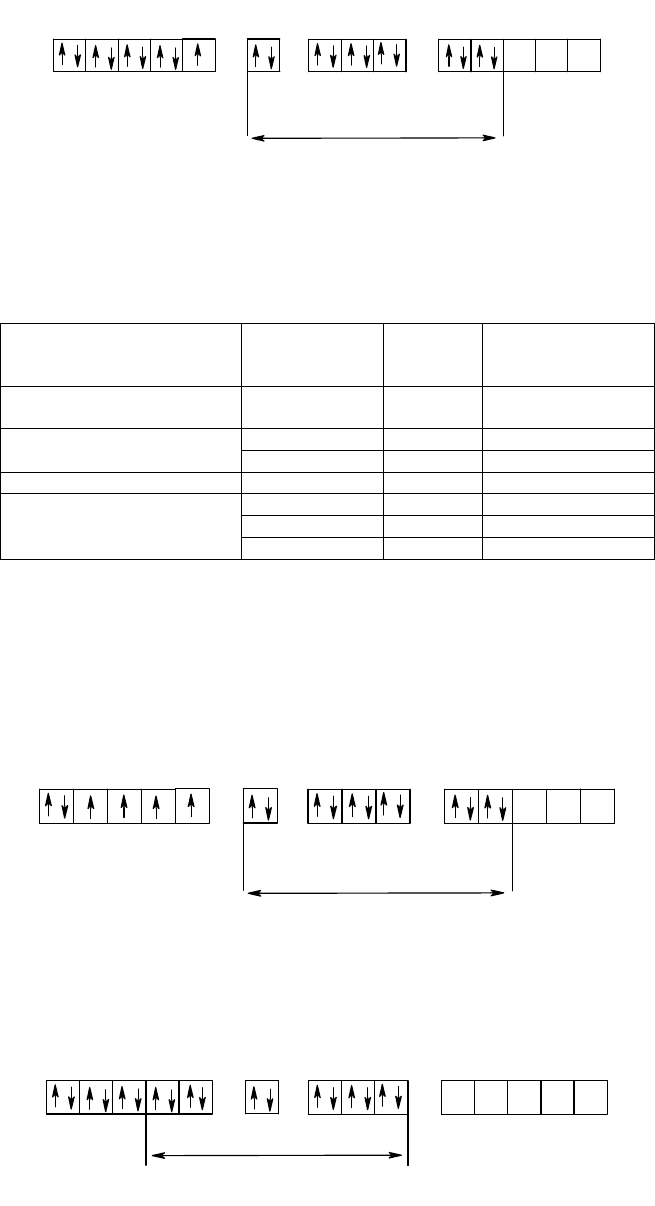
sp
3
d
2
3d 4s 4p 4d
Тип гибридизации центрального атома связан с координационным числом и определяет геометрическую
форму комплекса. Наиболее часто встречающиеся формы координационного многогранника и соответствующие
им типы гибридизации приведены в табл. 21.
Таблица 21
Формы координационного полиэдра и соответствующие им типы гибридизации
электронных орбиталей
Форма координационного
полиэдра
Тип
гибридизации КЧ Примеры
Линейная sp 2
[Ag(NH
3
)
2
]
+
,
[CuCl
2
]
-
Тетраэдрическая
sp
3
4 [Zn(NH
3
)
4
]
2+
d
3
s 4 [MnCl
4
]
2-
Квадратная dsp
2
4 [AuCl
4
]
-
Октаэдрическая
d
2
sp
3
6 [Fe(CN)
6
]
3-
sp
3
d
2
6 [Ni(NH
3
)
6
]
2+
dsp
3
d 6 [Cu(H
2
O)
6
]
2+
Метод валентных связей позволяет объяснить, почему данный комплекс имеет ту или иную форму, но не
позволяет предсказывать геометрию координационного полиэдра. Однако в ряде случаев эта задача может быть
решена, если воспользоваться методом ОЭПВО Гиллеспи (раздел 5.2.6.).
Используя метод валентных связей, можно также объяснить, почему данный комплекс является
парамагнитной или диамагнитной частицей. Так, например, комплекс [CoF
6
]
3-
является парамагнитным, а
комплекс [Co(CN)
6
]
3-
- диамагнитным. Этот факт связан с тем, что во фторидном комплексе наблюдается
внешняя гибридизация (sp
3
d
2
) и комплекс имеет 4 неспаренных электрона (высокоспиновый комплекс).
[CoF
6
]
3-
sp
3
d
2
3d 4s 4p 4d
В цианидном комплексе имеет место внутренняя гибридизация (d
2
sp
3
), сопровождающаяся спариванием
электронов атома кобальта на 3d-орбиталях, в результате чего комплекс не содержит неспаренных электронов
(низкоспиновый комплекс).
[Co(CN)
6
]
3-
d
2
sp
3
3d 4s 4p 4d
Однако следует отметить, что предсказать, будет ли данный комплекс парамагнитным или диамагнитным,
метод валентных связей не может.
6.2. Теория кристаллического поля
Основы теории кристаллического поля были заложены в 1929 году Бете; в дальнейшем она была развита в
работах Ван-Флека, Хартмана и Оргела. Эта теория применима как для кристаллов, так и для комплексов.
Теория кристаллического поля (ТКП) предполагает, что основным фактором, стабилизирующим
координационное соединение, является электростатическое взаимодействие центрального атома с лигандами,
92
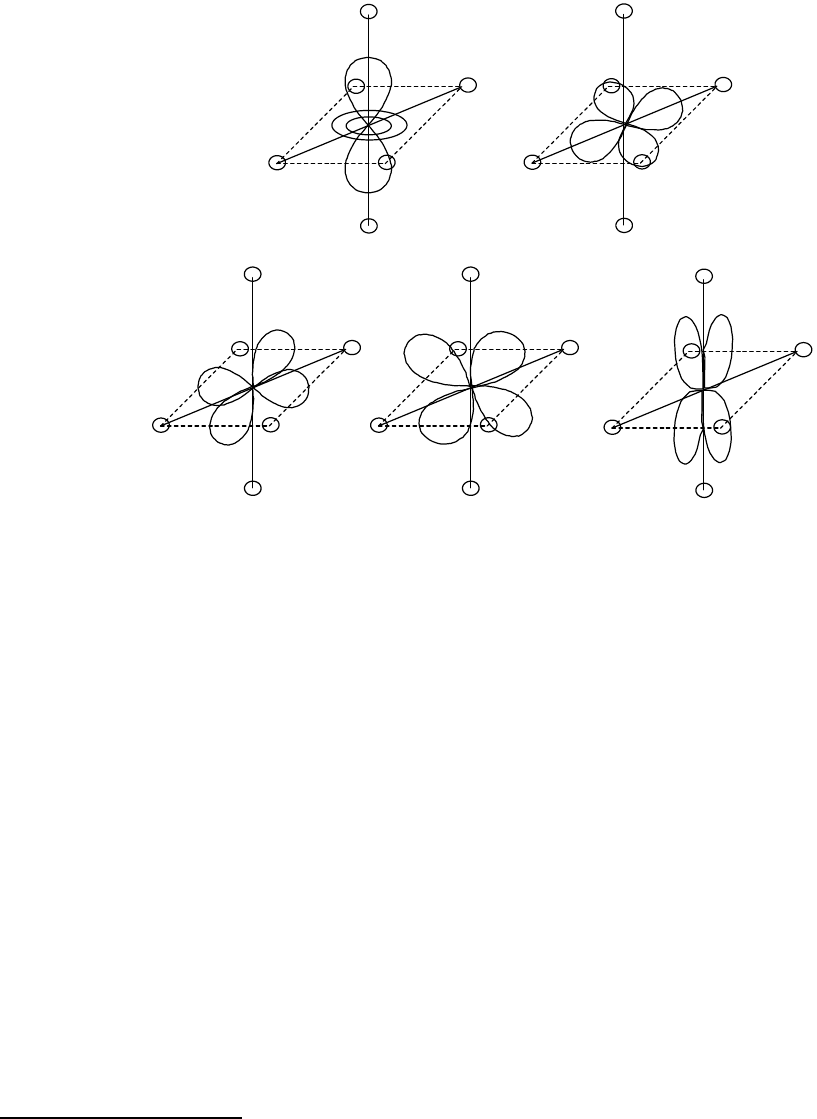
являющимися либо отрицательно заряженными ионами, либо полярными молекулами. При описании этого
взаимодействия центральный атом рассматривается с детальным учетом его электронной структуры. Лиганды
же фигурируют как бесструктурные источники внешнего электростатического поля определенной симметрии.
Электростатическое воздействие лигандов изменяет электронные орбитали центрального атома, в частности, их
энергию, что в свою очередь влияет на свойства координационного соединения.
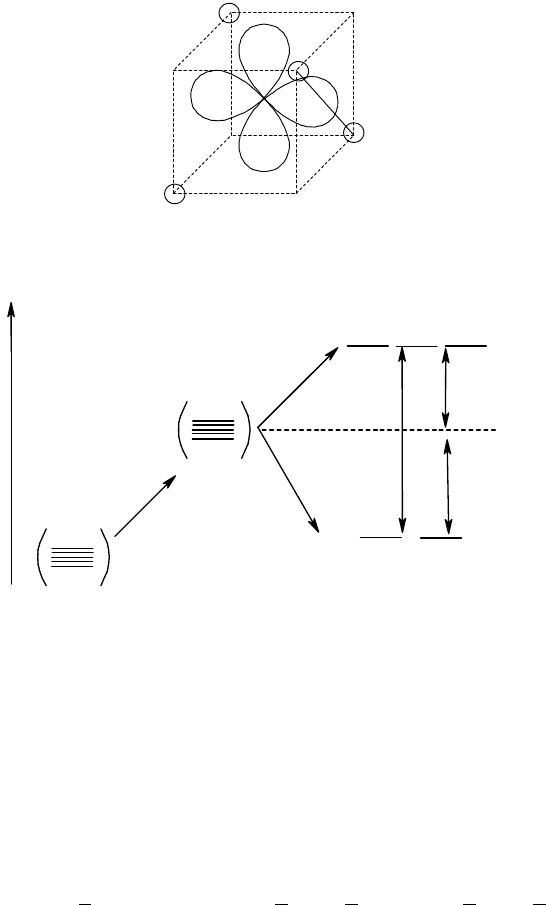
Рассмотрим взаимодействие d-орбиталей центрального атома с электростатическим полем, создаваемым
лигандами в октаэдрическом комплексе. Поместим центральный атом в центре координат, а лиганды - на
координатных осях. На рис. 35 показана ориентация d-орбиталей центрального атома относительно лигандов.
Совершенно очевидно, что сближение d-орбиталей с лигандами будет сопровождаться повышением энергии
этих орбиталей в результате увеличения отталкивания между электронами на этой d-орбитале ЦА и несущими
отрицательный заряд лигандами.
d
z
2 d
x
2-
y
2
d
xy
d
xz
d
yz
Рис. 35. Ориентация d-орбиталей в октаэдрическом поле лигандов
Пусть пятикратно вырожденный d-уровень ЦА характеризуется некоторой энергией (рис. З5). Если внести
этот ЦА в поле любой симметрии, энергия d-орбиталей повысится. В случае сферического поля, действующего
во всех направлениях одинаково, повышение энергии для всех d-орбиталей тоже будет одинаково, в результате
чего пятикратное вырождение уровня сохранится. Если же сосредоточить отрицательные заряды в вершинах
октаэдра, картина изменится. Как следует из рис. 36, в октаэдрическом поле пятикратно вырожденной d-уровень
расщепится на два уровня. Энергия орбиталей, ориентированных по координатным осям и сильно
сближающихся с лигандами (d
z
2
, d
x
2
-
y
2
) повысится. Эти орбитали образуют двукратно вырожденный уровень e
g
2
.
Орбитали d
xy
, d
xz
и d
yz
будут ориентированы по биссектрисам координатных углов; они образуют трехкратно
вырожденный уровень t
2g
, энергия которого ниже энергии уровня e
g
. Расщепление d-уровня не сказывается на
общей энергии пяти d-орбиталей: повышение энергии системы за счет двух e
g
-орбиталей равно понижению
энергии тремя орбиталями уровня t
2g
.
2
Символы e
g
и t
2g
заимствованы из теории групп; они обозначают соответственно двухкратное и трехкратное вырождение
уровня, симметричного относительно инверсии через центр симметрии.
93
Свободный
ион
Поле
сферической
симметрии
Октаэдрическое
поле
oкт
+0,6
-0,4
oкт
oкт
e
g
t
2g
Рис. 36. Расщепление d-подуровня в октаэдрическом поле.
Разность энергии уровней e
g
и t
2g
называется параметром расщепления (
окт
).
Для других типов кристаллического поля характер расщепления d-уровня может быть иным. В качестве
примера рассмотрим расщепление орбиталей по энергии в тетраэдрическом поле. Впишем в куб тетраэдр,
ориентируя координатные оси к середине граней этого куба (рис. 37) и расположим в принятой системе
координат d-орбитали.
По характеру взаимодействия с полем лиганда они разделятся на те же две группы, но орбитали уровня e
g
будут ориентированы между лигандами, и их энергия понизится, а орбитали уровня t
2g
- в направлении лигандов
(энергия этих орбиталей повысится). Энергетическая диаграмма расщепления d-уровня в тетраэдрическом поле
приведена на рис. 38.
Параметр расщепления является важной характеристикой комплекса. Его значения для различных
комплексов колеблются в пределах от 100 до 400 кДж/моль и зависят от следующих факторов:
1. Симметрия кристаллического поля. От нее зависит и число уровней, на которое расщепляется d-уровень,
и значение параметра расщепления. Так, например, параметр расщепления тетраэдрического комплекса
тетр
= 4/9
окт
Если в тетраэдрическом и октаэдрическом полях d-уровень подвергается двукратному расщеплению, то в
квадратном поле он расщепляется на четыре уровня.
x
y
z
d
z
2 d
x
2-
y
2
94
d
xz
Рис. 37. Ориентация d-орбиталей в тетраэдрическом поле лигандов
Свободный
ион
Поле
сферической
симметрии
Тетраэдрическое
поле
т
т
т
+0,4
-0,6
t
2
e
Рис. 38. Расщепление d-подуровня в тетраэдрическом поле
2. Природа центрального атома. Различным центральным атомам при одинаковой симметрии
кристаллического поля и одинаковых лигандах отвечают разные значения параметра расщепления. Так, для
октаэдрического поля значения
окт
возрастают в ряду:
Mn(II)Co(II)≈Ni(II)V(II)Fe(III)Cr(III)Mn(IV)Mo(III)Rh(III)Ir(III)Re(IV)Pt(IV).
3. Природа лиганда. Значение параметра расщепления возрастают в ряду:
I
-
Br
-
Cl
-
SCN
-
F
-
OH
-
H
2
O NCS
-
CN
-
NH
3
en NO
2
CN
-
(для амбидентатных лигандов подчеркнут атом, связанный с ЦА). Этот ряд называется спектрохимическим
рядом лигандов.
Теория кристаллического поля может быть использована для решения ряда практических задач. Так, эта
теория позволяет прогнозировать, будет ли данный комплекс высокоспиновым или низкоспиновым, и
количественно оценить магнитные свойства комплексов. Эти вопросы ТКП решает путем сопоставления двух
энергетических характеристик: параметра расщепления и энергии образования неподеленной электронной пары
на орбитале ЦА. Параметр расщепления комплекса () может быть определен экспериментально
спектроскопическими методами; энергия спаривания электронов (р) может быть рассчитана с использованием
математического аппарата квантовой механики. Рассмотрим этот вопрос на примере фторидного и аммиачного
комплексов кобальта(III), отвечающих формулам [CoF
6
]
3-
и [Co(NH
3
)
6
]
3+
. Оба эти комплекса являются
октаэдрическими; параметр расщепления для этих комплексов соответственно их положению в
спектрохимическом ряду составляет 156 кДж/моль для фторидного и 265 кДж/моль для аммиачного комплекса.
Энергия образования электронной пары для иона Со
3+
составляет 251 кДж/моль. Для каждого из комплексов
возможны два типа распределения шести электронов Со
3+
по e
g
и t
2g
-орбиталям (рис. 39). Для комплекса [CoF
6
]
3-
F
- < p,
в силу чего переход электрона с t
2g
-уровня на e
g
-уровень энергетически выгоднее образования электронной пары
на t
2g
-уровне (рис. 39, а). Комплекс [CoF
6
]
3-
будет высокоспиновым (случай слабого поля). Для комплекса
[Co(NH
3
)
6
]
3+
95
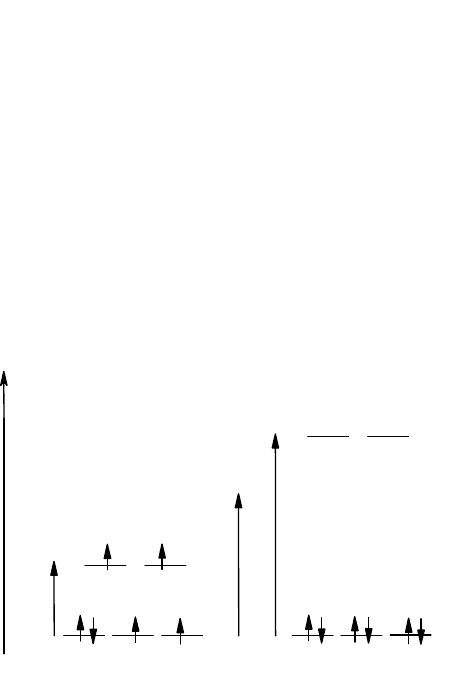
3
NH
Δ
>р,
в результате чего энергетически выгодным становится спаривание электронов на d-орбиталях ЦА (рис. 39, б) и
образование низкоспинового комплекса (случай сильного поля).
Используя теорию кристаллического поля, можно оценить относительную устойчивость комплексов с
различными центральными атомами. Так, среди комплексов V
3+
, Cr
3+
и Mn
3+
с одинаковыми лигандами наиболее
устойчивыми будут комплексы хрома(III). Действительно, в комплексах Сr
3+
(конфигурация d
3
) три неспаренных
электрона занимают три орбитали t
2g
-уровня. В случае V
2+
(конфигурация d
2
) на орбиталях t
2g
находится только
два неспаренных электрона, а в комплексах Мn
3+
(конфигурация d
4
) четвертый электрон либо попадает на е
g
-
уровень, либо образует пару на t
2g
-уровне. И то и другое сопровождается повышением энергии системы.
Используя теорию кристаллического поля, можно оценить относительную устойчивость комплексов с
различными центральными атомами. Так, среди комплексов V
3+
, Cr
3+
и Mn
3+
с одинаковыми лигандами наиболее
устойчивыми будут комплексы хрома(III). Действительно, в комплексах Сr
3+
(конфигурация d
3
) три неспаренных
электрона занимают три орбитали t
2g
-уровня. В случае V
2+
(конфигурация d
2
) на орбиталях t
2g
находится только
два неспаренных электрона, а в комплексах Мn
3+
(конфигурация d
4
) четвертый электрон либо попадает на е
g
-
уровень, либо образует пару на t
2g
-уровне. И то и другое сопровождается повышением энергии системы.
F
-
p
NH
3
e
g
e
g
t
2g
t
2g
E
Высокоспиновый Низкоспиновый
комплекс [CoF
6
]
3-
комплекс[Co(NH
3
)
6
]
3+
Рис. 39. Распределение электронов в высокоспиновых и низкоспиновых
октаэдрических комплексах кобальта(III)
Теория кристаллического поля позволяет ответить на вопрос, почему координационные соединения могут
быть как бесцветными, так и окрашенными. Окраска химического соединения связана со способностью
последнего поглощать кванты лучистой энергии определенных частот, соответствующие какому-либо из
разрешенных электронных переходов в частице. Чаcтица при этом приобретает цвет, дополнительный к
поглощенному. Энергии, соответствующие параметру расщепления, отвечают энергии квантов видимой части
спектра, откуда можно ожидать, что комплексы будут окрашены, если в них возможны электронные переходы
типа t
2g
е
g.
Так, например, как титан(III), так и титан(IV) образует октаэдрические аквакомплексы с
координационным числом 6. Комплекс [Ti(H
2
O)
6
]
3+
окрашен в пурпурно-фиолетовый цвет, комплекс [Ti(H
2
O)
6
]
4+
-
бесцветен. Это явление связано с тем, что Тi
4+
имеет конфигурацию d
0
, и переход t
2g
е
g
для него невозможен. По
той же причине бесцветны комплексы центральных атомов с конфигурацией d
10
(Zn
2+
, Cd
2+
и др.).
Ион Тi
3+
имеет конфигурацию d
1
и для него возможен переход t
2g
е
g
с энергией, равной параметру
расщепления (238 кДж/моль). Такой переход отвечает поглощению квантов желто-зеленой части спектра, что и
обусловливает фиолетовую окраску комплекса.
Теории кристаллического поля присущи и определенные недостатки. Главным из них является то, что эта
теория сводит взаимодействие в комплексе к электростатическому и, рассматривая лиганды как
неизменяющиеся частицы, пренебрегает возможностью образования ковалентных связей между центральным
атомом и лигандами. Это существенно ограничивает области применения теории кристаллического поля.
6.3. Метод молекулярных орбиталей
Метод молекулярных орбиталей является наиболее строгой и результативной теорией, объясняющей
строение и свойства координационных соединений. Этот подход, однако, значительно сложнее теории
кристаллического поля и связан с определенными расчетными трудностями.
При описании координационных соединений по методу МО прежде всего выделяют атомный базис - набор
атомных орбиталей центрального атома и лигандов, используемых в конструировании молекулярных орбиталей
комплекса. Далее для каждой орбитали центрального атома строится так называемая групповая орбиталь
лигандов (ГОЛ), представляющая собой комбинацию атомных орбиталей лигандов, имеющую ту же симметрию,
что и орбиталь центрального атома, и перекрывающаяся с ней. Линейно комбинируя орбитали центрального
атома и соответствующие ГОЛ, получают набор связывающих и разрыхляющих орбиталей комплекса. Если для
96

каких-то орбиталей центрального атома сконструировать ГОЛ невозможно, эти орбитали переходят в набор
молекулярных волновых функций как несвязывающие орбитали. После этого строят энергетическую диаграмму,
на которой распределяют электроны, что позволяет вынести заключения о свойствах комплекса.
Рассмотрим в качестве примера применение метода МО для не содержащих -связей октаэдрических
комплексов d-элементов. К таким комплексам можно отнести комплекс [Co(NH
3
)
6
]
3+
: поскольку в молекуле
аммиака неподеленная пара находится на sp
3
-гибридной орбитале, образование -связей между азотом и
кобальтом невозможно. В атомный базис такого комплекса войдут 9 атомных орбиталей центрального атома (4s,
4p
x
, 4p
y
, 4p
z
3
2
z
d
, 3
22
y-x
d
, 3d
xy
, 3d
xz
, 3d
yz
) и 6 орбиталей лигандов, которые мы обозначим символами
1
,
2
...
6
.
Таким образом, число конструируемых молекулярных орбиталей также должно равняться 15. Поместим атом
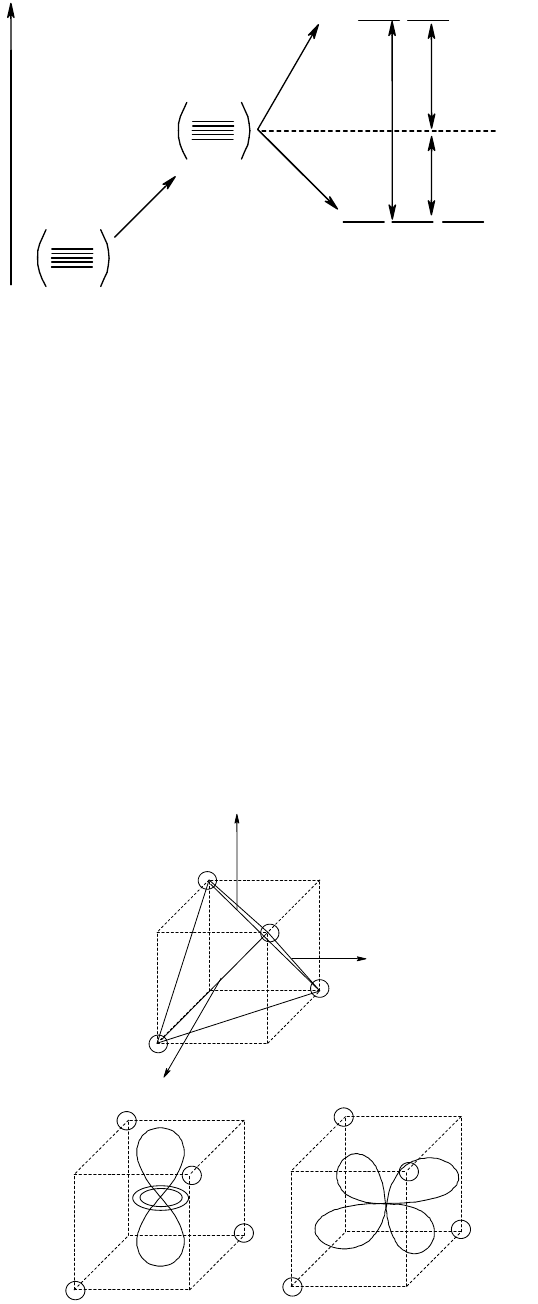
кобальта в центре координат, а лиганды расположим на координатных осях так, как это показано на рис. 40,а.
Для каждого лиганда координатная ось направлена от лиганда к центральному атому.
На рис. 40 представлены групповые орбитали лигандов, соответствующие по симметрии атомным
орбиталям центрального атома. Как следует из рис. 40,б, орбиталь 4s, имеющая сферическую симметрию,
одинаково перекрывается с орбиталями всех шести лигандов; это перекрывание будет положительным, если все
орбитали взяты со знаком плюс. Отсюда групповая орбиталь лигандов выразится уравнением:
ГОЛ(s) = N
1
(
1
+
2
+
3
+
4
+
5
+
6
)
где N
1
- нормирующий множитель, равный в данном случае 1/6 (способ расчета нормирующего множителя не
приводится). Линейно комбинируя орбитали 4s и ГОЛ(s), получим
св
s
(исходные орбитали складываются) и
р
s
(орбиталь ГОЛ(s) вычитается из орбитали 4s).
Орбиталь 4р
х
перекрывается только с
1
- и
3
-орбиталями (рис. 40,в), причем положительное перекрывание
наблюдается, если орбиталь
1
взята со знаком плюс, а
2
- со знаком минус. Аналогичное перекрывание (только
с другими парами -орбиталей) имеет место для орбиталей 4р
y
и 4р
z
, что приводит к уравнениям:
ГОЛ(p
x
) = N
2
(
1
-
3
)
ГОЛ(p
y
) = N
2
(
2
-
4
)
ГОЛ(p
z
) = N
2
(
5
-
6
)
(N = 1/2). Линейное комбинирование ГОЛ(р) и 4р-орбиталей даст три связывающие и три разрыхляющие
орбитали (
св
x
,
св
y
,
св
z
,
р
x
,
p
y
,
p
z
).
Для орбитали 3d
22
yx
, как следует из рис. 40,г,
ГОЛ(d
22
yx
) = N
3
(
1
+
3
-
2
-
4
)
97
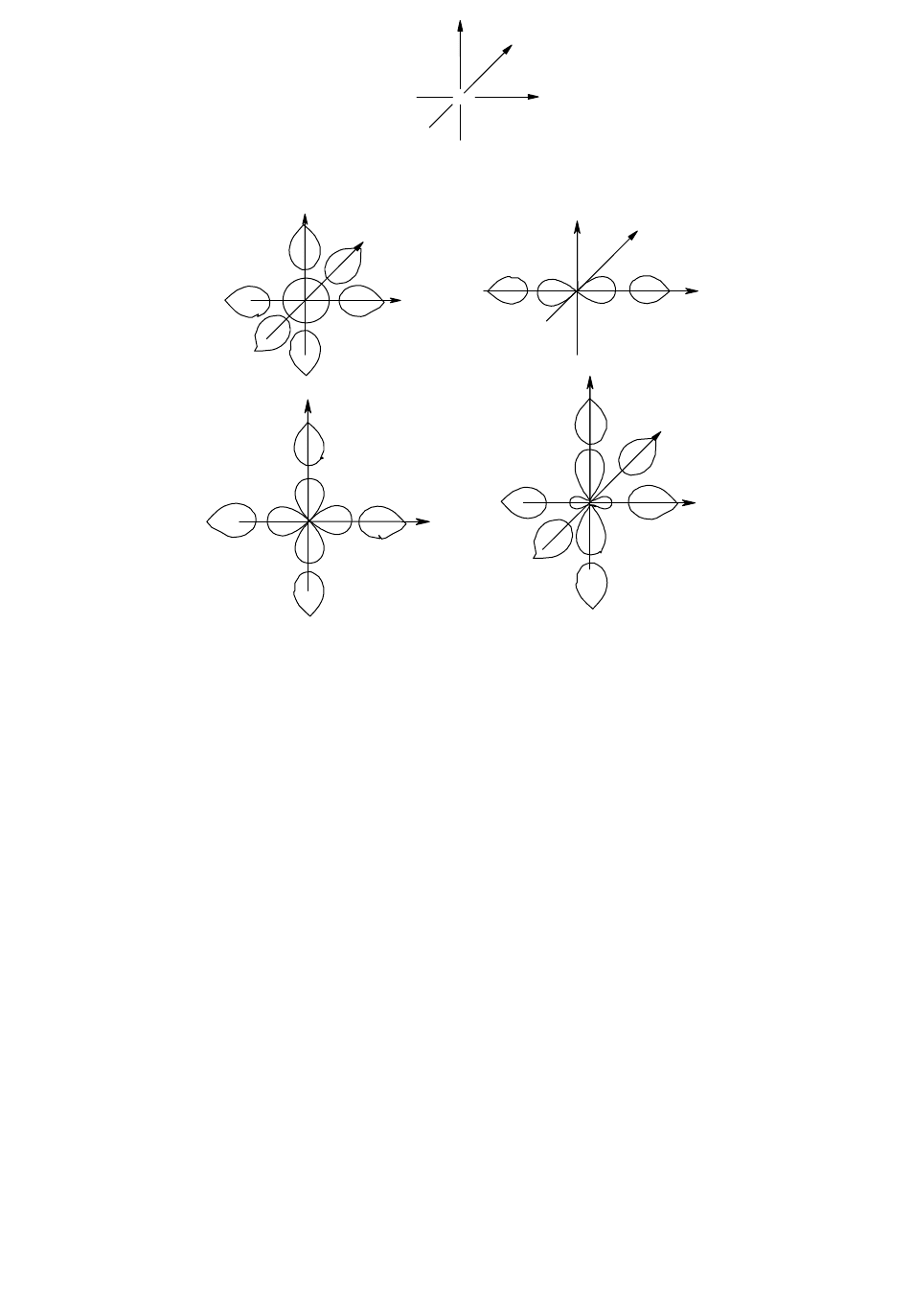
+
+
+
+
+
+
+
z
Co
x
y
z
+
+
z
-
-
+
y
x
x
y
+
+
+
+
-
-
-
-
x
y
+
+
+
+
-
-
-
-
x
y
z
a)
б)
в)
г)
д)
Рис. 40. Групповые орбитали лигандов в октаэдрическом комплексе и соответствующие им по симметрии
орбитали центрального атома
(N
3
= 1/2); из орбиталей 3d
22
yx
и ГОЛ(3d
22
yx
) конструируют орбитали
св
yx
22
и
p
yx
22
. Несколько
сложнее обстоит дело с d
2
z
-орбиталью. В этом случае орбитали
5
и
6
вносят больший вклад в ГОЛ( d
2
z
)-
орбитали, чем орбитали
1
,
2
,
3
, и
4
.
В соответствии с рис. 40,д, уравнение ГОЛ(d
2
z
) примет вид:
ГОЛ(d
2
z
) = N
4
(2
5
+ 2
6
-
1
-
2
-
3
-
4
)
(N = 1/23). Комбинирование этой волновой функции с 3d
2
z
-орбиталью дает орбитали
св
z
2
и
р
z
2
.
Для орбиталей 3d
xy
, 3d
xz
и 3d
yz
сконструировать ГОЛ невозможно. Поэтому указанные орбитали переходят в
комплекс как несвязывающие орбитали
нс
xy
,
нс
xz
и
нс
yz
.
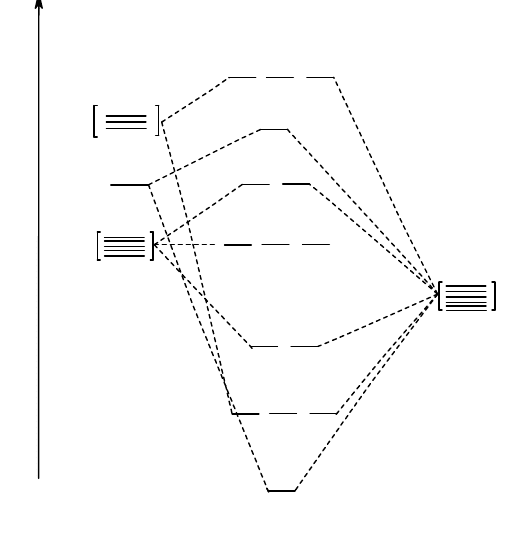
Энергетическая диаграмма молекулярных орбиталей октаэдрического комплекса без -связей приведена на
рис. 41. Эти пятнадцать молекулярных орбиталей распределяются по семи энергетическим уровням, из которых
два являются невырожденными, два - двукратно вырожденными и три - трехкратно вырожденными. Разность
энергий
p
d
-орбиталей и
нс
d
-орбиталей () соответствует параметру расщепления для данного комплекса.
Чем больше , тем правее в спектрохимическом ряду располагается лиганд.
Для того, чтобы описать тот или иной комплекс, необходимо распределить электроны этого комплекса по
молекулярным орбиталям на энергетической диаграмме. При этом особо важным является распределение
электронов по
нс
d
- и
p
d
-орбиталям, так как от него зависит, будет ли комплекс высокоспиновым или
низкоспиновым. В зависимости от значения и энергии образования электронной пары (р) возможно либо
образование электронных пар на орбиталях
нс
d
(р), либо заполнение орбиталей
нс
d
и
p
d
неспаренными
электронами (р). Так, например, для комплекса [Co(NH
3
)
6
]
3+
на молекулярных орбиталях необходимо
распределить 18 электронов (6 от иона Сo
3+
, имеющего конфигурацию d
6
, и 12 от шести молекул аммиака,
каждая из которых предоставляет для взаимодействия электронную пару). В связи с высоким значением для
аммиака рассматриваемому комплексу будет отвечать электронная формула (
св
s
)
2
(
св
р
)
6
(
св
d
)
4
(
нс
d
)
6
, а сам
комплекс будет низкоспиновым. В то же время комплексу [CoF
6
]
3-
соответствует электронная формула (
св
s
)
2
(
св
р
)
6
(
св
d
)
4
(
нс
d
)
4
(
p
d
)
2
в связи с малой величиной для иона фтора. Этот комплекс, имеющий 4 неспаренных
электрона, будет высокоспиновым.
98
Если в октаэдрических комплексах возможно образование -связей, число орбиталей атомного базиса
возрастет, так как в этом случае каждый лиганд может использовать для связи с центральным атомом три
орбитали (соответственно образованию одной - и двух -связей. В этом случае число молекулярных орбиталей
комплекса возрастет до 27. С применением метода МО при исследовании таких комплексов, а также комплексов
с иными формами координационного полиэдра (линейной, тетраэдрической, квадратной, пирамидальной)
читатель познакомится при изучении курсов "Квантовая химия" и "Химия координационных соединений".
E
АО
ЦА
МО
АОЛ
x
y
z
p
p
p
p
s
x
2
-y
2
x
2
-y
2
p
p
xy
xz
yz
нс
нс
нс
x
2
-y
2
св
св
x
y
z
св
св
св
св
s
1
6
-
ns
(n-1)d
np
Рис. 41. Энергетическая диаграмма молекулярных орбиталей для октаэдрического комплекса
(без учета -связей)
6.7. Реакции внешнесферного и внутрисферного замещения.
Принцип транс-влияния
Координационные соединения, подобно другим химическим соединениям, способны вступать в
разнообразные химические реакции как обменные, так и окислительно-восстановительные. Если подобные
реакции не сопровождаются изменением внутренней (координационной) сферы, то их относят к внешнесферным
реакциям. Примером внешнесферной реакции может служить взаимодействие сульфата гексаамминникеля(II) с
концентрированным раствором бромида калия:
[Ni(NH
3
)
6
]SO
4
+ 2KBr [Ni(NH
3
)
6
]Br
2
+ K
2
SO
4
(осадок)
Если в процессе взаимодействия внутренняя (координационная) сфера претерпевает изменения, то
протекающая реакция называется внутрисферной. Наиболее распространенным видом таких реакций являются
реакции внутрисферного замещения лигандов. Так, при действии на тетрахлороплатинат(II) водорода
концентрированным раствором аммиака протекает реакция:
H
2
[PtCl
4
] + 6NH
3
= [Pt(NH
3
)
4
]Cl
2
+ 2NH
4
Cl (6-2)
в результате которой ионы хлора замещаются на молекулы аммиака. Возможны также реакции замещения в
комплексе центрального атома.
Реакции внутрисферного замещения лигандов подчиняются определенным закономерностям, важнейшей из
которых является принцип транс-влияния, открытый И. И. Черняевым в 1926 г.
Принцип транс-влияния можно сформулировать следующим образом: Всякий лиганд оказывает влияние на
лиганд, находящийся по отношению к нему в транс-положении, увеличивая способность этого лиганда к
замещению (лабильность лиганда).
Различные лиганды по-разному воздействуют на транс-лиганды. По силе этого воздействия лиганды могут
быть расположены в так называемые ряды транс-влияния. Так, для платины(II) ряд трансвлияния имеет вид:
CN
¯
CO NO
2
¯
I
¯
Br
¯
Cl
¯
NH
3
OH
¯
H
2
O
99

В этом ряду слева направо способность повышать подвижность транс-лиганда понижается. Аналогичные ряды,
не слишком отличающиеся от приведенного, построены и для других центральных атомов (Pd(II), Pt(IV), Ir(III),
Rh(III), Co(III)). Совершенно очевидно, что транс-влияние наблюдается лишь в комплексах, для которых
возможно транс-положение лигандов (например, в квадратных и октаэдрических, но не в тетраэдрических
комплексах).
Механизм транс-влияния может быть объяснен в свете поляризационных представлений (Б. В. Некрасов,
1935 г.). Рассмотрим этот вопрос на примере квадратного комплекса [ML
4
]
2-
, где М - двухзарядный катион, а L -
однозарядные анионы L(1), L(2), L(3), L(4). Такой комплекс без обозначения зарядов центрального атома и
лигандов изображен на рис. 42,а.
-
-
-
-
+
+
+
+
+
+
+
+
-
-
-
-
L(1)
L(1)
L(4)
L(3)
L(1)
L(4)
L(3)
X
а)
б)
+
-
Рис. 42. Механизм транс-влияния лигандов
В этом комплексе центральный атом, несущий положительный эффективный заряд, поляризует лиганды,
индуцируя в них диполи, ориентированные отрицательным полюсом в сторону центрального атома. Лиганды
также поляризуют центральный атом, но поскольку все четыре диполя одинаковы, результирующий диполь
центрального атома будет равен нулю. Диполи лигандов, находящихся в транс-положении (например, L(1) L(3),
обращены друг к другу одноименными полюсами и взаимно друг друга отталкивают, повышая способность
лигандов к отщеплению.
Заменим лиганд L(1) лигандом Х, который сильнее поляризует центральный атом, чем лиганды L. В
результате в центральном атоме возникает некоторый результирующий диполь, упрочняющий связь
центрального атома с лигандом Х и ослабляющий связь его с лигандом K(3) (рис. 42,б). При протекании
следующей стадии реакции замещения именно лиганд К(3) проявит наибольшую подвижность и заместится
первым. Аналогичное явление наблюдается, если лигандами являются полярные молекулы.
Принцип транс-влияния позволяет предсказать ход многих реакций внутрисферного замещения и ответить,
будут ли продуктами этих реакций цис- или транс-изомеры соответствующих соединений. Рассмотрим этот
вопрос на примере образования дихлородиамминплатины - комплекса, имеющего цис- и транс-изомеры. Это
соединение может быть получено двумя путями: действием аммиака на тетрахлороплатинат(II) водорода и при
нагревании хлорида тетраамминплатины(II) по уравнениям
[PtCl
4
]
2-
+ 4NH
3
+ 2H
+
= [Pt(NH
3
)
2
Cl
2
] + 2NH
4
(6-3)
и
[Pt(NH
3
)
4
]Cl
2
= [Pt(NH
3
)
2
Cl
2
] + 2NH
3
(6-4)
Пусть комплекс [PtCl
4
]
2-
(рис. 43, а) взаимодействует с аммиаком.
Pt
Cl Cl
Cl Cl
+ NH
3
- Cl
Pt
Cl Cl
Cl NH
3
+ NH
3
- Cl
Pt
Cl NH
3
Cl NH
3
2 1
3 4
2 1
2 1
3 4
3 4
à) á) â)
Рис. 43. Образование цис-изомера [Pt(NH
3
)
2
Cl
2
]
Ионы хлора замещаются на молекулы аммиака последовательно. В комплексе [PtCl
4
]
2-
все ионы Сl
-
испытывают одинаковое транс-влияние со стороны таких же ионов хлора и на первой стадии процесса
100
