Ковда В.А., Розанов Б.Г. (ред.) Почвоведение. Часть 1 Почва и почвообразование
Подождите немного. Документ загружается.

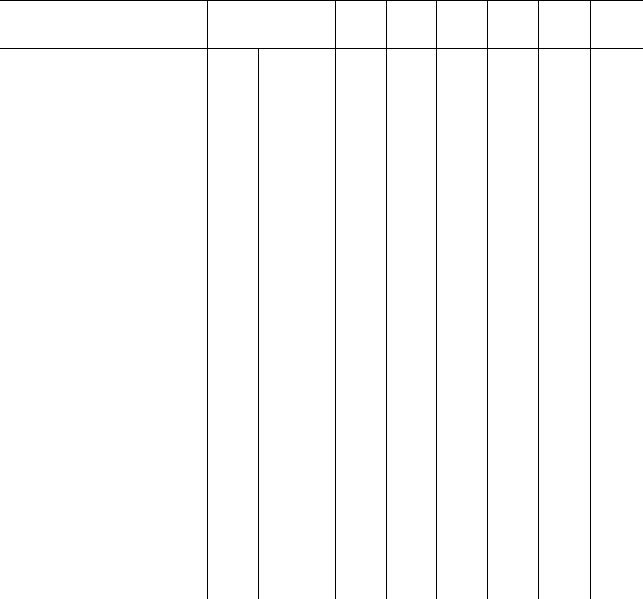
Таблица 35. Обменные катионы и емкость поглощения (ЕКО)
основных типов почв, мг-экв/100 г (Н. И. Горбунов, 1978)
Почва
Горизонт и глу
бина, см
Са
2+
Mg
2+
К
+
Na
+
H
+
+Al
3+
ЕКО
Дерново-среднеподзоли-
стая
А
1
— 5
28,1
6,6
Нет
Нет
10,5 45,2
Дерново-среднеподзоли-
стая
Е
20—30
1,9 1,4
» »
1,2
4,4
Дерново-среднеподзоли-
стая
В
50—60
6,2 2,1
» »
6,5 14,8
Дерново-среднеподзоли-
стая
С
180—190
4,4 2,9
» »
1,0
8,3
Темно-серая лесная А
0—7
35,4
3,5
Следы
«
Нет
38,9
Темно-серая лесная
АЕ
20—30
14,3 2,0
» » »
16,3
Темно-серая лесная
В
70—80
11,9
3,0
» »
1,0
15,9
Темно-серая лесная
ВС
170—180
14,9
3,0
» »
0,8 18,7
Чернозем типичный
А 0—10
43,9
9,6
0,2
0,1
Нет 53,7
Чернозем типичный
АВ
70—80
27,8
9,6
0,1 0,05
»
37,5
Чернозем типичный
С
160—170
27,6 9,5
0,1
0,05
»
37,2
Солонец степной
А 0—5
10,3
5,1
1,5
0,5
»
17,2
Солонец степной
Впа
18—23
16,1 9,3
1,3
2,4
»
29,1
Солонец степной
В2
45—50
17,1
8,0 1,4
2,5
»
29,4
Солонец степной
С
95—100
14,0 6,5
1,5
2,7
»
24,7
Солонец осолоделый
А 0—10
11,5 2,5
1,6
0,4
»
16,0
Солонец осолоделый
Е
20—25
7,4 2,0 0,8 0,4
»
10,6
Солонец осолоделый
ВС
50—60
17,5
5,7
2,3 0,9
»
26,4
Солонец осолоделый
С
100—110
18,0
8,9
2,5 0,9
»
30,3
Серозем
А 0—5
7,8
0,4
0,1
0,2
» 8,5
Серозем
АВ
20—25
6,8
0,9 0,1 0,2
»
8,0
Серозем
С
70—75
4,1
4,2
0,1
0,2
»
8,6
Желтозем
А
0—8
7,2
4,7
Нет Нет 0,2
12,1
Желтозем
В
45—55
6,6
2,5
» »
4,4 13,5
Желтозем
С
120—130
6,5
3,0
» »
7,3 16,8
Краснозем А
0—10 2,4
1,7
» »
7,2 11,4
Краснозем
В
30—40
2,8
1,3
» »
5,1
9,3
Краснозем
С
150—200
0,3 0,9
» »
10,8 12,0
быть приведено к виду уравнения закона действующих масс.
В одних случаях было установлено строгое подчинение ионооб-
менных реакций этому закону, в других — коэффициенты ионно-
го обмена являлись величинами переменными Наилучшее сов-
падение с экспериментальными данными обнаружено при исполь-
зовании логарифмической изотермы сорбции.
Общее количество всех поглощенных (обменных) катионов,
которые могут быть вытеснены из почвы, называется емкостью
поглощения или емкостью катионного обмена (ЕКО) (понятие
введено К. К. Гедройцем) и выражается в миллиграмм-эквива-
лентах на 100 г почвы. ЕКО зависит от содержания в почве
коллоидной и предколлоидной фракций, строения их поверхно-
стей, природы почвенного поглощающего комплекса, реакции
среды (табл. 34 и 35) При увеличении степени дисперсности
входящих в состав поглощающего комплекса коллоидных и пред-
коллоидных частиц емкость поглощения катионов возрастает
Органическая часть почвенного поглощающего комплекса обла-
дает значительно большей емкостью поглощения, чем минераль-
ная Высокая емкость поглощения минералов монтмориллонито-
188
вой группы обусловлена расши-
рением при увлажнении меж-
плоскостных пространств и об-
меном расположенных в меж-
плоскостных пространствах ка-
тионов на катионы взаимодей-
ствующих растворов (табл.34).
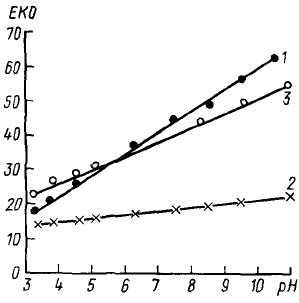
С ростом рН возрастает
ионизация функциональных
групп гумусовых кислот, гли-
нистых минералов, уменьшает-
ся положительный заряд полу-
торных оксидов и возрастает
ЕКО (рис. 38). Соответственно
определение ЕКО почв должно
проводиться при определенном
стандартном рН.
9.5. Сорбция анионов
почвами
Сорбция анионов зависит от заряда, строения и химических
свойств почвенного поглощающего комплекса. По способности
сорбироваться на почвенных частицах анионы располагаются в
следующий ряд:
Сl
-
~NO
-
3
< SO
2-
4
<< РO
3-
4
< SiO
4-
4
< ОН
-
По мере увеличения в почвенном поглощающем комплексе
содержания алюминия и железа и наличия сколов почвенных
минералов, а также при понижении рН среды сорбция анионов
возрастает. Так как анионы менее гидратированы, чем катионы,
они характеризуются высокой селективностью поглощения.
Анионы Сl
-
и NO
3-
практически не поглощаются почвой.
Известна отрицательная сорбция Сl
-
и NO
-
3
, которая впервые
была описана К. К. Гедройцем как отрицательное поглощение
веществ. Отрицательная сорбция этих анионов обусловлена
снижением их концентрации во внутренней части сорбционной
пленки, за счет чего концентрация анионов в более рыхло свя-
занных, а следовательно, и в более подвижных слоях водной
пленки возрастает. Отрицательная адсорбция нитратов усиливает
процессы вымывания их из почвы, что приводит к обеднению
почв соединениями азота. Отрицательная адсорбция хлоридов
благоприятствует быстрой промывке почв при хлоридном засо-
лении.
В поглощении анионов большую роль играют процессы соле-
образования. При взаимодействии растворимых солей образуют-
ся новые, нерастворимые в воде соли (сульфаты, карбонаты,
фосфаты), переходящие в твердую фазу почвы. Таким -путем
Рис. 38. Зависимость ЕКО от рН рав-
новесного раствора (М. Б. Минкин
и др., 1981):
1—чернозем обыкновенный (0—20 см);
2 — солонец степной средний (0—12 см);
3—солонец степной средний (13—21 см)
189
интенсивно поглощаются почвой ионы H
2
PO
-
4
, HPO
2-
4
, PO
3-
4
.
Однако механизм поглощения фосфат-ионов почвами сложен и
разнообразен Можно выделить следующие виды поглощения
почвой фосфат-ионов:
1) образование малорастворимых фосфатов в результате
взаимодействия внесенных в почву растворимых фосфатов с со-
лями почвенного раствора (химическое поглощение). Такой вид
поглощения возможен во многих почвах при наличии ионов
кальция, алюминия, железа при нейтральной или щелочной
реакции среды;
2) образование слаборастворимых фосфатов с катионами
поглощающего комплекса после вытеснения их катионами раст-
вора;
3) поглощение фосфат-ионов при взаимодействии их с мине-
ралами-солями; гипсом, кальцитом, доломитом. Часть фосфат-
иона связывается с кальцием, перешедшим в раствор Возможно
поглощение фосфат-иона на поверхности минералов без вытесне-
ния кальция, частичное окклюдирование фосфата в минерале;
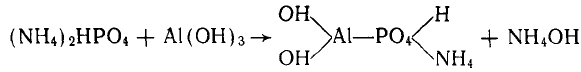
4) хемосорбция фосфат-ионов гидроксидами алюминия и же-
леза. Связь осуществляется с твердой фазой на внешней поверх-
ности коллоида. Одна из схем реакции:
190
При этом поглощение фосфат-ионов сильно зависит от дисперс-
ности. Свежеосажденные оксиды поглощают фосфаты в большом
количестве (Р
2
О
5
составляет 10—15% от массы поглотителя).
При кристаллизации полуторных оксидов (уменьшении внешней
поверхности) поглощение фосфатов уменьшается в 10 раз,
5) поглощение фосфат-ионов глинистыми и неглинистыми
алюмо- и ферросиликатными минералами. На внешней, иногда
на внутренней поверхности минералов происходит необменное
поглощение фосфат-иона. При этом фосфат-ион адсорбируется
в потенциалопределяюще.м слое отрицательных коллоидов, при-
тягиваясь к Аl кристаллической решетки;
6) возможна обменная сорбция анионов на положительно
заряженных участках коллоидной мицеллы:
ОН
-
[ППК]
+
ОН
-
+ К
3
РO
4
—> [ППК]
+
РО
3-
4
+ 3КОН
OH
-
2КОН + СO
2
—>К
2
СO
3
+ Н
2
O
7) аморфный кремнезем поглощает фосфаты путем механи-
ческого захвата — окклюдирования
Органические вещества, насыщенные основаниями, также
поглощают фосфаты, но значительно меньше, чем полуторные
оксиды и глинистые минералы (табл 36). Поглощение фосфатов

Таблица 36. Поглощение фосфат-иона различными минеральными сорбентами
из раствора Са(Н
2
РО
4
) , содержащего 600 мг/л Р
2
O
5
Сорбент
Поглощено
Р
2
O
5
, мг/100г
Сорбент
Поглощено
Р
2
О
5
, мг/100 г
Гель гидроксида алюми-
ния
Гель гидроксида железа
Окристаллизованная
форма гидроксида желе-
за (гематит)
Кварц
Кварц, покрытый пленкой
Fe(OH)
3
Аморфный кремнезем
1700
1100
760
0
296
46
Хлорит
Монтмориллонит нат-
риевый
Монтмориллонит каль-
циевый
Каолинит
Гипс
Кальцит
Гидрослюда
600
197
300
127
249
165
170
приводит к накоплению фосфора в почве, но снижает степень
доступности его растениям. Уменьшение поглощения фосфатов
может происходить за счет образования комплексных алюмо-
и железогумусовых соединений.
9.6. Физическое состояние почвенных коллоидов
Коллоиды в почве находятся главным образом в форме гелей,
в которых частицы сцепляются между собой и образуют прост-
ранственную структурную сетку, в ячейках которой удерживается
вода. Во влажной почве небольшое количество коллоидов может
находиться в состоянии золя (частицы разделены водной фазой).
Раздельное существование коллоидных частиц в состоянии золя
связано с наличием электрокинетического потенциала и водной
(гидратационной) оболочки на поверхности частиц. Одноименно
заряженные частицы отталкиваются друг от друга, м.огут долго
находиться в суспензии, не образуя осадка.
При падении электрокинетического потенциала и уменьшении
заряда частиц разноименно заряженные коллоиды, сталкиваясь
друг с другом при хаотическом движении, склеиваются, увеличи-
ваются в размерах и выпадают в осадок. Процесс соединения
коллоидных частиц и образования геля из золя называется
коагуляцией, дальнейшее осаждение — седиментацией. Переход
коллоида из состояния геля в состояние золя называется пепти-
зацией. Коллоиды, которые могут легко переходить из золя в гель
и обратно, называются обратимыми. В почве много коллоидов,
трудно переходящих в состояние золя и составляющих группу
необратимых коллоидов.
Взаимодействию и соединению коллоидных частиц мешают
водные пленки, которые удерживаются на их поверхности. По
количеству воды, удерживаемой коллоидами, они разделяются
на гидрофильные и гидрофобные. Гидрофильные коллоиды силь-
но гидратированы, труднее коагулируют. К ним относятся неко-
торые органические вещества, встречающиеся в почвах, минера-
191
лы монтмориллонитовой группы. Гидрофобные коллоиды содер-
жат небольшое количество воды. Это — гидроксид железа, мине-
ралы каолинитовой группы. Деление коллоидов на гидрофильные
и гидрофобные несколько условно, поскольку при измельчении
твердых коллоидных частиц степень гидратации их возрастает.
Физическое состояние коллоидов в значительной степени за-
висит от состава поглощенных катионов. Чем больше валент-
ность поглощенных ионов, больше их заряд, тем меньше будет
диссоциация их от коллоидной частицы, меньше электрокинети-
ческий потенциал частицы, тем легче идет процесс коагуляции.
К К. Гедройц расположил все катионы но их коагулирующей
способности в ряд, который он назвал лиотропным:
Li
+
< Na
+
< NH
4
+
< K
+
< Mg
2+
< H
+
< Ca
2+
< Ba
2+
< Al
3+
<
<Fe
3+
Коллоиды, насыщенные одновалентными катионами, находят-
ся в основном в состоянии золя; при замене одновалентных
катионов двух- и трехвалентными они переходят в гель. Так,
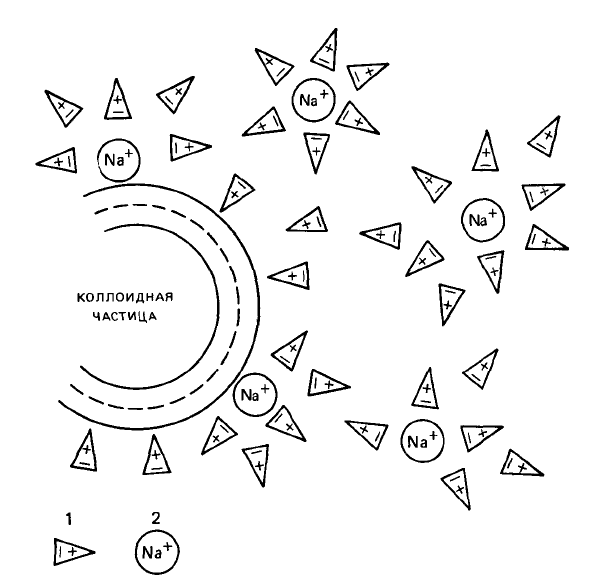
насыщение почвенного поглощающего комплекса натрием спо-
собствует образованию золя, распылению почвы, увеличению
Рис 39 Гидратация коллоидной частицы и
ионов натрия (Н И Горбунов)
1 — молекулы воды, 2 — ионы натрия
192
заряда почвенных коллоидов и их гидратации (рис. 39). Заме-
щение натрия кальцием способствует коагуляции и образованию
водопрочной структуры.
Реакция почвы также влияет на состояние коллоидов. Кислая
реакция способствует растворению некоторых коллоидов, напри-
мер гидроксида алюминия; щелочная реакция стимулирует выпа-
дение в осадок коллоидов полуторных оксидов и переход в со-
стояние золя органических и некоторых минеральных коллоидов.
Часть коллоидов в почве находится в свободном состоянии,
часть образует пленки на поверхности более крупных грануло-
метрических фракций путем адгезии, под которой понимается
слипание (склеивание) поверхностей каких-либо веществ раз-
личного химического состава, соприкасающихся друг с другом.
Таким путем в почве при периодическом высушивании, приво-
дящем к дегидратации коллоидов, происходит закрепление гуму-
совых кислот и их солей на поверхности коллоидных частиц, а
минеральных, органических и органоминеральных коллоидов —
на поверхности частиц пылеватых и песчаных гранулометри-
ческих фракций
Особым явлением представляется процесс тиксотропии колло-
идов. Она имеет две особенности: 1) образующийся из золя гель
не отделяется от дисперсной среды, а застудневает вместе с ней;
2) полученный гель обратим и может быть переведен в золь
путем механического воздействия (встряхивания, помешивания),
по прекращению которого золь снова с течением времени перехо-
дит в гель. В почвах результатом тиксотропии является возник-
новение особого рода коагуляционно-тиксотропной микрострук-
туры, которая характеризуется образованием рыхлого каркаса
из коллоидных частичек в основном удлиненной формы, внутри
которого находится почвенный раствор. Тиксотропия особенно
развита в криогенных почвах, вызывая их плывунность. Тиксо-
тропные почвы плохо проницаемы для воды и воздуха, в них
часто развиваются восстановительные процессы.
В почве под влиянием различных факторов — периодическое
высушивание, нагревание, увлажнение, промораживание, изме-
нение реакции среды и др. — происходит изменение вновь обра-
зующихся при выветривании и почвообразовании органических
и минеральных коллоидов. Одним из таких изменений является
процесс старения коллоидов, под которым понимается самопро-
извольное уменьшение их свободной поверхностной энергии.
Старение обычно не сопровождается изменением химического
и минералогического состава коллоидов, но при этом резко из-
меняются их свойства: они становятся более гидрофобными,
уменьшается их сорбционная способность, связь с дисперсионной
средой, может произойти частичная кристаллизация гелей. Для
некоторых коллоидов причиной старения является окисление ки-
слородом воздуха, например переход оксида Fe (II) в оксид
Fе (III). Свет, особенно ультрафиолетовое излучение, ускоряет
старение коллоидов.
7-817
193
9.7. Экологическое значение поглотительной
способности
Поглотительная способность почвы — одно из ее важнейших
свойств, в значительной степени определяющее плодородие поч-
вы и характер процессов почвообразования. Она обеспечивает и
регулирует питательный режим почвы, способствует накоплению
многих элементов минерального питания растений, регулирует
реакцию почвы, ее водно-физические свойства.
На свойства почвы и условия произрастания растений боль-
шое влияние оказывает состав обменных катионов. Так, у почв,
насыщенных кальцием, реакция близка к нейтральной; коллои-
ды находятся в состоянии необратимых гелей и не подвергаются
пептизации при избытке влаги; почвы хорошо оструктурены,
обладают благоприятными физическими свойствами. Черноземы
являются примером таких почв. Почвы, у которых в составе
обменных катионов в значительном количестве ионы натрия,
имеют щелочную реакцию, отрицательно влияющую на состояние
коллоидов и рост растений. Насыщенные натрием коллоиды легко
пептизируются; содержащие их почвы плохо оструктурены, име-
ют неблагоприятные водно-физические свойства: повышенную
плотность, плохую водопроницаемость, слабую водоотдачу, низ-
кую доступность почвенной влаги (солонцы, солонцеватые поч-
вы).
При наличии в почвенном поглощающем комплексе в составе
обменных катионов значительного количества Н
+
и Аl
3+
коллои-
ды легко разрушаются в результате кислотного гидролиза, почвы
плохо оструктурены.
Глава десятая
кислотность и ЩЕЛОЧНОСТЬ почв
10.1. Кислотно-основная характеристика почвы
Реакция почвы обусловлена наличием и соотношением в поч-
венном растворе водородных (H
+
) и гидроксильных (ОН
-
)
ионов и характеризуется рН — отрицательным логарифмом ак-
тивности водородных ионов в растворе. В зависимости от состава
растворенных веществ и характера их взаимодействия с твердой
фазой почв, определяющих соотношение между концентрациями
водородных и гидроксильных ионов в почвенном растворе, почвы
могут иметь нейтральную (рН 7), кислую (рН<7)или щелочную
(рН>7) реакцию.
Реакция почвы зависит от совокупного действия ряда факто-
ров: химического и минералогического состава минеральной
части почвы, наличия свободных солей, содержания и качества
194
органического вещества, состава почвенного воздуха, влажности
почвы, жизнедеятельности организмов. Важнейшим регулятором
реакции почвы являются находящиеся в ней соли. Нейтральные,
кислые, щелочные соли, переходя из твердой фазы в раствор при
увлажнении и обратно при иссушении, оказывают соответствую-
щее влияние на характер реакции почвенного раствора, что
отзывается и на плодородии почв.
Одной из наиболее распространенных в почве минеральных
кислот является угольная кислота. В зависимости от термодина-
мических условий и биологической активности она может под-
держивать рН почвы в пределах 3,9—4,5—5,7. Режим углекисло-
ты в почвах тесно связан с суточно-сезонными ритмами погоды,
с активностью микроорганизмов.
При окислении сернистых металлов (сульфидов) в почвах и
почвообразующих породах может образоваться серная кислота,
которая вызывает сильное подкисление почв (при осушении манг-
ровых или маршевых почв их рН может упасть с 7—8 до 2—3).
Значительное подкисление почвенного раствора могут вызывать
ненасыщенные катионами гуминовые кислоты и фульвокислоты
(рН может снижаться до 3—3,5). Малоразложившиеся остатки
органического вещества лесной подстилки имеют рН 3,5—5,
мхов — 2,5—3. В результате жизнедеятельности грибов и бакте-
рий, разложения растительного опада, выделения корнями или
насекомыми в почве могут присутствовать свободные органические
кислоты типа уксусной, щавелевой, лимонной и др.
В процессе своей жизнедеятельности растения, потребляя из
почвы в различных пропорциях анионы и катионы, выделяя в
почву эквивалентное количество ионов Н
+
, ОН
-
, НСО
-
3
, СО
2-
3
,
могут вызывать сдвиг реакции почвенного раствора в ту или
иную сторону. Значительная роль в регулировании реакции поч-
венного раствора принадлежит микроорганизмам. Деятельность
нитрификаторов может вызвать появление на короткое время в
почвенном растворе азотной и азотистой кислот и снизить рН
на 0,5—2,0. При разложении белков под воздействием микроор-
ганизмов происходит поступление в раствор небольшого количе-
ства серной кислоты.
Кислотно-основные свойства любого соединения (кислота,
основание или соль) оцениваются исходя из теории кислот и
оснований Бренстеда—Лоури. Согласно этой теории кислотой
считается любое вещество, способное отдавать протон (Н
+
),
переходя при этом в сопряженное с ней основание. Основание —
вещество, которое может присоединять протон, превращаясь в
сопряженную с ним кислоту. В водных растворах кислоты отдают
протоны воде, основания принимают протон от воды:
СН
3
СООН + Н
2
О<—>СН
3
СОО
-
+ Н
3
О
+
Отдавая протон воде, уксусная кислота превращается в основа-
ние СН
3
СОО
-
; вода, играя роль основания и принимая протон
от СН
3
СООН, переходит в кислоту Н
3
O
+
.
7*
195
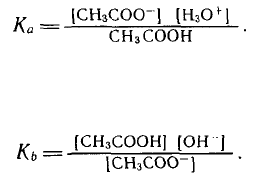
Кислотные и основные свойства могут проявить молекулярные
соединения (НСl — кислота, NH
3
— основание), катионы
[Рb(Н
2
O)
2+
4
— кислота, Рb(Н
2
O)
3
ОН
+
— основание] и анионы
[НСО
-
3 — кислота, СО
2-
3
— основание).
Сила кислот и оснований количественно оценивается конс-
тантой равновесия реакции переноса протона между компонента-
ми кислотно-основных пар. В состав одного из них входит изу-
чаемое соединение, в состав второго — молекула растворителя
(Н
2
О). Константу, характеризующую перенос протона от кисло-
ты к молекуле воды, обозначают символом К
а
(acid — кис-
лота) ;
10.2. Кислотность почв
Различают актуальную (активную) и потенциальную кислот-
ность почв в зависимости от того, при каком взаимодействии
она проявляется и измеряется.
Актуальная кислотность почвы обусловлена наличием водо-
родных ионов (протонов) в почвенном растворе, активность
которых зависит от свойств (ионной силы) раствора, влияющих
на коэффициент активности иона. Актуальная кислотность почвы
измеряется при взаимодействии почвы с дистиллированной водой
[водный рН, рНн
2
о, рН (Н
2
O)] при разбавлении 1:2,5 либо в
пасте. Иногда рН почвы измеряют непосредственно в почве при
естественной влажности, но для этого она должна быть доста-
точно увлажненной и гомогенной для обеспечения надежного
контакта с измерительным электродом. Можно актуальную кис-
лотность почвы измерять и колориметрически или путем титро-
вания.
Потенциальная кислотность — способность почвы при взаимо-
действии с растворами солей проявлять себя как слабая кислота.
Потенциальная кислотность определяется свойствами твердой
196
(37)
Обратный процесс переноса протона от воды к основанию
характеризует константа равновесия Кь (base — основание):
(38)
Произведение констант К
а
и К
b
любой сопряженной кислот-
но-основной пары равно ионному произведению растворителя
(воды):
К
a
К
b
= [Н
3
O
+
] [ОН
-
] =[Н
+
] [ОН
-
] = К
H2O
= 10
-14
. (39)
фазы почвы, обусловливающей появление дополнительного коли-
чества протонов в растворе при взаимодействиях с удобрениями
или химикатами.
Кислая реакция солевых вытяжек из почв объясняется появ-
лением в растворе ионов водорода (гидроксония Н
3
О
+
) в резуль-
тате вытеснения из почвенного поглощающего комплекса, а так-
же взаимодействия с водой молекулярных кислот и гидратиро-
ванных катионов. Гидратированные катионы при этом можно
рассматривать как кислоты (Бренстед — Лоури). Наиболее
сильные кислотные свойства в воде проявляют двух- и особенно
трехзарядные катионы металлов:
рК
а
pK
b
5,0 Аl(Н
2
O)
3+
6
+Н
2
O<—>Аl(Н
2
O)
5
ОН
2+
+Н
3
О
+
9,0
3,8 Сr(Н
2
O)
3+
6
+Н
2
О<—>Сr(Н
2
О)
5
ОН
2+
+Н
3
O+ 10,2
2,2 Fe(H
2
O)
3+
6
+H
2
O<—>Fe(H
2
O)
5
OH
2+
+H
3
O
-
11,8
В зависимости от характера взаимодействующего с почвой
раствора различают две формы потенциальной кислотности
почв — обменную и гидролитическую, характеризующиеся как
последовательные этапы выделения в раствор дополнительных
количеств протонов из твердой фазы.
Обменная кислотность обнаруживается при взаимодействии
с почвой растворов нейтральных солей. При этом происходит
эквивалентный обмен катиона нейтральной соли на ионы водоро-
да, алюминия и другие, находящиеся в поглощающем комплексе.
Обычно для определения обменной кислотности почв используют
1 н. раствор КСl (рН около 6,0).
Природа обменной кислотности зависит от состава и свойств
почвенных коллоидов. Кислотность органических почвенных
коллоидов (гумусовые кислоты) обусловлена главным образом
обменным водородом, причем непосредственным источником об-
менного водорода служат органические кислоты, включая гуму-
совые, и угольная кислота. При взаимодействии с коллоидами
водород этих кислот внедряется в их диффузный слой, занимая
место оснований, которые выщелачиваются или выпадают в
осадок:
[ППК
2-
]Са
2+
+R(COOH)
2
—>[ППК
2-
]2Н
+
+R(COO
-
]
2
Ca
[ППК
2-
]Са
2+
+Н
2
СО
з
—>[ППК
2-
]2Н
+
+СаСO
3
Кислотность минеральных коллоидов связана с наличием в
почвенном поглощающем комплексе обменных ионов водорода,
алюминия или железа. Источником обменных алюминия и желе-
за служат ионы кристаллической решетки глинистых минералов
и гидроксидов, мобилизуемые органическими кислотами или
присутствующие в почвенном растворе и также внедряющиеся
в диффузный слой почвенных коллоидов.
197
