Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

101
теля
0
кип
T
); Е – эбуллиоскопическая постоянная; m
– концентрация рас-
твора, выраженная через моляльность.
Эбуллиоскопическая постоянная называется также молярным по-
вышением температуры кипения и показывает, насколько повышается
температура кипения в результате растворения одного моль нелетучего
растворенного вещества в 1000 г растворителя. Эбуллиоскопическая по-
стоянная зависит только от свойств растворителя и не зависит от
свойств растворенного вещества:
1000
)(
0
1
20
кип
кип
H
MTR
E
, (4.23)
где R – универсальная газовая постоянная;
0
кип
T
– температура ки-
пения чистого растворителя; M
1
– молярная масса чистого растворите-
ля;
0
кип
H
– теплота кипения чистого растворителя.
Каждый растворитель имеет свою эбуллиоскопическую постоян-
ную.
Таблица 4.1
Эбуллиоскопические постоянные некоторых жидкостей
Жидкость
Е
Вода
Метиловый спирт
Этиловый спирт
Ацетон
Бензол
Хлороформ
0,52
0,84
1,2
1,48
2,64
3,76
Уравнения (4.22 и 4.23) позволяют рассчитать молярную массу рас-
творенного вещества:
кип
Tg
g
EM
1
2
2
1000
, (4.24)
где М
2
– молярная масса растворенного вещества; Е – эбуллиоско-
пическая постоянная; g
1
– масса растворителя; g
2
– масса растворенного
вещества,
кип
T
– повышение температуры кипения растворителя над
раствором.
Пример 4.6. При растворении 0,6 г некоторого вещества неэлек-
тролита в 25 г воды температура кипения раствора повышается на
0,204°С. При растворении 0,3 г этого же вещества в 20 г бензола темпе-

102
ратура кипения раствора повышается на 0,668°С. Рассчитайте эбуллио-
скопическую постоянную бензола, если эбуллиоскопическая постоянная
воды равна 0,512.
Решение:
1. Определяем молярную массу растворенного вещества в водном
растворе:
60
204,025
10006,0
512,0
1000
1
2
2
кип
Tg
g
EM
.
2. Рассчитаем эбуллиоскопическую постоянную бензола:
67,2
10003,0
2060668,0
1000
2
12
66
g
gMT
E
кип
HC
.
Понижение температуры замерзания растворов
нелетучих веществ
Температура замерзания раствора (
з
T
), содержащего нелетучее
растворенное вещество, всегда ниже температуры замерзания чистого
растворителя (
0
з
T
):
0
зз
TT
. (4.25)
Понижение температуры замерзания идеальных и предельно раз-
бавленных растворов неэлектролитов пропорционально их концентра-
ции:
КmT
з
, (4.26)
где
ззз
TTT
0
– понижение температуры замерзания (раз-
ность между температурами замерзания чистого растворителя
0
з
T
и рас-
твора
з
T
); К – криоскопическая постоянная; m
– концентрация раство-
ра, выраженная через моляльность.
Криоскопическая постоянная называется также молярным пони-
жением температуры замерзания и показывает, насколько понижается
температура замерзания в результате растворения одного моль нелету-
чего растворенного вещества в 1000 г растворителя. Криоскопическая
постоянная зависит только от свойств растворителя и не зависит от
свойств растворенного вещества:

103
1000
)(
0
1
20
пл
з
H
MTR
K
, (4.27)
где R – универсальная газовая постоянная;
0
з
T
– температура за-
мерзания чистого растворителя; M
1
– молярная масса чистого раствори-
теля;
0
пл
H
– теплота плавления чистого растворителя.
Каждый растворитель имеет свою криоскопическую постоянную.
Таблица 4.2
Криоскопические постоянные некоторых жидкостей
Жидкость
К
Вода
Бензол
Уксусная кислота
Фенол
Нафталин
1,86
5,12
3,81
6,81
7,14
Уравнения (4.26 и 4.27) позволяют определить молярную массу
растворенного вещества:
з
Tg
g
KM
1
2
2
1000
, (4.28)
где М
2
– молярная масса растворенного вещества; К – криоскопи-
ческая постоянная; g
1
– масса растворителя; g
2
– масса растворенного
вещества,
з
T
– понижение температуры замерзания.
Пример 4.7. Техническая уксусная кислота замерзает при 16,4°С.
Температура замерзания чистой уксусной кислоты 16,7°С, ее криоско-
пическая постоянная равна 3,9. Определите моляльную концентрацию
примесей в технической уксусной кислоте.
Решение:
гмоль
К
T
m
зам
1000/08,0
9,3
4,167,16
Осмотическое давление раствора
Осмос – это самопроизвольное проникновение растворителя в рас-
твор, отделенный от него полупроницаемой перегородкой, через кото-
рую может поступать растворитель, но не может проходить растворен-

104
ное вещество. Количественной характеристикой осмоса является осмо-
тическое давление.
Осмотическое давление – это избыточное давление, которое нуж-
но приложить к раствору, чтобы прекратился осмос, и в системе устано-
вилось равновесие.
Осмотическое давление раствора пропорционально его концентра-
ции и температуре и не зависит ни от природы растворенного вещества,
ни от природы растворителя. Величина осмотического давления опре-
деляется по уравнению Вант-Гоффа:
CRT
, (4.29)
где π – осмотическое давление раствора; С – молярная концентра-
ция раствора; R – универсальная газовая постоянная; Т – температура
раствора.
Уравнение справедливо для идеальных и предельно разбавленных
растворов неэлектролитов.
Уравнение Вант-Гоффа позволяет определить молярную массу рас-
творенного вещества:
1
12
2
1000
g
RTg
M
, (4.30)
где М
2
– молярная масса растворенного вещества; g
1
, ρ
1
– масса и
плотность растворителя; g
2
– масса растворенного вещества, π – осмо-
тическое давление раствора.
Пример 4.8. Плазма человеческой крови замерзает при –56°С.
Вычислите ее осмотическое давление при 37°С, измеренное при помо-
щи мембраны, проницаемой только для воды.
Решение:
1. Рассчитаем молярную концентрацию плазмы по уравнению
(примем, что молярная концентрация близка к моляльной):
./301,0/301,0
86,1
)56(0
лмолькгмоль
К
T
mC
зам
2. Рассчитаем осмотическое давление плазмы крови:
кПаПамДждмДж
КмольКДжлмольCRT
775)(/10775/775
310)/(314,8/301,0
333

105
5. ЭЛЕКТРОХИМИЯ
Различают две основные группы проводников электрического тока:
проводники первого рода, электрическая проводимость которых обу-
словлена электронами; проводники второго рода, обладающие ионной
проводимостью. Вещества, проводящие электрический ток своими ио-
нами, называются электролитами. Электролиты – химические соеди-
нения, полностью либо частично диссоциирующие на ионы в растворе.
Согласно теории Аррениуса электролиты при растворении диссо-
циируют на положительно (катионы) и отрицательно (анионы) заряжен-
ные ионы. Причина электролитической диссоциации заключается во
взаимодействии молекул растворяемого вещества и растворителя.
Электролиты при растворении могут диссоциировать на ионы пол-
ностью или частично. Для характеристики полноты диссоциации элек-
тролита Аррениус ввел понятие степени диссоциации ( ) – отношение
числа молекул электролита, распавшихся в растворе на ионы, к перво-
начальному числу его молекул в растворе. Степень диссоциации элек-
тролита в растворе зависит от его природы, концентрации, природы
растворителя, температуры и присутствия посторонних электролитов.
Все электролиты условно делят на сильные и слабые.
Сильные электролиты в растворах диссоциируют практически
нацело ( 1). К ним относятся вещества, у которых межчастичные
связи преимущественно электростатические (соли, сильные кислоты и
основания HCl, HNO
3
, H
2
SO
4
, NaOH, KOH, NaCl, K
2
SO
4
и др.).
Слабые электролиты — вещества с преимущественно ковалент-
ными связями (большинство органических веществ – CH
3
COOH, пири-
дин, некоторые неорганические кислоты и основания – H
2
CO
3
, H
3
PO
4
,
H
2
S, NH
4
OH и др.). Слабые электролиты диссоциируют частично и в
растворе устанавливается динамическое равновесие между ионами и
недиссоциированными молекулами.
Константа диссоциации слабого электролита
К равновесию, которое устанавливается в растворе слабого элек-
тролита между ионами и молекулами, можно применить законы хими-
ческого равновесия и записать выражение для константы равновесия.
Например, для диссоциации типичного слабого электролита – раствора
уксусной кислоты:
COOCHHCOOHCH
33

106
константа равновесия, выраженная через молярные концентрации
реагентов (C
i
), имеет вид:
CO OHCH
CO OCHH
C
CC
K
3
3
, (5.1)
Константа равновесия процесса диссоциации слабого электролита
называется константой диссоциации (К
Д
). Величина К
Д
зависит от
природы электролита и растворителя, а также от температуры, и харак-
теризует способность данного электролита распадаться на ионы в рас-
творе. Чем больше К
Д
, тем легче и полнее диссоциирует электролит в
растворе.
Многоосновные кислоты и основания диссоциируют ступенчато,
каждая из ступеней характеризуется своей константой диссоциации.
Для одно-одновалентного электролита связь между константой и
степенью диссоциации электролита выражает закон разбавления Ост-
вальда:
1
2
С
К
, (5.2)
где C – молярная концентрация электролита, моль/л; – степень
диссоциации электролита.
Ионное произведение воды. рН раствора
Вода является слабым электролитом и частично диссоциирует на
ионы
H
и
OH
по реакции:
OHHOH
2
. (5.3)
В водных растворах концентрации ионов
H
и
OH
связаны меж-
ду собой через константу диссоциации воды:
16
2
108,1
][
][][
OH
OHH
K
. (5.4)
Концентрация недиссоциированных молекул воды в растворе прак-
тически постоянна и равна:
лмоль
мольг
лг
OH /56,55
/18
/1000
][
2
. (5.5)
Произведение ионов
H
и
OH
является постоянной величиной
для данной температуры и называется ионным произведение воды
(К
W
):

107
1416
2
10156,55108,1][][][ OHKOHHK
W
,
14
101][][ OHHK
W
. (5.6)
Ионное произведение воды, согласно закону действующих масс,
является константой, не зависит от концентрации ионов водорода и
гидроксид-ионов и постоянно при данной температуре.
Ионное произведение воды – весьма важная величина, так как по-
зволяет для любого водного раствора найти концентрацию ионов водо-
рода при известной концентрации гидроксид-ионов и наоборот. В чис-
той воде или нейтральном растворе:
лмольOHH /101101][][
714
. (5.7)
В кислой среде
лмольH /101][
7
.
В щелочной среде
лмольH /101][
7
.
Для удобства обычно пользуются не концентрациями
][H
и
][OH
, а отрицательными их логарифмами, обозначаемыми символа-
ми рН и рОН:
]lg[];lg [ OHpOHHpH
. (5.8)
Для водных растворов выполняется соотношение:
рН + рОН = 14. (5.9)
Тогда:
В нейтральной среде
В кислой среде
В щелочной среде
рН = 7
рН < 7
рН > 7
Сильные электролиты
Сильные электролиты – это вещества, диссоциирующие в раство-
ре практически нацело. Основной теорией разбавленных растворов
сильных электролитов является теория Дебая и Хюккеля (1923 г.), ос-
нованная на следующих допущениях:
1. Ионы рассматриваются как материальные точки, имеющие заряд,
но не имеющие объема.
2. Учитывается только кулоновское взаимодействие, и игнориру-
ются все другие виды взаимодействий.
3. Электростатическое взаимодействие рассматривается как взаи-
модействие между центральным ионом и его ионной атмосферой.
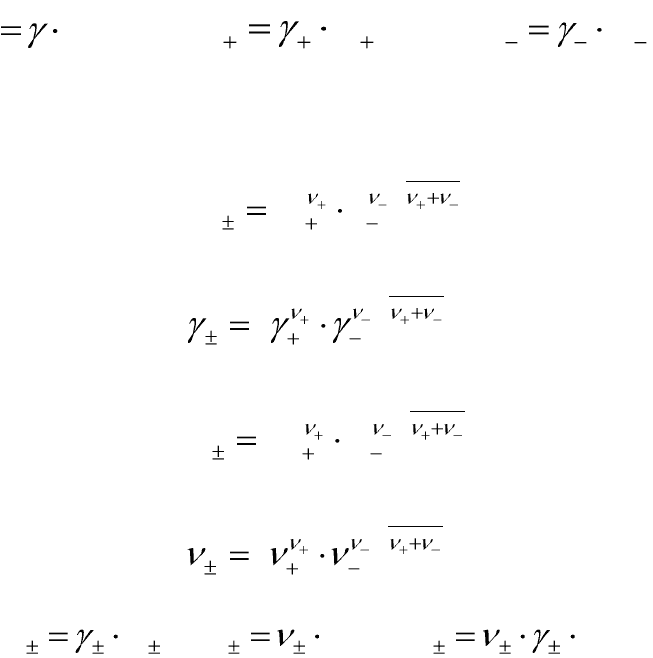
108
Ионная атмосфера – среднестатистическое распределение ионов,
связанное с электростатическим притяжением и отталкиванием заря-
женных частиц и их тепловым движением.
В результате совместного действия электростатических и броунов-
ских сил вокруг центрального отрицательного иона в среднем во време-
ни будет некоторая избыточная концентрация ионов противоположного
знака. По мере удаления от центрального иона плотность зарядов про-
тивоположного знака убывает и на бесконечно большом расстоянии
стремится к нулю.
Количественные расчеты характеристик растворов сильных элек-
тролитов осуществляются с помощью понятий активности электролита
(а) и активностей катионов (а
+
) и анионов (а
-
), которые равны произ-
ведению коэффициента активности на концентрацию (моляльность):
ma
;
ma
;
ma
. (5.10)
Активности и коэффициенты активности отдельных ионов экспе-
риментально определить нельзя, поэтому введены понятия:
– средней активности ионов электролита:
1
)( aaa
; (5.11)
– среднего коэффициента активности ионов электролита:
1
)(
; (5.12)
– средней моляльности ионов электролита:
1
)( mmm
; (5.13)
– среднего числа ионов электролита:
1
)(
. (5.14)
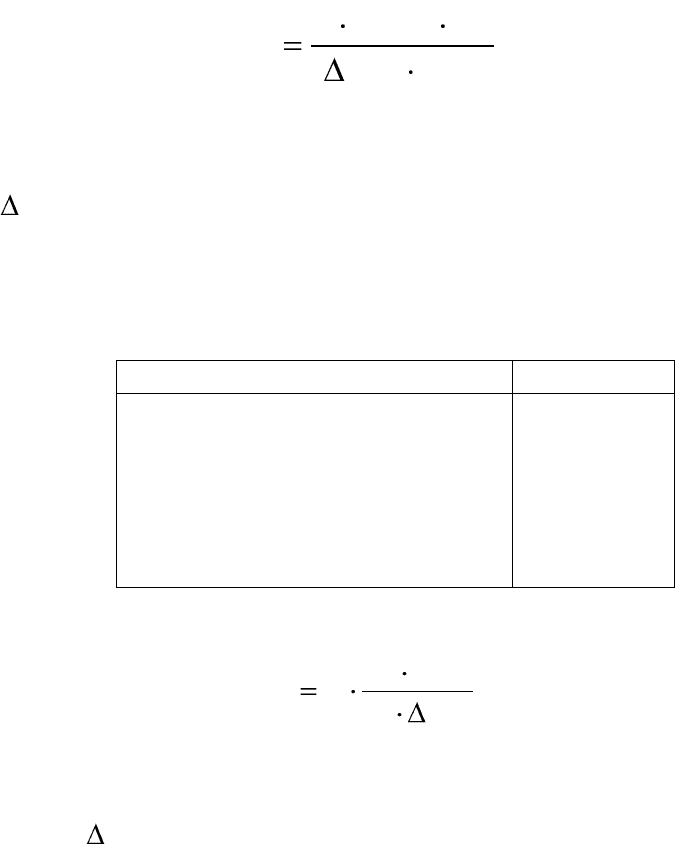
Между собой эти величины связаны уравнениями:
ma
;
mm
;
ma
. (5.15)
Для бинарного электролита, например, NaCl, величины: ν
+
= ν
–
= 1,
ν
±
=(1
1
·1
1
)
1/2
=1 и m
±
=m; средняя моляльность ионов электролита рав-
на его моляльности.
Для не бинарного электролита, например, Al
2
(SO
4
)
3
, величины:
ν
+
= 2, ν
–
= 3, ν
±
=(2
2
·3
3
)
1/5
=108
1/5
=2,55 и m
±
= 2,55m; средняя моляль-
ность ионов электролита не равна его моляльности.

109
Очень часто растворы представляют собой сложные смеси различ-
ных электролитов. В таких растворах все ионы взаимосвязаны, индиви-
дуальные коэффициенты активности катиона и аниона и среднеионный
коэффициент активности электролита зависят не только от концентра-
ции ионов данного электролита, но и от концентрации других электро-
литов в растворе. Для характеристики этой зависимости введено поня-
тие ионной силы раствора (I), определяемой как полусумма произве-
дений концентраций всех ионов в растворе на квадрат их заряда:
2
2
1
i
i
i
zmI
или
2
2
1
i
i
i
zcI
, (5.16)
где m
i
– моляльная концентрация i-ого иона; c
i
– молярная кон-
центрация i-ого иона; z
i
– заряд i-ого иона.
Пример 5.1. Определите ионную силу раствора, содержащего
0,1 моль/л K
2
SO
4
и 0,03 моль/л AlCl
3
.
Решение:
1. Запишем уравнения электролитической диссоциации указанных
солей, под каждым ионом укажем заряд иона, число ионов, получаемых
в результате диссоциации и концентрацию ионов:
лмольслмольс
v
zz
SOKSOK
/1,0/2,0
12
21
2
2
442
лмольслмольс
v
zz
ClAlAlCl
/09,0/03,0
31
13
3
3
3
2. Ионную силу раствора можно рассчитать следующим образом:
48,0)109,0303,021,012,0(
2
1
)(
2
1
2222
2222
332
4
2
4
ClClAlAlSOSOKK
zczczczcI
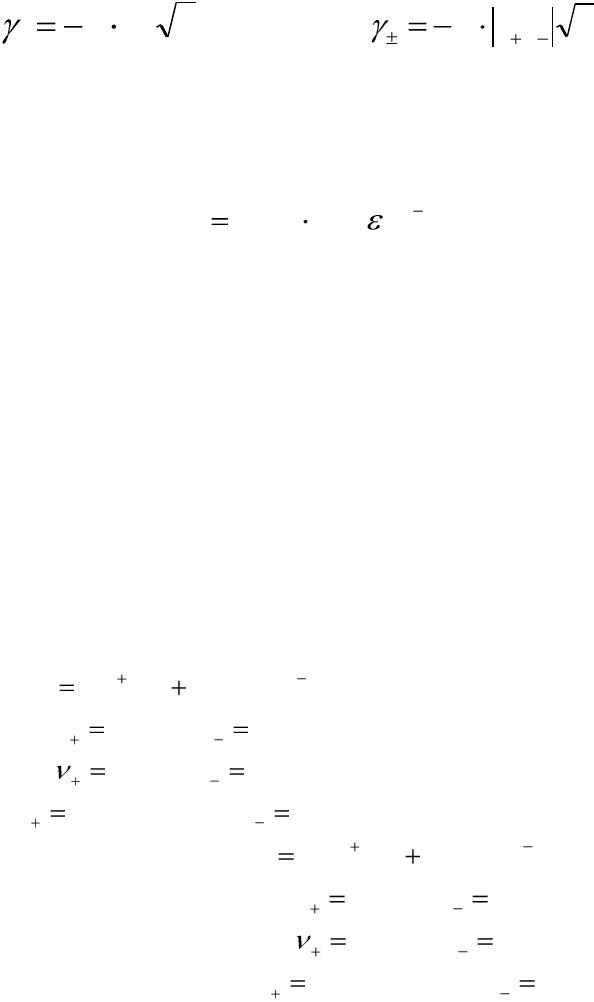
110
В разбавленных растворах, ионная сила которых не превышает
0,02, индивидуальные коэффициенты активности ионов (γ
i
) и средние
коэффициенты активности электролитов (γ
±
) вычисляют по уравнениям
Дебая-Хюккеля:
IzA
ii
2
lg
;
IzzAlg
, (5.17)
где I – ионная сила раствора; z
i
– заряд i-ого иона; z
+
, z
-
– заряды
катиона и аниона, A – эмпирическая константа, зависящая от темпера-
туры и диэлектрической проницаемости раствора (ε), определяемая по
уравнению:
2/36
)(10825,1 TA
. (5.18)
В водных растворах (ε=81) при 25°С величина А = 0,509.
Уравнения (5.17) носят название предельного закона Дебая-
Хюккеля: при данной ионной силе средний коэффициент активности
ионов электролита является величиной постоянной и не зависит от при-
роды других электролитов раствора.
Пример 5.2. Вычислите коэффициенты активности отдельных
ионов и средний ионный коэффициент активности 0,001 М раствора
Al(NO
3
)
3
в 0,003 М растворе Na
2
SO
4
.
Решение:
1. Рассчитаем ионную силу раствора, рассмотрев диссоциацию
сильных электролитов с указанием соответствующих значений z
i
, ν
i
, c
i
:
лмольслмольс
v
zz
NOAlNOAl
/003,0/001,0
31
13
3)(
3
3
33
лмольслмольс
v
zz
SONaSONa
/003,0/006,0
12
21
2
2
442
2. Ионную силу раствора рассчитываем по уравнению (5.16):
