Мутылина И.Н. Судостроительные материалы
Подождите немного. Документ загружается.

Одна группа – это соединения с нормальной валентностью, которые дают металлы с ти6
пичными неметаллами (О, S, Cl). Такими соединениями являются оксиды, сульфиды, хлори6
ды. В сплавах эти соединения присутствуют в виде так называемых неметаллических вклю
чений.
Другая группа – металлические соединения. Из этой группы наиболее важным являются
фазы внедрения и электронные соединения. Металлические соединения отличаются разнооб6
разием типов межатомной связи (металлической, ковалентной, ионной) с преобладанием ме6
таллической связи. Благодаря этому металлические соединения характеризуются металличе6
ским блеском, электропроводимостью и в отдельных случаях сверхпроводимостью. Метал6
лические соединения при обычных температурах тверды и хрупки, однако при нагреве до
температур, составляющих 70-90 % от температуры плавления, эти соединения очень пла6
стичны. Это объясняется увеличением при нагреве доли металлической связи между атома6
ми.
Металлическими соединениями являются также соединения переходных металлов с уг6
леродом (карбиды), азотом (нитриды), водородом (гидриды), бором (бориды). Эти соедине6
ния могут иметь как очень сложную, так и простую решетку типа гцк, гпу, реже оцк. Тип ре6
шетки определяется величиной отношения атомного радиуса неметалла к атомному радиусу
металла.
Кроме растворов и химических соединений возможно образование таких фаз, которые
не могут быть полностью отнесены к перечисленным и являются промежуточными фазами.
Вопросы для самоконтроля
1. Что называют компонентом, фазой, твердыми растворами замещения и внедрения?
2. В чем заключается отличие твердых растворов от химических соединений?
3. Какие условия должны выполняться для образования твердых растворов замещения
и внедрения?
4. Как изменяются механические свойства при образовании различных фаз?
5. Какие твердые растворы называют упорядоченными?
11
Глава 3. СПЛАВЫ НА ОСНОВЕ ДВОЙНЫХ СИСТЕМ
Микроструктура сплава формируется в процессе кристаллизации, фазовых превращений
и структурных изменений в твердом состоянии, происходящих при литье, обработке давле6
нием и термической обработке. Несмотря на многообразие факторов, влияющих на формиро6
вание микроструктуры сплавов, важнейшие ее особенности можно предсказать, используя
диаграммы состояния. Диаграммы состояния дают сведения о характере фазовых превраще6
ний и их последовательности при нагревании и охлаждении сплавов.
Диаграммы состояния, или диаграммы фазового равновесия, в удобной графической
форме показывают зависимость фазового состава сплава от температуры и концентрации.
Диаграммы состояния позволяет определить фазовые превращения в условиях очень медлен6
ного охлаждения или нагрева. Истинное равновесие в практических условиях достигается
редко. В подавляющем числе случаев сплавы находятся в метастабильном состоянии, т.е. в
таком состоянии, когда они обладают ограниченной устойчивостью и под влиянием внешних
факторов переходят в другие более устойчивые состояния, т.к. их энергия Гиббса больше
минимальной.
Для целей практики важно, что метастабильные состояния нередко сообщают сплавам
высокие механические свойства и др. В этом случае металловедение должно установить при6
роду метастабильных состояний, обеспечивающих оптимальный комплекс свойств, и разра6
ботать режимы термообработки или какой-либо другой обработки, позволяющей получить
эти неравновесные состояния. Исходным положением при решении этих задач является зна6
ние диаграммы фазового равновесия.
Правило равновесия фаз. Каждая фаза характеризуется термодинамическими парамет6
рами – температурой, давлением и концентрацией компонентов, образующих данную фазу.
Термодинамические параметры равновесной системы (сплава), которым можно придавать
произвольные (в некотором интервале) значения так, чтобы не появлялись новые и не исче6
зали старые фазы, называют термодинамическими степенями свободы. Число термодинами6
ческих степеней свободы – это вариантность системы. Зависимость между числом степеней
свободы (или вариантностью), числом компонентов и числом фаз устанавливает правило
равновесия фаз.
Правило равновесия фаз выражается уравнением C=K–Ф+2, где 2 – число внешних фак6
торов; С – число степеней свободы; К – число компонентов, образующих сплав; Ф – число
фаз, находящихся в равновесии. Под С понимают возможность изменения температуры, дав6
ления и концентрации без изменения числа фаз, находящихся в равновесии.
При изучении физико-химических равновесий за внешние факторы, влияющие на состо6
яние сплава, принимают температуру и давление. Применяя правило фаз к металлам, можно
во многих случаях принять изменяющимся только один внешний фактор – температуру, т.к.
давление, за исключением очень высокого, мало влияет на фазовое равновесие сплавов в
твердом и жидком состояниях. Тогда уравнение примет следующий вид: С=К–Ф+1, т.к. чис6
ло С не может быть меньше нуля и не может быть дробным числом, то К–Ф+1>0, а Ф≤К+1,
т.е. число фаз в сплаве, находящемся в равновесном состоянии, не может быть больше, чем
число компонентов +1. Следовательно, в двойной системе в равновесии может находиться не
более трех фаз, а в тройной – не более четырех и т.д.
Если С=0 (нонвариантное равновесие), это означает, что сплав из данного числа фаз мо6
жет существовать только в совершенно определенных условиях: при постоянной температу6
ре и определенном количестве всех находящихся в равновесии фаз. Превращение начинается
и заканчивается при постоянной температуре.
Диаграммы состояния строят экспериментально, правило фаз используют для анализа
опытных данных. Диаграммы состояния строят в координатах температура – концентрация в
% по массе или реже в атомных %.
12
Для построения диаграммы состояния, особенно для определения температур затверде6
вания, используют термический анализ. Для этой цели экспериментально получают кривые
охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми
эффектами превращений, определяют температуры соответствующих превращений. Эти тем6
пературы называют критическими точками. Для изучения превращений в твердом состоя6
нии используют различные методы физико-химического анализа: микроанализ, рентгено6
структурный, дилатометрический, магнитный и др.
Диаграммы состояния сплавов с неограниченной растворимостью в твердом и жидком
состояниях
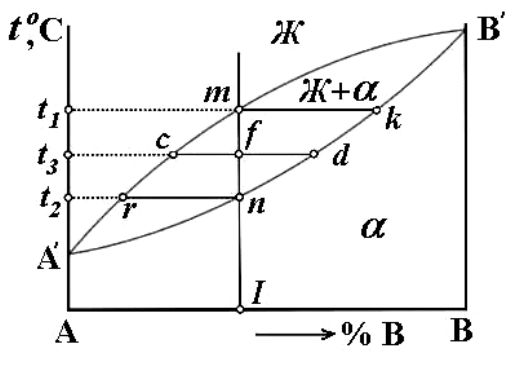
Диаграмма состояния для случая с полной взаимной растворимостью компонентов А и В
в жидком и твердом состояниях представлена на рис. 5.
Рис. 5. Диаграмма состояния системы А–В с неограниченной
растворимостью компонентов в жидком и твердом состояниях
При температурах выше линии А
′
mВ
′′
, которую называют линией ликвидус, существует
только жидкая фаза Ж. В области ниже А
′
nВ
′
, называемой линией солидус, устойчив α–
твердый раствор. Между линиями ликвидус и солидус в равновесии находятся Ж и
α
–
твердый раствор.
При охлаждении образца сплава I до температуры t
1
сплав остается однофазным. При
температуре t
1
из жидкого раствора, состав которого отвечает критической точке m, начнут
выделяться кристаллы α–твердого раствора, состав которых соответствует критической точ6
ке k.
При понижении температуры точка, отвечающая жидкой фазе Ж, перемещается от точки
m вниз по кривой ликвидуса, а точка, соответствующая α–твердому раствору, – от точки k
вниз по кривой солидуса. Точки r и n соответствуют составам последних капель жидкого
раствора и кристаллов α–фазы, находящихся в равновесии друг с другом при температуре t
2
.
Следовательно, процесс кристаллизации сплава I происходит в интервале температур от t
1
до
t
2
.
При достижении температуры t
2
сплав затвердевает, и при более низких температурах
существует только α–твердый раствор. Аналогично затвердевают и другие сплавы этой си6
стемы.
Правило рычага. Каждой температуре между линиями ликвидус и солидус соответ6
ствуют две фазы – жидкий сплав и α–твердый раствор. Для определения состава фаз, находя6
щихся в равновесии при любой температуре, лежащей между линиями ликвидус и солидус,
нужно через данный температурный уровень (например, t
3
) провести линию, параллельную
13
оси концентрации до пересечения с линиями ликвидус и солидус. Тогда проекция точки
пересечения этой линии с ликвидусом (c) на ось концентрации укажет состав жидкой фазы, а
точки пересечения с линией солидус (d) – состав твердой фазы (α–раствора).
Линии mk, cd, rn и другие, соединяющие состав фаз, находящихся в равновесии, называ6
ют конодами.
Если точка, которая показывает состав сплава при данной температуре, попадает в об6
ласть однофазного состояния, например выше линии ликвидус или ниже линии солидус, то
количество данной фазы (по массе) составляет 100 %, а ее состав соответствует исходному
составу сплава.
В процессе кристаллизации изменяется состав фаз и их количественное соотношение.
Для определения количественного соотношения фаз, находящихся в равновесии при данной
температуре, пользуются правилом отрезков (рычага). Согласно этому правилу, например,
для определения массового или объемного количества твердой фазы необходимо вычислить
отношение длины отрезка, примыкающего к составу жидкой фазы, к длине всей коноды;
для определения количества жидкой фазы – отношение длины отрезка, примыкающего к со6
ставу твердой фазы, к длине коноды. Следовательно, количество твердой α–фазы (в %) при
температуре t
3
определяется отношением отрезка cf к длине коноды cd:
α
=[cf/(cd)]
.
100, а мас6
са или объем жидкой фазы Ж=[fd/(cd)]
.
100.
Выделяющиеся кристаллы твердого раствора имеют переменный состав, зависящий от
температуры. При медленном охлаждении процессы диффузии в жидкой и твердой фазах
(объемная диффузия), а также процессы взаимной диффузии между ними (межфазная диф
фузия) успевают за процессом кристаллизации, поэтому состав кристаллов выравнивается. В
этих условиях, сплав после затвердевания будет состоять из однородных кристаллических
зерен твердого раствора, а их состав будет соответствовать исходному составу сплава.
Неравновесная кристаллизация. Процесс диффузии протекает медленно, поэтому в
реальных условиях охлаждения состав в пределах каждого кристалла и различных кристал6
лов не успевает выравниваться и будет неодинаковым.
В результате неравновесной кристаллизации химический состав образующихся кристал6
лов α–твердого раствора по сечению оказывается переменным. В процессе кристаллизации
обычно образуются кристаллы твердого раствора дендритного типа. Оси первого порядка,
возникающие в начальный момент кристаллизации, обогащены более тугоплавким компо6
нентом В. Периферийные слои кристалла и межосные пространства, кристаллизующиеся в
последнюю очередь, будут обогащены компонентом А, понижающим температуру плавления
сплава, и их состав близок к концентрации, соответствующей исходной концентрации спла6
ва. Такую неоднородность состава сплава внутри отдельных кристаллов называют внутри
кристаллитной, или дендритной, ликвацией. Чем больше разность температур между соли6
дусом и ликвидусом, тем больше дифференциация по составу между жидкой и твердой фаза6
ми и тем сильнее проявляется этот вид ликвации. Быстрое охлаждение способствует разви6
тию дендритной ликвации. Из-за разной травимости участков твердого раствора, имеющих
неодинаковый состав, неоднородность внутри каждого кристалла может быть легко выявле6
на при микроанализе. Дендритная ликвация ухудшает технологические и механические свой6
ства сплавов.
Дендритная ликвация может быть ослаблена продолжительным нагревом затвердевшего
сплава при температурах, обеспечивающих достаточную скорость диффузии (несколько
ниже солидуса). После такого нагрева, называемого диффузионным отжигом, или гомогени
зацией, дендритная структура литого сплава уже не выявляется и сплав состоит из однород6
ных кристаллов твердого раствора.
14

Диаграммы состояния сплавов с неограниченной растворимостью в жидком состоянии
и ограниченной растворимостью в твердом состоянии
Ограниченная растворимость наиболее часто встречается в металлических сплавах. При
образовании ограниченных твердых растворов различают два типа диаграмм состояния: с эв
тектическим и с перитектическим превращением.
Диаграммы состояния с эвтектическим превращением
Линия A
′
eB
′
– линия ликвидус (рис. 6), выше этой линии устойчива лишь жидкая фаза.
Линия A
′
aebB
′
– линия солидус. Между этими линиями в равновесии находятся две фазы: α
или β–твердые растворы и жидкая фаза. При температурах, соответствующих линии A
′
e, из
жидкого сплава выделяются кристаллы α–твердого раствора; а линии eB
′
– кристаллы β–
твердого раствора. Точка a характеризует предельную растворимость компонента В в А, точ6
ка b – компонента А в В при температуре t
e
, а точки c и d характеризуют предельную раство6
римость соответственно компонента В в А и А в В при нормальной температуре.
Рис. 6. Диаграмма состояния с эвтектическим превращением (а)
и кривые охлаждения сплавов Х1 и Х2 (б)
Линия ac характеризует изменение растворимости компонента В в А, а линия bd – изме6
нение растворимости компонента А в В с изменением температуры; эти линии называют ли6
ниями предельной растворимости (линиями сольвуса).
Сплав, соответствующий точке e, затвердевает при постоянной температуре t
e
. При тем6
пературе несколько ниже t
e
жидкий сплав оказывается насыщенным по отношению к обеим
фазам (α– и β–твердым растворам), т.к. точка e как бы одновременно принадлежит сразу
двум ветвям ликвидуса. Поэтому при температуре t
e
одновременно с жидким раствором со6
существуют предельно насыщенные кристаллы твердых растворов
α
a
и
β
b
, образующих гете6
рогенную структуру. Сплавы, в которых происходит одновременная кристаллизация α и β–
фаз при постоянной и самой низкой для данной системы сплавов температуре, называют эв
тектическими.
Структуру, состоящую из определенного сочетания двух (или более) твердых фаз, од6
новременно кристаллизовавшихся из жидкого сплава, называют эвтектикой. Эвтектическая
структура в условиях сравнительно высоких степеней переохлаждения состоит из мелких
кристаллов фаз (α и β), т.к. при одновременной кристаллизации их из жидкости рост каждой
из них затрудняется.
Рассмотрим процесс кристаллизации некоторых сплавов. Сплавы, расположенные левее
точки c и правее точки d, кристаллизуются так же, как и сплавы с неограниченной раствори6
мостью. После затвердевания сплавы, лежащие левее точки c, состоят только из кристаллов
α–твердого раствора, а сплавы, лежащие правее точки d, из кристаллов β–твердого раствора.
При кристаллизации сплава Х1 при достижении температуры несколько ниже t
1
в жид6
кости образуются кристаллы α–твердого раствора. Процесс кристаллизации α–твердого
раствора будет происходить в интервале температур, т.к. система имеет одну степень свобо6
ды.
15
Процесс выделения α кристаллов продолжается до t
e
. Состав кристаллов твердого
раствора в условиях равновесия определяется точками пересечения коноды с линией соли6
дус, а остающейся жидкости – точками пересечения коноды с линией ликвидус. Так, при t
e
составу жидкой фазы соответствует точка n, а составу твердой фазы – точка t.
Количество жидких и твердых фаз определяют по правилу отрезков. При достижении
эвтектической температуры t
e
α–кристаллы достигают предельной концентрации (точка a) В
в А, а жидкая фаза получает эвтектический состав (точка e). В этих условиях при t
e
из жидкой
фазы одновременно кристаллизуется предельно насыщенные растворы
α
a
и
β
b
с образовани6
ем эвтектики Ж
e
→ α
a
+ β
b
.
Процесс эвтектической кристаллизации протекает при постоянной температуре, т.к. со6
гласно правилу фаз при одновременном сосуществовании трех фаз постоянного состава (Ж
e
,
α
a
,
β
b
) система инвариантна (С=0). Следовательно, после затвердевания сплав состоит из пер6
вичных α–кристаллов и эвтектики (α+β). Любой доэвтектический сплав, соответствующий
составу, находящемуся между точками a и b, имеет те же структурные составляющие.
Кристаллизация эвтектического сплава протекает при постоянной температуре, и после
затвердевания сплав состоит только из (α+β). Кристаллизация заэвтектических сплавов про6
текает так же, как и доэвтектических. Однако вместо кристаллов α–твердого раствора из
жидкости будут выделяться кристаллы β–твердого раствора. Структура заэвтектических
сплавов состоит из первичных кристаллов β–фазы и эвтектики (α+β).
С понижением температуры сплавы меняют свой состав, при понижении температур из
α– (β) фазы будут выделяться β
II
(α
II
) по линии ac (bd). После окончательного охлаждения
доэвтектические сплавы будут иметь структуру
α
a
+эвтектика (α
a
+ β
b
)+ β
II
и заэвтектические
β
b
+(α
a
+ β
b
)+ α
II
. Количественное соотношение между α и β–фазами может быть установлено
по правилу отрезков.
Быстрым охлаждением можно подавить распад твердого раствора и переохладить его до
низких температур. Процесс нагрева выше линии ac (bd) и последующее быстрое охлажде6
ние, позволяющее задержать появление избыточной фазы и зафиксировать высокотемпера6
турное состояние, называется закалкой.
Пересыщенный α–твердый раствор неустойчив и при нагреве, а в некоторых случаях и
при нормальной температуре, начинает распадаться с выделением дисперсных частиц избы6
точной фазы. Распад пересыщенного твердого раствора, полученного путем закалки, связан6
ный с упрочнением сплава, называют дисперсионным твердением, или дисперсионным ста
рением. Образовавшиеся при старении дисперсные частицы избыточных фаз имеют пластин6
чатое строение.
При нагреве сплава в области (α+β) фаз выделения β
II
– фазы превращаются в сфериче6
ские и растут. Это приводит к уменьшению межфазной поверхности и понижению свобод6
ной энергии. Образование сферических частиц, например из пластинчатых выделений, назы6
вают сфероидизацией, укрупнение выделений – коагуляцией. Коагуляция и сфероидизация
частиц упрочняющей фазы сопровождаются разупрочнением сплава и повышением пластич6
ности.
Термообработку, вызывающую полный распад твердого раствора, коагуляцию и сферои6
дизацию избыточной фазы, а как следствие этого, разупрочнение сплава, называют отжи
гом.
Диаграммы состояния с перитектическим превращением
Линия A
′
pB
′
– соответствует линии ликвидус (рис. 7), линия A
′
abB
′
– солидус. Точка a
характеризует максимальную растворимость кристаллов В в А, а точка b – предельную
растворимость А в В. Линия pab называется линией перитектического превращения.
16
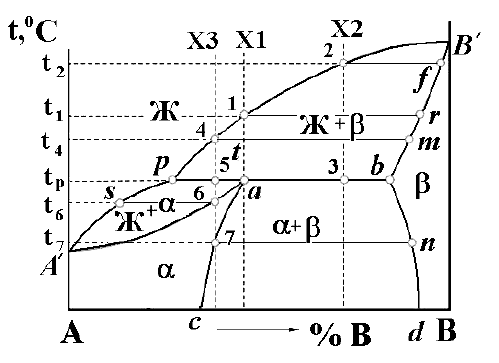
Рис. 7. Диаграмма состояния с перитектическим превращением
Перитектическое равновесие отличается от эвтектического. Если при эвтектическом
превращении из жидкой фазы одновременно кристаллизуются две твердые фазы, то при пе6
ритектическом превращении кристаллизуется лишь одна α–фаза, образующаяся за счет ра6
нее выделившейся твердой β–фазы и жидкой части сплава определенного состава (Ж
p
+ β
b
→
α
a
).
При кристаллизации сплавов, состав которых лежит правее точки p, из жидкого сплава
первоначально выделяются кристаллы β–твердого раствора. При достижении температуры t
p
в равновесии находится жидкая фаза состава точки p и β–кристаллы состава точки b.
α-кристаллы образуются в результате перитектической реакции, которая сводится к вза6
имодействию ранее выделившейся жидкости и кристаллов β
е
: Ж
p
+ β
b
→α
a
.
Перитектическая реакция, протекающая при участии трех фаз постоянного состава (Ж
p
,
β
b
, α
a
), соответствует нонвариантному равновесию (С=0), т.е. процесс протекает при посто6
янной температуре.
Для сплавов, концентрация которых лежит в интервале ab, (сплав X2) соотношение реа6
гирующих фаз характеризуется избыточным количеством β–кристаллов, поэтому в результа6
те перитектической реакции часть фазы β останется неизрасходованной: Ж
p
+ β
b
→α
a
+β
ост.
.
Структура этих сплавов после окончания процесса кристаллизации состоит из перитек6
тической смеси хорошо развитых кристаллов α и β.
Кристаллизация сплавов, состав которых соответствует линии pa (сплав Х3), начинается
с выделения из жидкой фазы кристаллов β–твердого раствора. По достижении температуры
t
n
происходит перитектическое превращение: Ж
p
+β
b
→α
a
+Ж
ост.
. В этих сплавах после перитек6
тического превращения в избытке оказывается жидкая фаза. При дальнейшем понижении
температуры из жидкого сплава Ж
ост
кристаллизуется α–твердый раствор. После затвердева6
ния сплавы состоят из кристаллов α–твердого раствора. При температуре ниже t
7
начинается
процесс вторичной кристаллизации (α→β
II
). При комнатной температуре структура сплава
Х3 состоит из α-фазы и небольшого количества вторичных β–кристаллов.
Кристаллизация сплава Х1, состав которого соответствует на перитектической линии pb
точке a, также начинается с выделения из жидкой фазы кристаллов β–твердого раствора. По
достижении температуры t
n
происходит перитектическое превращение: Ж
p
+β
b
→
a
. В этих
сплавах после перитектического превращения присутствует только α–фаза. При понижении
температуры наблюдается процесс вторичной кристаллизации, из α–твердого раствора выде6
ляются β–кристаллы. В сплавах, расположенных левее точки p, при кристаллизации из жид6
ких фаз выделяется α–твердый раствор.
Для системы с перитектическим превращением структурный и фазовый состав совпада6
ют.
17
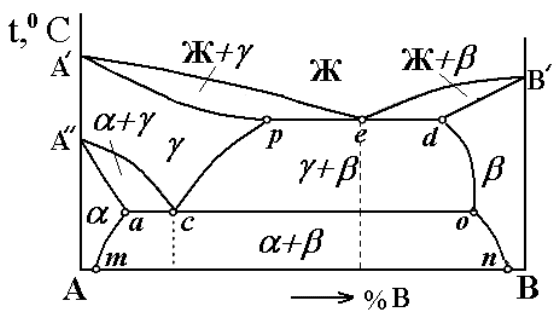
Диаграммы состояния сплавов, компоненты которых имеют
полиморфные превращения
Полиморфные превращения одного или обоих компонентов сплава изменяют его струк6
туру и свойства. Такие превращения происходят во многих промышленных сплавах, напри6
мер сплавах на основе железе, титана и др.
Рассмотрим диаграмму состояния сплавов, образующих твердые растворы с неограни6
ченной растворимостью, в которых один из компонентов А имеет две модификации α и γ
(рис. 8).
В области, ограниченной линиями A
′′
a и A
′′
c, в равновесии находятся две фазы α+γ, где
α–фаза является твердым раствором компонента В в α–модификации компонента А; γ–фаза
– твердым раствором В в γ–модификации компонента А. Ниже линии A
′′
a сплавы состоят
только из α–фазы. Кристаллическая решетка α–раствора отлична от решетки γ–твердого
раствора.
Рис. 8. Диаграмма состояния с полиморфным превращением
На диаграмме состояния линия A
′′
a при охлаждении соответствует температуре начала,
а линия A
′′
c – температуре окончания полиморфного превращения (α↔γ).
При температурах ниже линии A
′′
с γ–твердый раствор в условиях равновесия становится
неустойчивым и в его кристаллах возникают зародыши α–твердого раствора. Развитие
превращения γ→α возможно только при дальнейшем охлаждении сплава. Образующиеся
кристаллы α–твердого раствора при понижении температуры изменяют свой состав по ли6
нии A
′′
а, а кристаллы γ–твердого раствора – по линии A
′′
с.
Полиморфное превращение γ→α при охлаждении в условиях, близких к равновесному
состоянию, протекает в интервале температур и сопровождается диффузионным перераспре6
делением компонентов между обеими фазами.
Распад γ–раствора на смесь двух фаз α и β может быть описан аналогично эвтектическо6
му превращению, но в этом случае исходной фазой будет твердый раствор, а не жидкость,
как это встречается при эвтектическом превращении. Подобное превращение в отличие от
эвтектического называют эвтектоидным, а смесь полученных кристаллов – эвтектоидом.
Сплавы, расположенные левее точки с, называют доэвтектоидными, а правее точки с –
заэвтектоидными. Сплав, отвечающий точке с называют эвтектоидным.
Линии am и on указывают на изменение предельной растворимости компонентов.
Диаграммы состояния сплавов, образующих
химические соединения
Диаграмма состояния этого типа характерна для сплавов, состоящих из компонентов,
образующих химические соединения (рис. 9). Химические соединения могут быть изображе6
ны формулами типа А
m
В
n
, показывающими, что соединяются между собой m атомов компо6
18
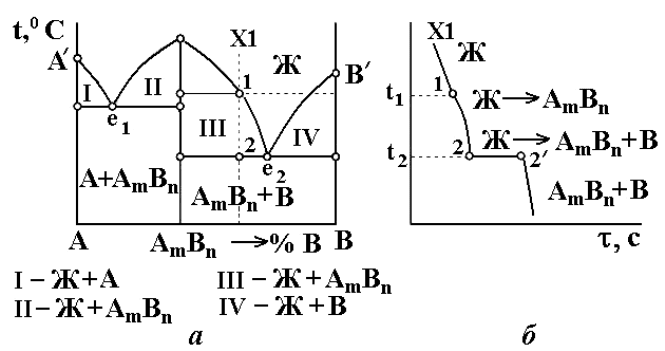
нента А и n атомов компонента В, образуя кристаллическую решетку, не сходную с решетка6
ми компонентов А и В.
Рис. 9. Диаграмма состояния сплавов, образующих химические
соединения (a) и кривая охлаждения сплава Х1 (б)
В металлических сплавах образуются химические соединения как между двумя или
несколькими металлами (их называют интерметаллидами), так и между металлами и неме6
таллами (карбиды, оксиды и т.д.).
Поскольку образующиеся соединения имеют кристаллическую решетку, не сходную с
решетками элементов, из которых соединение образовалось, то свойства химических соеди6
нений всегда резко отличаются от свойств элементов, входящих в них. Так, химические со6
единения имеют большую твердость, температуры плавления их резко отличаются от темпе6
ратур плавления компонентов, образующих соединения, и т. д.
Следовательно, образование соединений приводит к получению новых свойств. Как
было установлено Н.С. Курнаковым, в сплавах, соответствующих по составу химическому
соединению, имеется скачок в свойствах.
Во многих случаях химическое соединение может растворять в себе неограниченное или
ограниченное количество какого-либо элемента, т.е. могут образовываться твердые растворы
на основе химического соединения. В этом случае химическое соединение является раство6
рителем. Химические соединения могут быть устойчивыми (т.е. сохраняющимися вплоть до
температуры плавления) или неустойчивыми (т.е. распадающимися ниже температуры плав6
ления и образующимися по перитектической реакции).
Связь между составом, строением и свойствами сплавов
В зависимости от состава сплавы могут иметь разнообразную структуру в соответствии
с типом диаграммы состояния. Основоположником учения о связи диаграммы состояния со
свойствами сплавов является академик Н. С. Курнаков.
В сплавах, имеющих структуру смесей (например эвтектика, перитектика), свойства из6
меняются в основном прямолинейно (рис. 10,а). В сплавах – твердых растворах свойства из6
меняются по криволинейной зависимости (рис. 10,б). При образовании химических соедине
ний свойства изменяются очень резко (рис. 10,г).
Если диаграмма состояния показывает, что в сплавах образуется разнообразная структу6
ра, то и зависимость свойств тоже неоднозначна. А именно, в сплавах – твердых растворах
свойства изменяются по кривым, а в сплавах – смесях твердых растворов зависимость вновь
прямолинейная (рис. 10, в).
Твердость, прочность и электросопротивление твердых растворов выше, чем у чистых
металлов. Электропроводность и температурный коэффициент электросопротивления, пла6
стичность у твердых растворов ниже, чем у чистых металлов.
19
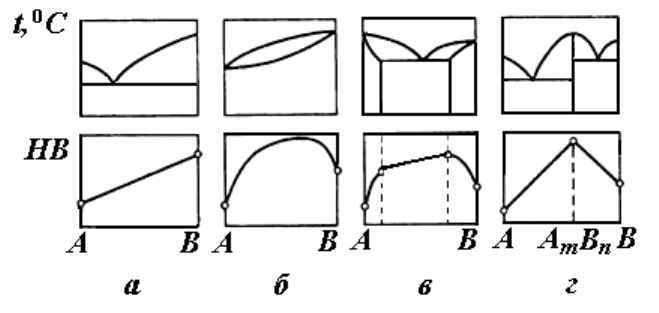
Рис. 10. Зависимость между типом диаграммы состояния сплавов
и их твердостью НВ
Многие физические и механические свойства сплавов четко зависят от структуры, но та6
кие технологические свойства, как литейные или свариваемость, зависят не столько от струк6
туры, сколько от того, в каких условиях по температуре проходило затвердевание сплавов.
Технологические литейные свойства, определяющие способность сплава при затвердева6
нии дать высококачественные отливки, слитки, детали, зависят от жидкотекучести, не6
склонности к образованию трещин внутри и на поверхности слитков, образования рассеян6
ной пористости или усадочной сосредоточенной раковины.
Жидкотекучесть зависит от интервала кристаллизации сплава. Чем больше расстояние
между ликвидусом и солидусом, т.е. чем больше температурный интервал кристаллизации,
тем ниже жидкотекучесть. Поэтому сплавы – твердые растворы имеют пониженную жидко6
текучесть.
Кроме того, чем больше интервал кристаллизации, тем сплавы более склонны образовы6
вать трещины на поверхности и внутри отливки.
В результате усадки образуется мелкая пористость, разбросанная по всему объему от6
ливки (что нередко приводит литье в брак), которая тем больше, чем больше расстояние
между ликвидусом и солидусом; при малом интервале кристаллизации в сплавах образуется
сосредоточенная усадочная раковина. Следовательно, для получения качественных отливок
необходимо выбрать все сплавы, у которых температуры солидуса и ликвидуса были бы как
можно ближе.
Таким образом, однофазные сплавы, представляющие собой твердые растворы, облада6
ют плохими литейными свойствами и не пригодны для фасонного литья. Однако однофазные
сплавы при достаточно высокой прочности обладают хорошей пластичностью, высоким со6
противлением коррозии. Поэтому сплавы – твердые растворы являются наилучшими для
изготовления деталей методами пластической деформации, когда качество деталей будет
определяться технологической пластичностью сплава.
Лучшая обрабатываемость резанием выявлена у сплавов, имеющих структуру эвтектики,
эти же сплавы дают и наилучшую чистоту поверхности при токарной обработке.
Очень важно отметить значительное влияние химических соединений на свойства спла6
вов. Присутствие их в сплавах даже в небольших количествах значительно повышает проч6
ность, износостойкость, жаропрочность и другие свойства, необходимые при эксплуатации
деталей.
Диаграммы состояния позволяют на научной основе предвидеть поведение сплавов, вы6
бирать сплавы в зависимости от их назначения, применять различные виды термообработки
и другие методы воздействия для получения заданной структуры и свойств.
20
