Орлов Д.С. Химия почв
Подождите немного. Документ загружается.


Селективность катионного обмена
Количественное соотношение между двумя любыми обменными
катионами
в ППК не
равно отношению активностей
(или
концентра-
ций)
тех же
катионов
в
равновесном растворе.
При
реакции обмена
nCa
2
+
+
Mg
2
+4=fcnMg
2
+
+
Ca
2
+
это
можно выразить неравенством:
где индекс
«П»
обозначает катионы
в
составе ППК;
а
са
2
+>
a
Mg
2
+
—
ак
"
тивности катионов
в
равновесном растворе.
Это
означает,
что при
равной активности катионов раствора один
из них
поглощается почвой
в больших количествах
и
удерживается более прочно. Иными словами,
почвы обладают способностью селективно (избирательно) поглощать
катионы одного рода
в
ущерб катионам другого рода. Рассматриваемое
явление можно выразить уравнением:
[
Са
п
+
1
_
к
а
Са
2
+
lMg
2
n
+
l
<V+'
где коэффициент пропорциональности К называется коэффициентом
селективности. Он показывает характер распределения катионов между
твердой частью почвы (ППК) и почвенным раствором. В общей форме
коэффициент селективности можно записать так:
к
_
[
M
I1«M
2
где М] иМ
2
— катионы 1-го и 2-го рода.
Селективность зависит как от свойств катионов, так и от химиче-
ских особенностей компонентов ППК- В общем случае предпочтитель-
нее связываются катионы с более высоким зарядом, а при равных за-
рядах — катионы с большей атомной массой. Это правило иллюстри-
руется следующими рядами катионов, расположенных в порядке
возрастания степени их поглощения почвой:
Li+<Na+<NH
4
+<K
+
<Rb+<Cs+<H+;
Mg
2
+<Ca
2
+<Ba
2
+;
Al
3
+<Fe
3
+.
Специфика почвенного поглощающего комплекса может изменить
порядок расположения катионов в ряду поглощения, как это видно из
следующих рядов поглощения на различных минералах (по П. Шахт-
штабелю):
монтмориллонит Li+<Na+<K
+
<H+<Rb+<Mg
2
+<Ca
2
+=Sr
2
+<Ba
2
+;
каолинит Li+<Na+<H+<K+<Rb+<Mg
2
+<Ca
2
+ =Sr
2
+=Ba
2
+;
мусковит Li+<Na+<Mg
2
+<Ca
2
+<Sr
2
+<Rb+<Cs+<K+<Ba
2
+.
В этих рядах начальные члены Li+ и Na+ и конечный — Ва
2
+ за-
нимают постоянное место. Для монтмориллонита и каолинита расхож-
дения рядов заключаются в положении К
+
и Н+, тогда как мусковит
поглощает одновалентные катионы Rb+, Cs+ и К
+
в большей степени,
чем двухвалентные Mg
2+
, Са
2
+ и Sr
2
+.
Взаимодействие между отрицательными зарядами поверхности твер-
дых частиц ППК и катионами можно рассматривать с чисто электро-
91

статических позиций; в этом случае следует ожидать в соответствии
с законом Кулона, что сила взаимодействия будет нарастать при уве-
личении заряда катиона и уменьшении его радиуса. Это одна из при-
чин преимущественного поглощения двух- и трехзарядных катионов.
Но поскольку ионы в почвенном растворе гидратированы, то часто пре-
имущество получают катионы с меньшей гидратационной оболочкой.
Не меньшую роль в селективности обмена играют свойства анион-
ной части ППК- В качестве адсорбционных центров ППК выступают
участки сколов кристаллов; обменные катионы входят в межпакетные
промежутки глинистых минералов. Предпочтительнее удерживаются
этими центрами те катионы, для которых радиус (с учетом гидратной
оболочки) соответствует кристаллохимическим особенностям структур
активных центров.
Активными центрами органической части ППК служат преимуще-
ственно кислые функциональные группы — карбоксильные и феноль-
ные.
Селективность поглощения катионов в этом случае обусловлена
различной прочностью их связи с функциональными группами и зави-
сит от расположения последних в молекуле. Если фенольная и гидро-
ксильная группа находятся в ортоположении, то они образуют прочные
соединения с двух- и трехвалентными катионами; селективность по-
глощения последних, по сравнению с одновалентными катионами, на-
растает. Тот же эффект проявляется при взаимодействии катионов с
двумя рядом расположенными группами СООН, независимо от того,
принадлежат они циклическим или алифатическим структурам. Изби-
рательность к ионам Fe
3
+ и А1
3
+, обусловленная пространственным рас-
положением функциональных групп, иллюстрируется приведенной выше
схемой образования комплексно-гетерополярных солей по Л. Н. Алек-
сандровой (см. с. 89). Селективность поглощения катионов нарастает
с увеличением констант диссоциации кислых функциональных групп;
константы диссоциации повышаются, если соседний с функциональной
группой атом углерода несет электроотрицательный заместитель. На-
растание окисленности органического вещества ППК и констант дис-
социации приводит к тому, что предпочтительнее поглощаются поли-
валентные катионы, а щелочные и щелочноземельные катионы уступают
место переходным металлам.
Кинетика обмена катионов
В опытах по вытеснению из почвы обменного Са^ действием 1,0 н.
раствора NH
4
C1 академик К. К. Гедройц наблюдал, что реакция про-
исходит очень быстро, практически мгновенно. За 1 мин из почвы вы-
теснялось такое же количество Са
2
+, как и через 30 дней взаимодей-
ствия. К- К- Гедройц объяснил это тем, что обменная реакция протекает
лишь на поверхности мелкораздробленных частиц поглощающего ком-
плекса почвы. Однако он указывал и на случай, когда реакция обмена
должна протекать не мгновенно, а во времени: если почва сложена
микроагрегатами, то для их разрушения и последующей реакции об-
мена потребуется некоторое время.
По современным представлениям высокая скорость обмена катио-
нов наблюдается в тех случаях, когда обмениваются катионы, распо-
ложенные на поверхностях, сколах частиц ППК и удерживаемые за
счет остаточных сил, обусловленных дефектами решетки, разрывами
связи и т. д. Быстро обмениваются катионы, удерживаемые функцио-
нальными группами, расположенными на внешней поверхности агре-
гатов гумусовых веществ. Другим условием высокой скорости обмена
92

является высокая влажность, достигаемая обычно в разбавленных
суспензиях почв. В природных условиях при низкой влажности почв
и ее агрегированности для установления равновесия может потребо-
ваться несколько суток. Замедляется реакция обмена и в том случае,
когда обмениваются катионы межпакетных промежутков глинистых
минералов или когда источником вытесняющих ионов служат трудно-
растворимые соли твердых фаз почвы.
Основываясь на общих законах ионообменной сорбции, М. Б. Мин-
кин выделяет пять последовательных стадий осуществления реакции
обмена катионов раствора на катионы ППК:
1) перемещение вытесняющего иона из объема раствора к поверх-
ности ППК;
2) перемещение вытесняющего иона внутри твердой фазы ППК к
точке обмена;
3) химическая реакция обмена катионов;
4) перемещение вытесненного иона внутри твердой фазы от точки
обмена к поверхности ППК;
5) перемещение вытесненного иона от поверхности ППК в раствор.
Наблюдаемая в опыте скорость обмена катионов зависит от той
стадии, которая протекает наиболее медленно. Собственно обмен ка-
тионов (третья стадия) осуществляется быстро и не является лимити-
рующей. Наибольшие ограничения скорости связаны с перемещением
ионов к точке обмена внутри твердой фазы (внутренняя диффузия) и,
отчасти, — с внешней диффузией ионов к поверхности ППК через ок-
ружающую ее пленку жидкости. Скорость внутренней диффузии очень
мала; коэффициент самодиффузии Na+ в гелях глинистых минералов
имеет величины порядка 10"~
6
—Ю
-9
см
2
-с
-1
, а для калия в иллите —
всего Ю
-23
см
2
-с
-1
(по П. Наю). Расчеты показывают, что путь, про-
ходимый ионом в растворе за счет самодиффузии, не превышает
1 —
2 см в сутки; тогда как К
+
в вермикулите проходит не более 1 нм за
10—15 лет. Высокие градиенты концентрации и перемешивание уско-
ряют внутреннюю диффузию, но все же она существенно влияет на
время установления равновесия реакции катионного обмена.
В почвенной среде поток диффундирующего вещества складыва-
ется двумя составляющими: диффузией в поровом растворе и переме-
щением в адсорбированном состоянии за счет поверхностной диффузии.
Общий поток вещества F может быть выражен суммой двух по-
токов:
F=-DQf — + F
E
,
dx
где D — коэффициент диффузии данного вещества в свободном рас-
творе; 8 — доля объема почвы, занятая раствором, / — коэффициент
dc
сопротивления; — градиент концентрации вещества в почвенном
dx
растворе; F
E
— дополнительный поток вещества за счет перемещения
в твердой фазе сорбированного компонента.
Соответственно, эффективный коэффициент диффузии Д. равен:
D
c
rr--D0f — + D
E
.
dx
В этом уравнении доля объема, занятого раствором, показывает фак-
тически ту часть поперечного сечения некоторого объема почвы, через
которую осуществляется диффузия в свободном поровом растворе.
Коэффициент сопротивления учитывает извилистость порового простран-
93

•ства и изменение вязкости пристенных слоев воды в тонких порах под
влиянием заряда поверхности твердых фаз.
Таким образом, внутренняя диффузия ограничена влажностью,
структурой порового пространства, зарядом поверхности твердых час-
тиц, химическими и кристаллохимическими особенностями твердых фаз
почвы. Поэтому в нативных почвах при естественной влажности реак-
ции обмена протекают в реально измеримые отрезки времени: для
достижения равновесия может потребоваться несколько суток и более.
Экспериментальные исследования показывают, что скорость обмена
лимитируется главным образом внутридиффузионными процессами, хо-
тя на начальных стадиях главную роль может играть внешнедиффу-
зионная кинетика.
При внешнедиффузионной кинетике скорость изменения содержа-
ния обменного катиона в ППК определяется уравнением (по А. А. Ка-
вокину):
где N
t
— содержание t'-того иона в ППК, С< — концентрация того же
иона в почвенном растворе, С^.— то же для равновесного состояния,
t — время, р,- — коэффициент скорости обмена ионов, А, — коэффици-
ент пересчета содержания иона в ППК в единицы концентрации поч-
венного раствора. Если концентрация выражена в миллиграмм-экви-
валентах, тогда 1= 10 d/W, где d — объемная масса почвы в г/см
3
, и
W — объемная влажность в мл/см
3
.
Особенность обменных реакций в почвах заключается также в
неравномерности скорости обмена. В первые 5—10 мин обычно всту-
пают в реакцию 70—90% обменных катионов, затем скорость процесса
снижается и реакция медленно приближается к состоянию равновесия,
момент наступления которого не всегда легко установить эксперимен-
тальным путем. Поэтому в лабораторной практике прибегают к заве-
домо длительному настаиванию изучаемых суспензий или избыточно-
му промыванию почвы раствором соли для обеспечения необходимой
полноты реакции.
До сих пор мы рассматривали кинетику катионного обмена толь-
ко для случая, когда соль, содержащая вытесняющий катион, пол-
ностью растворена в почвенном растворе. При почвообразовании и в
практике химической мелиорации источниками вытесняющих катионов
часто бывают труднорастворимые соли. Обычно это гипс CaS04-2H
2
0
или карбонат кальция СаСОз. В мелиоративной практике преследуется
цель замены обменного Н+ или А1
3
+ на Са
2+
при известковании кис-
лых почв или замены обменного Na+ на Са
2
+ при гипсовании солон-
цов,
а мелиорирующие средства — гипс и известь—-вносят в твердом
состоянии в почву. В этом случае скорость изменения состава обмен-
ных катионов почв зависит уже не только от диффузионной кинетики,
но и от скорости растворения мелиорантов. Последняя в почвенных
условиях сравнительно невелика, и поэтому, например, вытеснение об-
менного Na+ при гипсовании происходит медленно, особенно в усло-
виях засушливого климата ареалов солонцов.
Изотермы катионного обмена
Количественной характеристикой обмена катионов служат изотер-
мы катионного обмена и соответствующие им уравнения изотерм ка-
тионного обмена.
.94

Изотермой катионного обмена мы будем называть графическое
изображение зависимости между составом обменных катионов в ППК
и составом катионов равновесного раствора. Изотермы обмена обычно
строят в следующих координатах: по оси ординат откладывают отно-
шения количеств обменных катионов в почвенном поглощающем ком-
плексе, а по оси абсцисс
—
отношения концентраций или активностей
тех же ионов в равновесном растворе (рис. 13).
Уравнение, описывающее эту за-
висимость, называют уравнением изо-
термы
катионного обмена.
Первое уравнение обмена в 1913 г.
предложил Р. Ганс:
г'.
•=к-
(So-C,) (Co-CJ
123456789
10
11
pg
Zt
] |Ca
2t
] В растворе
Рис. 13. Изотерма обмена ионов
Са
2
+ и Mg
2+
(по данным Керра)
[СаХ
2
] и [MgX
2
] — количества
обменных Са
2
+ и Mg
2
+
где С/ — число мг-экв катиона в
обменной форме (на 100 г почвы),
С\ — его концентрации в равновес-
ном растворе, в тМ; С
0
— общая
концентрация катионов в растворе и
S
0
— емкость катионного обмена.
Если в системе присутствуют катио-
ны только двух видов, то Со—С\
отвечает концентрации катионов второго рода в растворе, а S
0
—С/ —
содержанию обменных катионов этого рода.
Аналогичную форму записи использовал X. Керр (1928), опи-
раясь на закон действия масс и считая, что активные массы компонен-
тов в твердых фазах пропорциональны их общей массе в составе поч-
вы.
В простейшем случае реакция обмена равновалентных катионов
записывается, по Керру, так:
CaCl
2
(aq)+MgX
2
(s)=MgCl
2
(aq)+CaX
2
(s),
где индекс aq означает равновесный раствор, s
—
твердую фазу, X со-
ответствует одному эквиваленту почвенного поглощающего комплекса..
Тогда константу реакции можно записать в виде
[MgCli] [CaX
2
]
к--
[СаС1
2
] [MgX
2
]
а уравнение изотермы для ее графического изображения привести к
следующему виду:
[СаХ
2
К
[СаС1
8
]
[MgX
2
] [MgCl
2
]
Уравнение Керра соответствует закону действия масс, но с использо-
ванием концентраций вместо активностей компонентов. По данным
X. Керра, константа обмена ионов Са
2
+ и Mg
2+
{K
Ce
?+
iMg
2
+)
Ha
пыле-
вато-суглинистой почве имеет практически постоянное значение при
изменении в растворе отношения [Mg
2+
] : [Са
2
+] от 3,3 до 10,1
(табл. 22). Построенная по этим данным изотерма обмена выражается
прямой линией, проходящей через начало координат, тангенс угла на-
клона которой равен константе уравнения катионного обмена (см.
рис.
13). Как видно из табл.22, отношение концентраций магния и каль-
ция в растворе примерно в Зраза выше, чем отношение тех же катионов в
ППК; средняя константа обмена
Kca, Mg
равна 2,98, и это означает,
?•>

Таблица 22
Обмен ионов Са
2
+ и Mg
2
+ на пылевато-суглинистой
почве (по Керру)
Отношение концент-
раций
[Mg
2
+] : [Са 2+]
в растворе
3,3
4,7
5,8
6,8
8,2
10,1
Содержгние обменных
катионов, Мкг"'
Са - '
0,029
0,023
0,021
0,019
0,016
0,014
Mg
2+
0,032
0,038
0,040
0,042
0,045
0,047
Константа обмена
КСа2+, Mg2+
2,99
2,84
3,05
3,07
2,92
3,01
что из раствора примерно в 3 раза энергичнее поглощается Са
2
+, чем
Mg
2
+. Константа AW,са равна соответственно 0,34
(K.czMg=~—jr
v
Mg,Ca
Прямолинейность изотермы скорее идеальный случай, чем прави-
ло;
строгое подчинение катионного обмена уравнению Керра возможно
при благоприятных условиях: равные заряды обменивающихся катио-
нов,
сравнительно небольшие изменения соотношения катионов в рас-
творе (от 3,3 до 10,1), близкие значения коэффициентов активности,
ле слишком тяжелый механический состав почвы.
Для разновалентных катионов, особенно при высокой селективно-
сти поглощения, и в широком диапазоне концентраций катионов рас-
твора изотермы часто приобретают сложную криволинейную форму,
которую с некоторым приближением можно описать уравнением па-
раболы.
Первое термодинамическое описание катионного обмена предло-
жил, видимо, А. Венслоу. Реакция обмена разновалентных ионов, на-
пример Na+ и Са
2+
, по Венслоу, записывается так:
2nNa++Ca
2
+^n
2
Ca
2
++2Na+
а уравнение изотермы в виде:
(Ша+)
8
(П
2
Са
2
-г)
'К
°Na+
Q
Ca
2
+
где (ПЫа) и (ПгСа)—активности соответствующих компонентов
ППК. Уравнение Венслоу может быть выведено строго термодинами-
чески, но сложность его решения заключается в том, что активности
компонентов ППК остаются неизвестными. Пытаясь обойти это за-
труднение, Венслоу вводит предположение о равенстве активностей об-
менных катионов их молярным долям:
[Ша+J
(Ша+)
=
(П
2
Са
2+
)
[ГШа+] + [П
2
Са
2
+]
[П
2
Са
2
+]
~ [Ша+] + [П
2
Са
2
+]'
где квадратные скобки обозначают число молей катиона на единицу
массы ППК. Это предположение справедливо только для идеальных
гомогенных смесей; поэтому уравнение Венслоу фактически остается
полуэмпирическим и не всегда подтверждается экспериментом. Откло-
96

нение экспериментальных данных от теоретических представлений
привело к поиску более совершенных способов математического описа-
ния изотермы катионного обмена.
Наиболее полную форму уравнения предложил Б. П. Никольский:
1
1
А'//
П
1
1
где ЛГ,- и Af
;
-— количества обменных катионов i-того и /-того видов в
ППК. в мг-экв/100 г, zi и
z,-
—
их заряды, Y«
H
Y/
—
коэффициенты ак-
тивности катионов в растворе,
С —
равновесная концентрация, а* и
UJ
— активности тех же катионов в равновесном растворе. Это уравне-
ние отвечает закону действия масс, но концентрации и активности
катионов берутся в степенях, обратных их зарядам, что соответствует
записи обменной реакции в форме:
— (Ме.
2
< ) + — Mef
•£.
— (Ме
г
/) + —
Ме
г
<
,
Z/ 2j Zj Zi
где Me
—
катион, а круглые скобки означают его нахождение в твер-
дой фазе (использованы обозначения, принятые Б. П. Никольским).
Константа К в уравнении Б. П. Никольского есть не что иное,
как коэффициент селективности.
Среди других способов описания изотермы обмена представляет
интерес уравнение Е. Н. Гапона, которое для обмена ионов Са
2+
—Na+
можно записать, используя те же обозначения, что и в уравнении
Б.
П. Никольского, в следующем виде:
N
CJ+
v
(
С
Са*+>'
/2
К
N
Na+
C
N.+
Уравнение Гапона основано на предположении, что обмен катио-
нов осуществляется по реакции:
nCa
0
,
5
+Na+^nNa+0,5Ca
2
+.
Это уравнение основано на концентрациях, и в нем не принимаются
во внимание заряды катионов в твердых фазах. Уравнение Е. Н. Га-
пона получило широкое распространение в мировой литературе благо-
даря относительно неплохому эмпирическому совпадению эксперимен-
тальных данных с результатами расчетов по этому уравнению. Сопо-
ставление приведенных уравнений показывает, что их вид зависит от
выбранного способа записи реакции обмена. При характеристике ионо-
обменных смол принята запись по Б. П. Никольскому.
Предложено немало и весьма сложных по форме уравнений, учи-
тывающих плотность зарядов в ППК, их распределение в двойном
электрическом слое, эффективные радиусы обменивающихся катионов
и т. п. Однако все эти уравнения, как и приведенные выше, имеют
ограниченное применение, и в большинстве случаев наблюдаются су-
щественные расхождения между результатами опыта и теоретическим
расчетом.
Расхождение теории и эксперимента проявляется особенно на-
глядно, когда обмениваются катионы с разными зарядами, а отноше-
ние активностей катионов в растворе меняется в широком диапазоне,
4
Д. С.
Орлов
97
охватывая практически весь аналитически доступный интервал ве-
личин.
Приложимость к почвам уравнений катионного обмена, основан-
ных на простой записи закона действия масс, требует соблюдения-
ряда условий. В их число входят постоянство рН, обратимость реак-
ций обмена, равноценность всех адсорбционных центров ППК в отно/'
шении прочности связи с катионами одного рода. Несоблюдение этих
предпосылок и вызывает расхождение между теорией и экспериментом.
Известно, что некоторые катионы, например К
+
, NH
4
+
, после вхожде-
ния в ППК частично переходят в необменное состояние (фиксируются-
кристаллической решеткой слоистых силикатов); это нарушает эквива-
лентность обмена. Прочность связи катионов зависит от порядка их
введения в ППК; ранее введенные в ППК катионы удерживаются поч-
вой прочнее, чем последующие порции. Очевидна также и неравноцен-
ность адсорбционных центров, рассмотренная выше в связи с селек-
тивностью обмена.
Достаточно только одного из перечисленных факторов, чтобы вы-
звать расхождение между теоретической и экспериментальной изотер-
мами катионного обмена.
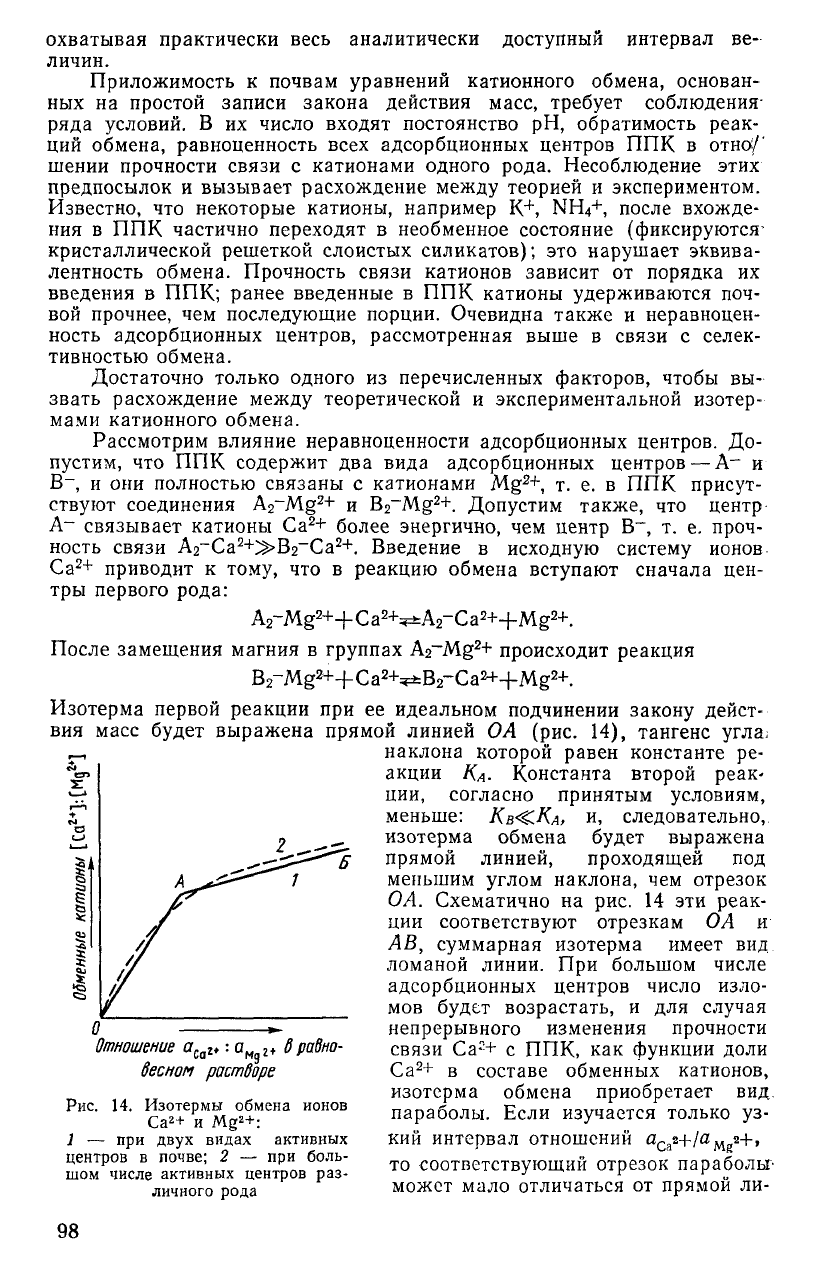
Рассмотрим влияние неравноценности адсорбционных центров. До-
пустим, что ППК содержит два вида адсорбционных центров
—
А
-
и
В
-
,
и они полностью связаны с катионами Mg
2+
, т. е. в ППК присут-
ствуют соединения A
2
~Mg
2+
и B
2
~Mg
2+
. Допустим также, что центр
А- связывает катионы Са
2
+ более энергично, чем центр В~, т. е. проч-
ность связи А
2
-Са
2+
^В
2
_
Са
2
+. Введение в исходную систему ионов
Са
2+
приводит к тому, что в реакцию обмена вступают сначала цен-
тры первого рода:
A
2
-Mg
2
++Ca
2
+=e±A2-Ca
2
++Mg
2
+.
После замещения магния в группах A
2
_
Mg
2
+ происходит реакция
Bz-Mg^+Ca^^Bs-Ca^+Mg
2
-*-.
Изотерма первой реакции при ее идеальном подчинении закону дейст-
вия масс будет выражена прямой линией О А (рис. 14), тангенс угла;
наклона которой равен константе ре-
акции КА- Константа второй реак-
ции, согласно принятым условиям,
меньше:
КВ-^КА,
и, следовательно,
изотерма обмена будет выражена
прямой линией, проходящей под
меньшим углом наклона, чем отрезок
ОА.
Схематично на рис. 14 эти реак-
ции соответствуют отрезкам ОА и
АВ,
суммарная изотерма имеет вид
ломаной линии. При большом числе
адсорбционных центров число изло-
мов будет возрастать, и для случая
непрерывного изменения прочности
связи Са
г
+ с ППК, как функции доли
Са
2
+ в составе обменных катионов,
изотерма обмена приобретает вид
параболы. Если изучается только уз-
кий интервал отношений a
Ca
2+/a
Mg
2+»
то соответствующий отрезок параболы''
может мало отличаться от прямой ли-
z*
:
0
м
я
г» 8рабно-
Отношение
a
CaL
,.
„
м
бесном растдоре
Рис.
14.
Изотермы обмена ионов
Са
2
+ и Mg
2
+:
1 — при двух видах активных
центров в почве; 2 — при боль-
шом числе активных центров раз-
личного рода
98

нии. Все это приводит к выводу о невозможности использования одних
и тех же коэффициентов селективности для прогноза изменения состава
обменных катионов при любых произвольно выбранных их отношениях.
Катионный обмен и адсорбция
При количественном описании явлений катионного обмена нередко
употребляют уравнения изотерм адсорбции, например уравнения
Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассмат-
ривают как один из видов адсорбции. Между тем различия между ад-
сорбционными явлениями и ионным обменом настолько велики, что на
этом следует остановиться подробнее.
Адсорбцией называют концентрирование вещества адсорбата из
объема газа или жидкости на поверхности твердого тела (адсорбента)
или жидкости. Если молекулы адсорбата образуют поверхностное хи-
мическое соединение с адсорбентом, то говорят о хемосорбции. Ад-
сорбция увеличивается с ростом давления газа или концентрации рас-
твора. При снижении парциального давления адсорбируемого компо-
нента газовой смеси или при бесконечном разбавлении раствора ад-
сорбция уменьшается вплоть до полного освобождения поверхности
адсорбента от молекул адсорбата.
Сухие почвы обладают способностью адсорбировать различные
газы и пары. Наиболее интенсивно происходит адсорбция молекул
воды, которая описывается уравнением Брунауера—Эммета—Теллера
(изотерма БЭТ). В меньшей степени адсорбируются ССЬ, Ог, N
2
. Ад-
сорбция воды, диоксида углерода и кислорода может сопровождаться
химическим взаимодействием с компонентами твердых фаз почв (хе-
мосорбция). Из растворов почвы адсорбируют нейтральные молекулы
органических соединений, гумусовые вещества.
Адсорбцию вызывают молекулярные силы поверхности адсорбен-
та. Неполярные молекулы удерживаются за счет дисперсионных сил.
Полярные молекулы (диполи, мультиполи) взаимодействуют с элек-
тростатическим полем поверхности адсорбента, что усиливает ад-
сорбцию.
Одно из главных различий между адсорбцией и ионным обменом
заключается в том, что обменные катионы являются обязательным
компонентом ППК и могут быть только заменены на катионы другого
рода, но не удалены вовсе. Попытка пространственного расчленения
ППК на анионную часть и катионы привела бы к нарушению принци-
па
электронейтральности.
В противоположность этому поверхность ад-
сорбента может быть полностью лишена молекул адсорбата. Общее
содержание обменных катионов остается сравнительно постоянным
(в пределах постоянства величины ЕКО), тогда как количество адсор-
бированного вещества является функцией активности адсорбата в
объеме фазы. Иными словами, адсорбент и адсорбат могут существо-
вать раздельно, тогда как ППК составляет единое целое.
В то же время количественные закономерности адсорбции и ион-
ного обмена могут быть описаны сходными по форме уравнениями.
Для описания изотерм адсорбции пользуются уравнением Фрейндлиха
или уравнением Ленгмюра.
Эмпирическое уравнение Фрейндлиха имеет вид,
тде
Q —
количество адсорбированного вещества, С
—
его равновесная
концентрация (или равновесное парциальное давление), m и п
—
эм-
4*
99
лирические константы. Это уравнение впервые было сформулировано»
Ван Беммеленом в 1888 г., но в литературе закрепилось как уравне-
ние Фрейндлиха. Оно хорошо описывает многие сорбционные процесс
сы,
хотя и не позволяет найти предельную величину максимальной ад-
сорбции.
Уравнение Ленгмюра для мономолекулярной адсорбции записы-
вают в следующем виде:
о= $£ о
где
Q
— количество адсорбированного вещества на 1 г адсорбента,
С —
равновесная концентрация, К — константа равновесия, Qmax
—
макси-
мальное количество вещества, адсорбируемое адсорбентом, его сорб-
ционная емкость.
Если числитель и знаменатель правой части уравнения разделить
на К, получим:
Т
+ с
А
+
С
'
Уравнение Ленгмюра записывают и в несколько иной форме:
fl
Q а с
чл
А
+
С
или а-
а
к
с
А
+
С'
где 8
—
доля заполнения поверхности адсорбента адсорбатом, а
—
по-
верхностная концентрация заполненных адсорбционных мест и ам
—
общее число адсорбционных мест на поверхности адсорбента.
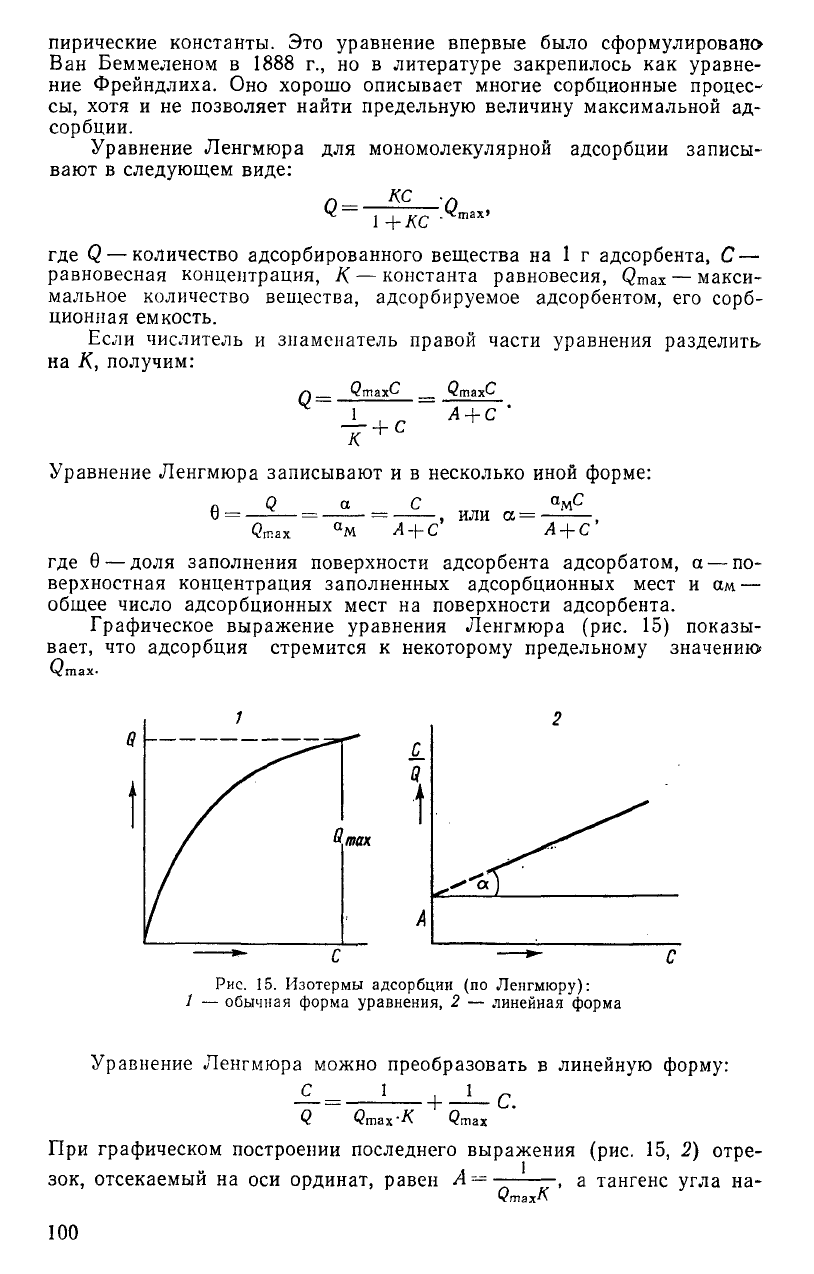
Графическое выражение уравнения Ленгмюра (рис. 15) показы-
вает, что адсорбция стремится к некоторому предельному значению
Угаах.
так
Рис.
15. Изотермы адсорбции (по Ленгмюру):
1 — обычная форма уравнения, 2 — линейная форма
Уравнение Ленгмюра можно преобразовать в линейную форму:
С 1,1
•К
С.
При графическом построении последнего выражения (рис. 15, 2) отре-
зок, отсекаемый на оси ординат, равен А
— —
, а тангенс угла на-
QmaxK
100
