Панов В.П., Якунина Е.С. Биохимия. Конспект лекций
Подождите немного. Документ загружается.


МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ
ФЕДЕРАЦИИ
МОСКОВКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ТЕХНОЛОГИЙ И УПРАВЛЕНИЯ
(образован в 1953 году)
Кафедра Технологии продуктов питания и экспертизы товаров
Дистанционное
обучение
Общ.пит.-19.21.2701.очн. Общ.пит.-19.21.0135.очн. Общ.пит.-19.21.2705.очн.
Общ.пит.-19.21.2701.вчр.плн. Общ.пит.-19.21.0135.зчн.скр. Общ.пит.-19.21.2705.вчр.плн.
Общ.пит.-19.21.2701.вчр.скр. Общ.пит.-19.21.0135.зчн.плн. Общ.пит.-19.21.2705.вчр.скр.
Общ.пит.-19.21.2701.зчн.плн. Общ.пит.-19.21.0135.вчр.скр. Общ.пит.-19.21.2705.зчн.плн.
Общ.пит.-19.21.2701.зчн.скр. Общ.пит.-19.21.0135.вчр.плн Общ.пит.-19.21.2705.зчн.скр.
Общ.пит.-19.21.2703.очн. Общ.пит.-19.21.2707.очн. Общ.пит.-19.21.2708.очн.
Общ.пит.-19.21.2703.вчр.плн. Общ.пит.-19.21.2707.вчр.скр. Общ.пит.-19.21.2708.вчр.скр.
Общ.пит.-19.21.2703.вчр.скр. Общ.пит.-19.21.2707.вчр.плн. Общ.пит.-19.21.2708.вчр.плн.
Общ.пит.-19.21.2703.зчн.плн. Общ.пит.-19.21.2707.зчн.плн. Общ.пит.-19.21.2708.зчр.скр.
Общ.пит.-19.21.2703.зчн.скр. Общ.пит.-19.21.2707.зчн.скр. Общ.пит.-19.21.2708.зчр.плн.
Общ.пит.-19.21.2710.очн. Общ.пит.-19.21.2710.зчн.плн. Общ.пит.-19.21.2712.вчр.плн.
Общ.пит.-19.21.2710.вчр.плн. Общ.пит.-19.21.2710.зчн.скр. Общ.пит.-19.21.2712.вчр.скр.
Общ.пит.-19.21.2710.вчр.скр. Общ.пит.-19.21.2712.очн. Общ.пит.-19.21.2712.зчн.плн.
Общ.пит.-19.21.2704.вчр.плн. Общ.пит.-19.21.2704.зчн.скр. Общ.пит.-19.21.2704.зчн.плн.
Общ.пит.-19.21.2704.вчр.скр. Общ.пит.-19.21.2704.очн.
В.П. Панов, Е.С. Якунина
БИОХИМИЯ
Конспект лекций
для студентов всех технологических специальностей
(всех форм обучения)
www. msta.ru
4312
Москва - 2004
УДК 577.1
© Панов В.П., Якунина Е.С. Биохимия. Конспект лекций. М., МГТА, 2004.
Рекомендовано Институтом информации образования РАО
В конспекте лекций доктора химических наук профессора В.П. Панова,
кандидата химических наук доцента Е.С. Якуниной, в кратком и
систематическом виде изложены краткие теоретические сведения и подробные
описания хода проведения лабораторных работ по биохимии. В биохимию
студента вводят основополагающие принципы молекулярной логики жизни.
Даётся оригинальный материал по биологическим мембранам и клеточному
транспорту, процедурам гормональной регуляции, молекулярной генетике,
генетической инженерии.
Практикум предназначен для студентов 2, 3, 4 курсов технологических
специальностей, всех форм обучения.
Авторы: Панов Валерий Петрович
Якунина Елена Сергеевна
Рецензенты: профессор кафедры биохимии медико - биологического
факультета Российского государственного медицинского
университета доктор биологических наук, А.В. Карякин,
директор Института питания РАМН, академик РАМН,
профессор В.А. Тутельян.
Редактор: Свешникова Н.И.
© Московский государственный университет технологий и управления, 2004
109004, Москва, Земляной Вал, 73
2

С О Д Е Р Ж А Н И Е
Стр.
Тема 1. Аминокислоты и пептиды ____________________________________ 5
1.1. Пептиды ______________________________________________________ 9
Вопросы для самоконтроля __________________________________________ 9
Тестовые вопросы _________________________________________________ 10
Тема 2. Введение в белки ____________________________________________ 10
Вопросы для самоконтроля __________________________________________14
Тестовые вопросы _________________________________________________ 14
Тема 3. Пространственная структура белков ____________________________15
Вопросы для самоконтроля __________________________________________ 17
Тестовые вопросы __________________________________________________18
Тема 4. Введение в ферменты ________________________________________ 18
Вопросы для самоконтроля __________________________________________ 21
Тестовые вопросы __________________________________________________ 22
Тема 5. Липиды ____________________________________________________ 22
Вопросы для самоконтроля __________________________________________ 26
Тестовые вопросы __________________________________________________ 26
Тема 6. Витамины __________________________________________________ 27
6.1. Водо-растворимые витамины ____________________________________ 27
6.2. Жирорастворимые витамины _____________________________________ 29
Вопросы для самоконтроля __________________________________________ 30
Тестовые вопросы __________________________________________________ 30
Тема 7. Биомембраны и транспорт ____________________________________ 30
Вопросы для самоконтроля __________________________________________ 33
Тестовые вопросы __________________________________________________ 33
Тема 8. Углеводы __________________________________________________ 33
8.1. Моносахариды _________________________________________________ 34
8.2. Дисахариды ____________________________________________________37
8.3. Полисахариды __________________________________________________38
Вопросы для самоконтроля __________________________________________ 38
Тестовые вопросы __________________________________________________ 39
Тема 9. Нукелеотиды и нуклеиновые кислоты __________________________ 39
Вопросы для самоконтроля __________________________________________ 42
Тестовые вопросы __________________________________________________ 42
Тема 10. Принципы биоэнергетики ____________________________________43
Вопросы для самоконтроля __________________________________________ 46
Тестовые вопросы __________________________________________________ 46
Тема 13. Метаболизм липидов ________________________________________47
13.1.
- окисление насыщенных жирных кислот _______________________ 48
13.2. Метаболизм полинасыщенных жирных кислот _____________________ 49
Вопросы для самоконтроля __________________________________________ 50
Тестовые вопросы __________________________________________________50
Тема 14. Обмен белков ______________________________________________ 51
Вопросы для самоконтроля __________________________________________ 52
3
Тестовые вопросы __________________________________________________ 52
Тема 15. Гормональная регуляция _____________________________________52
Вопросы для самоконтроля __________________________________________ 55
Тестовые вопросы __________________________________________________ 55
Тема 16. Введение в молекулярную генетику ___________________________ 56
Тестовые вопросы __________________________________________________58
Тестовые вопросы по дисциплине _____________________________________58
Список рекомендуемой литературы ___________________________________ 61
4
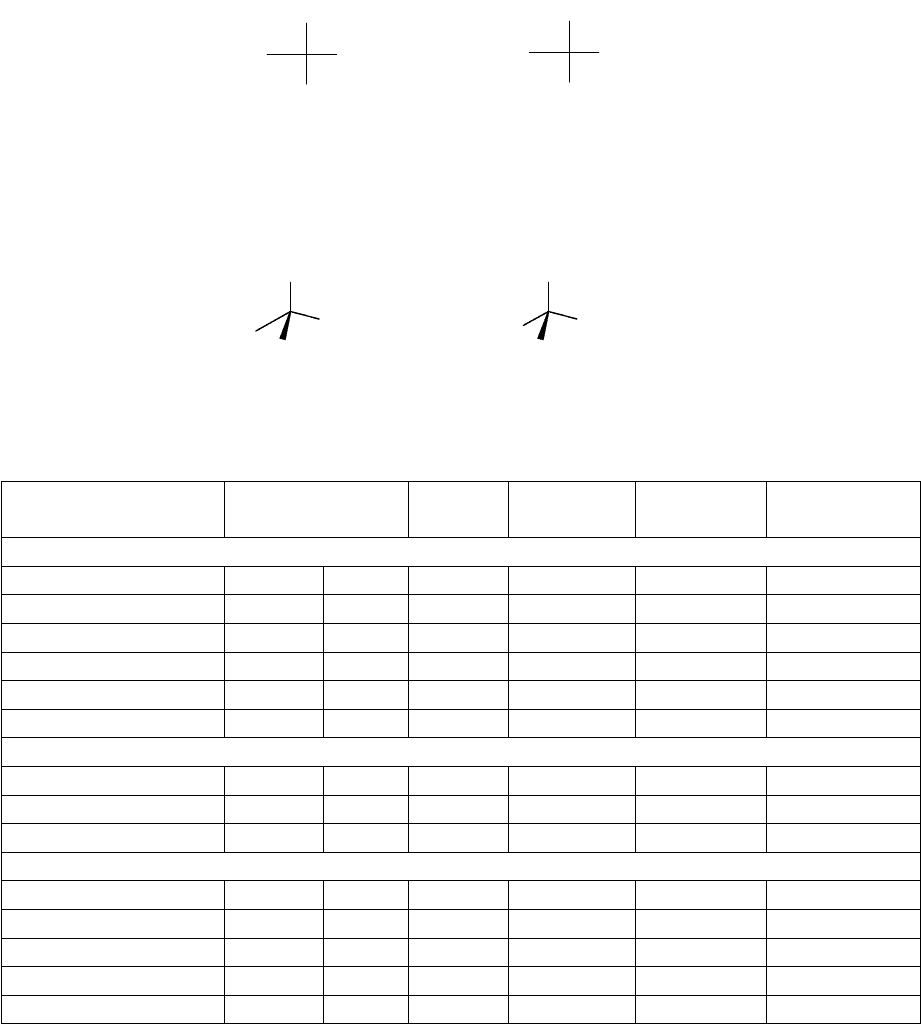
ТЕМА 1. АМИНОКИСЛОТЫ И ПЕПТИДЫ
Все белки, независимо от того принадлежат ли они древним линиям
бактерий или наиболее сложным формам жизни, сконструированы из одних и
тех же субъединиц - 20 аминокислот, ковалентно связанных в
характеристичные линейные последовательности. Из этих строительных
блоков различные организмы могут изготовить ферменты, гормоны, антитела,
линзы глаз, рога, антибиотики, яды грибов и мириады других веществ с ярко
выраженной биологической активностью. Первой аминокислотой, открытой в
белках в 1806г. был аспарагин, последняя из 20 аминокислот - треонин была
найдена в 1938г. Все 20 аминокислот, найденные в белках, имеют
карбоксильную группу и аминогруппу, присоединенные к С
- атому углерода.
аминокислота глицин
Во всех аминокислотах, за исключением глицина, С
- атом хирален, все
аминокислоты (кроме глицина) оптически активны. Аминокислоты являются L-
стереоизомерами. т.е. вращают плоскополяризованный свет влево.
L-аланин D-аланин
Свойства аминокислот
L-аминокислота Аббревиатура М рК
1
(-СООН)
рК
2
(-NH
3
+
)
Доля в
белках, %
Неполярные алифатические R-группы
Глицин Gly G 75 2,34 9,60 7,5
Аланин Ala A 89 2,34 9,69 9,0
Валин Val V 117 2,32 9,62 6,9
Лейцин Leu L 131 2,36 9,60 7,5
Изолейцин Ile I 131 2,36 9,68 4,6
Пролин Pro P 115 1,99 10,96 4,6
Ароматические R-группы
Фенилаланин Phe F 165 1,83 9,13 3,5
Тирозин Tyr Y 181 2,20 9,11 3,5
Триптофан Trp W 204 2,38 9,39 1,1
Полярные незаряженные R-группы
Серин Ser S 105 2,21 9,15 7,1
Треонин Thr T 119 2,11 9,62 6,0
Цистеин Cys C 121 1,96 8,18 2,8
Метионин Met M 149 2,28 9,21 1,7
Аспарагин Asn N 132 2,02 8,80 4,4
5
COO
H
NH
3
R
COO
H
NH
3
H
+
+
COO
NH
3
CH
3
H
COO
CH
3
NH
3
H
- -
+
+
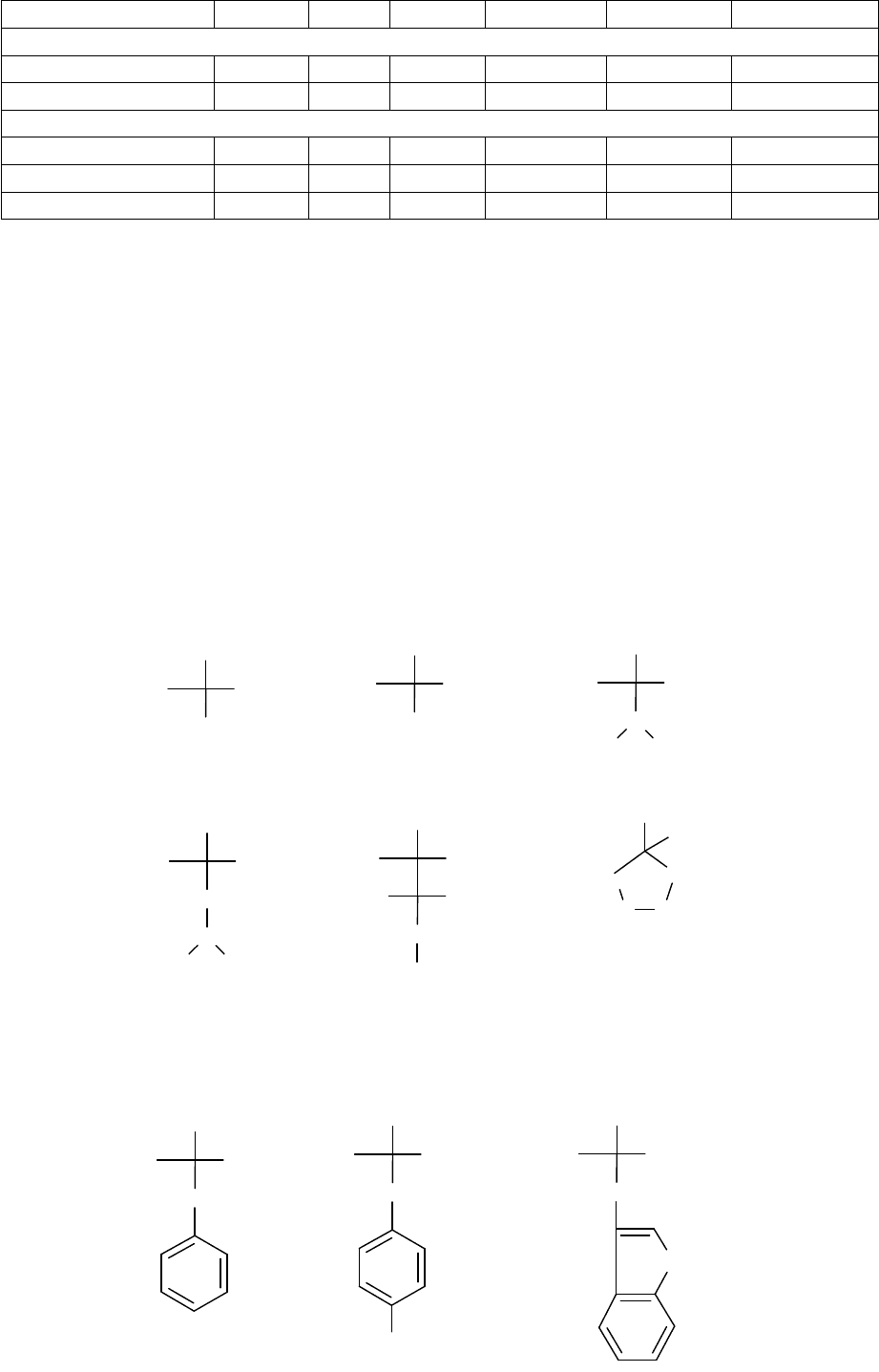
Глутамин Gln Q 146 2,17 9,13 3,9
Отрицательно заряженные R-группы
Аспартат Asp D 133 1,88 9,60 5,5
Глутамат Glu E 147 2,19 9,67 6,2
Положительно заряженные R-группы
Лизин Lys K 146 2,18 8,95 7,0
Аргинин Arg R 174 2,17 9,04 4,7
Гистидин His H 155 1,82 9,17 2,1
Аминокислоты в водном растворе ионизованы и могут действовать как
кислоты или основания. Знание кислотно-основных свойств аминокислот
чрезвычайно важно для понимания физико-химических и биологических
свойств белков. Способы разделения, идентификации и количественного
определения аминокислот, что является необходимой стадией определения
аминокислотного состава и аминокислотной последовательности в белках,
также основаны на характеристиках их кислотно-основного поведения.
Аминокислоты, имеющие одну амино- и одну карбоксильную группы,
кристаллизуются из нейтральных водных растворов в полностью
ионизованных формах, называемых цвиттерионами, имеющими как
положительный, так и отрицательный заряды.
Аминокислоты с неполярными алифатическими R-группами
глицин аланин валин
лейцин изолейцин пролин
Аминокислоты с ароматическими R-группами
фенилаланин тирозин триптофан
6
COO
H
H
NH
3
COO
CH
3
H
NH
3
COO
C
H
H
NH
3
CH
3
CH
3
COO
H
NH
3
CH
2
CH
3
H CH
3
CH
2
C
H
CH
3
CH
3
COO
H
NH
3
C
H
2
C
H
2
CH
2
NH
3
COO
H
-
-
-
-
-
-
++
+
+
+
+
COO
CH
2
H
NH
3
-
+
COO
CH
2
H
NH
3
OH
NH
COO
CH
2
H
NH
3
+ +
-
-
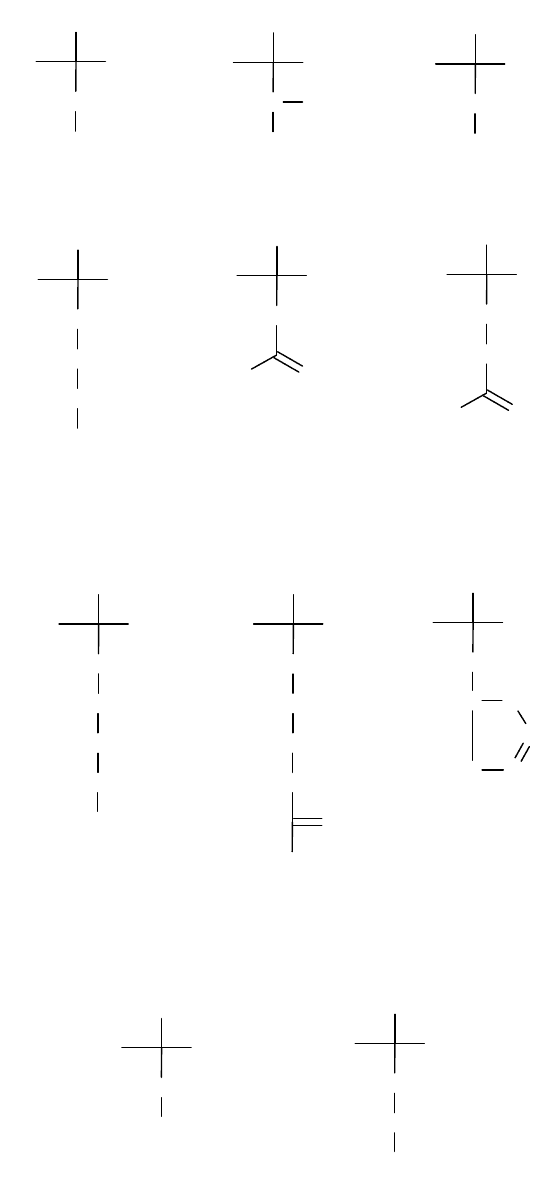
Аминокислоты с полярными незаряженными R-группами
серин треонин цистеин
метионин аспарагин глутамин
Аминокислоты с положительно заряженными R-группами
лизин аргинин гистидин
Аминокислоты с отрицательно заряженными R-группами
аспартат глутамат
Триптофан, тирозин и в меньшей степени фенилаланин поглощают в
ультрафиолетовом свете. Аспарагин и глутамин являются амидами двух других
аминокисдот: аспартата и глутамата. Цистеин легко окисляется с образованием
ковалентно связанной димерной аминокислоты, называемой цистином, в
котором две цистеиновые молекулы соединены дисульфидным мостиком.
7
COO
CH
2
H
NH
3
OH
-
+
COO
CH
H
NH
3
CH
3
OH
-
+
COO
CH
2
H
NH
3
SH
-
+
COO
CH
2
H
NH
3
CH
2
S
CH
3
-
+
COO
CH
2
H
NH
3
NH
2
O
-
+
COO
CH
2
H
NH
3
CH
2
NH
2
O
-
+
COO
CH
2
H
NH
3
CH
2
CH
2
CH
2
NH
3
+
-
+
COO
CH
2
H
NH
3
CH
2
CH
2
NH
NH
2
NH
2
+
-
+
+
-
N
H
CH
C
H
2
NH
CH
COO
CH
2
H
NH
3
+
COO
CH
2
H
NH
3
COO
+
-
COO
CH
2
H
NH
3
CH
2
COO
+
-
-
-
Дисульфидные мостики встречаются во многих белках, стабилизируя их
структуру.
В дополнение к стандартному набору из 20 аминокислот найдены другие
аминокислоты, как компоненты ограниченных типов белков, они образуются в
белках путем модификации стандартных аминокислот. Нестандартными
аминокислотами являются: 4-гидроксипролин, 5-гидроксилизин, N-метил-
лизин, селеноцистеин, орнитин и другие. Аминокислоты могут действовать как
кислоты и как основания.
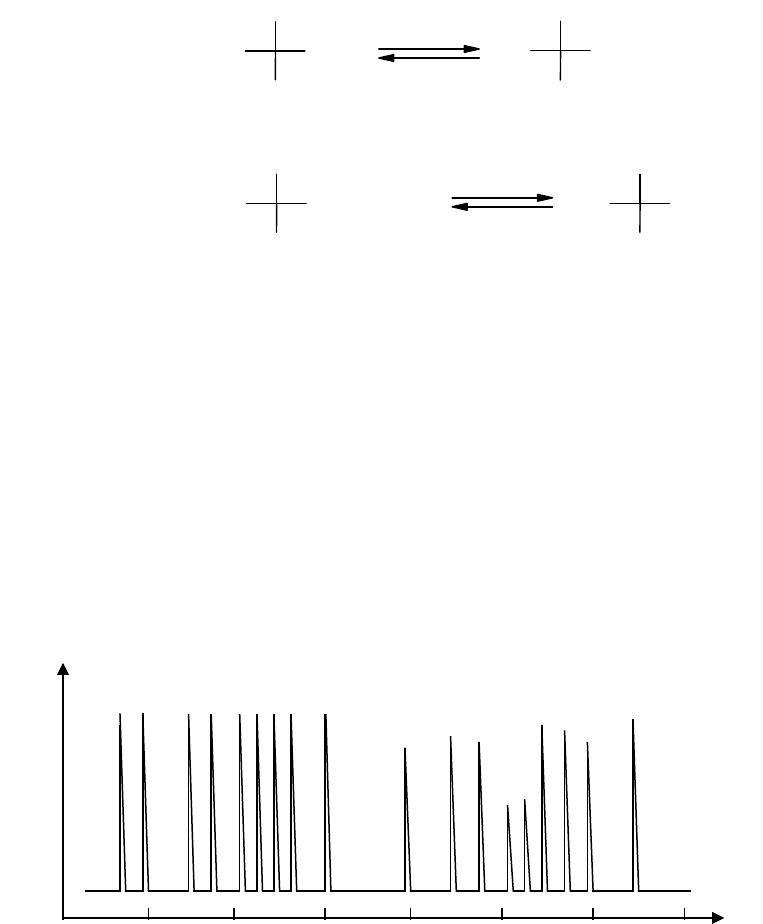
Ионообменная хроматография наиболее широко распространенный метод
разделения, идентификации и количественного определения аминокислот в
смеси. Эта техника основана на различии зарядов и величин зарядов
аминокислот при заданном значении рН и следовательно различной
аффинности каждой аминокислоты к ионообменной смоле. Наиболее
развитыми методами аминокислотного анализа являются автоматический
аминокислотный анализ и высокоэффективная жидкостная хроматография
(жидкостная хроматография высокого давления, ЖХВД).
0 5 10 15 20 25 30 35
Аминограмма Время, мин.
1.1. Пептиды.
8
H
NH
3
R
COO
H
NH
2
R
COO
+
H
H
NH
3
R
COO
H
NH
3
R
COOH
+
H
-
-
-
+
+
+
+
+
Поглощение
Asp
Glu
Ser
Gly
His
Thr
Ala
Arg
Pro
Tyr
Val
Met
Ile
Leu
Phe
Lys
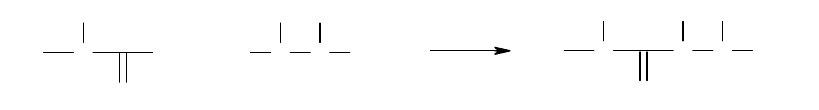
Две аминокислоты могут ковалентно соединяться посредством пептидной
связи с образованием дипептида.
Три аминокислоты могут соединяться посредством двух пептидных
связей с образованием трипептида. Несколько аминокислот образуют
олигопептиды, большое число аминокислот - полипептиды. Пептиды содержат
только одну -аминогруппу и одну -карбоксильную группу. Эти группы
могут быть ионизованы при определенных значениях рН. Подобно
аминокислотам они имеют характеристические кривые титрования и
изоэлектрические точки, при которых они не двигаются в электрическом поле.
Подобно другим органическим соединениям пептиды участвуют в
химических реакциях, которые определяются наличием функциональных
групп: свободной аминогруппой, свободной карбоксигруппой и R-группами.
Пептидные связи подвержены гидролизу сильной кислотой (например, 6М
НС1) или сильным основанием с образованием аминокислот. Гидролиз
пептидных связей - это необходимый этап в определении аминокислотного
состава белков. Пептидные связи могут быть разрушены действием ферментов
протеаз.
Многие пептиды, встречающиеся в природе, имеют биологическую
активность при очень низких концентрациях.
Пептиды - потенциально активные фармацевтические препараты, есть
три способа их получения:
1) выделение из органов и тканей;
2) генетическая инженерия;
3) прямой химический синтез.
В последнем случае высокие требования предъявляются к выходу
продуктов на всех промежуточных стадиях.
Вопросы для самоконтроля
1. Связь между структурой и свойствами аминокислот.
2. В какой форме присутствуют молекулы L-аланина в изоэлектрической
точке?
3. Сколько хиральных центров имеет L-изолейцин?
4. Сравните величины рК
а
аминокислоты и ее пептидов.
5. Методы получения пептидов.
Тестовые вопросы
9
NH
3
C
H
OH
O
R
+
H N
H
C
H
R'
COO
N
H
C
H
R'
COONH
3
C
H
O
R
- H
2
O+
-
+
-

1. Какой связью соединяются остатки аминокислот в белковой молекуле?
а) пептидной;
б) водородной;
в) сложноэфирной.
2. Как классифицируют аминокислоты?
а) по количеству аминных и карбоксильных групп;
б) по химическому строению боковой цепи;
в) по количеству SH – групп.
3. Сколько незаменимых аминокислот известно?
а) 8;
б) 5;
в) 4;
г) 3.
4. Какие белки называют полноценными?
а) состоящие из углеводов;
б) состоящие из восьми незаменимых аминокислот;
в) состоящие из трёх витаминов.
5. Какие аминокислоты относятся к заменимым?
а) могут синтезироваться в организме человека;
б) не могут синтезироваться в организме человека;
в) могут частично синтезироваться.
ТЕМА 2. ВВЕДЕНИЕ В БЕЛКИ
Почти все что происходит в клетке включает в свое действие один или
несколько белков. Белки формируют структуру, катализируют реакции в
клетке, а также выполняют множество других задач. Их центральное место в
клетке отражено в том факте, что выражением генетической информации
выступает белок. Для каждого белка существует сегмент ДНК (ген), который
кодирует информацию, специфическую для его аминокислотной
последовательности. В типичной клетке присутствуют тысячи различных видов
белков, каждый из которых геном, и несет специфическую функцию. Белки в
отличие от других биологических макромолекул имеют чрезвычайно
разносторонние функции.
Белки имеют множество различных биологических функций, их часто
классифицируют в соответствии с их биологической ролью.
Ферменты. Это, как правило, белки, обладающие каталитической
активностью. Большинство химических реакций органических биологических
молекул в клетках катализируются ферментами. Многие тысячи различных
ферментов, каждый из которых в состоянии катализировать определенный тип
химической реакции, открыты в различных организмах.
Транспортные белки. Транспортные белки в плазме крови связывают и
переносят определенные молекулы или ионы от одного органа к другому.
10
