Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов
Подождите немного. Документ загружается.

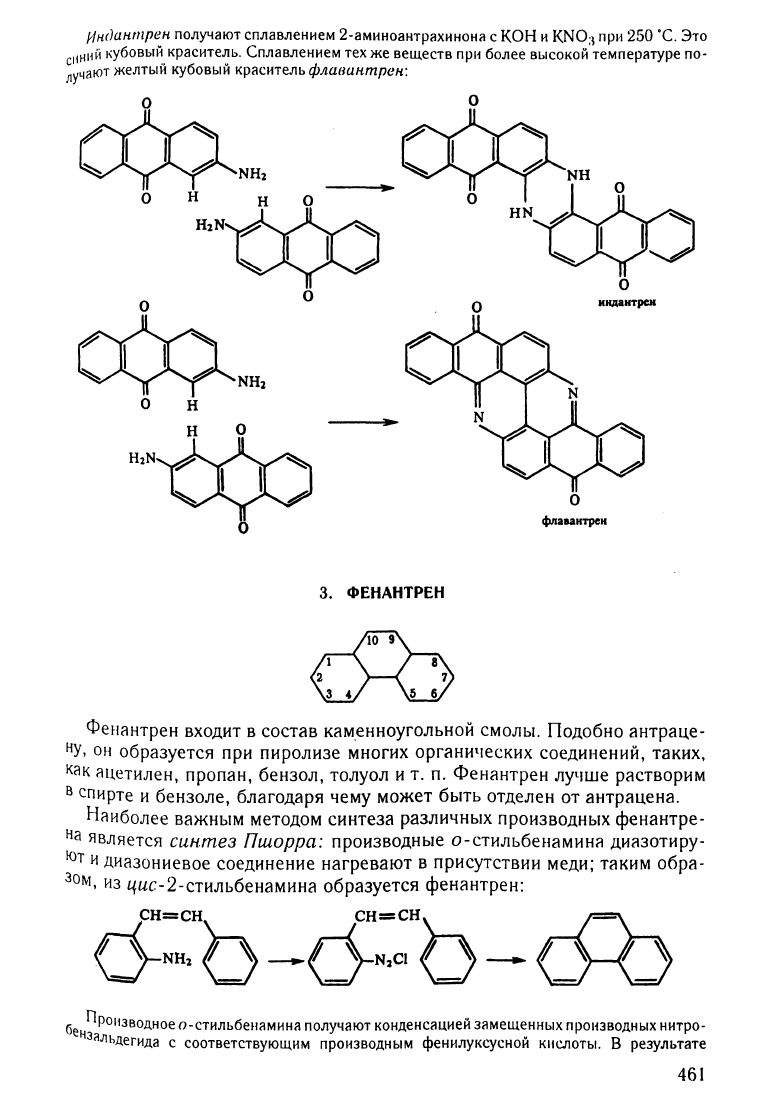
инrJuнmрен
получают
сплавленнем
2-амнноантрахннона
с
КОН
и
КNO:\
при
250
·с.
Это
i\НИЙ
кубовый
краситель.
Сплавлением
тех
же
веществ
при
более
выокойй
температуре
по
~учают
желтый
кубовый
краситель
фЛUCluнmрен:
о
~
~NHz
О
Н
Н
HzN
•
3.
ФЕНДНТРЕН
о
икдантрсн
о
фпаааитрен
Фенантрен
входит
в
состав
кам.енноугольноЙ
смолы.
Подобно
антраце
ну,
он
образуется
при
пиролизе
многих
органических
соединений,
таких,
как
ацетилен,
пропан,
бензол,
толуол
и
т.
п.
Фенантрен
лучше
растворим
В
спирте
и
бензоле,
благодаря
чему
может
быть
отделен
от
антрацена.
НаИболее
важным
методом
синтеза
различных
производных
фенантре
на
ЯВляется
сuнтез
Пшорра:
производные
о-стильбенамина
диазотиру
!от
И
диазониевое
соединение
нагревают
в
присутствии
меди;
таким
обра
Зом,
из
цuс-2-стильбенамина
образуется
фенантрен:
cS-NН~
) -(
~H':<
) - <
~
о
бе
ПРОllзводное
о-стильбеllзмина
получают
конденсацией
Зl1мещенных
производных
IIИТРО
НзаЛьдегида
с
соответствующим
производным
фенилуксусной
КlIСЛОТЫ.
В
результате
461
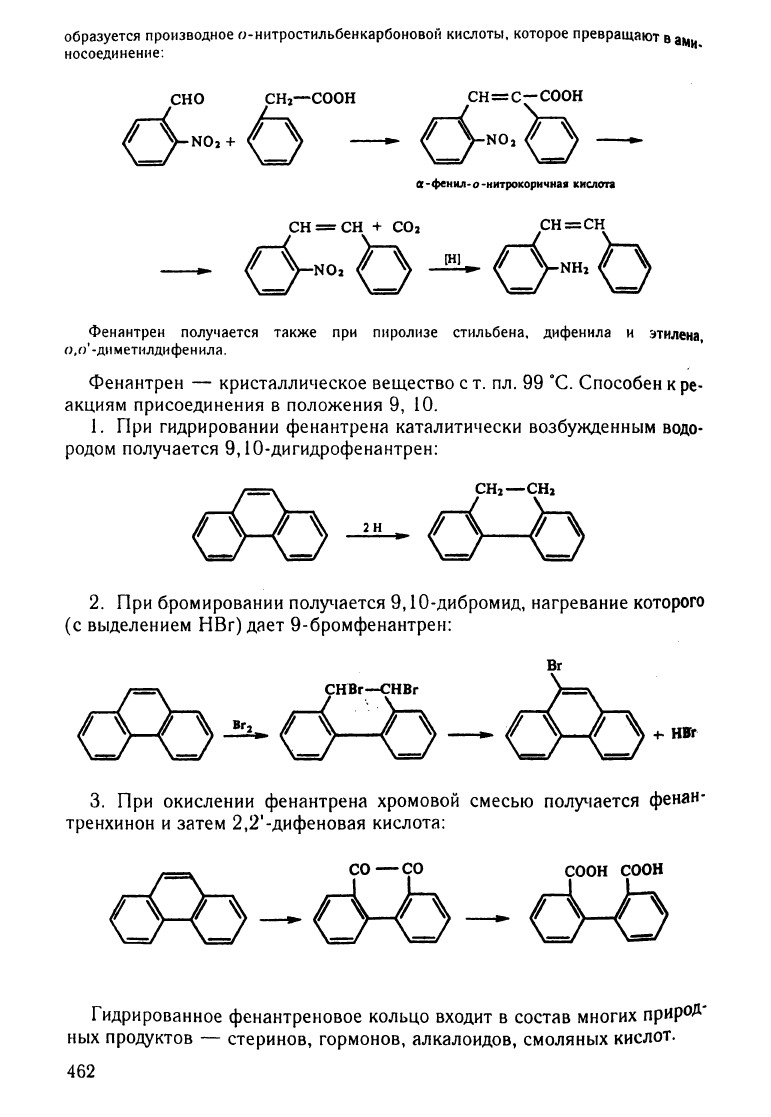
образуется
производное
()-нитростильбенкарбоновоli
кислоты,
которое
превраЩ8ЮТ
в
81111.
носоединение:
сн=с-соон
0--0·0
-
lI-фенил-о-нитрокориqна8
киcnora
сн==сн
+
СО2
сн=сн
О-но.
Ь
~
ONН.
Ь
-
,Фенантрен
ПОЛУ'lается
также
при
Пllролизе
стильбена,
дифеиила
и
этилена,
(),О
·Дllметилдифенила.
Фенянтрен
-
кристяллическое
вещество
с
т.
пл.
99
ос.
Способен
к
ре
акциям
присоединения
в
положения
9,
10.
1.
При
гидрировании
фенантрена
каталитически
возбужденным
водо
родом
получается
9,1
О-дигидрофенантрен:
2Н
•
2.
При
бромировании
получается
9,10-дибромид,
нагревание
которого
(с
выделением
НВг)
дает
9-бромфенантрен:
.--г'h.
снв.-сн.,
~
u---u
~
~
-
{)-U-'
+ивr
3.
При
окислении
фенантрена
хромовой
смесью
получается
фенан
тренхинон
и
затем
2,2'
-дифеновая
кислота:
со-со
0=<>-6
Ь
соон
СООИ
6Ь
-
Гидрированное
фенантреновое
кольцо
входит
в
состав
многих
прироД
ных
продуктов
-
стеринов,
гормонов,
алкалоидов,
смоляных
кислоТ.
462
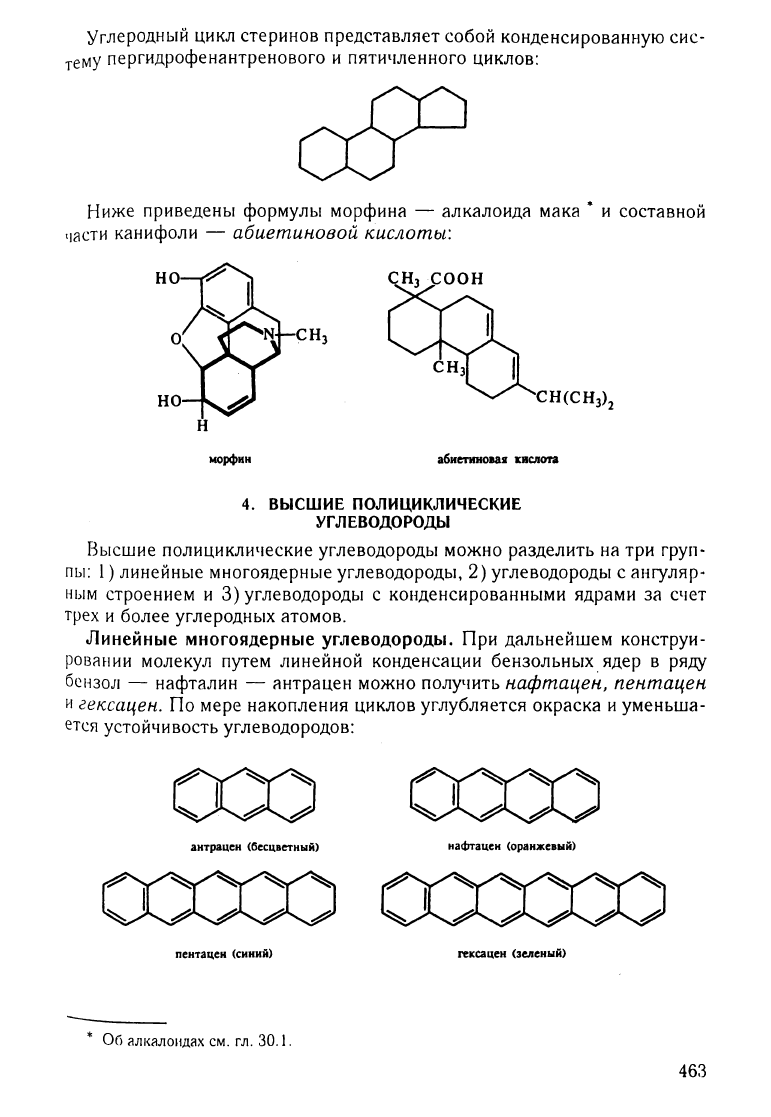
углеродный
цикл
стеринов
представляет
собой
конденсированную
сис
теМУ
пергидрофенантренового
и
пятичленного
циклов:
Ниже
приведены
формулы
морфина
-
алкалоида
мака·
и
составной
частИ
канифоли
-
абиетиновой
кислоты:
морфин
4.
ВЫСШИЕ
ПОЛИЦИКЛИЧЕСКИЕ
УГЛЕВОДОРОДЫ
Высшие
полициклические
углеводороды
можно
разделить
на
три
груп
пы:
1)
линейные
многоядерные
углеводороды,
2)
углеводороды
сангуляр·
liblM
строением
и
3)
углеводороды
с
конденсированными
ядрами
за
счет
трех
и
более
углеродных
атомов.
Линейные
многоядерные
углеводороды.
При
дальнейшем
конструи
РОВ<lНИИ
молекул
путем
линейной
конденсации
бензольных
ядер
в
ряду
беНЗОJl
-
нафталин
-
антрацен
можно
получить
нафтацен,
nентацен
и
гексацен.
По
мере
накопления
циклов
углубляется
окраска
и
уменьша
ется
устойчивость
углеводородов:
антрац.н
(бесцветн"й)
каФт"ц.н
(оранж
....
й)
п.нтац.н
(синий)
reксацен
(aenсн
..
Й)
•
Об
аЛI<аЛОllДах
СМ.
гл.
30.1.
463
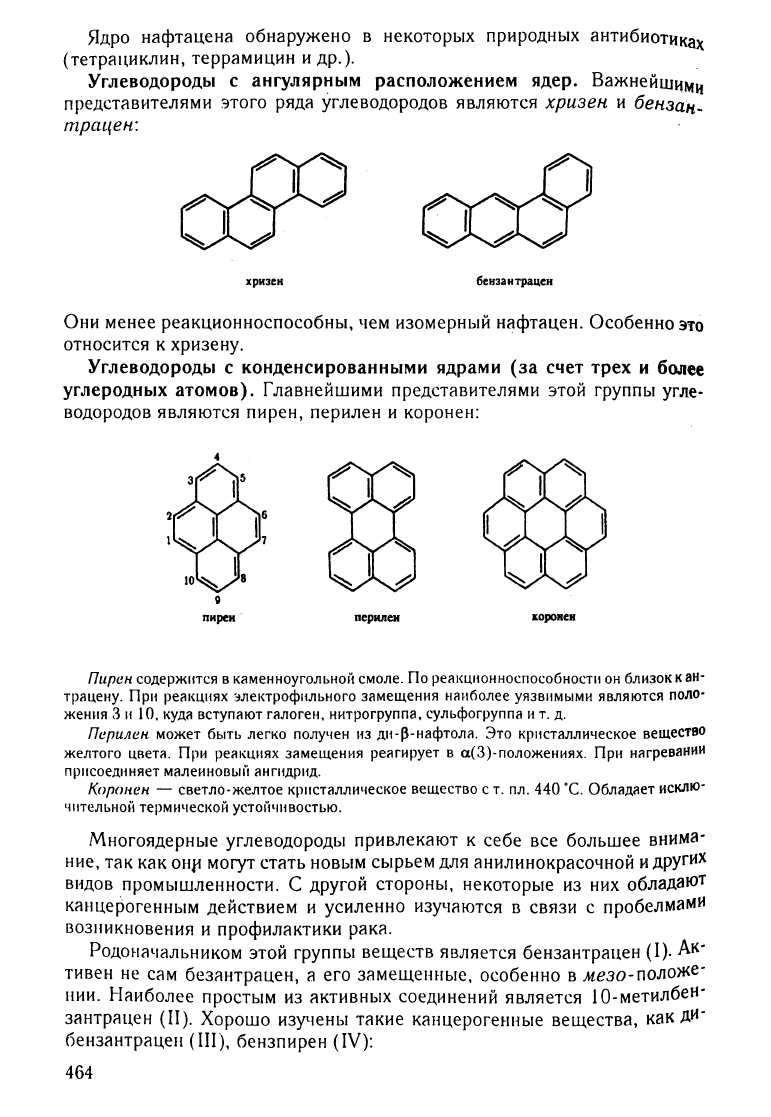
Ядро
нафтацена
обнаружено
в
некоторых
при
родных
аНТИБИОТИках
(тетрациклин,
террамицин
и
др.).
Углеводороды
с
ангулярным
расположением
ядер.
ВажнеЙWI1МИ
представителями
этого
ряда
углеводородов
являются
хрuзен
и
бензаlt_
mрацен:
хризсн
беИЗ8НТрацен
Они
менее
реакционноспособны,
чем
изомерный
нафтацен.
Особенно
это
относится
к
хризену.
Углеводороды
с
конденсированными
ядрами
(за
счет
трех
и
БOJlее
углеродных
атомов).
Главнейшими
представителями
этой
группы
угле
водородов
являются
пирен,
перилен
и
коронен:
о
пНреи
пеpиlJеи
Пuрен
содеРЖllТСЯ
в
каменноугольной
смоле.
По
реаlЩl1ОнноспосоБНОСТII
он
близок
к
ан
трацеltу.
ПРI'
реаlЩИЯХ
электрофltльного
замещения
наиболее
уязвимыми
являются
поло
жения
311
10.
куда
вступают
галогеlt,
иитрогруппа,
сульфогруппа
и
т.
д.
Перилен
может
бblТЬ
легко
полу'tен
из
дlt-р-нафтола.
Это
КРltсталлическое
вещество
желтого
цвета.
При
реаКЦIIЯХ
замещеltия
реагирует
в
а(3)-положеltиях.
ПРIt
нагревании
пр"соед"няет
малеиновыil
аНГIIДРИД.
К()р()нен
-
светло-желтое
кр"сталлическое
вещество
с
т.
пл.
440
·С.
Обладает
исКJIЮ
ЧllТельной
термической
устойчивостью.
Многоядерные
углеводороды
привлекают
к
себе
все
БОJIьшее
внима
ние,
так
как
OH(I
могут
стать
новым
сырьем
для
аНИJIинокрасочной
и
других
видов
промышленности.
С
другой
стороны,
некоторые
из
них
обладаюТ
канцерогенным
действием
и
усиленно
изучаются
в
связи
с
пробелмамИ
ВОЗlIикновения
и
профилактики
рака.
Родоначальником
этой
группы
веществ
является
бензантрацен
(1).
Ак'
тивен
не
сам
безантрацен,
а
его
замещенные.
особенно
в
.мезо-поло
же
•
нии.
Наиболее
простым
из
активных
соединений
является
1
Q-метилбен'
зантрацен
(11).
Хорошо
изучены
такие
канцерогенные
вещества,
как
ДИ'
бензантрацеll
(111).
бензпирен
(IV):
464
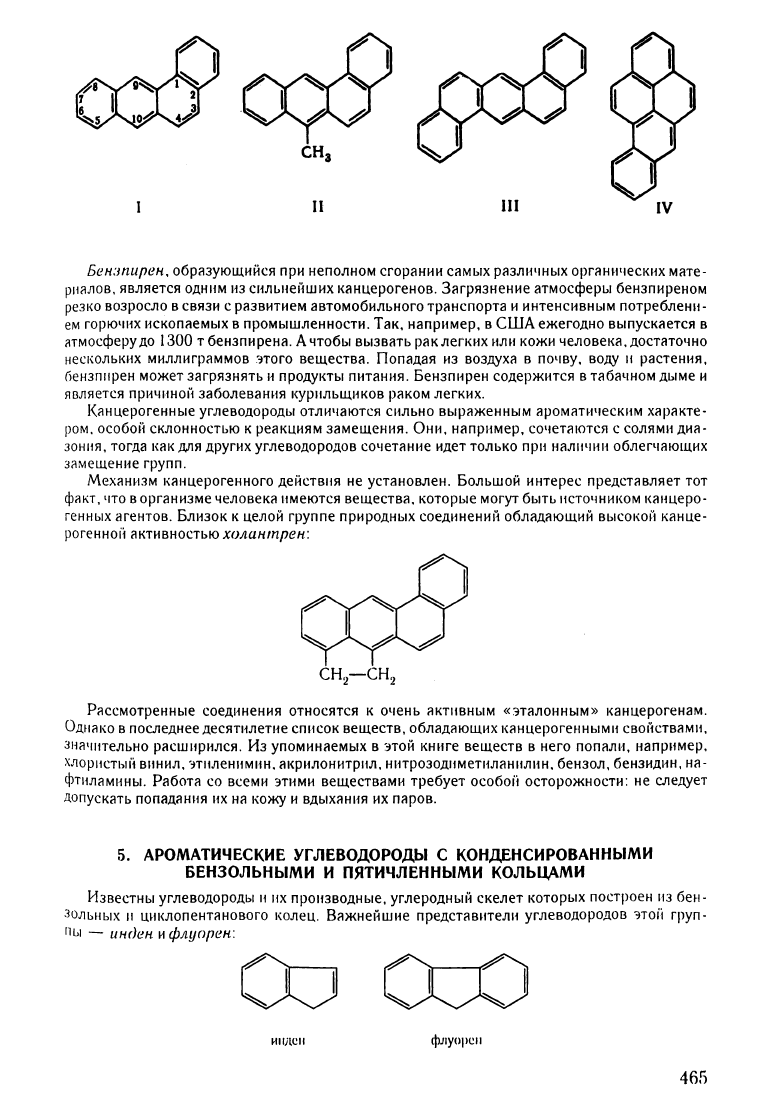
СНа
11
111
Бен:muрен.
образующийся
при
неполном
сгорании
самых
различных
оргаНllческих
мате
риалов.
является
ОДНIIМ
liЗ
СИЛЫlейших
канцерогенов.
Загрязнение
атмосферы
бензпиреном
реЗI<О
возросло
в
связи
с
развитием
автомобильного
транспорта
и
интенсивным
потреблеНII
ем
ГОРЮ'IIIХ
ископаемых
в
промышленностн.
Так.
например.
в
США
ежегодно
выпускается
в
атмосферу
до
1300
т
бензпирена.
А
чтобы
вызвать
рак
легких
ИЛII
кожи
человеl<а.
достаточно
нескольких
миллиграммов
этого
вещества.
Попадая
из
воздуха
в
почву.
воду
11
растения.
(\еНЗПllрен
может
загрязнять
и
продукты
ПliТания.
БеНЗПliрен
содержится
в
табачном
дыме
и
является
ПРИЧI·lноil
заболевания
I<УРIIЛЬЩИКОВ
раком
легких.
Канцерогенные
углеводороды
отличаются
СliЛЬНО
выраженным
аромаПI'lеСКIIМ
характе
ром.
особой
СКЛОННОСТl>ю
к
реакциям
замещения.
Они.
например.
СО'lетаются
с
солями
диа
ЗОНIIЯ.
тогда
l<aK
для
других
углеводородов
СО'lетание
идет
только
npll
наЛIIЧИИ
облегчающих
замешение
групп.
Механизм
I\аlщерогенного
деikТВllЯ
не
установлен.
Большой
интерес
представляет
тот
факт.
что
в
организме
человека
Ilмеются
вещества.
"оторые
могут
быТ!.,
IIСТОЧНИI<ОМ
I<alluepo-
генных
агентов.
Близок
к
целой
группе
при
родных
соединений
обладающий
высокой
канце
poreHHoii
активностью
х()ланmрен:
Рассмотренные
соединения
относятся
к
o'leHb
aKТlIBHbIM
«эталонным»
канцерогенам.
Однако
в
последнее
деСЯТliЛетие
СПlIСОК
веществ.
обладающих
l<aHueporeflHbIMII
своЙстваМII.
ЗllаЧllТельно
раСШIlРИЛСЯ.
Из
упоминаемых
в
этой
книге
веществ
в
него
попали.
например.
X.10p11CTblit
ВIIНИЛ.
3Т1lлеНIIМИН.
аl<РIIЛОНИТРIIЛ.
НИТРОЗОДllмеТllлаНIIЛИН.
бензол.
бензидин.
на
фТllламины.
Работа
со
всеми
этими
веществами
требует
особо"i
осторожности:
не
следует
допускать
попадаЮIЯ
IIХ
на
кожу
и
вдыхания
их
паров.
5.
АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ
С
КОНДЕНСИРОВАННЫМИ
БЕНЗОЛЬНЫМИ
И
ПЯТИЧЛЕННЫМИ
КОЛЬLlt\МИ
Известны
углеводороды
11
IIX
ПРОlIзводные.
углеродны
..
1
скелет
I<OTOPbIX
построен
из
бен
ЗОльных
11
Цlшлопентанового
I(олец.
Важне"1шие
представитеЛl1
углеводородов
,то
..
!
груп-
1l~1
-
инден
и
флу()рен:
ИIIДСII
ФIIYОРСII
465
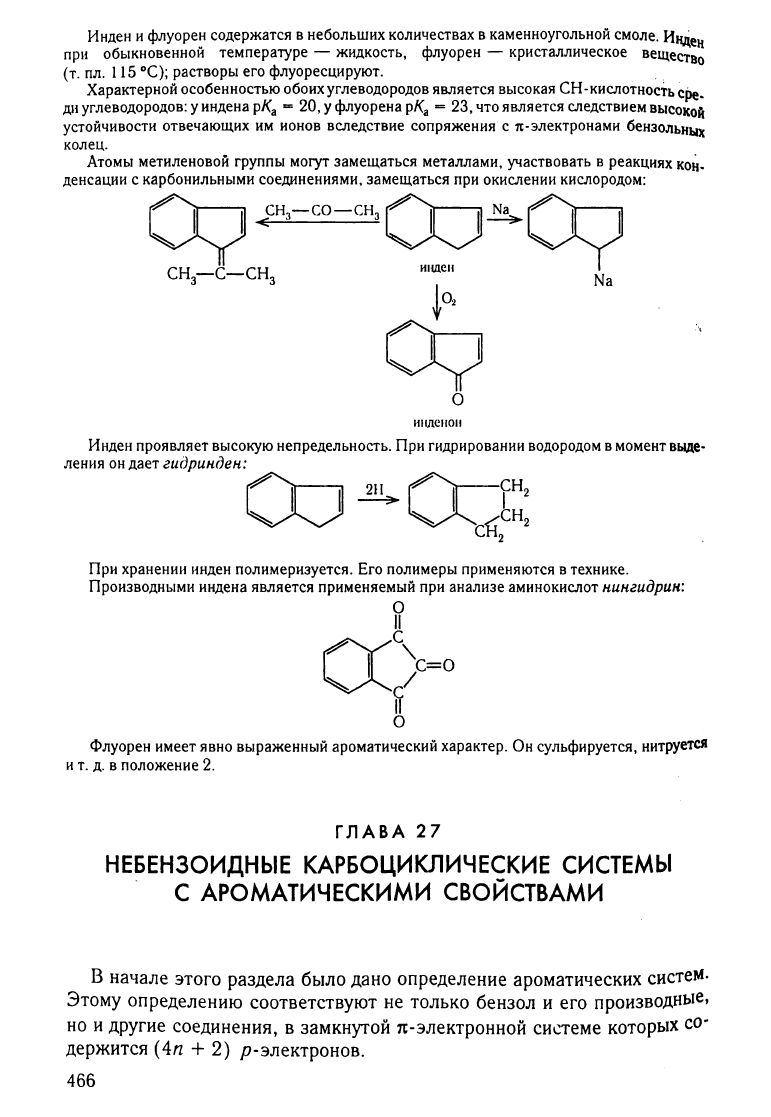
Инден
и
флуорен
содержатся
в
небольших
количествах
в
каменноугольной
смоле.
Ив.Цен
при
обыкновенной
температуре
-
жидкость,
флуорен
-
кристаллическое
вещество
(т.
пл.
115
·С);
растворы
его
флуоресцируют.
. .
Характерной
особенностью
обонхуглеводородов
является
высокая
СН-кислотность
сРе.
ДlI
углеводородов:
У
индена
рК.
= 20,
У
флуорена
рК.
= 23,
что
является
следствием
высокой
устойчивости
отвечающих
им
ионов
вследствие
сопряжения
с
п-электронами
бензольных
колец.
Атомы
метиленовой
группы
могут
замещаться
металлами,
участвовать
в
реакциях
кон.
денсации
с
карбонильными
соединениями,
замещаться
при
окислении
кислородом:
ау
,щ-со-щO:=J~('r-l
СН
-С-СН
ИIЩСII
~
3 3 I
Na
,О,
су
.\
О
IIIIДСIЮII
Инден
проявляет
высокую
непредельность.
При
гидрировании
водородом
в
момент
выде·
ления
он
дает
гuдрuнден:
~Д~CH2
~
~~<:,tH2
СН
2
При
хранении
IIнден
полимеризуется.
Его
полимеры
применяются
в
технике.
Производиыми
индена
является
при
меняемый
при
анализе
аминокислот нингидрин:
О
(Х
I
~'\c>=o
"
f(
о
Флуорен
имеет
явно
выраженный
ароматический
характер.
Он
сульфируется,
нитруeтCJI
и
т.
д.
В
положение
2.
ГЛАВА
27
НЕБЕНЗОИДНЫЕ
КАРБОЦИКЛИЧЕСКИЕ
СИСТЕМЫ
.
С
АРОМАТИЧЕСКИМИ
СВОЙСТВАМИ
в
начале
этого
раздела
было
дано
определение
ароматических
систеld.
Этому
определению
соответствуют
не
только бензол
и
его
производны
е
,
но
и
другие
соединения,
в
замкнутой
п-электронной
системе
которых
со'
держится
(4n + 2)
р-электронов.
466
1.
ЦИКЛОПРОПЕНИЛЬНЫЙ
КАТИОН
Наиболее
простой
ароматической
системой,
содержащей
всего
три
уг
леродных
атома
(при
n =
О),
является
циклопропенильный
катион.
Устойчивые
соли
циклопропенилия
были
синтезированы
в
1967
г.
(А.
Бреслоу).
Соли
трифенилциклопропенилия
получены
еще
в
1957
г.
по
схеме:
.
Известны
н
другне
пронзводные
ЦНКJ\опропенильноro
катиона.
Напрнмер,
д.
Н.
Курса
новым
и
М.
Е.
8ольпиным
получены
соли
днфенил6ромциклопропенилия
и
днфенилгидро
ксициклопропениJiия
по
схеме:
С
•.
Н.
.
Н
С
1)
..
5
6,
m
(CI-lВг
з
+
RONa~
C
II
,,../8r
С
(:СВг
2
)
c/~8Г
I /
С Н
Н5С6
6 5
2.
ЦИКЛОПЕНТдДИЕНИЛЬНЫЙ
АНИОН.
МЕТAJ1ЛОЦЕНЫ
Аро~атическими
системами
с
четырьмя
углеродными
атомами
в
цикле
являются
двухэарядные
ионы
C;H~n
(n
в
формуле
Хюккеля
равно
О)
и
С
~H~-
(n
=
1).
Соли
таких
ионов
известны.
Важнейшая
пятичленная
ароматическая
система
-
циклопентадие
нильный
анион
(n
=
1).
Карбоциклическое
пятичленное
кольцо,
включа
ющее
две
двойные
связи,
имеет
циклопентадиен
(1).
Он
ведет
себя
как
алкадиен,.
например,
при
дненовом
синтезе.
Однако
он
дает
калиевую
соль,
анион
которой
(1I)
обладает
устойчивостью
сопряженного
аромати
ческого
иона
III
(6е-):
OQ
или
11
111
Все
пять
атомов
кольца
имеют
по
одному
электрону.
Шестой
электрон
равномерно
распределен
между
пятью
незаполненными
р-орбиталями
467

(на
каждой
из
них
может
быть
по
два
электрона),
т. е.
каждая
из
пяти
Ор
биталей
с
равным
правом
может
обладать
этим
электроном.
ЦиклопентадиеНИJIЬНЫЙ
анион
легко
взаимодействует
с
электрофиль_
ными
реагентами,
легко
сульфируется
комплексом
пиридина
с
SОз,
мер
курируется
при
действии
сулемы
в
метиловом
спирте,
вступает
в
реакцию
нзосочетания
с
диазотированным
n-
нитроанилидом.
При
действии
на
циклопентадиен
солей
хлорноватистой
и
бромновати
стой
кислот
в
очень
мягких
условиях
все
атомы
водорода
замещаются
га
Jlогеном,
по-видимому,
с
промежуточным
образованием
циклопен
тадиенил-аниона.
Интересные
соединения
дает
ЦИКJlопентадиенильный
анион
с
катиона
ми
двухваJlентных
металлов
группы
железа
(жеJlезо,
кобальт,
никель),
а
та"..
с
Mac:H~apГВHЦ'M'
хромом:
~
м,В,
+
,.о,
~
I!s;
+
2MgBrCI
ФСРР(ЩСII
Эти
вещества
(ферроцен,
коабльтоцен,
никелецен)
ГJlубоко
окрашены,
очень
устойчивы,
перегоняются
без
разложения
и
оБJlадают
ароматичес
ким
характером,
т.
е.
имеют
явно
ковалентные
связи.
Рентгеноструктурный
анализ
показаJl,
что
оба
циклопентадиенильных
цикла
в
ферроцене
расположены
друг
над
другом,
как
два
куска
хлеба
в
сандвиче,
и
заключают
между
собой
атом
двухвалентного
железа,
как
начинку,
-
«сандвичевая
структура».
Таким
образом,
атом
железа
связан
со
всеми
10
атомами
углерода.
Ферроцен
-
оранжевое
кристаллическое
вещество,
т.
пл.
172-
173
ос.
Растворим
в
обычных
органических
растворителях
и
нерастворим
в
воде.
Он
обладает
ароматическим
характером,
не
вступает
в
реакции,
характерные
д.ля
циклопентадиена, устойчив
к
нагреванию
(до
470
ос
в
парах),
каталитическому
восстановлению
(на
платине),
не
разрушается
разбавленными
щелочами
или
кислотами
даже
при
кипячении,
вступает
в
реакции
эл~ктрофильного
замещения.
ГалогеНllровltть
IIЛlt
Нlпровftть
ферроцен
нельзя.
так
Kftl<
при
этом
он
ОКl1сляется
в
ферро
ценневый
"он
(C;;Ii5)~Fe
+.
АЦI1Лl1ровftНl1е
же
I1дет
обычным
путем
по
методУ
фриде
ЛЯ-Крltфтсlt.
Ферроцен
легко
сульфируется
смесью
серной
I<liСЛОТЫ
11
YI<CYCHOrO
ItНГИДРllда.
При
этом
БЫЛII
получеliЫ
кяк
моно-.
так
11
дисульфоферроцены.
МеРI\УРllрование
ферроценft
в
отли'ше
от
бензола
осуществляется
ацетатом
ртути
при
I'ОМНЯТНОI1
температуре.
Через
ртутные
прОllзводные
ферроценft
синтеЗllровftны
некоторые
дрУГllе
зftмещенные
ферроцены.
в
чftСТНОСТl1
гftлогенопроизводные.
которые
не
удается
полу
чить
прямым
гltлогенированием
(А.
Н.
Несмеянов).
468

Ферроцен,
подобно
apoMaTII'leCKIIM
углеводородам,
конденсируется
с
MypaBЫIHbIM
11
бен
зоftным
альдегиДIIМИ.
Он
реагирует
сдиазосоеДl1неНИЯМII
с
выделеНltем
азотаlt
арилироваНlt
еМ
ядра:
Соединения,
содержащие
альдегидную,
кетонную,
карбоксильную,
сульфо-
и
аминогруппы, связанные
с
ферроценовым
кольцом,
как
прави
ло,
проявляют
главнейшие
свойства
соответствующих
соединений
арома
тического
ряда.
Введение
заместителей
в
ферроценовое
ядро,
как
и в
бензоле,
оказы
вает
сильное
влияние
на
способность
к
последующему
замещению.
Предложено
применять
ферроцен
в
качестве
присадки
к
минеральным
маслам,
в
качестве
антидетонатора
и
термически
стойкого
теплоносителя,
а
также
для
осуществления
бездымного
сгорания
масел.
Растворимая
в
воде
натриевая
соль
продукта
аЦltЛl1рования
ферроцеНII
фталевым
ангид
PIIДOM
-
ферр()церон
-
может
быть
использована
при
лечении
раЗЛИ'IНЫХ
форм
анемии.
3.
ЦИКЛОГЕnТДТРИЕНИЛЬНЫЙ
КАТИОН.
СОЛИ
ТРОПИЛИЯ.
ТРОПОЛОНЫ_
ДЗУЛЕНЫ
ШестиtlЛенной
ароматической
системой
(при
n =
1)
является
уже
рас
смотренный
ранее
беIlЗОЛ.
Семичленной
ароматической
системой
(при
11
=
1)
является
циклогептатриенильный
катион
-
троnuлuЙ.
Карбоциклическое
семичленное
I<ОЛЬЦО,
включающее
три
двойные
свя
зи,
имеет
1.3.5-lIuклогеnтатрuен.
Это
типичное
непредельное
соедине
ние,
лишенное
ароматического
характера.
Если
в
случае
циклопентадиена
для
образованин
яроматической
струк
туры
необходимо
было
отнять
протон,
то
для
превращения
циклогептат
риена
в
устойчивую
ароматическую
систему
-
троnuлuевый
кати
ОН
-
необходимо
отнять
гидридный
анион
(водород
с
парой
электронов):
~=CH
HC-~
нс
"сн
н(
r=\
сн
11
11
~
1
\.J
I +
н-
нс,
..........
сн
нс.....::::
__
сн
СН
2
сн
I
Тропилиевый
катион
(1)
-
плоская
система,
в
которой
между
семью
Углеродными
атомами
равномерно
распределены
6
электронов.
Седьмой
атом
предоставляет
для
этих
электронов
как
бы
«пустую»
р-орбиталь
(не
заштрихована
):
469
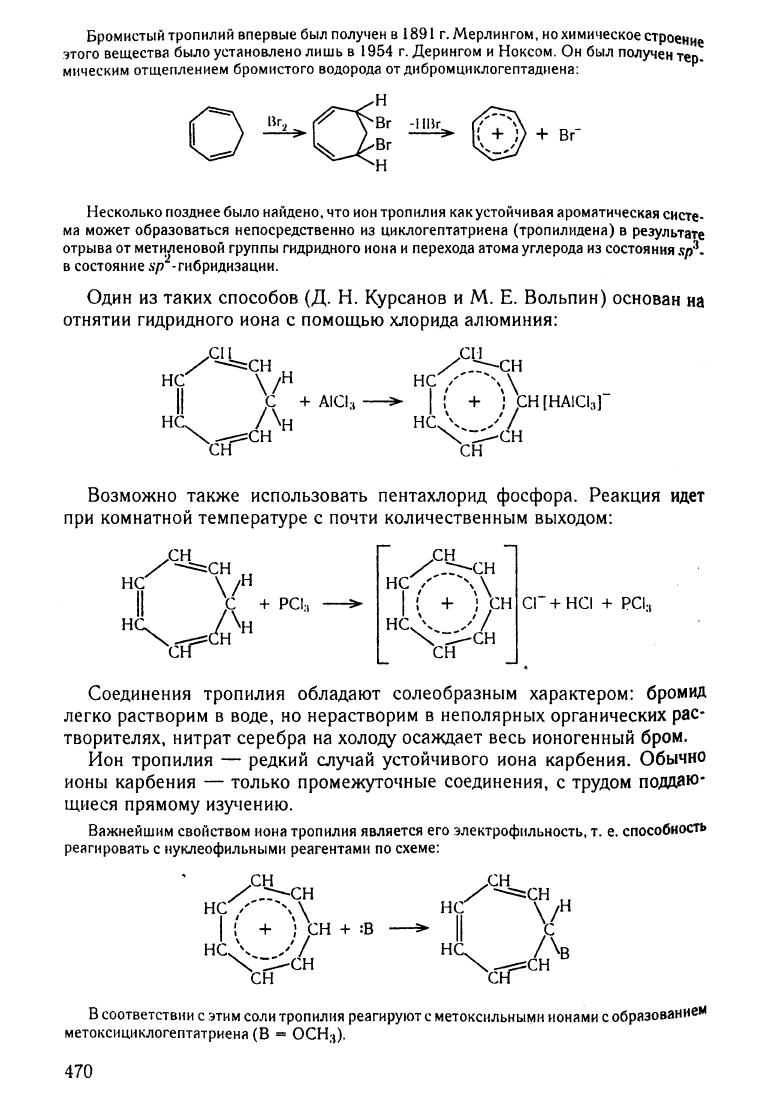
Бромистый
тропилий
впервые
был
ПОЛУ'lен
в
1891
г.
Мерлингом.
но
химическое
СТРоеНИе
этого
вещества
было
установлено
лишь
в
1954
г.
Дерингом
и
Ноксом.
Он
был
получен
тер_
мическим
отщеплением
бромистого
водорода
от
ДlfБРОМЦIfКJ10гептадиена:
н
O
~
~aBГ~
.--;;
~
Вг
Н
Несколько
позднее
было
найдено.
что
ион
ТРОПI1ЛIfЯ
как
устойчивая
аромаТИ'lеская
систе
ма
может
образоваться
непосредственно
из
ЦИКJ10гептатриена
(ТРОПИЛl1дена)
в
реЗУльтате
отрыва
от
меТl!леновой
группы
гидридного
иона
и
перехода
атома
углерода
из
состояния
sp3_
в
состояние
sp2
-Гlfбридизации.
Один
из
таких
способов
(Д.
Н.
Курсанов
и
М.
Е.
Вольпин)
основан
НII
отнятии
гидридного
иона
с
помощью
хлорида
алюминия:
/~CH
/C~CH
нс
\
/н
нс
'-----', \
11
/С
+
AICI:!
-----+
1.
( + )
сн
[НАIСlзГ
нс,
\н
нс,',_
,-/
,~CH
,
:;-сн
сН-
СН
Возможно
также
использовать
пентахлорид
фосфора.
Реакция
идет
при
комнатной
температуре
с
почти
количественным
выходом:
сн
/
-=:::::сн
нс
\/н
11
~C
+
PCI:!
-----+
нс.
\н
.........
~H
Сн
[
СН
J
/,_::-сн
нс,-
"
1 ( +
)\н
СГ+НСI
+
PCI:!
HC~-:'::!н
сн
Соединения
тропилия
обладают
солеобразным
характером:
бромид
легко
растворим
в
воде,
но
нерастворим
в
неполярных
органических
рас'
творителях,
нитрат
серебра
на
холоду
осаждает
весь
ионогенный
бром.
Ион
тропилия
-
редкий
случай
устойчивого
иона
карбения.
ОбычнО
ионы
карбения
-
только
промежуточные
соединения,
с
трудом
поддаю'
щиеся
прямому
изучению.
ВажнеЙШIfМ
свойством
иоиа
тропилия
является
его
элеКТРОфltЛЬИОСТЬ.
т. е.
спосоБНОСТЬ
реаГlfровать
с
нукnеофильными
реагентами
по
схеме:
сн
/
-=:::::СН
НС
\/н
11
С
нс,
/\В
,~CH
Сн
В
соответствии
с
этим соли
тропилия
реагируют
с
меТОКСИЛЬНЫмli
нонами
с
образование
..
меТОКСIIЦliклогептатрнена
(В
=
ОСН
а
).
470
