Горбачев В.В. Концепция современного естествознания
Подождите немного. Документ загружается.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
181
К особым видам химических соединений относятся также и макромолекулы. Они
могут состоять из большого числа атомов, до нескольких тысяч, и обладают в отличие от
обычной молекулы качественно новыми свойствами, как это имеет место в соотношении
целого и его частей. Органическими молекулами являются те, которые содержат углерод,
образованные из него веще-
304
ства также относят к органическим. Их насчитывается более 1700 тысяч. Одним из
химических процессов органической химии является полимеризация — синтез
макромолекул полимеров. Для образования каждой новой химической связи, а следова-
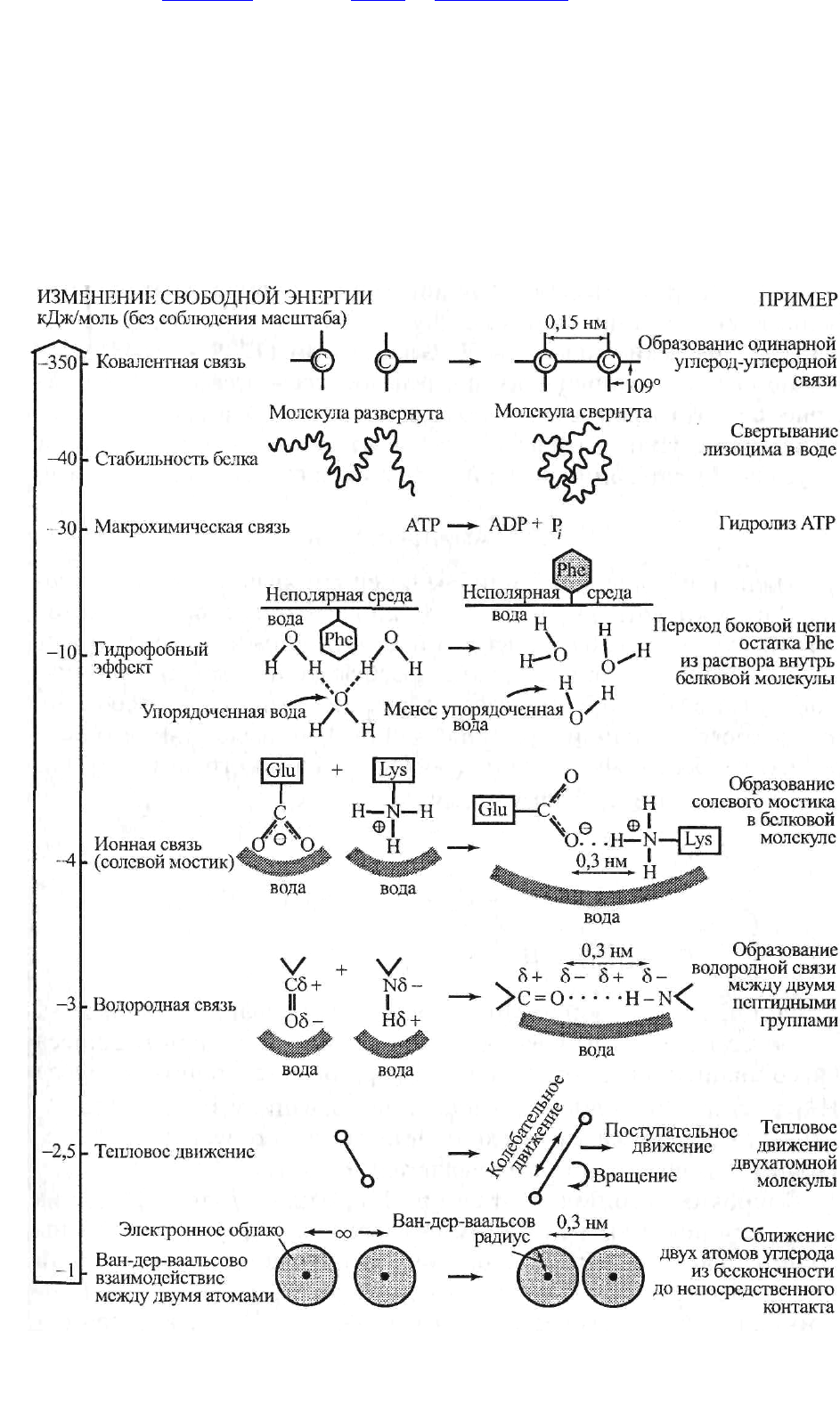
Рис. 12.1. Схема изменения свободной энергии и химической связи в
молекулах живых организмов.
305
тельно, и полимера, требуется энергия (8—12 Дж/моль), так как все биологические

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
182
полимеры находятся в водной среде, где весьма вероятен их гидролиз.
Полимеры не имеют кристаллической структуры и состоят из большого числа
повторяющихся звеньев — органических макромолекул. Каталитические реакции и
процессы играют особую роль в образовании макромолекул. Термин «полимер» введен в
1833 г. шведским химиком Й. Берцелиусом (1779 — 1848). Наряду с полимеризацией
могут идти и процессы деструкции — разрушение полимеров, распад их до мономеров.
Оба процесса происходят как самопроизвольно, так и направленно в зависимости от
условий протекания реакции и возможного воздействия на нее.
12.2.2. Аминокислоты
Важнейшим для биохимии соединением является аминокислота. Аминокислоты —
это такие органические соединения, которые служат основным элементом построения
растительных и животных белков и поэтому играют особую роль в жизни организмов,
участвуя в обмене азотсодержащих веществ. Свободные аминокислоты, например,
моноаминокарбоновые (глицин), содержат карбоксильную группу (—COOH) и
аминогруппу (—NH
2
), присоединенные к одному атому углерода С:
Они обладают свойствами и кислот, и оснований. Напомним, что кислоты —
химические соединения, характеризующиеся диссоциацией в водном растворе с
образованием ионов водорода Н
+
, а основания — диссоциацией с образованием иона ОН
-
.
Замена атома водорода в кислоте металлами образует соли, а растворимые в воде
основания являются щелочами.
Природных аминокислот свыше 170, однако только 20 из них служат мономерными
звеньями цепей, из которых построены полимерные молекулы всех белков.
Образующиеся при удалении атома водорода от аминокислоты, аминокислотные остатки
соединяются с ней пептидной связью ( —СО—NH— ), которая соединяет аминогруппу
одной кислоты (или остатка) с карбоксильной группой другой. Полипептидная цепь
образуется в ре-
306
зультате повторения актов пептидной связи. На одном конце этой цепочки (N-конце)
свободная NH
2
группа, на другом (С-конце) — COOH карбоксильная группа.
Поэтому аминокислотные остатки являются полимерами полипептидов. Если
заменить хотя бы один атом или одну аминокислоту в полипептиде, то возникает новая
молекула с другими свойствами и структурой. Каждый остаток имеет постоянную часть и
вариабельные концевые или боковые части, через которые осуществляется пептидная
связь таким образом, что формируется непрерывная основная цепь белковой молекулы.
Каждая аминокислота имеет свое значение — отрицательный логарифм концентрации
Н
+
, характеризующий кислотность рН, при котором аминокислота электрически
нейтральна. При увеличении рН водного раствора аминокислоты выступают как доноры
положительных ионов водорода Н
+
, а при уменьшении — как их акцепторы. Химические
связи в цепях полипептида могут иметь разный характер. Между положительно и
отрицательно заряженными боковыми группами аминокислот или их остатками
возникает ионная связь, могут образоваться также водородные и ковалентные связи, что
и определяет многофункциональность и значение аминокислот при построении белков
живого организма. Аминокислоты входят также в состав других макромолекул —
нуклеиновых кислот.
12.2.3. Теория химической эволюции в биогенезе
Проблема самоорганизации сложных макромолекулярных структур имеет общие
корни с проблемой самосборки белков живых организмов: за очень короткое время
полимерная цепочка из определенных аминокислотных звеньев точно складывается в
определенную молекулярную конструкцию, формируя именно данный конкретный
белок. Таким образом, процессы химической самоорганизации органических молекул
играют важнейшую роль в предбиологической эволюции живых организмов. В
настоящее время в химических науках сформировалось новое направление —
эволюционная химия — наука о самоорганизации и саморазвитии химических систем, в

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
183
основе которой лежат представления о решающей роли катализа при переходе от
химических систем к биологическим.
В 1964 г. А.П. Руденко была предложена теория химической эволюции и биогенеза,
где было показано, что эволюционирую-
307
щими элементами в развитии предбиологических химических систем являются те
структуры и органические соединения, которые усиливали активность и селективность
действия катализаторов. Таким образом, и на этой стадии эволюции природы происходил
отбор наиболее «нужных» ей веществ для создания живых организмов.
Самопроизвольная автокаталитическая реакция в природе «служит» делу эволюции,
является как бы «орудием» отбора наиболее прогрессивных эволюционных изменений
катализаторов. В этом смысле биокатализ с участием ферментов связан с проблемами
биогенеза и происхождения жизни.
В биологии роль таких катализаторов выполняют специфические белковые протеины
— ферменты. Эти макромолекулы ферментов обладают такой пространственной
конфигурацией, которая дает возможность изменить скорость реакции. Молекулы
веществ, участвующих в реакциях, стремятся присоединиться к активным участкам
молекул фермента, повышая вероятность их столкновения и, следовательно, начала
химической реакции. Самоуправлением в химических процессах как раз и занимается
автокаталитическая реакция: продукт этой реакции начинает управлять ее скоростью и
даже самой возможностью протекания.
12.2.4. Теория молекулярной самоорганизации М. Эйгена
Другой моделью добиологической фазы образования макромолекул и их эволюции
является теория молекулярной самоорганизации М. Эйгена (р. 1927), которая позволяет
применить физические представления теории информации, кибернетики и
термодинамики к эволюции живых организмов. В этой модели организм рассматривают
как открытую термодинамическую систему, которая обменивается веществом, энергией и
информацией с окружающей средой. Эти условия наряду с обеспечением за счет такого
обмена стационарного неравновесного состояния системы являются причиной процесса
ее самоорганизации. Живая открытая система пытается получить от окружающей среды
именно свободную энергию и отдать ей «омертвленную» для него связанную энергию —
энтропию, которую нельзя превратить в работу для процессов, происходящих в живом
организме.
Обмен веществом (в биологии это называется метаболизмом) и информация связаны
между собой. Метаболизм можно также рассматривать как совокупность всех
химических реакций в живой клетке, приводящих к необходимому для нее обмену
веществ. Молекулы-мономеры, переходя из внешней среды в орга-
308
низм, несут информацию, которая внутри организма перерабатывается и закрепляется
при процессах полимеризации и деструкции, т.е. первоначальная информация об
окружающем мире для живого организма закодирована химическим путем. Например,
«память» макромолекул — это фиксированная последовательность химических связей.
Полимеризация идет путем самоинструктируемой репродукции (воспроизведения)
образованных макромолекул. Если скорость репродукции больше скорости распада
биополимеров, то макромолекулы растут, в противном случае — распадаются.
При этом необходимо учитывать потоки поступающих мономеров от внешней среды в
организм и самовоспроизведение в нем макромолекул. Такие процессы описывают
нелинейными кинетическими уравнениями переноса и взаимодействия молекул.
Внешние ограничения и потоки создают в системе отбор, что позволяет рассматривать
селекционную ценность информации для физики эволюции живого. По Волькенштейну,
«вымирают» те макромолекулы, которые не обладают максимальной селекционной
ценностью.
Физическое понимание количественного представления принципа естественного
отбора Дарвина и будет определяться ценностью информации, которую И.И.
Шмальгаузен [153] сравнивал со степенью ее незаменимости для живого организма.
Заметим, что естественный отбор имеет место и в неживой природе. Более сложные
органические молекулы являются более стойкими к излучению, чем простые, поэтому в
природе происходило накопление молекул более сложных конфигураций.
Такой подход вносит физический смысл в дарвиновское определение «наиболее

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
184
приспособленный». Информация в теории Эйгена оценивается по способности
макромолекул к саморепродукции. В теории молекулярной самоорганизации Эйгена
сделана попытка установить взаимосвязь этой «ценной для выживания» информации с
физическими свойствами системы — параметрами действующих статистических сил и
динамическим воздействием молекул. Таким образом, предшественниками живых систем
могут быть не любые макромолекулы, а лишь те, которые обладают необходимыми
информационными свойствами, и тем самым дарвиновская эволюция в форме селекции и
отбора реализуется уже на добиологической стадии развития.
Для самоорганизации перехода от макромолекулы неживой природы к
биомакромолекулам живой необходимы еще два ус-
309
ловия: самовоспроизведение нужных организму молекул и способность генов —
элементов, отвечающих за наследственность, — к рекомбинации или образованию при
случайных изменениях новых признаков, т.е. к созданию новой информации. Под
самоорганизацией в этой теории понимается не только накопление информации при
оттоке энтропии при упорядочении организма, но и построение в условиях теплового
хаотического движения молекул некоторой структурной копии этой информации, как бы
передачи ей плана строения и функционирования исходной структуры в создаваемых
макромолекулярных комбинациях.
Однако тепловые флуктуации не дают возможности точного воспроизведения
информации, что приводит к возникновению ошибок или, как их обозначают в биологии,
мутаций. Согласно Г. Кастлеру, запоминание случайного выбора — это возникновение
новой информации для развития организма. Матричное копирование
1
биополимера с
позиции химии означает автокаталитический процесс, приводящий к убыстряющемуся
самовоспроизведению. Поэтому химическая система, способная к эволюции, должна
быть автокаталитической, т.е. способной к самовоспроизведению.
Накопленная генетическая информация в молекулах нуклеиновых кислот передается
через синтез. Взаимодействие нуклеиновых кислот и белков в живой клетке приводит к
образованию макроскопических функциональных структур, способных к
самовоспроизведению, отбору и эволюции. Важную роль играет цикличность процессов
образования белков.
12.2.5. Циклическая организация химических реакций и гиперциклы
Химические реакции самоорганизуются таким образом, что циклическая организация
химических реакций одного уровня становится элементом цикла другого, более высокого
уровня. По Эйгену, возникают гиперциклы, определяющие репродукцию последующих
белков, и осуществляют роль самовоспроизводящейся системы реакций. Реальный
гиперцикл, построенный из нуклеиновых кислот и синтезируемых ими с помощью
ферментов белков, обеспечивает отбор макромолекул с объемом информа-
1
В п. 13.4.2 подробно рассмотрено, как матричное копирование осуществляется
молекулами нуклеиновых кислот ДНК и РНК.
310
ции и ее ценностью, достаточными для возникновения живого организма.
Необходимой информации можно добиться, если максимально разнообразить
множество этих реакций, увеличить их скорости и диапазон действий. Это дает
организму те представления, на основе которых он действует. Цикл, повторяясь
многократно в процессе эволюции, приводит как бы к надстраиванию управляющей
системы и ведет к образованию новых, уже более совершенных механизмов управления.
Развитие обеспечивает каждому поколению организмов все большую свободу по
отношению к окружающей среде, увеличивает дальнейшее разнообразие их реакций. В
этом смысл гиперцикла, который, возможно, отражает имеющуюся в целом цикличность
явлений и процессов на Земле и в Космосе. Одновременно происходит усложнение
структур, повышение уровня их организации и уменьшение энтропии внутренних
состояний. В физическом понимании гиперцикл может быть представлен периодической
во времени волновой структурой, возникновением предельного цикла — аттрактора.
Когерентное взаимодействие объектов обеспечивает условия для возникновения и
существования открытой устойчивой неравновесной макроскопической системы живого
организма, который может быть проанализирован в представлениях синергетики.
Когерентность процессов в самоорганизующихся системах через малые, но правильно
пространственно организованные управляющие параметры (сигналы возникшей

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
185
информации) приводит к селекции необходимой для организма «инструктирующей»
информации.
Система самоорганизуется так, что на создание и переработку этой информации
уходит большая часть поступающей извне энергии, в результате чего из
информационного шума выделяется полезная часть информации. Переход от одного
уровня организации к другому идет через хаотические состояния при конкуренции с
другими структурами. Хаотичность возможных состояний означает, что
самоорганизующаяся система, прежде чем выбрать какое-то определенное состояние,
должна находиться в целом наборе других. Это означает, что живой организм участвует в
отборе и передаче необходимой ему для развития информации и в целом в управлении
своей жизнедеятельностью. В ходе эволюции появление новой информации определяется
запоминанием мутаций и генетических рекомбинаций при изменении
311
вида и закреплением этой информации в генах. Генная информация передается из
поколения в поколение только после ее преобразования в биогеоценозе, частью которого
является популяция особей. В этом смысл самовоспроизводства и саморегуляции живых
саморазвивающихся систем.
Можно предположить, что появление гиперцикла связано с переходом от молекул
неживой природы к биомакромолекулам живой, с преодолением барьера между живым и
неживым. Модель Эйгена молекулярной самоорганизации материи хорошо согласуется с
представлениями нелинейной динамики и термодинамики неравновесных процессов
Пригожина для открытых систем и с уменьшением энтропии при самоорганизации.
Гиперцикл проявляет себя как открытая система с нелинейной динамикой роста
процессов. Физическая модель Эйгена самоорганизации молекул дает количественную
основу для возможного объяснения естественно-научным путем возникновения живого,
но не может объяснить реальный исторический путь эволюции, поскольку процессы
перехода от простых молекул к «молекулам жизни» имеют стохастическую природу при
большом разнообразии выбора.
Основу любой самоорганизации физической, химической или биологической системы
изначально характеризуют случайность, флуктуация или мутация. Понимание основных
принципов эволюции как самоорганизации на молекулярном еще уровне не требует пока
привлечения новых физических законов. Единые законы управляют физическими
процессами в живой и неживой природе на основе общих закономерностей,
характеризующих строение и природу материи, вещества и поля. Отличие состоит лишь в
конкретных механизмах проявления этих законов.
Имеющиеся в теории гиперциклов представления о метаболизме,
самовоспроизведении, мутабельности и селекционной ценности информации позволяют
связать дарвиновский эволюционный принцип, теорию информации, нелинейную
динамику и термодинамику неравновесных процессов в рамках биологии и новой
синтетической теории эволюции. Можно предположить, что селекционные и
эволюционные свойства нуклеиново-белковых гиперциклов более предпочтительны по
сравнению с другими механизмами, объясняющими возникновение живой природы из
неживой.
312
12.3. Биохимические составляющие живого вещества
Tак, как истина вечно уходит из рук — Не пытайся понять непонятное, друг.
Чашу в руки бери, оставайся невеждой, Нету смысла, поверь, в изучении наук.
Омар Хайям
12.3.1. Молекулы живой природы
Известно, что нет никаких различий в строении молекул элементов, образующих
живую и неживую природу. Однако из известных к настоящему времени 111 химических
элементов, встречающихся на Земле, в живых организмах встречается не так много —
всего 16, причем четыре из них — водород, углерод, кислород и азот — составляют 99%
массы живого вещества. Это связано с их физическими и химическими свойствами:
валентностью и способностью образовывать прочные ковалентные связи между атомами.
В живом организме происходят всевозможнейшие превращения разнообразных крупных
молекул и их соединений, главным элементом которых является углерод. В основе
клеточной химии лежат углеродные соединения, в которых атомы углерода связываются

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
186
между собой наиболее прочной из всех химических связей — ковалентной,
обеспечивающей стабильность химического соединения (а значит, и стабильность живого
организма).
Атомы углерода могут образовывать разветвленные длинные цепочки не только друг с
другом, но и с атомами кислорода. Учитывая антропный принцип, можно не по
распространенности, а по значению углерода для жизни) даже сказать, что мы живем в
углеродной Вселенной. Поскольку ранее предполагалось, что молекулы углерода
присущи только живому, соединения с углеродом получили название органических.
Развитие химии и особенно работы русского химика Бутлерова по структурной химии
привели к созданию органической химии, которая занимается изучением углерода и
синтезом его соединений.
Напомним, что ядро углерода, по его положению в таблице Менделеева, содержит 6
протонов и 6 нейтронов, вокруг ядра вращается 6 электронов, масса атома равна 12. При
различных химических реакциях углерод присоединяет 4 электрона и образует
устойчивую оболочку из 8 электронов, т.е. обладает валент-
ностью, равной 4. В настоящее время соединений углерода известно гораздо больше,
чем соединений всех остальных элементов Периодической таблицы Менделеева.
Большая их часть не встречается в живых организмах.
Любопытно, что в неживой природе по распространению элементов на Земле углерод
занимает лишь 16-е место. В атмосфере Земли углерод составляет менее 0,01 массового
процента, в гидросфере — около 0,002, в литосфере — около 0,1, причем в литосфере
углерод распространен в 276 раз меньше, чем кремний. Вероятно, определяющим
фактором того, что углерод стал главным строительным материалом живых организмов,
является его функциональность в высокоорганизованных структурах. Кроме прочных
ковалентных связей углерод образует с другими атомами и многоэлектронные связи, в
том числе и гибкие лабильные связи, с различными энергиями их образования и
способностью возникновения новых разнообразных связей, образуя длинные линейные и
разветвленные цепи с очень большим их разнообразием. Атомы углерода могут
выступать и как доноры, и как акцепторы, способствуя перемещению электронов в
химических связях.
К другим важным для жизни макроэлементам относятся также сера S, фосфор Р, ионы
натрия Na, кальция Са, магния Mg, хлора О, калия К, железа Fe. Эти элементы, так или
иначе участвующие в жизнедеятельности, получили название органогенов. К
микроэлементам относятся также медь Cu, марганец Mn, цинк Zn, кобальт Со, бор В,
алюминий Al, кремний Si, молибден Мо, ванадий V, иод I. Они имеют важное
функциональное значение — например, йод регулирует процессы обмена, атомы магния
участвуют в образовании хлорофилла, железо входит в состав гемоглобина. В живом
организме могут присутствовать также неорганические растворенные в воде организма
соединения в виде минеральных веществ.
Напомним, что возникновение соединений обусловлено свободной энергией Гиббса
— энергией образования молекул AG
0
. По определению, ∆G
0
образования наиболее
стабильной формы каждого элемента при стандартных условиях (Т = 298 К и p = 1 МПа)
равна нулю. Если ∆G
0
> 0, то образуемая форма не стабильна. При термодинамическом
равновесии наиболее стабильному соединению соответствует отрицательное и
наибольшее по абсолютному значению ∆G
0
. Для воды (Н
2
O) оно равно —224 Дж/моль,
для кварца (SiO
2
), основного компонента земной
314
коры, ∆G
0
= —768 Дж/моль. Установлено, что все важнейшие молекулы аминокислот,
углеводов и фосфатов при условиях, оптимальных для жизни, являются
термостабильными. Этим и объясняется их широкое распространение не только на Земле,
но и в Космосе.
Кроме углерода большое значение для жизненных процессов имеет фосфор, входящий
в их соли — фосфаты, при расщеплении которых выделяется необходимая организму
энергия. Поэтому, видимо, количество фосфора в живых организмах превышает его
количество в любых других средах, исключая лишь литосферу.
12.3.2. Мономеры и макромолекулы
Живые организмы образуются из всевозможных малых органических молекул —
мономеров, которые при объединении создают макромолекулы; в биохимии их называют
также биологическими молекулами, представляющими собой полимерные цепочки.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
187
Процесс строительства биомолекул из мономеров обратим: макромолекулы могут
разлагаться до мономеров, что происходит, например, в желудочно-кишечном тракте
животных. Биомолекулы пищи распадаются до молекул-мономеров, которые затем
всасываются в кровь и используются живым организмом для создания тех макромолекул,
которые нужны именно этому организму.
В биохимии особую роль играют три класса малых молекул-мономеров:
аминокислоты, нуклеотиды и моносахариды. Они служат теми «кирпичиками», из
которых затем строятся полимерные биологические макромолекулы — белки,
нуклеиновые кислоты и полисахариды. Размер мономеров 0,5 — 1 нм, в то время как
макромолекулы достигают размеров от 3 до 300 нм. Диаметр атомов углерода, кислорода,
азота и водорода, из которых в основном и состоят биологические молекулы, составляет
около 0,4 нм; диаметр молекулы аминокислоты — 0,5 нм; диаметр небольшого белкового
образования — 4 нм, хромосомы ~ 1 нм. Однако атомы в 100000 раз меньше клетки, а
диаметр клетки в 100000 раз меньше человеческого роста. Английский ученый Дж.
Кендрю [64] приводит такое сравнение: если увеличить дождевую каплю до размеров
земного шара, то атом будет размером с человека, а его ядро — размером с бактерию.
В дополнение к рис. 6.8 и 6.9 по масштабам макро- и микромира можно привести для
сравнения характерные размеры и других объектов. Толщина человеческого волоса 0,1
мм, расстояние до линии горизонта на уровне моря 4 км, окружность эква-
315
тора Земли 40000 км, расстояние до Луны всего в 10 раз больше экватора — 400000
км, до Солнца 1,5 · 10
8
км. Радиус Вселенной предполагают равным от 8 · 10
9
до 2 · 10
10
световых лет.
Исходя из атомных характеристик можно объяснить поведение и малых, и больших
макромолекул. Органеллы, клетки и живые организмы являются просто совокупностями
макромолекул. Применяя методы статистического описания элементарных единиц жизни
на квантовом уровне, можно попробовать описать жизненные процессы как поведение
атомов в рамках синергетического подхода. В этом смысле жизнь определяет квантово-
механическая динамика атомной структуры вещества живого организма.
Все живые организмы содержат четыре основных класса органических веществ —
белки, нуклеиновые кислоты, углеводы и липиды. Рассмотрим кратко эти классы
биополимеров.
12.3.3. Белки
Широкий диапазон выполняемых белками функций находит свое отражение в
разнообразии их химических структур и пространственных форм. На рис. 12.2 показана
структура белка — миоглобина, который содержится в мышцах животных и человека.
Белковая цепь миоглобина свернута таким образом, что несколько отдельных ее участков
оказываются сближенными в пространстве и формируют центр для образования гема (он
на рисунке показан черным) — железосодержащую группу, способную присоединить
кислород. Следует особенно подчеркнуть роль белков в организации живого вещества.
Белки представляют собой полипептидные последовательности 20 стандартных
аминокислот. Синтез белка осуществляется путем последовательной
поликонденсации отдельных аминокислотных остатков, от амино (N) конца
полипептидной цепи к ее карбоксильному (С) концу.
Карбоксильная группа (—COOH) и амино-группа (—NH
2
) каждой из аминокислот
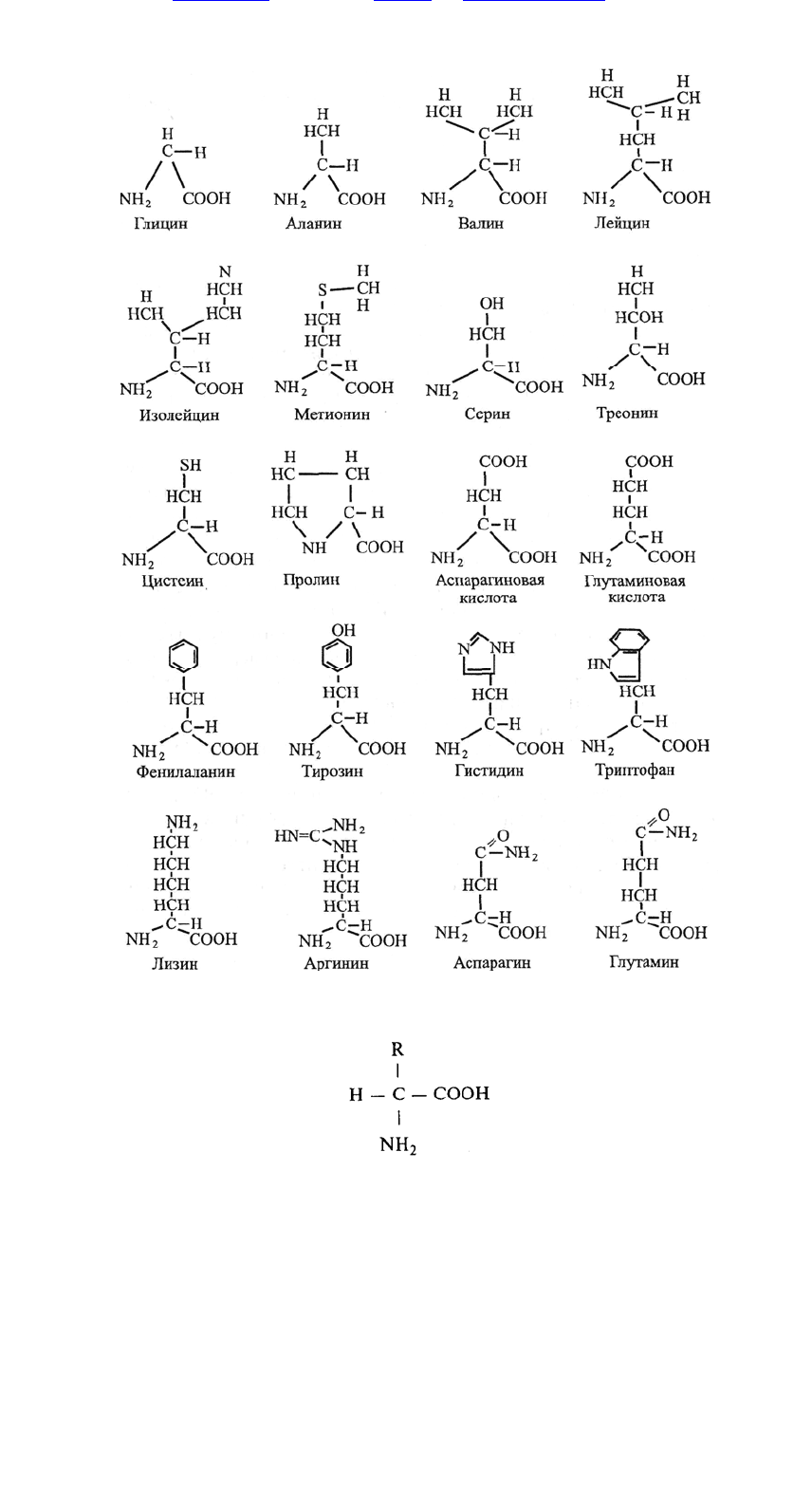
присоединяется к одному и тому же атому углерода С. К этому же атому С
присоединится и одна из многих возможных боковых групп, образуя ту или иную
аминокислоту (рис. 12.3). Из этого рисун-

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
188
Рис. 12.2. Структура белка-миоглобина.
316
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
189
Рис. 12.3. Структуры 20 аминокислот, встречающихся в белках.
317
ка видно, что все они, за исключением пролина, имеют одинаковую основу и
отличаются только строением боковой группы R:
Все используемые организмом в белках 20 аминокислот различаются этими
присоединенными атомами или соединениями. В организме человека синтезируется 12
аминокислот, 8 должны поступать с пищей. Всего в клетках и тканях может содержаться
до 170 аминокислот. Таким образом, аминокислоты являются для макромолекулы белка
мономерами. Белок, содержащий тысячи аминокислот, синтезируется в живой клетке за 5
— 6 мин.
Свойства белков определяются пространственной трехмерной структурой их цепей.
Такая пространственная форма очень чувствительна к температуре окружающей среды.
При повышении температуры белок денатурируется — теряет свою пространственную
конфигурацию, а вместе с ней и биологические свойства. У живых организмов это
происходит при температуре около 60 °С. Эти белковые цепи могут самопроизвольно
свертываться в строго определенные структуры, геометрия и динамика которых

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21
век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
190
определяется составом и порядком аминокислотных остатков в цепи. Поскольку
синтезирующиеся полимеры находятся в водном растворе организма в виде
статистического клубка, то они не образуют стабильных и идентичных для всех
макромолекул трехмерных структур. Функциональность и специфичность белка зависит
от генетического кода ДНК и исполнения его в РНК.
Белки — строительный материал в живой природе. В них преобразуется тепловая
энергия хаотического движения в энергию более высокого порядка — механическую и
энергию стереоспецифических внутримолекулярных взаимодействий. Если в неживой
природе тепловая энергия рассеивается при установлении равновесия, то роль белков в
живой природе заключается в преобразовании тепловой энергии хаоса в нужные для
развития и функционирования живого организма виды энергии. Поэтому белки обладают
способностью взаимопревращения всех необходимых для жизни энергий (тепловой,
механической, химиче-
318
ской, световой), а также уникальной способностью зарождения из хаоса
упорядоченной структуры молекул живого организма.
Эта способность и обусловлена их пространственной химической структурой. Причем
белок может иметь первичную, вторичную, третичную и четвертичную структуры. Под
первичной понимают химическую, структурную формулу белка, представленную в виде
линейной последовательности аминокислотных остатков и определяющую порядок их
чередования. Остальные структуры — это различные уровни этой линейной
последовательности в пространстве. Вторичная структура представляет собой спираль, в
которой отдельные аминокислоты соединены водородной связью, третичная образует
клубок (глобулу) из белка одной природы, а четвертичная — клубок из белковых глобул,
различных по своей природе и структуре.
Взаимодействие между отдельными участками цепи определяется характером
химической связи (водородной, ковалентной, ионной) и ранее рассмотренной
последовательностью расположения аминокислот в полипептидной цепи. После
соединения аминокислот в определенной последовательности цепь автоматически
закручивается, образует петли и свертывается в присущую ей правильную структуру, т.е.
происходит самосборка белковых молекул в трехмерном пространстве. Если многократно
растягивать полипептидную связь и затем отпускать, то она всегда будет
восстанавливаться в присущую для каждого вида цепи структуру.
Изменяя в цепи лишь одну аминокислоту, можно получить молекулу с совершенно
другой структурой и иными свойствами. Цепь длиной уже в 1000 звеньев открывает
безграничные возможности формирования таких свойств белка, которые полностью
отсутствуют в каждой отдельной молекуле. Огромное разнообразие живых организмов на
Земле в основном определяется различиями в составе и пространственной форме
составляющих их белков. Например, глобулярные белки принимают участие в катализе,
транспорте, регуляции, а фибилярные белки (коллаген, кератин и фиброин шелка) играют
структурную роль. Коллаген — наиболее распространенный белок у млекопитающих —
образует основу сухожилий, костей, кожи и хрящей. Структурной единицей
коллагенового волокна является тропо-коллагеновая молекула, состоящая из трех
полипептидных цепей, каждая из которых содержит около 1000 аминокислотных
остатков. Белки-глобины участвуют в переносе кислорода.
319
Глобулярный белок — гемоглобин — входит в состав красных клеток крови —
эритроцитов, обусловливает красный цвет крови и обладает способностью связывать
молекулярный кислород. Одна его молекула присоединяет к себе одновременно четыре
молекулы кислорода. При этом в легких, где давление кислорода более высокое,
происходит присоединение кислорода к гемоглобину, в тканях, где давление более
низкое, кислород освобождается и происходит его диффузия в клетки. В клетке кислород
взаимодействует с белком — миоглобином, который тоже может связывать кислород, но
только одну его молекулу. Таким образом, молекулы кислорода переходят от
гемоглобина к миоглобину и хранятся там до тех пор, пока они не потребуются.
Миоглобин тоже красного цвета и придает красный цвет мясу.
Все биосистемы содержат белки, которые отвечают за фундаментальные свойства
живого: разнообразие его органического мира, избирательность и эффективность
процессов жизнедеятельности, целесообразность форм организмов, самоорганизацию
живой материи; они — активное начало жизни. В чистом виде белок является веществом
белого цвета или бесцветным, что и определяет его название.
