Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


выражается законом Аррениуса, к Т оо, найдем к%
ез
/к
реак
~ 75
п
.
В обзоре [711] приводятся константы скорости дезактивации
J' (5
2
А
г
) большим числом атомов и молекул, полученные различными
авторами. Малая эффективность атомов инертных газов (&
дез
10
б
) сви-
детельствует о малой вероятности превращения энергии электронного
возбуждения (5
2
PI/
2
— 5
2
Р
3
/
2
= 21,7 ккал/моль) в энергию поступатель-
ного движения. Столкновения с двухатомными молекулами оказываются,
по крайней мере на 2 порядка более эффективными, что, согласно [711],
обусловлено взаимодействием электронного и ядерного угловых момен-
тов в трехатомном комплексе. Исключительно большая эффективность
0
2
и N0 (/Сдез порядка 10
13
), по-видимому, объясняется увеличением ве-
роятности передачи энергии в результате действия неоднородного магнит-
ного поля этих молекул (см. [710]).
В отличие от рассмотренных выше реакций электронно-возбужденного
атома иода с молекулами С
2
Н
б
иС
3
Н
8
реакции невозбужденного атома
иода (состояние 5
2
Р
3
/
2
) с теми же молекулами имеют значительно большую
энергию активации в соответствии с большой эндотермичностью этих ре-
акций. Согласно [1079], константы скорости реакций
Ц+ С
2
НБ(СЗН
8
) = Н J + С
2
Н5(СНЗСНСНЗ)—26,6 + 1(—23,6 + 2) ккал/моль
выражаются формулами
к
с
2
я
в
=
1014,6
ехр (—27600/Л7
1
) см
3
-моль'
1
-се
И
/с
СзНв
—
10
14
'
3
ехр
(—24400/RT)
см^-моль^-сек^.
При сравнении этих формул с приведенными выше обращает внима-
ние значительное увеличение предэкспоненциальных множителей (на че-
тыре порядка величины) в реакциях невозбужденного атома иода. Таким
образом, здесь мы имеем своеобразный компенсационный эффект (см. вы-
ше). Аналогичная картина наблюдается также в случае процессов J +
+ CH
3
J - J
2
+ СН
3
— 19,3 ккал и J' + CH
3
J = J
2
+ СН
3
+ 2,5 ккал,
константы скорости которых выражаются формулами соответственно
k - 10
13
'
65
ехр (— 18800//?Г) и к = 10
11
'
25
ехр (— 1900/ЯГ) см*-моль^-сек^ [178].
И так же как природа компенсационного эффекта теоретически не вы-
яснена, вопрос о причине различия предэкспоненциальных множителей
в рассмотренных выше примерах остается открытым.
Как мы видели выше, компенсационный эффект наблюдается далеко не
всегда. Также не является общей и отмеченная выше закономерность.
Рассмотрим, например, реакции О (
3
Р) + Н
2
= ОН + Н — 2,0 ккал
и О' (
г
В) + Н
2
= ОН -j- Н + 43,4 ккал. Константа скорости первой из
них выражается формулой к = 10
13
>
39
-ехр (—9840IRT) см
3
•
моль"
1
• сект
1
[178] и при 300° К равна 1,6 -10
6
см
3
*
моль"
1
-
сек'
1
. Константа] скорости
второй реакции известна только для 300° К, при которой она составляет
2,3-10
14
см*-моль'
1
-сек-
1
[1452].
Отсюда следует, что энергия активации этой реакции практически
равна нулю, и величина 2,3• 10
14
см
3
• моль'
1
•
сек'
1
фактически представ-
ляет предэкспонент, который таким образом оказывается больше пред-
экспонента первой реакции (2,5«10
13
-см**моль'
1
•сек'
1
),— при обратном
соотношении между энергиями активации этих реакций (0 и 9,84 ккал).
В отличие от реакции 0'(
L
D) + Н
2
= ОН + Н константа скорости
реакций 0'(
х
£) + Н
2
= ОН + Н + 94,65 ккал и ОН' + Н Ашаз
11
На основании приведенной выше формулы для /с
реак Сз11
, далее следует /с
дез CsHg
=
= 10
12
>
12
ехр (—2320/RT).

при комнатной температуре является величиной ^1,7-10
8
см
9
-моль'
1
х
ХсекГ
1
[1452]. Отождествляя эту величину с предэкспоненциальным множи-
телем (Л), т. е. полагая энергию активации реакции О' (*S) с Н
2
равной
нулю, можно отметить симбатную зависимость между А
ж
Е для реакций
О (
3
Р) и О' S) с Н
2
, объяснение которой в данном случае можно видеть
в неадиабатичности второй из них [1452].
Коснемся еще реакций метилена. Основным состоянием радикала СН
2
является триплетное; ближайшее к нему возбужденное синглетное со-
стояние отстоит от основного на расстоянии, меньшем 1 эв ([65,
стр. 491—492]). Преимущественно изучались реакции присоединения СН
2
к молекулам олефинов и диенов при комнатной температуре, т. е. реак-
ции присоединения по двойной связи, и реакции внедрения по связи
С—Н (см., например, [1107]). Отношение константы скорости внедрения
к константе скорости присоединения по связи С=С для реакции с цикло-
С
4
Н
6
было найдено равным 0,09 [736]. См. также [463]. Преобладающая
роль реакции присоединения по двойной связи следует также из того фак-
та, что реакционная способность (23,5° С) мало изменяется от олефина
к олефину (как в случае основного
3
СН
2
, так и возбужденного состояния
1
СН
2
) и увеличивается в несколько раз при переходе от (СН
3
)
2
С=СН
2
к
Н
2
С=(СН
2
)
2
==СН
2
[1107].
Если присоединение радикалов
3
СН
2
и
1
СН
2
к молекуле олефина,.
по-видимому, происходит с близкой эффективностью, что нужно припи-
сать большой экзотермичности реакции присоединения, составляющей
~ 90 ккал, а также малой величине энергии возбуждения синглетного
состояния метилена, то в также экзотермических реакциях отщепления
атома водорода СН
2
+ Н
2
= СН
3
+ Н и СН
2
+ СН
4
= СН
3
+ СН
3
ре-
акционная способность метилена
1
СН
2
оказывается значительно выше>
чем
3
СН
2
(по-видимому, это относится также и к реакциям внедрения по
связи С—Н [463]). Измерения Брауна, Басса и Пиллинга [538]
12
для констант
скорости этих реакций при 298° К в случае
1
СН
2
дали к = 4,2-10
12
и соот-
ветственно к = 1,1-10
12
см
3
-
моль'
1
*
сек"
1
и в случае
3
СН
2
& < 3-10
10
см
3
*
моль'
1
- сект
1
.
Высокую реакционную способность электронно-возбужденных частиц
обычно связывают с их повышенной энергией (что, несомненно,, играет
основную роль в эндотермических реакциях, например, в рассмотренной
выше реакции J + CH
3
J = J
2
+ СН
3
), а также с сохранением спина си-
стемы (правило Вигнера). В некоторых реакциях [например, в реакциях
О (
В
Р) + СО С0
2
и О' (
г
П) + СО С0
2
] это правило, несомненно,
играет известную роль, однако в большинстве экзотермических реакций
основную роль, по-видимому, играет конфигурация поверхностей потен-
циальной энергии [711] (см. также § 9). Большое различие констант ско-
рости реакций
1
СН
2
и
3
СН
2
с Н
2
и СН
4
, являющихся экзотермическими,
протекающими без нарушения правила Вигнера, очевидно, нужно связать*
с различием поверхностей потенциальной энергии.
Укажем еще, что электронно-возбужденные частицы принимают так-
же участие в развитии цепных реакций. Примером здесь могут служить
атомы кислорода O'^JD), С образованием которых при фотолизе озона в
УФ-области спектра связан квантовый выход г] = 817, свидетельст-
вующий о цепном протекании реакции разложения озона. Увеличение
квантового выхода во влаяшом озоне до 130 [789] объясняется быстрой
реакцией О' (*D) + Н
2
0 = 20Н [1225].
12
В работе [538] были измерены также константы скорости дезактивапии радикалов
1
СН
2
различными газами. Так, для процесса
1
СН
2
+ N
2
=
S
CH
2
+ N
a
получено-
значение k = 5.10
11
см
3
•
моль"
1
» сек"
1
(298® К).

Глава VIII
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
§ 26. ФОТОХИМИЧЕСКАЯ АКТИВАЦИЯ МОЛЕКУЛ
Закон Ламберта — Беера
В фотохимических реакциях, т. е. в реакциях, идущих под действием
света, главным источником активации молекул реагирующих веществ
является световая энергия. Естественно, что фотохимически активным
может быть только свет, поглощаемый данным веществом. Рассматривая
поглощение света как взаимодействие фотонов с молекулами поглощающего
вещества и приняв за меру интенсивности света данной длины волны X
число соответствующих фотонов Cf-h, ослабление света в поглощающем
слое толщины х можно выразить уравнением:
= (26.1)
где JLIX — множитель пропорциональности, зависящей от длины волны и
природы поглощающего вещества, называемый удельным коэффициентом
поглощения; с — концентрация поглощающего вещества. Интегрируя
выражение (26.1), получаем:^
CT
x
= Cf\e
х
• (26.2)
Здесь Jx — интенсивность падающего света и Cf\ — интенсивность света,
прошедшего слой поглощающего вещества толщиной х.
При постоянной концентрации поглощающего [вещества с [выраже-
ние (26.1) можно представить в следующем виде:
(
где
|Ххс
= ^- '(26.4)
Формула (26.3) выражает закон Ламберта, согласно которому доля пог-
лощенного света при с = const определяется толщиной поглощающего
слоя.
Точно так же при постоянной толщине поглощающего слоя х из (26.1)
следует:
где
[(26.6)
Формула (26.5) выражает закон Беера, согласно которому при х = const
доля поглощенного света определяется концентрацией поглощающего
вещества.

Формула (26.1) или получающаяся в результате интегрирования фор-
мула (26.2) выражает, таким образом, общий закон поглощения света,
носящий название закона Ламберта — JВеера.
Из формулы (26.2) можно определить долю поглощенного света в слое
толщиною х посредством уравнения:
При слабом поглощении (малая концентрация или малый коэффициент
поглощения) или достаточно малом х формула (26.7) может быть представ-
лена в виде:
В этом случае доля поглощенного света пропорциональна концентрации
поглощающего вещества. В случае сильного поглощения экспонен-
циальный член в выражении (26.7) становится ничтожно малым по срав-
нению с единицей, и 8J>, оказывается практически равной единице. Это
означает практически полное поглощение света в слое толщины х.
Как видно из формулы (26.7), независимо от индивидуальных значе-
ний сих при сх = const, доля поглощенного света б Должна быть по-
стоянной.
Закон (26.2), очевидно, сохраняет силу до тех пор, пока коэффициент
поглощения рх не зависит ни от с, ни от х, что, однако, не всегда имеет
место и приводит к отклонениям от закона Ламберта — Веера.
Одна из обычных причин нарушения этого закона заключается в изме-
нении состава поглощающего вещества при изменении его концентрации.
Так, например, вследствие того, что при увеличении давления равнове-
сие между N0
2
и N
2
0^ смещается в сторону N
2
0
4
из-за различия коэффи-
циентов поглощения обоих газов, коэффициент поглощения смеси при
этом изменяется (приближаясь к коэффициенту поглощения N
2
0
4
).
В случае линейчатого поглощения (спектры атомов и линейчато-поло-
сатые спектры молекул) одна из причин нарушения закона Ламберта —
Веера — большая величина коэффициента поглощения в центре линии,
приводящая к практически полному поглощению света на участке линии
вблизи ее центра уже при малых толщинах поглощающего слоя. Изменение
доли поглощения, приходящегося на этот участок, с изменением кон-
центрации поглощающего вещества (вследствие расширения линий погло-
щения) или с изменением толщины поглощающего слоя и проявляется
в виде отклонений от закона поглощения.
Увеличение поглощения света, обусловленное уширением спектраль-
ных линий, имеет важное значение для количественного определения эф-
фективности фотохимического действия света, выражаемого так назы-
ваемым квантовым выходом (см. § 29), в различных условиях давления и
температуры.
Отклонения от закона Ламберта — Веера особенно велики в области
индуцированной предиссоциации (см. ниже), где увеличение концентра-
ции или простое повышение давления за счет любого постороннего газа
при неизменной концентрации поглощающего газа приводит к аномально
большому расширению линий поглощения. Причина аномального уши-
рения спектральных линий в данном случае состоит в том, что здесь,
в отличие от обычного — ударного или допплеровского уширения — пло-
щадь линии, т. е. величина интеграла определяющего вероят-
ность квантового перехода, не остается постоянной (с учетом поправки,
вносимой полным поглощением света в центре линии, см. выше), а растет
с увеличением давления.
в-^х = - -
1
- ехр ftiOcs).
(26.7)
б J
x
=
(26.8)
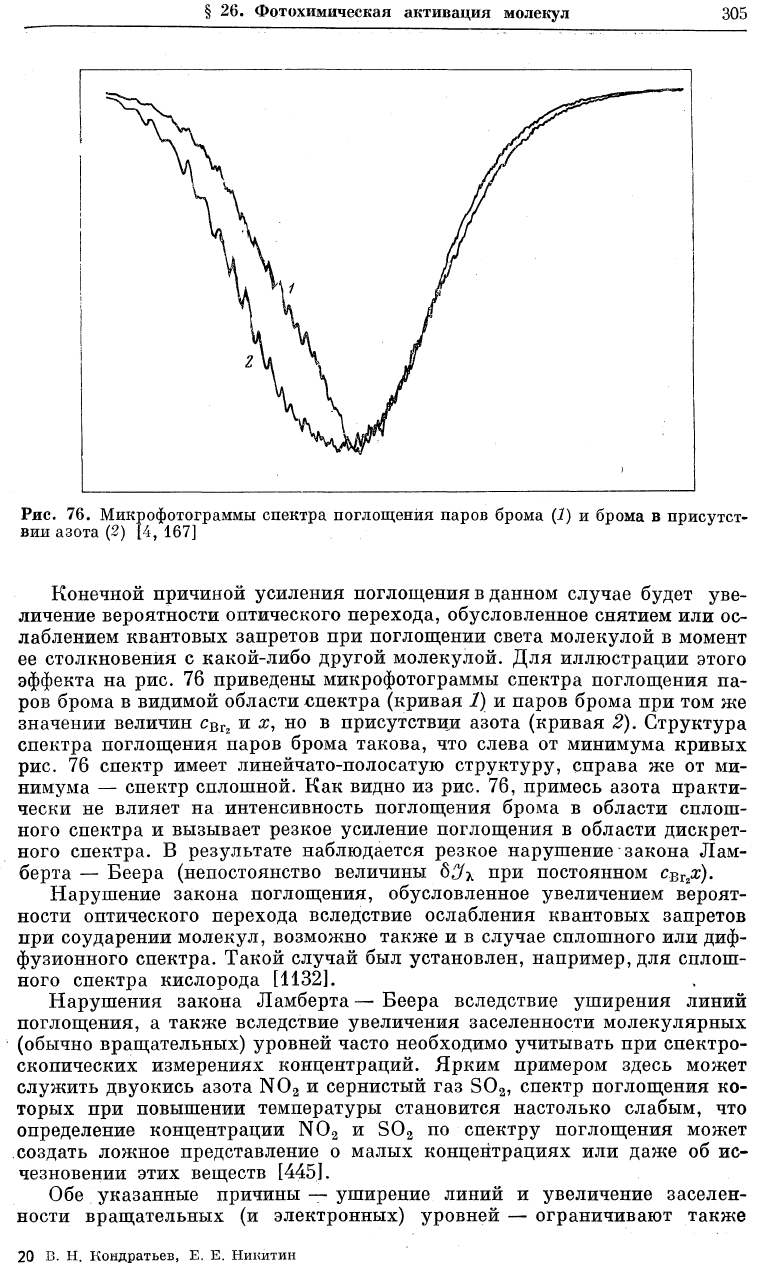
Рис. 76. Микрофотограммы спектра поглощения паров брома (1) и брома в присутст-
вии азота (2) [4, 167]
Конечной причиной усиления поглощения в данном случае будет уве-
личение вероятности оптического перехода, обусловленное снятием или ос-
лаблением квантовых запретов при поглощении света молекулой в момент
ее столкновения с какой-либо другой молекулой. Для иллюстрации этого
эффекта на рис. 76 приведены микрофотограммы спектра поглощения па-
ров брома в видимой области спектра (кривая 1) и паров брома при том же
значении величин с
ВГ2
и о;, но в присутствии азота (кривая 2). Структура
спектра поглощения паров брома такова, что слева от минимума кривых
рис. 76 спектр имеет линейчато-полосатую структуру, справа же от ми-
нимума — спектр сплошной. Как видно из рис. 76, примесь азота практи-
чески не влияет на интенсивность поглощения брома в области сплош-
ного спектра и вызывает резкое усиление поглощения в области дискрет-
ного спектра. В результате наблюдается резкое нарушение закона Лам-
берта — Веера (непостоянство величины SJ^ при постоянном с^х).
Нарушение закона поглощения, обусловленное увеличением вероят-
ности оптического перехода вследствие ослабления квантовых запретов
при соударении молекул, возможно также и в случае сплошного или диф-
фузионного спектра. Такой случай был установлен, например, для сплош-
ного спектра кислорода [1132].
Нарушения закона Ламберта— Веера вследствие уширения линий
поглощения, а также вследствие увеличения заселенности молекулярных
(обычно вращательных) уровней часто необходимо учитывать при спектро-
скопических измерениях концентраций. Ярким примером здесь может
служить двуокись азота N0
2
и сернистый газ S0
2
, спектр поглощения ко-
торых при повышении температуры становится настолько слабым, что
определение концентрации N0
2
и S0
2
по спектру поглощения может
создать ложное представление о малых концентрациях или даже об ис-
чезновении этих веществ [445].
Обе указанные причины — уширение линий и увеличение заселен-
ности вращательных (и электронных) уровней — ограничивают также
20 В. Н. Кондратьев, Е. Е. Никитин

область применения спектроскопии ЭПР для измерения концентраций.
Так, например, надежное определение концентрации гидроксила возмож-
но только при давлениях не выше 2—3 мм рт. ст.
Из сказанного следует, что справедливость закона Ламберта — Бе-
ера ограничена определенными условиями-, накладываемыми темпера-
турой и плотностью газа.
Первичный фотохимический акт
С точки зрения механизма фотохимической реакции весьма существен-
ное значение имеет вопрос о том, каков результат первичного воздействия
света на молекулу поглощающего вещества. В зависимости от частоты
света и структурных особенностей поглощающих свет молекул в резуль-
тате фотохимической активации (поглощения света) может произойти
возбуждение, ионизация или диссоциация молекулы. В большом числе
случаев, особенно когда речь идет о газах и парах, природа первичного
фотохимического акта может быть установлена на основании данных о
структуре спектра поглощения.
Этот вопрос наиболее просто решается в случае сплошных спектров
поглощения газов: в этом случае отсутствие вращательно-колебательной
структуры служит признаком неустойчивости возбужденного состояния
молекулы, т. е. признаком того, что поглощение света ведет к немедленной
диссоциации молекулы. Рассмотрим вопрос о происхождении и особенно-
стях сплошных спектров поглощения на примере спектров двухатомных
молекул.
Сплошные спектры поглощения здесь возникают в двух случаях:
когда верхнее (возбужденное) состояние молекулы является полностью не-
устойчивым состоянием, характеризующимся потенциальной кривой
отталкивания, либо когда в результате поглощения света молекула ока-
зывается на неустойчивом участке верхней кривой.
Распределение интенсивности в спектре поглощения определяется ве-
личиной
где i|v и — колебательные волновые функции верхнего и нижнего (основ-
ного) состояний молекулы (являющиеся функциями расстояния между
атомами г в молекуле). При низких температурах, когда подавляющая
часть молекул находится в нулевом колебательном состоянии, вычисление
распределения интенсивности в сплошном спектре поглощения в полном
согласии с опытом (см., например, [845]) дает почти симметричную (коло-
колообразную) кривую с максимумом.
Заметим, что максимум этой кривой отвечает максимальному пере-
крыванию волновых функций o|v и а|)
0
(v = 0) в формуле распределения
интенсивности в сплошном спектре, выражающему принцип Франка —
Кондона. Согласно этому принципу, максимальная интенсивность в спек-
тре приходится на тот его участок, который связан с переходом с одного
электронного уровня на другой при неизменном расстоянии между ато-
мами (вертикальный переход). Поэтому, если верхняя кривая потенциаль-
ной энергии отвечает устойчивому состоянию возбужденной молекулы,
то максимум в спектре поглощения будет приходиться на сплошной уча-
сток лишь в том случае, когда равновесное расстояние между атомами в
возбужденной молекуле г
0
будет достаточно велико по сравнению с вели-
чиной г
0
(г
0
— равновесное расстояние в невозбужденной молекуле). Это,
в частности, имеет место в случае молекулы хлора, где г
0
= 1,983 А (со-
стояние Х
1
^) и г
0
= 2,42 А (состояние -4
3
По
и
) и где максимум интен-

сивности в спектре поглощения приходится на сплошную часть (вблизи
X = 3300 А).
С уменьшением разности г
0
— г
0
максимум интенсивности переме-
щается в сторону больших длин волн. При достаточно глубоком минимуме
верхней кривой (большая энергия диссоциации D
0
) и близких г'
0
и г
0
сплошная часть спектра поглощения может вообще отсутствовать. В этом
случае спектр поглощения будет состоять из дискретных полос: резуль-
татом первичного фотохимического акта будет не диссоциация, а возбуж-
дение молекулы.
В многоатомных молекулах квантовые состояния характеризуются
не потенциальными кривыми, а потенциальными поверхностями, и опти-
ческий переход представляет собой переход молекулы с одной потен-
циальной поверхности на другую. Неустойчивым состояниям отвечают
потенциальные поверхности с энергией, превышающей энергию продук-
тов диссоциации молекулы; оптические переходы на такие поверхности
связаны со сплошными спектрами поглощения. Таким образом, и в слу-
чае многоатомных молекул сплошные спектры поглощения обозначают
фотодиссоциацию молекулы. Правда, здесь всегда нужно быть уверенным,
что спектр действительно является сплошным, так как колебательная
структура в спектрах многоатомных молекул нередко явно не выступает
вследствие расширения полос (см. [253]).
Значительно более труден вопрос о химической природе и об энерге-
тическом состоянии продуктов фотбдиссоциации молекул. Даже в про-
стейшем случае двухатомных молекул решение этого важного с точки зре-
ния кинетики и механизма фотохимической реакции вопроса нуждается
в дополнительном исследовании.
Прямой путь решения этого вопроса состоит в использовании метода
спектроскопии продуктов фотодиссоциации [42]. В этом методе пучок мо-
лекул облучается импульсами поляризованного света. Образующиеся
при этом продукты диссоциации детектируются квадрупольным масс-спек-
трометром, что делает возможным их идентификацию и измерение распре-
деления энергии между поступательными и внутренними степенями сво-
боды. При помощи этого метода были исследованы процессы диссоциации
молекул галогенов (например, иода [585, 1191, 1316]) и др.
В отдельных случаях, однако, достаточно знания энергии диссоциа-
ции молекулы, чтобы решить вопрос о том, в каком энергетическом со-
стоянии находятся продукты диссоциации. Так, например, если энергия
активирующего света Е удовлетворяет условию: D Е D + А, где
А — наименьшая энергия возбуждения продуктов диссоциации, то мож-
но утверждать, что при поглощении этого света молекула диссоциирует на
невозбужденные атомы. Из положения границы между сплошной и ди-
скретной частями спектра поглощения молекул 0
2
и S
2
следует, что при
поглощении света в области сплошного спектра эти молекулы диссоци-
ируют на нормальный и возбужденный атомы.
Возникающие при этом возбужденные атомы в данном случае нахо-
дятся в метастабильном состоянии, что затрудняет их обнаружение по из-
лучению света. Однако в аналогичных случаях, когда возбужденные со-
стояния продуктов фотодиссоциации не являются метастабильными, ис-
следование спектра флуоресценции позволяет однозначно установить
характер диссоциационного процесса и энергетическое состояние продук-
тов диссоциации. На этом основывается разработанный Терениным [1587}
оптический метод изучения фотодиссоциации, заключающийся в наблю-
дении флуоресценции, возникающей при облучении различных газов све-
том коротких длин волн. Так, например, было установлено, что при об-
2Q*

лучении перекиси водорода в области длин волн ~ 2025 А имеет место про-
цесс Н
2
0
2
+ hv — ОН + ОН' (минимальная энергия возбуждения гидро-
ксила составляет 92,5 ккал). При облучении паров метилового спирта и
метилцианида длинами волн X 1560 А протекают процессы СН
3
ОН -f-
+ hv =! СН
3
+ ОН' и CH
3
GN + hv = GH
3
+ CN' [минимальная энергия
возбуждения GN 26,4 (A
2
U) и 73,6 (В
2
2) ккал] и т. д. [1589]. В [1236]
приводятся соображения о возбуждении уровня А
2
П радикала GN через
уровень В
2
2.
В большом числе случаев природа продуктов фотохимической диссо-
циации молекул была установлена на основании оптических спектров по-
глощения этих продуктов. Таким путем был обнаружен радикал GS, об-
разующийся при фотодиссоциации CS
2
в области X 2000 А [187] (см.
также [590]), гидроксил — при фотодиссоциации паров воды [883], ради-
кал НСО — при фотодиссоциации НСНО, СН
3
СНО, С
2
Н
5
СНО, (НСО)
2
[945, 1394], радикал СН
3
— при фотодиссоциации Hg(CH
3
)
2
, CH
3
J,
СН
3
СНО, СН
3
СОСН
3
[947] и др. По спектру ЭПР обнаружены радикалы
ОН, образующиеся при фотодиссоциации Н
2
0
2
[1003].
Спектроскопический (оптический) метод обнаружения продуктов фо-
тодиссоциации, измерения концентрации и изучения их кинетики широко
применяется в импульсном фотолизе, при помощи которого были получены
приведенные выше данные, относящиеся к радикалам ОН, НСО и СН
3
.
В методе импульсного фотолиза, разработанном Портером и Нор-
ришем (см. [1374, 1302]), источником света служит импульсный разряд
в инертном газе при весьма большой энергии разряда (тысячи джоулей)
и при продолжительности импульса от нескольких миллисекунд до сотых
долей миллисекунды. При облучении газа, находящегося под давлением
в несколько миллиметров или в несколько сантиметров ртутного столба
и способного поглощать свет, испускаемый этим источником, можно
достичь практически полной диссоциации этого газа на атомы и радика-
лы. Так, например, в хлоре Портером было обнаружено исчезновение
спектра поглощения молекулярного хлора, свидетельствующее о полной
диссоциации молекул С1
2
на атомы. Об этом свидетельствует также наблю-
давшееся в момент освещения повышение давления (от 10 до 22 мм рт. ст.)
без существенного повышения температуры, связанное с процессом
С1
2
+ hv =
С1 (
2
Р
3
/
2
)
+
CI
(
2
P
if
)
1
.
Регистрация продуктов импульсного фотолиза и наблюдение за ходом
их концентрации после прекращения облучения ведется путем просве-
чивания зоны реакции специальным источником света через короткие
(микросекунды) промежутки времени (кинетическая спектроскопия). Из-
менение концентрации первичных продуктов фотолиза обусловлено их
рекомбинацией или реакциями с присутствующими в реакционной зоне
молекулами. В настоящее время методом импульсного фотолиза изуче-
но большое число реакций. Среди них рекомбинация атомов О, Вг и J,
радикалов СН, ОН, CN, СН
3
, присоединение атомов Н к С
2
Н
4
, C
2
D
4
и
другим олефинам, атомов О и С1 к молекулам 0
2
, атомов О к олефинам,
атомов S к COS и CS
2
, радикалов CN и СН
3
к NO, СН
3
и С
2
Н
5
к 0
2
и т. д.
Методом кинетической спектроскопии изучены десятки обменных реак-
ций, а также ряд взрывных реакций [1300, 1301]
2
.
1
Здесь С1 (
2
Р
3/г
) представляет нормальный атом хлора и С1(
2
Ру,) — метастабильный
атом, обладающий энергией электронного возбуждения, отвечающей разности тер-
мов
2
Pt[
2
—
2
Р
Ъ
= 881 см"
1
, т.е. 2,5 ккал/г-атом.
2
В недавнее время в результате использования лазерной техники оказалось возмож-
ным изучение процессов продолжительностью в несколько миллиардных долей се-
кунды [1377].

Вследствие большой концентрации радикалов, являющихся первич-
ными активными центрами реакций, осуществляющихся при импульсном
фотолизе, вторичные химические процессы в этих реакциях в основном
представляют собой процессы, происходящие между свободными радика-
лами.
Эта особенность химического механизма рассматриваемых реакций,
в частности, проявляется в резком различии продуктов этих реакций и
продуктов обычных фотохимических реакций [1082, 1295].
Наряду со спектроскопическими методами для установления приро-
ды первичного фотохимического акта привлекаются и другие экспери-
ментальные методы. Так, используя C
2
D
2
в качестве детектора атомов Н
при фотохимическом разложении NH
3
и Н
2
0, Мак-Несби с сотр. [1231]
г
нашли, что при Х= 1849 А аммиак разлагается преимущественно на
Н + NH
2
, при % =. 1286 А наблюдается также распад по схеме NH
3
+
+ hv = Н
2
+ NH, причем последний процесс приблизительно в 6 раз
медленнее, чем распад на И + NH
2
. Фотолиз Н
2
0 при X = 1236 А в трех
случаях из четырех дает II + ОЙ и в одном — Н
2
+ О. См. также
[1553].
В работе [1659] изучалось распределение энергии в продуктах реак-
ции Н
2
0 +hv ='К (l
1
^) + ОН (Х
2
П) и в работе [611] — в продуктах
реакции Н
2
0 + hv = Н + ОН' (
2
2
+
). В [1558] приводятся данные, сви-
детельствующие об образовании О' D) в реакции Н
2
0 -f- hv = Н
2
+
+ О'.
Далее при помощи метода гсара-ор/тго-конверсии водорода, а также ме-
тода зеркал было показано, что при фотолизе кетонов образуются ал-
кильные радикалы [581, 853, 1343, 1344, 1387]. Исследования фотолиза
метилкетонов RCH
3
CO показывают, что распад молекулы кетона на ра-
дикалы R и CHgCO
RCHsCO + Av=R + СНзСО
представляет собой главный фотолитический процесс. Установлено, что
при распаде ацетона (СН
3
)
2
СО радикалы СН
3
и СН
3
СО образуются при-
близительно в равных количествах (см. [1417, стр. 235—236]; см. также
[1304]). При температурах выше 60° С ацетил СН
3
СО, по-видимому,* не-
устойчив и распадается на СН
3
+ СО
3
.
Это заключение следует из того факта, что при температуре выше
60° С в продуктах фотолиза ацетона отсутствует диацетил (СН
3
СО)
2
, об-
разование которого связывается с процессом рекомбинации 2СН
3
СО =
= (СН
3
СО)
2
. Вместе с тем имеются данные, свидетельствующие о том, что
в области дискретного поглощения света ацетон распадается по схеме:
СНзСОСНз + hv С
2
Н
б
+ СО.
Предполагается, что этот процесс Осуществляется по механизму инду-
цированной предиссоциации (см. [1417, § 8]).
Фотолитический распад на насыщенные молекулы на основании ряда
данных возможен также и в случае соединений других классов. Так, мож-
но полагать, что, наряду с распадом на радикалы
RCHO + fcv = R + CHO,
альдегиды распадаются также по схеме:
RCHO + /iv = RH + СО.
3
Согласно [605], константа скорости реакции СН
3
СО = СН
3
-f СО приближенно мо-
жет быть выражена формулой: к = 1,25.10
10
ехр (— 13
400/RT),
из которой для вре-
мени жизни радикала СН
3
СО при 60° С следует V20 сек.

Наряду с данными, приводимыми в [1417, стр. 72], на наличие обоих ти-
пов распада альдегидов указывают также результаты работы [14511,
относящиеся к фотохимическому разложению формальдегида НСНО.
Согласно этим данным, в области длин волн X 3650 А фотолиз НСНО
протекает по схеме: НСНО + hv = Н
2
-f- СО, а в области коротких
длин волн параллельно этому процессу идет также процесс НСНО -f
+ hv = Н + СНО, причем последний имеет большую скорость. Так,
при длине волны X = 3650 А скорость распада молекулы НСНО на ра-
дикалы превышает скорость распада на насыщенные молекулы минимум
в 5 раз.
Отметим," что наряду с фотодиссоциацией молекул на нейтральные ча-
стицы наблюдаются также случаи фотоионизации, заключающиеся в рас-
паде молекулы на противоположно заряженные ионы или на положи-
тельный ион и электрон. Распад на ионы впервые был установлен Тере-
ниным й Поповым [1588, 1591] при облучении галоидных солей однова-
лентного таллия, распадавшихся по схеме:
Т1Х
+ hv=Т1
+
+ X-
Для этих солей эффективные длины волн, отвечающие максимуму
поглощения, равны соответственно: < 1850 А (Т1С1), 2000 A (TlBr) и
2125 A (T1J).
Особенно многочисленны случаи фотодиссоциации на ион и электрон.
Однако этот тип фотоионизации имеет место лишь в вакуумной области
спектра, обычно при
X
1200 А, и поэтому не играет роли в обычных фо-
тохимических реакциях.
С точки зрения природы первичного фотохимического акта важную
роль играет предиссоциационный распад молекул.
Предиссоциация как самопроизвольный распад возбужденной моле-
кулы наблюдается в тех случаях, когда переход в неустойчивое состояние
не связан с нарушением того или иного правила отбора. Однако и в слу-
чае запрещенных переходов предиссоциационный распад мЪжет оказать-
ся возможным при условии действия какого-либо из внешних факторов,
снимающих квантовый запрет. Предиссоциация в этом случае называется
индуцированной. Прямыми опытами были обнаружены случаи предис-
социации, индуцированной магнитным полем (J
2
) и молекулярными со-
ударениями (J
2
, Br
2
, N
2
, NO, S
2
, Se
2
, Te
2
). С точки зрения механизма фо-
тохимических реакций предиссоциация, индуцированная молекулярны-
ми соударениями (давлением), представляет наибольший интерес.
Предиссоциационный распад молекул (спонтанный или индуцирован-
ный соударениями), по-видимому, представляет собой наиболее часто
встречающийся случай первичного фотохимического акта, характерный
для фотохимических реакций в области дискретного спектра поглощения
[1417]. Наряду со структурой спектра, далеко не всегда в достаточной
степени изученной, о большой распространенности предиссоциационного
распада свидетельствуют также данные, относящиеся к взаимоотноше-
нию между центром возбуждения молекулы и разрываемыми связями.
Так, например, у альдегидов, кетонов и карбоновых кислот центром воз-
буждения является общая всем этим соединениям группа СО. Разры-
вающимися связями при фотохимическом распаде молекулы здесь могут
быть как связи с атомом углерода этой группы, так и связи в других
группах, как это следует из анализа продуктов фотохимического разло-
жения альдегидов, кетонов и кислот.
Разрыв связей, не подвергающихся прямому воздействию лучистой
энергии, очевидно, возможен лишь в тех случаях, когда при поглощении
