Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.

111
Так как эквивалентная электропроводность
и удельная элек-
тропроводность Ì связаны между собой соотношением:
Ì /
Cz
Ì /
Cz
,
то с учетом уравнения (2.13),
т
и
связаны соотношением
,
zz
m
где
zz , – заряд иона;
, – количество образующихся из мо-
лекулы катионов и анионов.
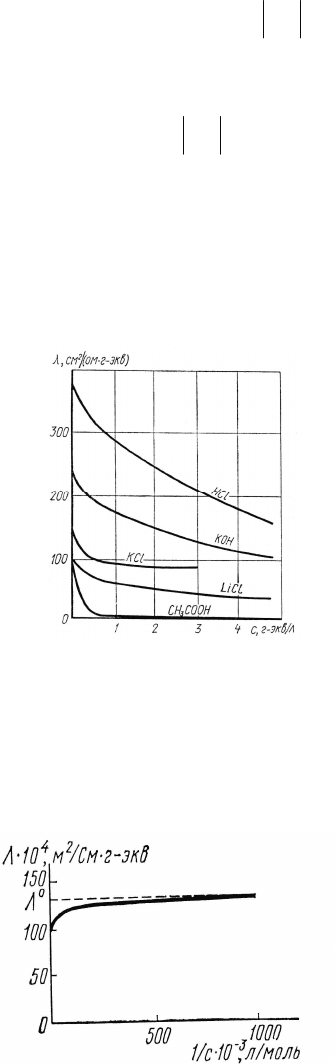
В реальных системах эквивалентная электропроводность зави-
сит от концентрации, согласно представленному рисунку:
Рис. 2.2. Зависимости эквивалентной электропроводности от
концентрации водных растворов некоторых электролитов.
При с 0 величина стремится к своему предельному значению
, отвечающему отсутствию ион-ионных взаимодействий рис. 2.3:
Рис. 2.3 Зависимость эквивалентной электропроводности раствора
KCl от разбавления (разведение V).
Связь электропроводности при конечной концентрации и беско-
нечно разбавленного раствора можно представить в виде:
f
, (2.16)

112
где
u u
f
u u
- коэффициент электропроводности; u
i
- абсо-
лютная скорость движения иона (м
2
с
-1
В
-1
).
Из теории Аррениуса следует, что подвижности ионов не зави-
сят от концентрации (т.е.
или
i
u u
), а отличие
от
обу-
словлено только частичной диссоциацией электролита.
Такое приближение приемлемо для слабых электролитов, для
которых можно пренебречь ион-ионным взаимодействием, т.е. f
1.
При этом допущении уравнение(2.16) упрощается:
.
(2.17)
Для слабого 1-1 зарядного электролита константа диссоциации
может быть представлена как:
1
2
c
K
a
, (2.18)
а при условии <<1 это соотношение можно упростить
cK
a
2
. (2.19)
Выразив из уравнения (2.19) , подставим ее в (2.17) и пролога-
рифмируем:
.lg
2
1
lg
2121
cconst
c
K
c
K
aa
(2.20)
Такая зависимость эквивалентной электропроводности от кон-
центрации для слабых электролитов подтверждается эксперимен-
тально.
Для разбавленных растворов сильных 1-1 зарядных электроли-
тов Кольраушем было получено эмпирическое соотношение
const c
, (2.21)
где const – величина, зависящая от температуры, диэлектрической
постоянной растворителя и вязкости раствора.
Как следует из уравнений (2.17) и (2.18), константу диссоциа-
ции для бинарного электролита можно определить из данных по
электропроводности:

113
2
2 2
.
1
1
c
c c
K
(2.22)
Сильные электролиты диссоциируют практически полностью
при любой концентрации, т.е. a = 1, и возрастание эквивалентной
электропроводности с разведением
1
1
V моль л
c
раствора
объясняется возрастанием подвижностей ионов. Количественно
связь между эквивалентной электропроводностью и абсолютными
скоростями движения ионов выражается уравнением:
,
F u u
(2.23)
где F = 96485 Κ/моль постоянная Фарадея; произведения величин
;F u F u
называются подвижностями ионов, их раз-
мерность [(Cм∙м
2
)/моль].
Для сильных электролитов и предельно разбавленных растворов
сильных электролитов из выражения (2.23) получаем уравнения
Кольрауша:
(2.24)
Подвижности ионов при предельном разбавлении растворов элек-
тролитов – величины справочные.
В растворах электролитов существует как минимум два типа но-
сителей заряда (катионы и анионы) и их подвижности (скорости
движения) неодинаковы, поэтому, количество электричества, пере-
носимое ионами каждого вида не одинаково. Количественной оцен-
кой этого факта является величина, которая называется - числом пе-
реноса. Число переноса (t
i
) - доля электричества, переносимая ио-
ном данного вида:
Q I
t
Q Q I I
;
Q I
t
Q Q I I
(2.25)

114
Сумма чисел переноса всегда равна единице:
1
t t
(2.26)
Для растворов сильных электролитов, учитывая условие элек-
тронейтральности
z c z c
и вышеприведенные уравнения, не-
сложно получить:
u
t
u u
;
u
t
u u
(2.27)
Из уравнений (2.27) следует, что числа переноса определяются
относительными подвижностями ионов: чем больше подвижность
данного вида иона, тем большую долю электричества он перено-
сит.
Если через цепь, состоящую из металлических электродов и
раствора электролита пропускать постоянный электрический ток, то
на границе раздела фаз неизбежно должен осуществляться процесс
трансформации носителей заряда, иными словами некоторые элек-
трохимические реакции, называемые электролизом. Например, при
электролизе раствора хлорида меди CuCl
2
на отрицательном элек-
троде будут восстанавливаться катионы меди, т.е. к ним присоеди-
няются электроны:
Cu
2+
+ 2ē Cu. (2.28)
Одновременно на аноде будет происходить окисление хлорид
ионов, т.е. отдача ими электронов:
Cl
-
Cl + ē (2.29)
Соотношения между количеством электричества и количеством
вещества, претерпевшего превращения в ходе реакций определяется
законами Фарадея.
1-й закон. Масса m вещества, претерпевшего превращение на
электроде, при прохождении через него постоянного тока, пропор-
циональна количеству пропущенного электричества, т.е. силе тока и
времени:
m = k
эх
Q = k
эх
I, (2.30)
где k
эх
– коэффициент пропорциональности, электрохимический эк-
вивалент – масса претерпевшего превращение на электроде вещест-
ва при пропускании 1 Κл электричества.
115
2-й закон. При прохождении через различные электролиты од-
ного и того же количества электричества (Q = сonst) массы различ-
ных веществ, участвующих в электродных реакциях, пропорцио-
нальны их химическим эквивалентам (Э
i
). Аналитически этот закон
можно представить следующим образом:
1 2
1 2
...
i
i
m
m m
Э Э Э
(2.31)
Из уравнений (2.30, 2.31) следует, что количество электричест-
ва необходимое для того, чтобы масса претерпевшего превращения
вещества стала равной эквивалентной массе, должно быть:
./94485 мольлFeNQ
A
(2.32)
Это значение носит название константы Фарадея и представля-
ет собой суммарный заряд одного моля электронов. В случае Q = F
первый закон Фарадея принимает вид:
.FkЭ
эхi
(2.33)
В окончательном виде после соответствующих замен имеем:
Q
m
Э
F
(2.34)
Это уравнение называют объединенным выражением 1
го
и 2
го
законов Фарадея.
Пример 48. Сопротивление 0,1 М раствора СООKСН
3
при 25
0
С равно 28 Ом, а сопротивление 0,02 М стандартного раствора
KCl
,
измеренное в том же сосуде, равно 93,1 Ом. Определить эквива-
лентную электропроводность раствора СООKСН
3
; подвижности и
абсолютные скорости движения ионов
COOCHK
3
, , используя
табличные значения чисел переноса катионов [1] для 0,1 М раствора
СООKСН
3
.
Решение. Электропроводность зависит от условий измерения и
формы сосуда, в котором проводят эти измерения. Поэтому, следует
определить константу сосуда, в котором измерено сопротивление
0,1 М раствора СООKСН
3
. Для этого из табличных данных [1] об
удельной электрической проводимости раствора
KCl
находим зна-
чение € = 0,2765 См/м. Тогда константа сосуда равна
1
0, 2765 93,1 25,74 .
c
K R
м
Ä

116
Удельная электропроводность 0,1 М раствора СООKСН
3
оп-
ределим из уравнения
25, 74
0,92 / .
28
c
K
См м
R
Ä
В расчетах эквивалентной электропроводности концентрацию рас-
твора СООKСН
3
необходимо перевести в моль/м
3
и тогда:
.1092
101,0
92,0
124
3
3
3
мольмCм
c
COOKCH
COOKCH
Число переноса катионов калия, согласно табличным данным
[1], равно 661.0
K
t . Сумма чисел переноса равна 1. Поэтому,
число переноса анионов будет равно
.339,0661,01
3
COOCH
t
Подвижности ионов определим из уравнения (2.27):
3
3
3
3
2
4 4
2
4 4
;
0, 661 92 10 60,81 10
;
0,339 92 10 31, 2 10 .
K
CH OOK
K
CH COO
CH COOK
CH COO
t
См м
t
моль
t
См м
моль
Пример 49. Константа диссоциации масляной кислоты
284
OHC равна 1,54∙10
-5
, эквивалентная электропроводность равна
41,3∙10
-4
См∙м
2
/моль. Определить степень диссоциации водного рас-
твора кислоты при разведении V = 1024 л/моль, концентрацию ио-
нов водорода в этом растворе, эквивалентную электропроводность
при бесконечном разбавлении раствора и рН раствора до разведе-
ния.
Решение. Из уравнения (2.18) рассчитаем степень диссоциации
кислоты. Для этого, определяем из разведения концентрацию рас-
твора (моль/л):
117
1 1
/
1024
c
моль л
V
,
тогда
2 2
5
; 1, 54 10 ;
1 1024 1
0,118
c
K
Концентрация ионов водорода с учетом степени диссоциации равна:
4
1
0,118 1,153 10 / .
1024
H
c c
моль л
Эквивалентная электропроводность при бесконечном разведении
раствора, согласно уравнению (2.17), будет равна:
4
4 2
41, 3 10
350 10 ( ) / .
0,118
См м моль
Из формулировки, что такое рН раствора, с учетом выражения кон-
центрации раствора в моль/л, получим:
4
lg lg1,153 10 3, 94
H
pH a
При разведении 1024 л/моль можно принять
,
H H
a c
т.к.
1.
Пример 50. В ячейке с электродами (S = 2,34 см
2
) и расстоянии
между ними l = 0,65 см измерено сопротивление (R) 5% раствора
сернокислого калия. По результатам измерения
2 4
5, 61
K SO
R
Ом
;
плотность раствора
3
1 /
г см
. Определить эквивалентную элек-
тропроводность
2 4
1
2
K SO
.
Решение. Выразим концентрацию сернокислого калия из про-
центной в (моль-экв)/м
3
. С учетом плотности раствора, объем рас-
твора равен 100 см
3
; 1 моль-экв
2 4
K SO
равен 174 : 2 = 87 г. В 100
см
3
содержится 5 г
2 4
K SO
, тогда в 1м
3
(10
6
см
3
) содержится 5∙10
4
г
2 4
K SO
или
4
3
5 10
574,7
87
моль экв
м
2 4
K SO
.
Определим удельную электропроводность 5% раствора
2 4
K SO
.
Для этого, величины, данные в условии задачи, следует перевести в
систему СИ и подставить в соответствующее уравнение:

118
3
4
6,5 10
4,56 .
5, 61 2,54 10
l
См
R S
м
Ä =
Значение эквивалентной электропроводности будет равно:
3 2 1
4,56
7,95 10 .
574,7
См м моль
с
Ä
Пример 51. Для раствора
4
NH OH
различных концентраций
измерена удельная электропроводность:
концентрация
раствора, моль/м
3
50 30 10
удельная
электропроводность,
Ì, См∙м
-1
0,097 0,069 0,04
Определить степень и константу диссоциации
4
NH OH
; сде-
лать заключение: подчиняется ли электролит закону разведения
Оствальда; найти разведение, при котором степень диссоциации
равна 0,05.
Решение. По уравнениям 2.14, 2.17 и 2.18 определим эквива-
лентную электропроводность и степень диссоциации. При опреде-
лении константы диссоциации, концентрации растворов выразим в
моль/л. Все данные сведем в таблицу.
2 1
C
м м моль
c
Ä
19,4∙10
-4
23∙10
-4
40∙10
-4
0,07 0,085 0,147
2
1
д
с
K
2,7∙10
-4
2,4∙10
-4
2,5∙10
-4
Значение
определено из данных справочника по уравнению
Кольрауша (2.24). Близкие значения констант диссоциации показы-
вают, что электролит подчиняется закону разведения Оствальда.
Среднее значение константы диссоциации равно 2,5∙10
-4
. Определим

119
концентрацию, при которой степень диссоциации
4
NH OH
равна
0,05.
2
2
4
2 2
. . 1,
1
2,5 10 1 1
0,1 / , 10 / .
0.1
0, 05
д д
д
с
K т к то K с
K
с моль л V л моль
c
Пример 52. Определить эквивалентную электропроводность
ацетата аммония при бесконечном разведении, если значения этой
величины для хлорида аммония, ацетата натрия и хлорида натрия
при 25
0
С соответственно равны: 129,9∙10
-4
; 91,01∙10
-4
; 108,9∙10
-4
См∙м
2
∙моль
-1
.
Решение. Чтобы определить эквивалентную электропровод-
ность ацетата аммония при бесконечном разведении, следует из
уравнений диссоциации предложенных соединений и закона Коль-
рауша составить уравнение для расчета
.
3
3
34
COOCHNH
COOCHNH
Необходимое уравнение получим следующим образом:
4 4
4 4
3
3
3
3
3 4
3 4
4 3
;
;
;
; .
129,9 90, 0
NH Cl NH Cl
NH Cl NH Cl
CH COONa
CH COO Na
CH COONa
CH COO Na
NaCl NaCl
Na Cl Na Cl
CH COONH
CH COO NH
NH Cl CH COONa NaCl
4 4 2 1
1 108,90 10 112,01 10 .
См м моль
ЗАДАЧИ.
2.11. Сопротивление ячейки, заполненной раствором
KCl
с
удельной электропроводностью 5,79∙10
-3
равно 103,6 Ом. Сопротив-
ление той же ячейки, заполненной 0,01 М раствором уксусной ки-
120
слоты, равно 5771 Ом. Определить эквивалентную электропровод-
ность 0,01 М раствора уксусной кислоты.
Ответ: 10,4 Ом
-1
∙см
2
.
2.12. Определить эквивалентную электропроводность при бес-
конечном разведении для
LiBr
, если известны эквивалентные элек-
тропроводности при бесконечном разведении для следующих рас-
творов:
2 4
2 4
4 2 1
4 2 1
4 2 1
151, 9 10 ;
153,3 10 ;
118,5 10 .
KBr
K SO
Li SO
См м моль
См м моль
См м моль
Ответ: 117,1∙10
-4
См∙м
2
∙моль
-1
.
2.13. Удельная электропроводность 4%-ного раствора
2 4
H SO
при 18
0
С равна 16,8 См∙м
-1
. Плотность раствора равна 1,026
г/см
3
. Определить молярную электропроводность раствора
2 4
H SO
.
Ответ: 200,2∙10
-4
См∙м
2
∙моль
-1
.
2.14. При титровании 50 см
3
раствора
HCl
2 М раствором
NaOH
были получены следующие результаты:
Определить концентрацию раствора
HCl
.
2.15. Определить концентрацию раствора соляной кислоты, ес-
ли при титровании 100 см
3
раствора
HCl
1,045 М раствором гидро-
ксида натрия получены следующие результаты:
объем
титранта
NaOH
, см
3
3,2 6,0 9,2 15,6 20,0 23,5
удельная элек-
тропровод-
ность, См∙м
-1
320 256 186 164 238 296
