Мальцева Г.Н. . Коррозия и защита оборудования от коррозии
Подождите немного. Документ загружается.

11
— точечную, или питтинговую (д), которая поражает металл в отдель-
ных точках на большую глубину, в некоторых случаях насквозь;
— межкристаллитную коррозию (е) – коррозию по границам кристалли-
тов металла; распространяется на обширной поверхности металла и на
большую глубину. Этот вид коррозии опасен тем, что внешний вид металли-
ческого изделия не изменяется
, но при этом металл теряет прочность и пла-
стичность, например, коррозия стали Х18Н10 после ее нагрева до 600°С.
Растрескивающая коррозия (ж) – это коррозия металла при одновремен-
ном воздействии на металл коррозионной среды и механических напряже-
ний, при этом скорость коррозии металла резко возрастает, например, сезон-
ное растрескивание холодно деформированных
α- и β-латуней, содержащих
более 10% цинка.
Неравномерная коррозия более опасна, чем равномерная, так как вызы-
вает в отдельных местах значительное уменьшение сечения.
Приведенная классификация условна, потому что реальные формы кор-
розионных разрушений могут находиться между характерными типами, по-
казанными на рисунке.
12
2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
2.l Возникновение электродного потенциала
Электрохимическая коррозия металлов представляет собой самопроиз-
вольное разрушение металла вследствие электрохимического взаимодейст-
вия его с электролитом. Это гетерогенная реакция, протекающая на поверх-
ности металла. Причиной электрохимической коррозии является термодина-
мическая неустойчивость металла в данных коррозионных условиях.
Для понимания механизма электрохимической коррозии необходимо
установить, какие процессы наблюдаются на границе металл – раствор. На
границе двух соприкасающихся фаз при определенных условиях может воз-
никнуть разность потенциалов или, как принято говорить, скачок потенциа-
ла, например электродный потенциал – на границе металл – раствор; кон-
тактный потенциал – на границе двух различных металлов; контактный по-
тенциал второго рода – на границе металл
– газ; диффузионный потенциал –
на границе двух растворов, имеющих различную концентрацию растворен-
ного вещества, и др.
Скачок потенциала между двумя фазами определяется переходом заря-
женных частиц из одной фазы в другую или избирательной адсорбцией за-
ряженных или полярных частиц одной фазы на поверхности другой с обра-
зованием двойного электрического слоя.
Рассмотрим
механизм возникновения электродного потенциала. Элек-
тродом называется металл, погруженный в раствор электролита. Что же про-
исходит на поверхности металла при погружении его в раствор собственных
ионов?
В металле и растворе имеются одинаковые ионы – ионы металла. В ме-
талле эти ионы находятся в узлах кристаллической решетки и удерживаются
в ней благодаря энергии
связи ионов решетки. Чтобы вывести ион из кри-
сталлической решетки, необходимо затратить работу, равную энергии связи
ионов, которую также можно назвать работой выхода иона из металла.
В растворе ионы металла окружены полярными молекулами воды, т. е.
находятся в гидратированном состоянии. Чтобы вывести ион металла из рас-
твора необходимо совершить работу,
равную энергии гидратации, т. е. энер-
гии связи иона металла с молекулами воды.
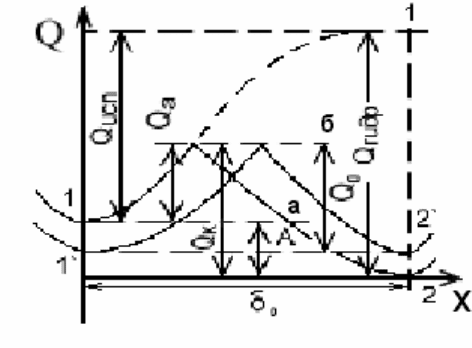
13
Рис. 2.1 Схема изменения энергии при испарении катиона металла в вакуум
и при переходе в раствор: а – момент погружения металла в
раствор его соли; б – момент установления равновесия
Установление электродного потенциала на металле зависит от соотно-
шения энергии кристаллической решетки и энергии гидратации ионов. На-
ходящиеся на поверхности металла катионы имеют запас потенциальной
энергии, отвечающей значению энергии в точке 1 (нижняя) на рис. 2.1. От-
рыв катиона от поверхности металла с переходом в вакуум требует значи-
тельной энергии (пунктирная кривая 1-1),
соответствующей энергии испаре-
ния Q
исп
. Полярные молекулы воды (или другого растворителя), ориентиру-
ясь вокруг поверхностных катионов металла, облегчают переход катионов в
раствор с освобождением энергии гидратации, так как уровень энергии гид-
ратированного иона ниже, чем катиона в вакууме, на величину Q
гидр
. По-
тенциальная энергия катионов, находящихся в растворе, в пределах двойного
электрического слоя отвечает точке 2.
Для перехода в раствор поверхностный катион металла должен преодо-
леть лишь энергетический барьер Q
а
. Разность уровней потенциальных энер-
гий в точках 1 и 2, равная А, соответствует работе процесса перехода ионов
металла в раствор. Для перехода из раствора в металл гидратированный ка-
тион должен преодолеть энергетический барьер Q
к
.
Согласно теории А.Н. Фрумкина, при взаимодействии металла и рас-
твора протекают два сопряженных процесса:
1. Переход ионов из металла в раствор с образованием гидратированных
ионов (анодный процесс):
Me + mН
2
O = Ме
n+
· mН
2
O + ne.
Скорость этого процесса, измеренная числом ионов, переходящих из
одной фазы в другую через единицу поверхности в единицу времени, может
быть выражена через плотность тока
i
r
.
14
2. Переход ионов из раствора с выделением их на поверхности металла
в виде нейтральных атомов, входящих в состав кристаллической решетки
металла (катодный процесс):
Ме
n+
· mН
2
O + ne = Ме + mН
2
O.
Скорость катодного процесса выражается через соответствующую
плотность тока
i
s
. Какой из этих процессов преобладает, определяется уров-
нем потенциальной энергии катионов в узлах кристаллической решетки ме-
талла U
Ме
и в растворе U
р
.
Если U
Ме
> U
р
, то преобладает анодный процесс, суммарная скорость
которого i
а
=
i
r
–
i
s
. Раствор получает избыточный положительный заряд в
виде катионов металла, а поверхность металла приобретает избыточный от-
рицательный заряд оставшихся электронов. Переход части катионов в рас-
твор сопровождается снижением средней потенциальной энергии поверхно-
стных катионов (точка 1 перемещается вниз до точки 1′), появлением на ме-
таллической поверхности избыточных отрицательных зарядов и повыше-
нием
энергетического барьера Q
а
. Повышение концентрации ионов у по-
верхности металла сопровождается ростом потенциальной энергии (точка 2
перемещается вверх до точки 2′), приобретением раствором избыточного по-
ложительного заряда и снижением энергетического барьера Q
к
. По мере уве-
личения концентрации катионов у поверхности, с ростом величины заряда
раствора и металла, затрудняется протекание прямого процесса и облегчает-
ся протекание обратного процесса, т. е. переход ионов металла из раствора в
кристаллическую решетку.
Когда энергетические уровни ионов на поверхности металла и в раство-
ре становятся одинаковыми, т. е
. U
Ме
= U
р
, устанавливается динамическое
равновесие. Равновесие характеризуется тем, что Q
к
= Q
а
= Q
о
и скорости
анодного и катодного процессов также равны:
i
r
= i
s
= i
о
, где i
о
— плотность
тока обмена.
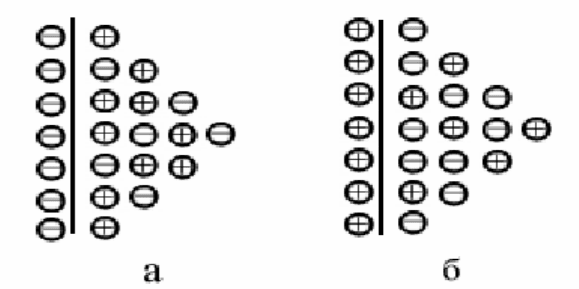
15
Рис. 2.2 Двойной электрический слой системы: а – Zn/ZnSO
4
; б – Cu/CuSO
4
Вследствие электростатического притяжения катионов и избыточных
электронов на поверхности металла ионы металла не могут удалиться вглубь
раствора, а находятся у поверхности. Образуется двойной электрический
слой (рис.2.2,а). Разность электрических потенциалов, возникающая на гра-
нице металл — раствор, вследствие избыточных зарядов, называется элек-
тродным потенциалом.
Если U
Ме
< U
р
, то потенциальная энергия катиона в металле меньше по-
тенциальной энергии гидратированного иона. Тогда в начальный момент
происходит не растворение, а осаждение металла из раствора, суммарная
скорость которого i
к
= i
s
– i
r
. При этом поверхность металла приобретает из-
быточный положительный заряд катионов, a оставшийся в приэлектродном
пространстве избыток анионов сообщает ему отрицательный заряд. Положи-
тельный заряд поверхности металла затрудняет дальнейшее осаждение ка-
тионов и облегчает обратный процесс — переход ионов металла из решетки
в раствор. В результате в системе устанавливается динамическое равновесие
и возникает
двойной электрический слой с противоположным распределени-
ем зарядов, т. е. поверхность металла заряжается положительно, а в растворе
у поверхности металла образуется избыток анионов (рис.2.2,б).
Таким образом, независимо от энергетических соотношений, наступает
динамическое равновесие между металлом и раствором его соли, которое
характеризуется определенным по величине и знаку равновесным потенциа-
лом.
2.2 Равновесные и неравновесные электродные потенциалы
16
При погружении металлов в раствор любого электролита возникает
электродный потенциал. Если в установлении потенциала принимают уча-
стие только собственные ионы металла (заряды переносятся только ими), то
такой потенциал называют равновесным, или обратимым (рис. 2.3, а). Вели-
чина равновесного электродного потенциала зависит от природы металла и
растворителя, температуры, активности ионов металла в
растворе.
Равновесные потенциалы металлов, определенные для активности ионов
металла в растворе, равной единице, при температуре 25°С, называют стан-
дартными электродными потенциалами. Стандартные электродные потен-
циалы можно рассчитать по изменению изобарно – изотермических потен-
циалов электродных процессов, отнесенных к 1 молю металла и выраженных
в вольтах:
ΔG = – nFE; E = – (ΔG/nF). (2.1)
По известным значениям энергии Гиббса реакции (ΔG) можно рассчи-
тать величину электродного потенциала. Уравнение (2.3) показывает пре-
вращение химической энергии в электрическую и обратно.
Значения стандартных электродных потенциалов для некоторых метал-
лов приведены в табл.2.1.
Ряд металлов, расположенный по возрастанию положительных значе-
ний стандартных электродных потенциалов, называется рядом напряжений.
Положение металла
в ряду определяет его химическую активность, окисли-
тельные и восстановительные свойства. Чем более отрицательное значение
потенциала имеет металл, тем в большей степени возрастает его способность
к окислению.
Таблица 2.1
Электрод
K
+
⏐K↔
Al
3+
⏐Al↔ Ti
2+
⏐Ti↔
Mn
2+
⏐Mn↔Zn
2+
⏐Zn↔
↔Cr
3+
⏐Cr
E
0
, В - 2,925 - 1,66 - 1,63 - 1,18 - 0,762 - 0,74
Электрод
Fe
2+
⏐Fe
2H
+
⏐H
2
↔ Cu
2+
⏐Cu
Hg
2+
⏐Hg
Pd
2+
⏐Pd
Pt
2+
⏐Pt↔
E
0
, В - 0,447 0,000
+ 0,337
+ 0,799 + 0,987 + 1,19
Зависимость равновесного электродного потенциала от активности ио-
нов металла в растворе и температуры определяется формулой Нернста:
+
+=
n
Me
anFRTEE ln)/(
0
(2.2)
где E
0
— стандартный электродный потенциал металла, В; Т — температура
измерения потенциала, К; n — степень окисления металла; F — число Фа-
17
радея, 96500 Кл; R — универсальная газовая постоянная, 8,31 Дж/К; а — ак-
тивность ионов металла в растворе, г-ион/л.
Подставив значения всех констант (при Т = 298 К) в формулу 2.2, полу-
чим:
+
+=
n
Me
anEE lg)/059,0(
0
(2.3)
Пример. Определить потенциал медного электрода в растворе CuSO
4
,
если а
Cu
2+
= 0,001г-ион/л, E
0
= + 0,337 В:
E = 0,337 + (0,059/2) lg 10
–3
= 0,337 – 0,088 = + 0,249 (В).
Во многих практических случаях на металлах (медь, ртуть, серебро) ус-
танавливаются равновесные, или обратимые, потенциалы. Абсолютные зна-
чения стандартных потенциалов определить экспериментально и вычислить
теоретически не представляется возможным. В связи с этим их определяют
по отношению к стандартному водородному электроду, потенциал которого
условно принят равным нулю.
Если в установлении
электродного потенциала принимают участие не
только собственные ионы металла, но и другие ионы и атомы, то возникают
неравновесные, или необратимые, потенциалы. Условием образования не-
равновесного потенциала является равенство скоростей переноса зарядов в
прямом и обратном направлениях, т. е. баланс заряда, но баланс массы при
этом не соблюдается, так как в передаче
зарядов принимают участие различ-
ные частицы (рис. 2.3, б).
Рис. 2.3 Схема установления потенциалов: а – равновесного; б – неравновесного.
18
Устойчивое во времени значение необратимого электродного потен-
циала металла, соответствующее равенству сумм скоростей анодных и ка-
тодных процессов, называют стационарным потенциалом металла. Металл
преимущественно растворяется, а баланс зарядов, переносимых в обратном
направлении, компенсируется ионами металла и другими частицами, напри-
мер переходом Н
+
из раствора в газовую фазу.
Таким образом, при установлении на металле необратимого электродно-
го потенциала может происходить электрохимическое растворение металла
Me + mH
2
O → Me
n+
mH
2
O+ne (анодный процесс)
и восстановление какого-либо деполяризатора (иона или молекулы), на-
ходящегося в растворе, напрмер, ионов водорода:
H
+
H
2
O + e → H + H
2
O (катодный процесс).
К необратимым электродным потенциалам относятся потенциалы мно-
гих металлов в растворах собственных ионов (никель, железо, хром, титан и
др.). Для неравновесных потенциалов формула Нернста неприменима, так
как электродный потенциал определяется несколькими параллельными реак-
циями.
Величины необратимых электродных потенциалов металлов зависят как
от внутренних факторов, связанных с природой металла,
так и от внешних,
связанных с составом электролита и физическими условиями. К внутренним
факторам относятся: физико-химическое состояние и структура металла, со-
стояние поверхности, наличие механических деформаций и напряжений и
др. Внешние факторы — это химическая природа растворителя, природа и
концентрация растворенных газов, температура, давление, перемешивание
раствора и др.
Неравновесные электродные потенциалы
определяются только опыт-
ным путем. В табл.2.2 приведены опытные значения стационарных потен-
циалов ряда металлов в нейтральных средах.
Таблица 2.2
Потенциал Al Zn Cr Fe Ni Cu
E
0
, В - 1,66 - 0,762 - 0,74 - 0,44 - 0,23 + 0,337
19
E
стац.
3% NaCl
- 0,63 - 0,83 + 0,23 - 0,50 - 0,02 + 0,05
E
стац.
1%
Na
2
SO
4
- 0,47 - 0,81 - - 0,5 + 0,035 + 0,24
Для решения вопроса, является ли потенциал данного металла в каком-
либо электролите обратимым или необратимым, следует сопоставить теоре-
тическое значение, рассчитанное по уравнению (2.3), и значение электродно-
го потенциала металла, полученное опытным путем.
2.3 Строение двойного электрического слоя
Как было показано ранее, на границе металл – раствор образуется двой-
ной электрический
слой. Ионы, скопившиеся у поверхности металла при ус-
тановлении равновесия, не могут покинуть приэлектродный слой и удалить-
ся от него вглубь раствора. Этому препятствует электростатическое притя-
жение между ионами и избыточным зарядом на поверхности металла. Одна-
ко двойной электрический слой может образоваться и без перехода заряжен-
ных частиц из фазы
в фазу. В этом случае образование двойного слоя воз-
можно за счет избирательной адсорбции ионов одной фазы на поверхности
другой, например специфическая адсорбция анионов хлора из водного раст-
вора соли на поверхности какого-либо инертного металла. Это приводит к
появлению в прикатодном слое избыточного отрицательного заряда и поло-
жительного заряда в
близлежащем слое раствора.
Строение двойного слоя и изменение потенциала с увеличением рас-
стояния от поверхности металла для растворов, не содержащих поверхност-
но-активных веществ, показаны на рис.2.4,а; для растворов, содержащих по-
верхностно-активные анионы — на рис.2.4,б. Согласно теории Штерна,
двойной электрический слой подразделяется нa плотную часть δδ
0
, толщина
которой равна среднему радиусу ионов электролита, и диффузную часть, где
концентрация ионов постепенно падает, достигая концентрации, свойствен-
ной данному раствору в целом.

20
а б
Рис. 2.4 Строение двойного электрического слоя: а – при отсутствии в растворе
поверхностно-активных веществ; б – при их наличии
Величина электродного потенциала складывается из потенциалов плот-
ной ψψ и диффузной ψζ′ частей двойного слоя:
g
LM
=ψ ψψ + ζ′ψ′. Общая толщина двойного слоя слагается из толщины,
приблизительно равной радиусу сольватированного иона (плотная часть
двойного слоя), и толщины диффузной части двойного слоя: μμ = δδ
0
+ λλ.
Толщина диффузной части двойного слоя зависит от природы и особен-
но от концентрации раствора. В чистой воде толщина диффузной части
уменьшается, а с повышением температуры, вследствие теплового движения
раствора — увеличивается.
По теории Штерна, в плотной части двойного слоя ионы удерживаются
не только электростатическими силами, но и силами специфической адсорб
-
ции, т. е. силами некулоновского происхождения. Поэтому в растворах, со-
держащих поверхностно – активные ионы, их число в плотной части двойно-
го слоя может быть не эквивалентным заряду поверхности металла, а пре-
восходить его на некоторую величину, зависящую от свойств ионов и заряда
металла.
Таким образом, следует различать две модели двойного
электрического
слоя, одна из которых относится к растворам, не содержащим поверхностно-
активных веществ (рис.2.4,а), другая — к растворам, содержащим специфи-
чески адсорбирующиеся ионы (рис.2.4,б).
