Протопопов А.В., Комарова Н.Г. Лабораторный практикум по коллоидной химии
Подождите немного. Документ загружается.


1
Министерство образования и науки Российской Федерации
ГОУ ВПО «Алтайский государственный технический
университет им. И.И. Ползунова»
А.В.Протопопов, Н.Г.Комарова
Лабораторный практикум по коллоидной химии
Методическое пособие
Барнаул 2011

2
Протопопов А.В., Комарова Н.Г. Лабораторный практикум по
коллоидной химии: Методическое пособие / А.В. Протопопов, Н.Г. Комарова;
Алт. гос. техн. ун-т им. И.И.Ползунова.- Барнаул: Изд-во АлтГТУ, 2011. – 68 с.
Методическое пособие содержит указания к выполнению лабораторных
работ по курсу «Коллоидная химия» («Поверхностные явления и дисперсные
системы»), теоретический материал для самостоятельной работы студентов и
вопросы и задания для контроля знаний.
Рассмотрено и одобрено
на заседании кафедры ТППиЭ
Протокол № 7 от 10.03.2011
3
Содержание
Введение .................................................................................................................................... 5
1 Коллоидное состояние вещества ........................................................................................ 5
2 Поверхностный слой ........................................................................................................... 6
3 Свободная поверхностная энергия. Поверхностное натяжение ....................................... 7
4 Адгезия и когезия ................................................................................................................ 8
5 Смачивание .......................................................................................................................... 9
6 Адсорбция .......................................................................................................................... 11
7 Адсорбция Гиббса ............................................................................................................. 12
8 Поверхностно-активные вещества .................................................................................... 13
9 Адсорбция поверхностно-активных веществ ................................................................... 14
10 Уравнение Шишковского. Правило Траубе ..................................................................... 15
11 Поверхностная активность. Работа адсорбции ................................................................ 16
12 Адсорбция на твердых адсорбентах ................................................................................. 17
12.1 Уравнение Ленгмюра ..................................................................................................... 17
12.2 Уравнение Фрейндлиха .................................................................................................. 19
12.3 Полимолекулярная (потенциальная) теория адсорбции Поляни.................................. 20
12.4 Теория полимолекулярной адсорбции БЭТ .................................................................. 21
13 Адсорбционное понижение прочности. Эффект Ребиндера ........................................... 22
Лабораторная работа №1. Адсорбция ПАВ на твердом абсорбенте ..................................... 25
Вопросы ................................................................................................................................... 26
Задания .................................................................................................................................... 27
14 Получение коллоидных растворов. Лиофильные и лиофобные коллоидные растворы . 28
15 Образование и строение заряженных коллоидных частиц .............................................. 31
16 Очистка коллоидных систем ............................................................................................. 34
17 Теории строения двойного электрического слоя ............................................................. 35
18 Электрокинетические явления .......................................................................................... 37
19 Устойчивость дисперсных систем .................................................................................... 39
20 Коагуляция лиофобных дисперсных систем .................................................................... 43
21 Защита коллоидных частиц и сенсибилизация ................................................................ 45
Лабораторная работа №2. Получение коллоидных систем конденсационными методами . 47
Лабораторная работа №3. Очистка коллоидных систем ....................................................... 48
Лабораторная работа №4. Определение знака заряда золя методом капиллярного анализа 48
4
Лабораторная работа №5. Определение электрокинетического потенциала методом
электрофореза .......................................................................................................................... 49
Лабораторная работа 6. Определение порога коагуляции ..................................................... 50
Лабораторная работа 7. Определение защитного числа желатины для золя Fе(ОН)
3
.......... 51
Лабораторная работа 8. Взаимная коагуляция золей ............................................................. 51
Вопросы для самоподготовки и контроля. ............................................................................. 52
Задания. ................................................................................................................................... 52
22 Общая характеристика высокомолекулярных соединений ............................................. 54
23 Растворы полимерных электролитов. Изоэлектрическая точка ...................................... 54
24 Белки – природные полиамфолиты .................................................................................. 55
25 Влияние рН на структуру и свойства растворов белка .................................................... 57
26 Оптические свойства коллоидных систем........................................................................ 59
26.1 Рассеяние света ................................................................................................................ 59
26.2 Абсорбция света .............................................................................................................. 61
27 Оптические методы исследования коллоидных систем .................................................. 62
28 Фотоэлектроколориметр ФЭК-56 ..................................................................................... 62
Порядок работы на приборе ФЭК-56 ..................................................................................... 63
Лабораторная работа 9. Определение изоэлектрической точки казеина .............................. 64
Вопросы для самоподготовки и контроля. ............................................................................. 65
Список использованной литературы ...................................................................................... 66

5
Введение
Коллоидная химия возникла в середине XIX века. В 1861 г известный английский
химик Томас Грэм (1805-1869 гг) изучал диффузию различных веществ в водных растворах.
Он обнаружил, что некоторые вещества (желатин, агар-агар и др.) диффундируют в воду и
проходят через полупроницаемые перегородки во много раз медленнее, чем, например, соли
и кислоты. Кроме того, эти вещества при пересыщении растворов не кристаллизуются, а
формируют студнеобразную клейкую массу. По древнегречески клей называется «колла», и
эти «особые» вещества Грэм назвал «коллоидами». Так появилось название науки
«коллоидная химия». На основе своих опытов Грэм выдвинул весьма смелую гипотезу о
существовании в природе двух диаметрально противоположных классов химических
веществ – «кристаллоидов» и «коллоидов». Эта идея вызвала большой интерес многих
ученых, и во второй половине XIX века коллоидная химия стала развиваться очень быстро и
плодотворно, причем основное внимание уделялось именно химическим аспектам. В эти
годы были открыты многие вещества с типично коллоидными свойствами. Вместе с тем
были разработаны различные методы очистки и стабилизации коллоидов (неорганических,
органических и белковых веществ), созданы оригинальные и высокочувствительные методы
для измерения размеров частиц, поверхностного натяжения чистых жидкостей и растворов,
скорости электрофореза и ряда других параметров коллоидных систем. Однако по мере
открытия все новых коллоидных систем гипотеза Грэма утрачивала свою значимость.
В начале ХХ века было установлено, что любое вещество может быть получено в
виде коллоида и, следовательно, нужно говорить не о коллоидных веществах, а о
коллоидном состоянии как о всеобщем особом состоянии материи (это было
сформулировано впервые П. П. Веймарном).
Согласно определению, данному П. А. Рeбиндером, коллоидная химия – это
физикохимия дисперсных систем и поверхностных явлений в этих системах.
В других химических дисциплинах свойства вещества рассматриваются на двух
уровнях организации материи: макроскопическом (свойства сплошных фаз) и молекулярном
(строение и свойства отдельных молекул). В коллоидной химии речь идет о дисперсном
(раздробленном) состоянии вещества, когда его частицы крупнее молекул, но меньше
макроскопических тел.
1 Коллоидное состояние вещества
В коллоидном состоянии обычно существуют все реальные тела. Поэтому можно
говорить о коллоидном состоянии вещества как о всеобщем особом состоянии материи.
Коллоидное состояние вещества – это такое состояние, в котором вещество находится в
высокодисперсном (сильно раздробленном) виде, отдельные его частицы являются не
молекулами, а агрегатами, состоящими из множества молекул. Таким агрегатам могут быть
приписаны все термодинамические свойства фазы. Молекулы среды, в которой
диспергированы коллоидные частицы, образуют другую фазу.
Основными признаками коллоидного состояния вещества являются:
1. Дисперсность – определенная степень раздробленности (~1 нм-1 мкм) вещества
хотя бы в одном из трех измерений, при которой система приобретает ряд специфических
свойств, не присущих (или выраженных незначительно) макроскопическим телам того же
химического состава.
2. Наличие в системе двух или более фаз, ограниченных поверхностью раздела
(гетерогенность, многофазность).
Понятие «коллоид» применимо к любой системе, удовлетворяющей указанным
признакам, независимо от ее химического состава, структурно-фазового и агрегатного
6
состояния, а также морфологии. Таким образом, основными признаками коллоидных систем
являются гетерогенность и дисперсность.
В 1934 г Н.П. Песков в книге «Физико-химические основы коллоидной науки» писал:
«Коллоидная система есть система гетерогенная, т. е. многофазная. С этой многофазностью
коллоидных систем и с тем фактом существования у них поверхности раздела связаны все
самые существенные и самые характерные свойства коллоидов. Поэтому все те явления и
закономерности, которые имеют место на поверхности раздела фаз, приобретают для нас
большое значение, а, следовательно, требуют специального изучения...»
2 Поверхностный слой
Фаза - часть системы одного состава, имеющая одинаковые физические свойства,
ограниченная от других частей поверхностью раздела. Систему, состоящую из одной фазы,
а, следовательно, имеющую одинаковые макроскопические свойства во всех ее точках,
называют гомогенной. Гетерогенная система состоит из двух и более фаз.
В отличие от геометрического понятия поверхности, поверхность раздела фаз в
коллоидной химии – это граничная область между фазами, слой определенной толщины, в
котором происходит изменение различных свойств от значений, характерных для одной
фазы, до значений, характерных для другой.
Итак, поверхность раздела фаз – это не просто граница, не имеющая толщины. На
границе раздела фаз формируется поверхностный слой (межфазная поверхность) толщиной
в один или несколько молекулярных размеров (диаметров). Термодинамические параметры
межфазной поверхности отличаются от аналогичных параметров объемной фазы того же
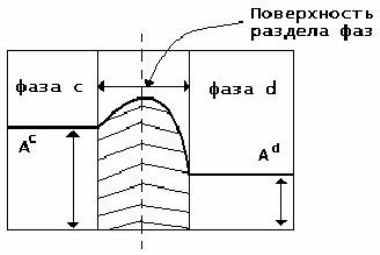
вещества, как это проиллюстрировано на рисунке 1. Например, такая характеристика, как
структура поверхности жидкости будет отличаться от структуры жидкости во внутреннем
объеме. П.А. Ребиндер отмечал, что поверхностные слои каждой фазы толщиной около
0,5 мм обладают особыми свойствами, так как находятся в поле действия сил соседней фазы.
А
с
и А
d
– значение свойства
соответственно в фазах с и d.
Рисунок 1 – Поверхностный слой и изменение физико-химических свойств на его
границе
Дисперсность - коллоидное состояние характеризуется определенной дисперсностью
(раздробленностью) вещества. Вещество в этом состоянии диспергировано до очень малых
частиц или пронизано мельчайшими порами. Эти частицы и поры невидимы в оптическом
микроскопе, но превышают по размерам обычные молекулы. Поскольку раздробленное
вещество находится всегда в какой-либо среде, свойства его нельзя рассматривать в отрыве
от этой среды.
Мерой дисперсности могут служить либо поперечник частиц а, либо обратная ему
величина 1/а = D (дисперсность), либо удельная поверхность S
уд
= S
1,2
/V , т.е. площадь
раздела фаз S
1,2
, приходящаяся на единицу объема дисперсной фазы V. Все эти величины
взаимосвязаны. Чем меньше размеры частиц, тем больше дисперсность или удельная
поверхность.
7
Понятие дисперсность нецелесообразно распространять на гомогенные
(молекулярные) растворы. Понятие дисперсности применимо лишь к крупным
(относительно обычных молекул) частицам и макромолекулам.
Коллоидные системы состоят из двух (или более) фаз: дисперсной фазы
(совокупность частиц или пор) и дисперсионной среды, т.е. они являются гетерогенными
системами. Таким образом, коллоиды - это не вещества, а гетерогенные системы,
содержащие вещества в высокодисперсном состоянии.
3 Свободная поверхностная энергия. Поверхностное натяжение
В коллоидных (ультрамикрогетерогенных) системах, имеющих огромную
поверхность раздела между фазами и обладающих большим запасом свободной
поверхностной энергии, большую роль играют процессы, происходящие на поверхности.
Свободная поверхностная энергия – та часть свободной энергии системы, которая
обусловлена наличием межфазной поверхности. Источником поверхностной энергии
являются силы межмолекулярного взаимодействия, нескомпенсированные в поверхностном
слое (вследствие различной энергии ван-дер-ваальсова взаимодействия молекул
поверхностного слоя с молекулами смежной фазы и между собой).
При обратимом изменении площади поверхности (S) в изобарно-изотермических
условиях изменение энергии Гиббса (G) системы определяется выражением:
dG = ζ∙dS (3.1)
где ζ - удельная величина свободной поверхностной энергии (свободная энергия
Гиббса единицы площади поверхности), измеряется в Дж/м
2
или Н/м.
Можно показать, что удельная свободная поверхностная энергия численно равна силе
поверхностного натяжения, действующей на единицу длины контура, ограничивающего
поверхность, и стремящейся сократить поверхность раздела фаз (физическое толкование
поверхностного натяжения (измеряется в Н/м)). Величина поверхностного натяжения ζ
легко определяется экспериментально.
Молекулы конденсированных фаз, находящиеся в поверхности раздела, обладают
избыточной энергией по сравнению с молекулами в объеме из-за нескомпенсированности их
межмолекулярных взаимодействий (энергетический смысл поверхностного натяжения
(измеряется в Дж/м
2
)). Нескомпенсированность межмолекулярных взаимодействий, в свою
очередь, обусловлено различием состава и строения контактирующих фаз. Это порождает
возникновение на поверхности раздела поверхностных сил и избытка энергии –
поверхностной энергии.
Наиболее просто связь между поверхностными свойствами и термодинамическими
характеристиками контактирующих фаз проявляется для однокомпонентных двухфазных
систем (например, жидкость на границе с ее насыщенным паром).
На поверхности раздела фаз молекулы испытывают сильное притяжение со стороны
жидкой фазы и почти никакого притяжения со стороны паровой фазы. Равнодействующая
сил направлена в сторону жидкости и стремится втянуть молекулы внутрь жидкой фазы. Эта
равнодействующая сила называется внутренним молекулярным давлением. Его причиной
является межмолекулярное взаимодействие, и чем оно больше, тем больше внутреннее
давление. Так, для воды оно равно 15∙10
8
Па, а для бензола – 3,8∙10
5
Па. Вы видите, таким
образом, что для обеих жидкостей внутреннее давление довольно велико. Именно поэтому
жидкости малосжимаемы.
Две вышеупомянутые фазы (жидкость и пар) могут существовать в равновесии только
при наличии устойчивой границы раздела между ними, не проявляющей тенденции к
самопроизвольному увеличению, то есть термодинамически устойчивой (при данных
температуре и объеме системы). С макроскопической точки зрения это означает, что с

8
поверхностью связана некоторая энергия, так что общая энергия системы не является
суммой энергии двух объемных фаз, а включает еще и избыточную энергию,
пропорциональную площади поверхности раздела фаз:
ss
ds
dG
G
s
(основное уравнение коллоидной химии)(3.2)
Следует учитывать, что данное уравнение действительно только для индивидуального
чистого вещества. Входящая в это уравнение величина G
S
– это удельная (приходящаяся на
единицу площади) поверхностная энергия. Наличие на поверхности раздела фаз избытка
энергии означает, что для образования новой поверхности нужно совершить работу, поэтому
величина ζ одновременно представляет собой работу обратимого изотермического
образования единицы поверхности; эту величину также называют поверхностным
натяжением. Поверхностное натяжение можно трактовать и как силу, действующую
тангенциально к поверхности раздела фаз и препятствующую ее увеличению.
Реальная межфазная граница имеет поверхностный слой конечной толщины, в
пределах которого термодинамические параметры (концентрация компонентов, давление,
температура и др.) испытывают резкие изменения. П.А. Ребиндер отмечал, что
поверхностные слои каждой фазы толщиной около 0,5 нм обладают особыми свойствами,
так как находятся в поле действия молекулярных сил соседней фазы. Частица дисперсной
фазы не может состоять из одних лишь поверхностных слоев, она должна иметь «ядро»,
содержащее однородную массу вещества. В этом случае размер частицы во всех трех
измерениях должен превышать, по крайней мере, удвоенную толщину поверхностного слоя,
то есть 1 нм, что составляет нижний предел размера коллоидных частиц.
По Гиббсу межфазную поверхность следует рассматривать как конечный по толщине
слой (рисунок 1), в котором осуществляется переход от свойств, характерных для одной
фазы, к свойствам, характерным для другой. Этот неоднородный по свойствам
поверхностный слой Гиббс назвал физической поверхностью разрыва.
4 Адгезия и когезия
В гетерогенных системах различают два типа межмолекулярного взаимодействия:
внутрифазное и межфазное. Притяжение атомов и молекул внутри отдельной фазы называют
когезией (от лат. cohaesus – связанный, сцепленный). Именно она определяет возможность
существования веществ в конденсированном состоянии.
К межфазным взаимодействиям относятся понятия адгезии, смачивания и растекания.
Адгезия (от лат. adhaesio – прилипание) – взаимодействие между приведенными в контакт
поверхностями конденсированных фаз разной природы. Адгезия обеспечивается
физическими или химическими силами взаимодействия. Смачивание и растекание – это
адгезионные взаимодействия между жидким и твердым телом.
Явления адгезии и смачивания широко распространены в природе и технологических
процессах: склеивание различных материалов, нанесение лаков, красок, металлических
покрытий, печать, крашение тканей, изготовление различных материалов на основе
связующих веществ (стеклопластики, резина, бетон и т. д.).
На рисунке 2 проиллюстрировано понятие когезии и адгезии, где 1 – газообразная
фаза (воздух), 2 – первая конденсированная фаза, 3 – вторая конденсированная фаза.
Рисунок 2 – Схема, иллюстрирующая понятия когезии (а) и адгезии (б)
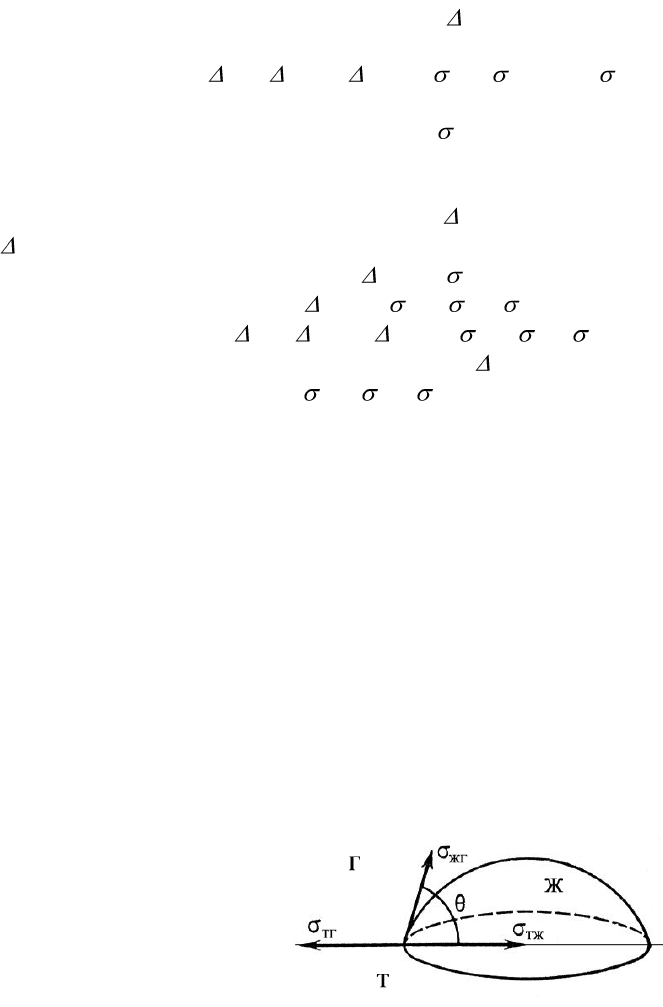
9
Чтобы разорвать столбик жидкости с образованием двух новых поверхностей раздела
(см. рисунок 2 а), необходимо затратить работу, которая равна работе когезии, но
противоположна по знаку:
W
разр
= – G (4.1)
Изменение энергии Гиббса в этом процессе:
G = G
кон
– G
нач
=
12
+
12
– 0 = 2
12
(4.2)
–W
разр
= W
к
(4.3)
W
к
= 2
12
(4.4)
Работа, затрачиваемая на разрыв поверхностного слоя (см. схему б), будет равна
работе адгезии с обратным знаком:
–W
разр
= G, (4.5)
где G – изменение энергии Гиббса в процессе разрушения адгезионного слоя.
G
нач
=
13
(4.6)
G
кон
=
32
+
12
–
13
(4.7)
G = G
кон
– G
нач
=
32
+
12
–
13
(4.8)
–W
разр
= W
а
= G (4.9)
W
а
=
32
+
12
–
13
(уравнение Дюпре) (4.10)
5 Смачивание
Смачивание — это поверхностное явление, заключающееся во взаимодействии
жидкости с твердым или другим жидким телом при наличии одновременного контакта трех
несмешивающихся фаз, одна из которых обычно является газом (воздухом). Степень
смачивания количественно характеризуется безразмерной величиной косинуса краевого
угла, или просто краевым углом (углом смачивания).
При нанесении небольшого количества жидкости, например, капли, на поверхность
другой жидкости, имеющей большую плотность, или на поверхность твердого тела можно
наблюдать два процесса, если приводимые в контакт вещества взаимно нерастворимы. В
одном случае нанесенная жидкость остается на поверхности другой фазы в виде капли,
принявшей при установившемся равновесии определенную форму. В другом случае капля
растекается по поверхности. Капля на поверхности твердого тела представляет собой
трехфазную систему: фаза Ж – жидкость капли, фаза Г – воздух, фаза Т – твердое тело:
Поверхностная энергия твердого тела, стремясь уменьшиться, растягивает каплю по
поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с
воздухом ζ
т,г
. Межфазная энергия на границе твердого тела с жидкостью ζ
ж,т
стремится
наоборот, сжать каплю, то есть поверхностная энергия уменьшается за счет снижения
площади поверхности. Растеканию препятствуют когезионные силы, действующие внутри
капли. действие когезионных сил направлено от границы между твердой, жидкой и
газообразной фазами по касательной к сферической поверхности капли и равно ζ
ж,г
(силы
гравитации не учитываются). Угол ζ, который образован касательными к межфазным
поверхностям ограничивающим смачивающую жидкость и имеет вершину на линии раздела
трех фаз, называется углом смачивания. Так как поверхностное натяжение можно
рассматривать как энергию, приходящую на единицу площади, или как силу, действующую
на еденицу длины, то все эти составляющие поверхностной энергии можно выразить с
помощью векторов сил. При равновесии между ними соблюдается следующее соотношение:

10
т,г
=
ж,т
+
ж,г
cos (5.1)
Полученное соотношение называется законом Юнга. Отсюда количественную
характеристику смачивания как косинус краевого угла можно выразить через поверхностные
межфазные натяжения следующим образом:
ГЖ
ТЖГТ
,
,,
cos
(5.2)
Важно отметить, что при выводе закона Юнга предполагается взаимное равновесие
между всеми фазами. Отсюда следует, что в результате установления равновесия между
парами жидкости и поверхностью твердого тела на последней образуется адсорбционная
пленка, снижающая поверхностное натяжение твердого тела
Различают три случая контактного взаимодействия жидкостей с поверхностью
твердых тел: 1) несмачивание, когда 180° > > 90° (например, ртуть на стекле, вода на
парафине); 2) ограниченное смачивание, когда 90° > > 0° (например, вода на оксидах
металлов); 3) полное смачивание, когда капля растекается в тонкую пленку (ртуть на
свинце). Измеряемые на практике краевые углы часто отличаются от термодинамически
равновесных значений . Эти расхождения обусловлены главным образом дефектами
поверхности твердого тела: шероховатостями (микрорельеф), химической неоднородностью
(гетерогенность), наличием пор, локальными деформациями вблизи линий смачивания (они
достаточно заметны при смачивании тел с малыми модулями упругости). Шероховатость и
другие дефекты твердой поверхности приводят к тому, что краевой угол смачивания зависит
от условии формирования, например при натекании жидкости на "сухую" подложку и при
оттекании жидкости с предварительно смоченной поверхности, это явление называют –
гистерезис смачивания. Полного несмачивания, то есть такого положения, когда краевой
угол равен 180°, практически никогда не наблюдается, так как при соприкосновении
конденсированных тел поверхностная энергия всегда уменьшается и ζ
ж,т
не может оставаться
равной сумме ζ
т,г
+ ζ
ж,г
.
Разные жидкости неодинаково смачивают одну и ту же поверхность. Согласно
приближенному правилу лучше смачивает поверхность та жидкость, которая ближе по
полярности к смачиваемому веществу (она сильнее с ним взаимодействует) и имеет меньшее
поверхностное натяжение.
При нанесении на поверхность твердого тела двух жидкостей, нерастворимых друг в
друге, между ними образуется краевой угол, характеризующий относительную способность
этих жидкостей смачивать данное тело, то есть избирательность смачивания. Очевидно,
что та жидкость, которая лучше смачивает поверхность, обладает большим избирательным
смачиванием по отношению к данному веществу (его поверхности).
При нанесении капли жидкости на твердую поверхность возможно явление
растекания капли, при условии:
ТГ
>
ТЖ
.
Следует также принять во внимание, что в этом процессе увеличивается энергия на
границе жидкость–газ и поэтому можно ожидать остановку процесса растекания при
достижении равенства
ТГ
–
ТЖ
и
ЖГ
·cosθ, или неограниченное растекание, если
ТГ
–
ТЖ
>
ЖГ
·cosθ.
Если
ТГ
<
ТЖ
может произойти стягивание капли. В первом случае происходит
смачивание, а во втором – несмачивание твердого тела жидкостью.
Это уравнение называется уравнением Юнга-Дюпре:
2
cos1
к
а
W
W
(5.3)
Таким образом, смачивание, характеризующееся косинусом краевого угла θ,
определяется отношением работы адгезии к работе когезии для смачивающей жидкости.
Растекание жидкости с меньшим поверхностным натяжением по жидкости с большим
поверхностным натяжением — проявление эффекта Марангони. Под этим эффектом
