Ушакова И.П., Брагина Н.А., Миронов А.Ф. Методы галогенирования в тонком органическом синтезе
Подождите немного. Документ загружается.


28
ROH H
+
ROH
2
ROH
2
R
+
H
2
O
R
+
Hal
RHal
Для первичных спиртов характерно бимолекулярное нуклео-
фильное замещение по механизму S
N
2:
Hal
-
ROH
2
[ Hal
-
.......R......OH
2
]
RHal
H
2
O
Метод пригоден для получения хлор-, бром- и йодпроизвод-
ных алканов. Скорость реакции зависит от природы галогено-
водорода и строения спирта. Реакционная способность HHal
возрастает в ряду: HCl<HBr<HI, а спиртов – в ряду: первич-
ный < вторичный < третичный.
В качестве катализаторов используют протонные кислоты
(H
2
SO
4
) и кислоты Льюиса (ZnCl
2
).
CH
2
CH CH
2
OH
HBr
H
2
SO
4
CH
2
CH CH
2
Br
4.3. Взаимодействие галогеноводородов с простыми эфи-
рами.
I
OCH
3
HI
∆
OH
CH
3
Расщепление простой эфирной связи происходит таким обра-
зом, что водород присоединяется к атому кислорода, а гало-
ген, обычно иод, к атому углерода. Таким образом, анализи-
руя количество алкилиодида, определяют наличие и число
алкоксильных групп в соединении.
21
нирование - выделяющийся в процессе реакции галогеново-
дород окисляют до молекулярного галогена и вновь
исполь-
зуют в реакции:
RH
RBr
HBr
Br
2
H
2
O
2
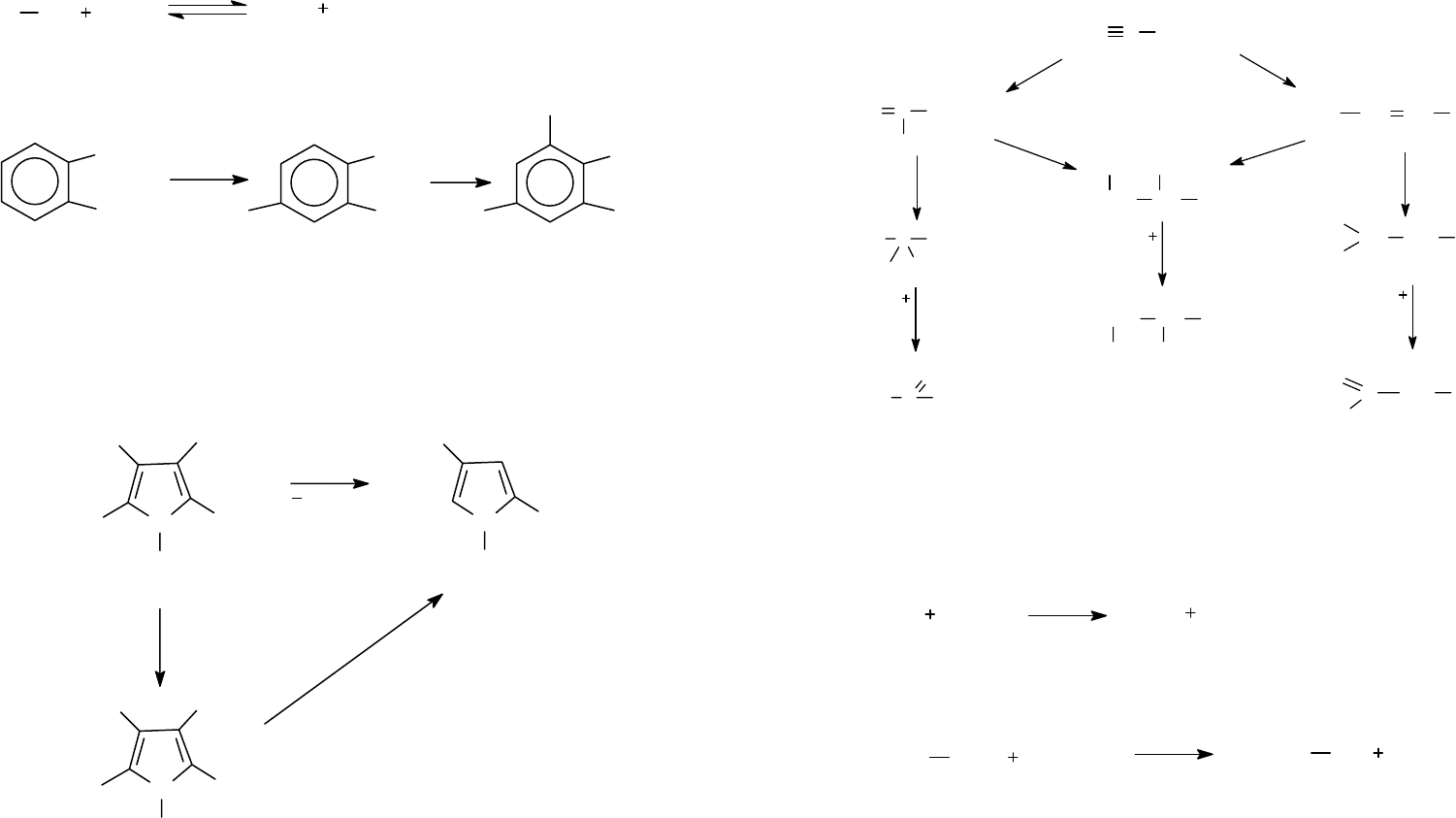
2.3. Иодирование.
2.3.1. Присоединение йода по кратным связям.
Осуществляется при комнатной или более низкой температу-
ре:
CH
2
CH
2
I
2
60
o
ICH
2
CH
2
I
Выход 98%.
Атомы йода по размеру больше, чем атомы брома, поэтому
наличие при двойной связи даже двух заместителей препятст-
вует дальнейшему присоединению йода:
HC CH
I
2
CC
I
H
H
I
2.3.2. Замещение под действием молекулярного йода.
Молекулярный йод менее реакционноспособен, чем хлор и
бром. Для увеличения скорости реакции замещения атома во-
дорода на йод связывают образующийся йодоводород, добав-
ляя в реакционную смесь основный реагент (Na
2
CO
3
,
NaHCO
3
, Ca(OH)
2
), соли серебра, ртути, либо окислитель, на-
пример, иодноватую кислоту:
5 HI
HIO
3
3 I
2
H
2
O
3
22
Замещение водорода на йод в алканах протекает медленно,
реакция является обратимой:
RH
I
2
RI
HI
Замещение водорода и карбоксильной группы на йод в арома-
тических соединениях:
OH
COOH
I
2
HgO
OH
COOHI
I
2
OH
II
I
Йодирование часто используют как способ удаления
карбоксильной группы из ароматических соединений. Напри-
мер, прямое декарбоксилирование пирролдикарбоновой ки-
слоты проходит с небольшим выходом, а через йодпроизвод-
ные – почти с количественным выходом:
N
H
3
C
COOH
CH
3
HOOC
H
∆
CO
2
N
H
3
C
CH
3
H
I/KI
N
H
3
C
I
CH
3
I
H
H
2
/Pd
27
Например:
H
3
O
HBr
HC C CH
2
CH
3
HBr
R
2
O
2
FeCl
3
Br CH CH C
2
H
5
H
2
CCC
2
H
5
Br
HBr
FeCl
3
HBr
R
2
O
2
CH
3
CCH
2
CH
3
Br Br
CH
3
CCH
2
CH
3
O
гидролиз
CH
2
CH C
2
H
5
Br Br
гидролиз
CCH
2
C
2
H
5
O
H
CH CH
2
C
2
H
5
Br
Br
гидролиз
CH
2
CH C
2
H
5
OH OH
HBr
R
2
O
2
HBr
FeCl
3
H
3
O
H
3
O
4.2. Взаимодействие галогеноводородов со спиртами.
Реакция представляет нуклеофильное замещение гидроксиль-
ной группы на галоген.
ROH
HCl RCl
H
2
O
Для вторичных и третичных спиртов нуклеофильное замеще-
ние протекает по механизму S
N
1:
(CH
3
)
3
COH HCl
(газ)
20
o
(CH
3
)
3
CCl H
2
O

26
Hal
CH
2
CH
2
Hal
CH
2
CH
2
(∆H
1
)
Hal CH
2
CH
2
HHal
Hal (∆H
2
)CH
2
CH
3
Hal
Табл. 3. Энтальпия присоединения галогеноводородов к
этилену.
∆ H, ккал/моль
Hal
присоединения Hal· роста цепи
HCl - 26 + 5
HBr - 5 - 11
HI + 7 - 27
Радикальное присоединение легче всего протекает в случае
HBr. Для стимулирования радикального присоединения реак-
ции проводят в присутствии пероксидов, инициирующих го-
молитические реакции, в результате чего образуются менее
разветвленные алкилгалогениды (правило Хараша):
CH
2
CH CH
3
HBr
R
2
O
2
Br CH
2
CH
2
CH
3
При гетеролитическом (электрофильном ) присоединении га-
логеноводородов реализуется правило Марковникова, соглас-
но которому образуется наиболее разветвленный алкилгало-
генид. Скорость электрофильного присоединения увеличива-
ется в присутствии кислот Льюиса:
CH
2
CH CH
3
HBr
FeCl
3
CH
3
CH
Br
CH
3
Хлороводород легче присоединяется по ионному, чем по ра-
дикальному механизму.
Совокупность реакций присоединения по ионному и по ради-
кальному механизмам позволяет получить набор разнообраз-
ных соединений.
23
2.3.3. Замещение хлора и брома на йод.
Реакция Финкельштейна.
ClCH
2
COOH
NaI
ICH
2
COOH
NaCl
(Br)
Реакция является обратимой, но проведение процесса в аце-
тоне или метилэтилкетоне, в которых йодид натрия раство-
рим, а хлорид натрия выпадает в осадок, позволяет сместить
равновесие в сторону образования йодпроизводного.
2.3.4. Получение алкилйодидов из спиртов.
6
3
62
ROH
2P
I
2
RI H
3
PO
4
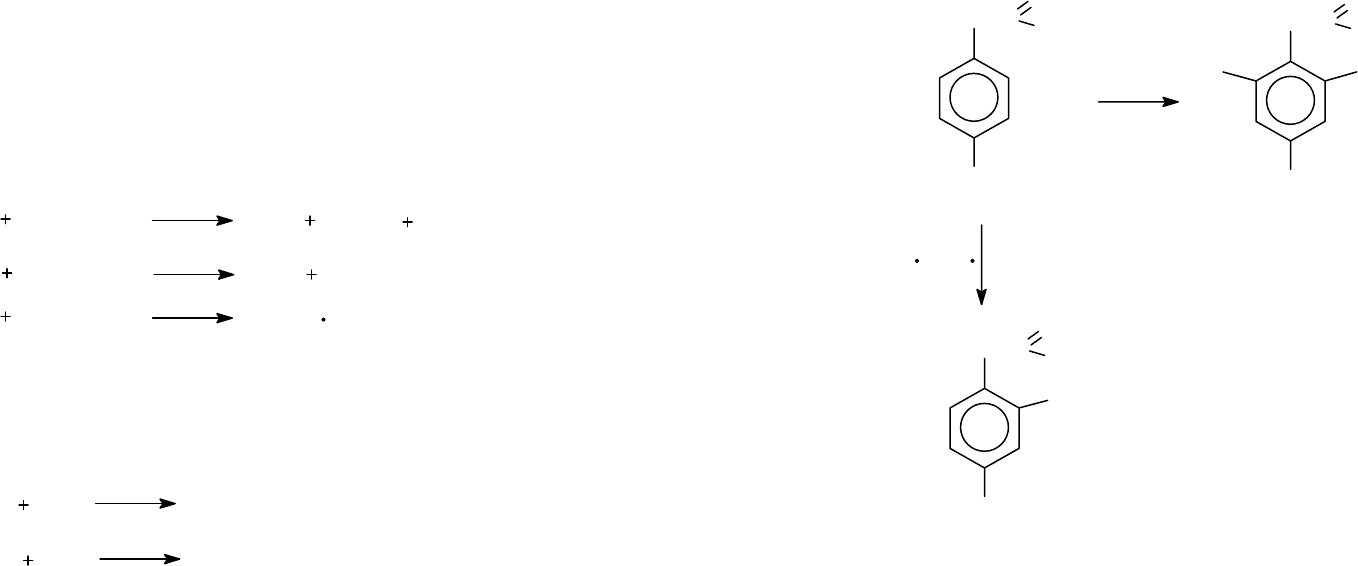
2.3.5. Реакция Бородина - Хунсдиккера.
Под действием йода (и других галогенов) проводят декарбок-
силирование серебряных солей карбоновых кислот в безвод-
ных органических растворителях с образованием соответст-
вующих алкилгалогенидов:
CF
3
COOAg I
2
76
o
CCl
4
CF
3
I
CO
2
AgI
CF
3
C
O
OAg
I
2
CF
3
C
O
OI
AgI
CF
3
C
O
OI
CF
3
CO
2
I
CF
3
I
CF
3
I
CF
3
C
O
OI
CO
2
I
Механизм реакции:
24
Метод используют в основном для алифатических соедине-
ний.
2.3.6. Удаление остатка молекулярного йода после
окончания реакции.
Проводят с использованием восстанавливающих агентов
(SO
2
, NaHSO
3
), аналогично удалению хлора.
I
2
2 NaOH
NaI
NaOI H
2
O
H
2
S
HI
S
I
2
(Et)
3
N (
I
2
Et)
3
N I
2
2
3. ГАЛОГЕНИРОВАНИЕ СМЕШАННЫМИ
ГАЛОГЕНАМИ (ICl, IBr).
Cl
2
I
2
2
ICl
Br
2
I
2
2
BrIl
В зависимости от условий проведения реакции атом галогена
вступает в молекулу органического соединения либо по ради-
кальному, либо по ионному механизму. В первом случае мо-
лекула ICl выступает как хлорирующий агент (1), а при ион-
ном механизме – как иодирующий (2). При этом в силу высо-
кой поляризованности молекулы смешанного галогена иоди-
рование
протекает исключительно легко. Так, присоединение
иода к этилену в ряду I
2
, IBr, ICl протекает с относительными
скоростями 1 : 3000 : 100000.
25
I
(1)
(2)
и
NOC
NO
2
O
CH
3
ICl
10
o
NOC
NO
2
O
CH
3
II
NOC
NO
2
O
CH
3
Cl
200
o
Cl
4. ГАЛОГЕНИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ
ГАЛОГЕНОВОДОРОДОВ.
4.1. Присоединение галогеноводородов по кратной связи.
Легкость протекания реакций присоединения уменьшается в
ряду:
HF<HCl<HBr<HI.
Возможно гетеролитическое электрофильное и гомолитиче-
ское радикальное присоединение.
