Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

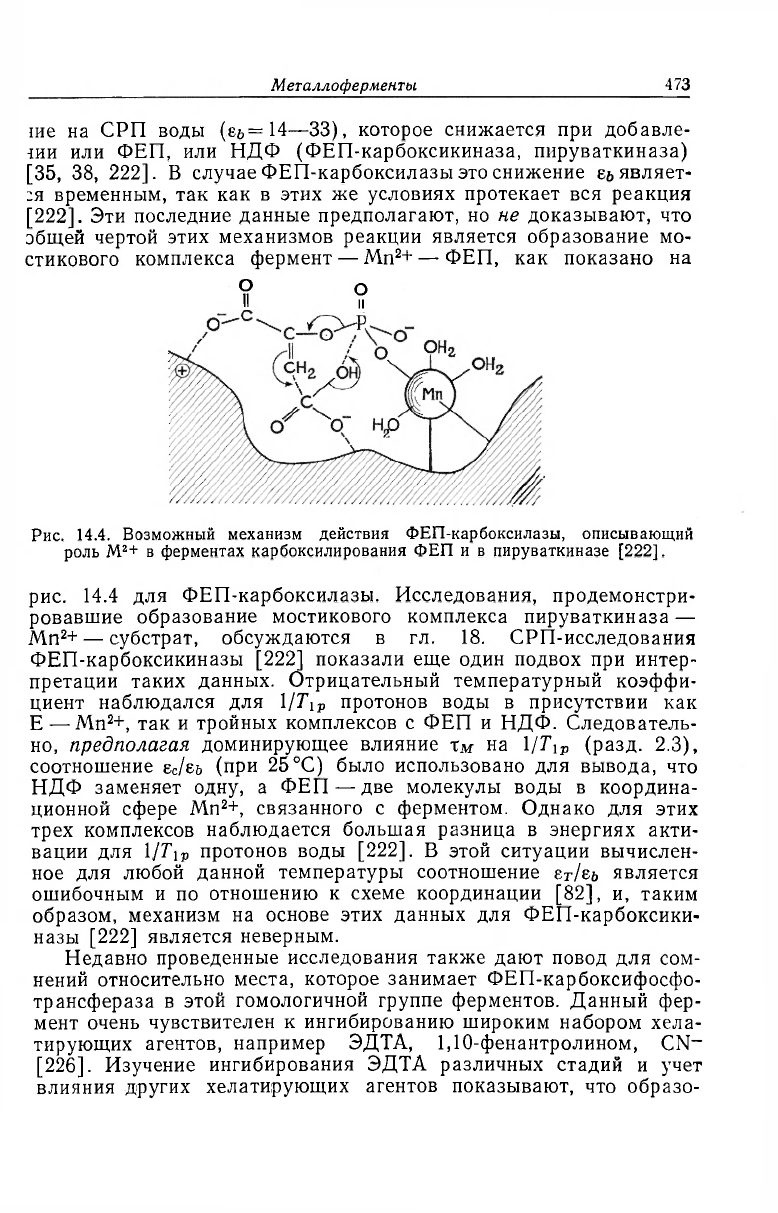
Металлоферменты. 473
ше на СРП воды (еб=14—33), которое снижается при добавле-
•ши или ФЕП, или НДФ (ФЕП-карбоксикиназа, пируваткиназа)
[35, 38, 222]. В случае ФЕП-карбоксилазы это снижение еьявляет-
:я временным, так как в этих же условиях протекает вся реакция
[222]. Эти последние данные предполагают, но не доказывают, что
общей чертой этих механизмов реакции является образование мо-
стикового комплекса фермент — Mn
2
+ —- ФЕП, как показано на
Рис. 14.4. Возможный механизм действия ФЕП-карбоксилазы, описывающий
роль M
2
+ в ферментах карбоксилирования ФЕП и в пируваткиназе [222].
рис. 14.4 для ФЕП-карбоксилазы. Исследования, продемонстри-
ровавшие образование мостикового комплекса пируваткиназа —
Mn
2
+ — субстрат, обсуждаются в гл. 18. СРП-исследования
ФЕП-карбоксикиназы [222] показали еще один подвох при интер-
претации таких данных. Отрицательный температурный коэффи-
циент наблюдался для XlTi
v
протонов воды в присутствии как
E — Mn
2
+, так и тройных комплексов с ФЕП и НДФ. Следователь-
но, предполагая доминирующее влияние х
м
на 1 IT
xv
(разд. 2.3),
соотношение е
с
/еь (при 25°С) было использовано для вывода, что
НДФ заменяет одну, а ФЕП — две молекулы воды в координа-
ционной сфере Mn
2
+, связанного с ферментом. Однако для этих
трех комплексов наблюдается большая разница в энергиях акти-
вации для Iyr
lp
протонов воды [222]. В этой ситуации вычислен-
ное для любой данной температуры соотношение ег/еь является
ошибочным и по отношению к схеме координации [82], и, таким
образом, механизм на основе этих данных для ФЕП-карбоксики-
назы [222] является неверным.
Недавно проведенные исследования также дают повод для сом-
нений относительно места, которое занимает ФЕП-карбоксифосфо-
трансфераза в этой гомологичной группе ферментов. Данный фер-
мент очень чувствителен к ингибированию широким набором хела-
тирующих агентов, например ЭДТА, 1,10-фенантролином, CN
-
[226]. Изучение ингибирования ЭДТА различных стадий и учет
влияния других хелатирующих агентов показывают, что образо-
O
О
11
Il

474
Г лава
10
вание комплекса фермент — ФЕП требует связанного иона метал-
ла [227]. Однако прямые попытки продемонстрировать присутст-
вие связанного металла в этих ферментах до сих пор давали лишь
двусмысленные и неопределенные результаты [228].
5.3. Рибулозо-1,5-дифосфаткарбоксилаза
Карбоксилирование рибулозо-1,5-дифосфата, в результате ко-
торого образуются 2 моля 3-фосфоглицерата [реакция (23)], ка-
тализируется ферментом, который, как принято считать, требует
активации ионом двухвалентного металла [229, 230] (однако см.
Андерсон и др. [231]):
м
2+
Рибулозо-1,5-дифосфат -f-CO
2
> 2,3-фосфоглицерат + H
+
(23)
Потенциальный ингибитор, 2-карбоксирибит-1,5-дифосфат (I), ко-
торый является аналогом предполагаемого промежуточного про-
дукта в реакции рибулозо-1,5-дифосфаткарбоксилазы (II) [232],
прочно связывается с ферментом только в присутствии M
2
+ [233]:
CH
2
OP CH
2
OP CH
2
OP
I I I
C(OH)COO- C(OH)COO" C(OH)CN
C=O H-C-OH н—с—он
I I I
н—с—он н—с—OH Н—С—OH
I
Л I
CH
2
OP CH
2
OP CH
2
OP
II I III
Однако прочное связывание рибулозо-1,5-дифосфата в присутствии
CN- [возможно, в виде аддукта рибулозо-1,5-дифосфатцианида
(III)] не требует присутствия M
2
+ [234]. Эти данные позволяют
предположить, что M
2
+ играет роль в стабилизации промежуточ-
ного соединения II в реакции рибулозо-1,5-дифосфаткарбоксилазы.
Более ранние сообщения об образовании стабильного комплекса
фермент — Mg
2
+—CO
2
не подтвердились [233].
Кроме того, было показано, что связанный Cu
2
+ является
структурным компонентом рибулозодифосфаткарбоксилазы из
шпината [236]. Этот связанный ион металла не играет непосред-
ственной роли в механизме катализа, так как его удаление не вы-
зывает уменьшения каталитической активности. Однако наблюда-
лись некоторые тонкие изменения при связывании природным
ферментом рибулозодифосфата плюс цианид или 2-карбоксирибит-
дифосфата по сравнению с ферментом, свободным от Cu
2
+ [233].
Следовательно, связанный Cu
2
+ участвует в поддержании конфор-
мации рибулозо-1,5-дифосфаткарбоксилазы.

Металлоферменты.
475
5.4. Декарбоксилазы
Помимо металлактивируемых оксалатдекарбоксилаз (разд.
>.1), имеется ряд других декарбоксилаз, которым необходима ак-
ивация M
2
+, например оротидин-5-фосфатдекарбоксилаза [237],
шридоксиндекарбоксилаза [238]. Роль ионов двухвалентных ме-
•аллов в механизме действия этих декарбоксилаз детально не ис-
:ледована. Однако следует заметить, что необходимость иона ме-
талла является скорее исключением, чем правилом среди фермен-
тов этого типа [239].
6. ТИАМИНПИРОФОСФАТЗАВИСИМЫЕ ФЕРМЕНТЫ
Ферменты, использующие ТДФ как кофактор, катализируют ре-
акции, в которых расщепление углерод-углеродной связи (или ее
синтез) сопровождается образованием аддукта между частью рас-
щепленного субстрата и ТДФ; примером могут служить ферменты
декарбоксилирования а-кетокислот, транскетолазы, фосфокетола-
зы, глиоксалаткарболигазы [240]. Для многих ТДФ-зависимых
ферментов требуется активация ионом M
2
+ [240], однако имеется
ряд примеров, где для работы ферментов этого типа либо вообще
не требуется присутствия ионов M
2
+, как, например, для транске-
толазы из печени крысы [241], бензоилформиатдекарбоксилазы
[242], либо проявляется только частичная зависимость активно-
сти от добавления M
2
+, как, например, для пируватдекарбоксила-
зы из ростков пшеницы [243], оксидазы а-кетокислот с разветвлен-
ной цепью [243а, 244]. Наблюдалось широкое разнообразие в ха-
рактере взаимодействия этих апоферментов с ТДФ и (или) M
2
+.
Эти кофакторы связываются очень прочно с некоторыми ТДФ-за-
висимыми ферментами, например с пируватдекарбоксилазой, и
удалить их можно только в специальных условиях [245]. В противо-
положность другим ферментам оксалил-КоА-декарбоксилаза и
глиоксалаткарболигаза, не проявляющие активности в отсутствие
ТДФ и M
2
+, связываются с кофакторами обратимо [246, 247а]. Ес-
ли фермент после отделения ТДФ оказывается лишенным связан-
ного M
2
+, как в случае с пируватдекарбоксилазой из ростков
пшеницы [243], нельзя сделать вывода, нужен ли M
2
+ наряду с
ТДФ для активации полученного апофермента.
Изучение пируватдекарбоксилазы [248] подтвердило предпо-
ложение о включении M
2
+ в образование комплекса фермент —
ТДФ [249]. После отделения природного фермента от ТДФ и Mg
2
+
холофермент может снова образоваться лишь при инкубации апо-
фермента с избытком ТДФ и M
2
+ [250]. Как скорость образова-
ния, так и стабильность полученного холофермента зависит от
природы иона двухвалентного металла, хотя каталитическая ак-

476
Г лава 10
тивность одинакова для всех изученных M
2
+ (Ca
2
+, Mg
2
+, Mn
2
+
/Ca
2+
Со
2
+). Например, комплекс E и образуется, и диссоциируе
Х
ТДФ
быстрее, чем соответствующий Mg
2
+-кoмплeкc [250], как и был
предсказано из изучения свойств простых комплексов этих ионо
металлов [84]. Исследование концентрационных зависимостей прс
цессов рекомбинации показало, что ТДФ и Mg
2
+ взаимодействую
независимо с апоферментом и первоначально образуется диссоци
ирующий тройной комплекс (IV), который затем в результате мед
ленной и квазинеобратимой реакции превращается в другой трой
ной комплекс (V), который и является каталитически активныл
холоферментом [251]:
,E-Mg
t
4
ТДФ ТДФ
E E <—" E (24)
Ч-ТДФ^
Х
М
2
а+ x
Mg
2t
IV V
Превращение IV в V можно блокировать действием ЭДТА [244].
Однако еще не определены ни природа медленной реакции прев-
ращения IV в V, ни какие-либо группы ТДФ, которые являются
лигандами по отношению к иону металла. Кроме того, неясно, при-
меним ли механизм реакции, предложенный в уравнении (24), к
другим ТДФ-зависимым ферментам, особенно к тем, в которых
этот кофактор легко диссоциирует, например к глиоксалаткарболи-
газе [246, 247], или же в этом случае ион металла не только облег-
чает связывание с ТДФ, но и играет какую-то дополнительную
роль в реакции.
7. ИЗОМЕРАЗЫ
7.1. Пентозизомеразы
Ферменты, катализирующие изомеризацию таких Сахаров, как
L- и D-арабиноза [252, 253], D-ксилоза [254], D -ликсоза [255] и
ь-рамноза [256], согласно уравнению (25), проявляют максималь-
ную активность только в присутствии иона двухвалентного метал-
ла, например Mn
2
+, и в большинстве случаев неактивны в отсутст-
вие M
2
+:
м
2
+
альдопентоза < > кетопентоза (25)
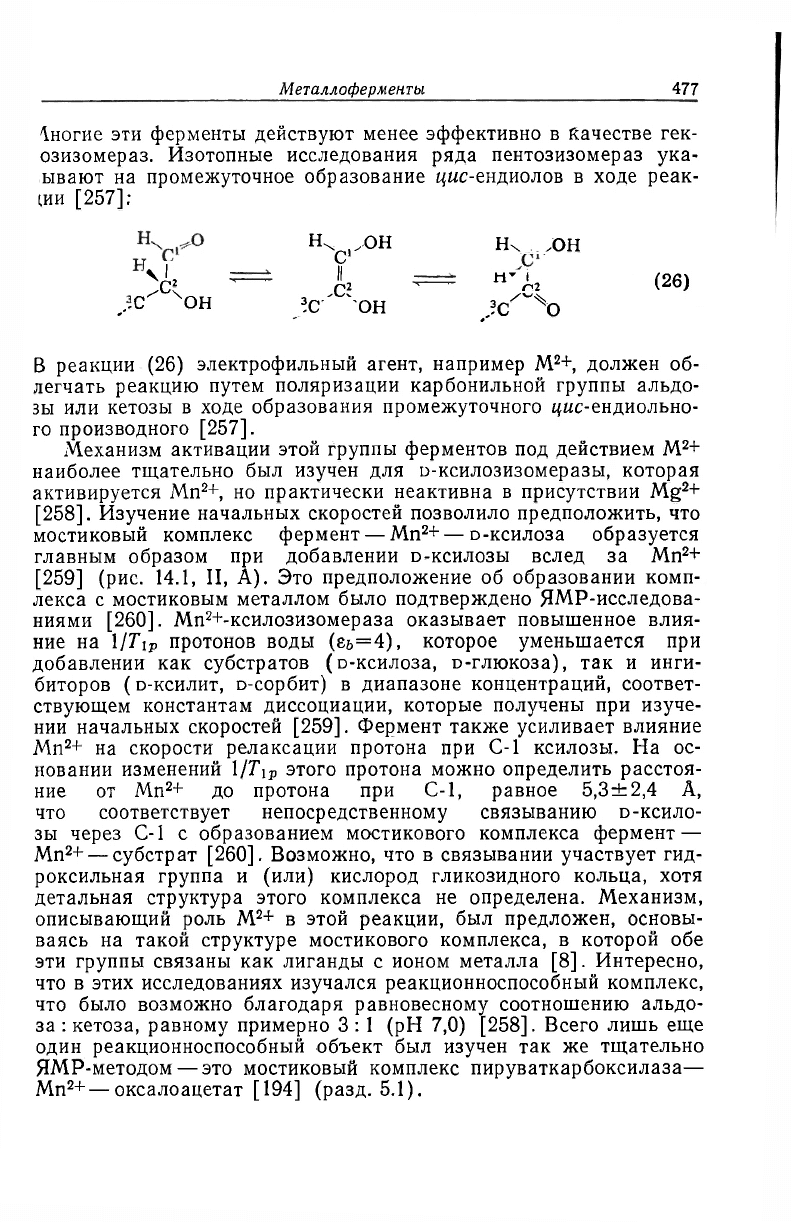
Металлоферменты.
477
!ногие эти ферменты действуют менее эффективно в Качестве гек-
озизомераз. Изотопные исследования ряда пентозизомераз ука-
ывают на промежуточное образование цыс-ендиолов в ходе реак-
ции [257]:
н>У
он н он
^ — I — W
,.-С
4
OH !с он X о
В реакции (26) электрофильный агент, например M
2
+, должен об-
легчать реакцию путем поляризации карбонильной группы альдо-
зы или кетозы в ходе образования промежуточного цыс-ендиольно-
го производного [257].
Механизм активации этой группы ферментов под действием M
2
+
наиболее тщательно был изучен для о-ксилозизомеразы, которая
активируется Mn
2
+, но практически неактивна в присутствии Mg
2
+
[258]. Изучение начальных скоростей позволило предположить, что
мостиковый комплекс фермент — Mn
2
+ — D-ксилоза образуется
главным образом при добавлении D-ксилозы вслед за Mn
2
+
[259] (рис. 14.1, II, А). Это предположение об образовании комп-
лекса с мостиковым металлом было подтверждено ЯМР-исследова-
ниями [260]. Мп
2+
-ксилозизомераза оказывает повышенное влия-
ние на I/Ti
p
протонов воды (еь=4), которое уменьшается при
добавлении как субстратов (D-ксилоза, D-глюкоза), так и инги-
биторов ( D-КСИЛИТ, D-сорбит) в диапазоне концентраций, соответ-
ствующем константам диссоциации, которые получены при изуче-
нии начальных скоростей [259]. Фермент также усиливает влияние
Mn
2
+ на скорости релаксации протона при C-I ксилозы. На ос-
новании изменений
1
/Т
Х
р этого протона можно определить расстоя-
ние от Mn
2
+ до протона при С-1, равное 5,3±2,4 А,
что соответствует непосредственному связыванию D-КСИЛО-
зы через C-I с образованием мостикового комплекса фермент —
Mn
2
+ —субстрат [260]. Возможно, что в связывании участвует гид-
роксильная группа и (или) кислород гликозидного кольца, хотя
детальная структура этого комплекса не определена. Механизм,
описывающий роль M
2
+ в этой реакции, был предложен, основы-
ваясь на такой структуре мостикового комплекса, в которой обе
эти группы связаны как лиганды с ионом металла [8]. Интересно,
что в этих исследованиях изучался реакционноспособный комплекс,
что было возможно благодаря равновесному соотношению альдо-
за : кетоза, равному примерно 3 : 1 (рН 7,0) [258]. Всего лишь еще
один реакционноспособный объект был изучен так же тщательно
ЯМР-методом — это мостиковый комплекс пируваткарбоксилаза—
Mn
2
+ — оксалоацетат [194] (разд. 5.1).

478
Г лава
10
Необходимо заметить, что п-ксилозизомераза обратимо дезак
тивируется при добавлении хелатирующих агентов, наприме
ЭДТА или 1,10-фенантролина [261], хотя и не доказано наличи
связанного иона металла в этом ферменте.
7.2. Гексозо- и пентозофосфатизомеразы
В противоположность пентозизомеразам большинство гексозо
или пентозофосфатизомераз полностью активны в отсутствие HOHOI
двухвалентных металлов, хотя в нескольких случаях изотопны*
исследования указывают на промежуточное образование цис-ен
диольного производного [261а]. Недавно фосфоманнозизомеразг
из дрожжей была строго идентифицирована как цинксодержащш
металлофермент, в котором ферментативная активность зависит от
присутствия связанного иона металла [262]. И хотя факт непосред-
ственного участия Zn
2
+ в механизме катализа не установлен, за-
манчивым является предположение, согласно которому этот ион
металла играет ту же роль, которая предложена для Mn
2
+ в реак-
циях, катализируемых D-ксилозизомеразой [8]. В противополож-
ность ферменту, выделенному из дрожжей, фосфоманнозизомера-
за из красных кровяных телец является металлактивируемым фер-
ментом [262а]. Это наблюдение, а также тот факт, что Zn
2
+ уско-
ряет неферментативную изомеризацию маннозо-6-фосфата во
фруктозо-6-фосфат [2626], должны помочь разъяснить роль M
2
+
в ферментативной реакции.
Другие гексозо- и пентозофосфатизомеразы, например фосфо-
глюкозизомераза [262, 263] и фосфорибозизомераза [264], не со-
держат связанного иона металла, хотя для фосфоглюкозизомеразы
[261а] было показано промежуточное образование ^ис-ендиольно-
го производного. Возможно, что в этих ферментах вместо M
2
+ име-
ется другой электрофильный центр.
7.3. Другие изомеразы
Описан ряд изомераз, действующих на другие субстраты и про-
являющих частичную необходимость в активации ионами двухва-
лентных металлов. Примером могут служить изопентилпирофосфа-
тизомераза [265], цис.цис-муконатлактоназа [266], оксалоацетат-
кетоенолтаутомераза [267] и манделатрацемаза [267а]. До сих
пор не проводилось детальных исследований по выяснению роли
ионов металлов в этих реакциях.
8.МУТАЗЫ И ТРАНСФЕРАЗЫ
8.1. Фосфоглюкомутаза и другие мутазы
Ферментам, которые катализируют реакции переноса между
двумя атомами углерода в гексозо- или пентозофосфатах (мута-
зы), необходим для активации ион двухвалентного металла, как
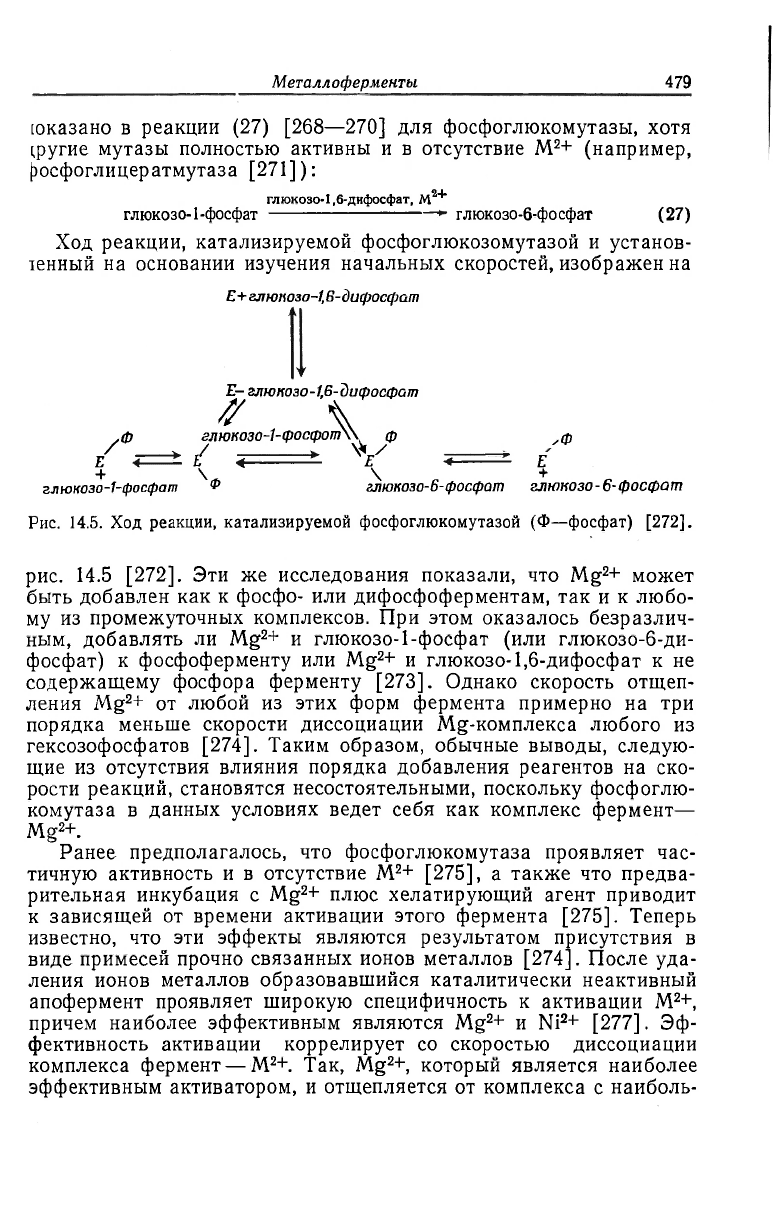
Металлоферменты.
479
[оказано в реакции (27) [268—270] для фосфоглюкомутазы, хотя
фугие мутазы полностью активны и в отсутствие M
2
+ (например,
|эосфоглицератмутаза [271]):
глюкозо-1,6-дифосфат, M
2+
глюкозо-1-фосфат глюкозо-6-фосфат (27)
Ход реакции, катализируемой фосфоглюкозомутазой и установ-
ленный на основании изучения начальных скоростей, изображен на
£+
глюпозо-1,В-дифосфат
E- глюкозо-1,6-дифосфат
ff
\
,ф глюкозо-1- фопфот\\ ф ф
/ <=± / <
x
V . E
+ N \ +
глюкозо-1-фосфат
ф
глюкозо-6- фосфат глюкозо-6-фосфат
Рис. 14.5. Ход реакции, катализируемой фосфоглюкомутазой (Ф—фосфат) [272].
рис. 14.5 [272]. Эти же исследования показали, что Mg
2
+ может
быть добавлен как к фосфо- или дифосфоферментам, так и к любо-
му из промежуточных комплексов. При этом оказалось безразлич-
ным, добавлять ли Mg
2
+ и глюкозо-1-фосфат (или глюкозо-6-ди-
фосфат) к фосфоферменту или Mg
2
+ и глюкозо-1,6-дифосфат к не
содержащему фосфора ферменту [273]. Однако скорость отщеп-
ления Mg
2
+ от любой из этих форм фермента примерно на три
порядка меньше скорости диссоциации Mg-комплекса любого из
гексозофосфатов [274]. Таким образом, обычные выводы, следую-
щие из отсутствия влияния порядка добавления реагентов на ско-
рости реакций, становятся несостоятельными, поскольку фосфоглю-
комутаза в данных условиях ведет себя как комплекс фермент—
Mg
2
+.
Ранее предполагалось, что фосфоглюкомутаза проявляет час-
тичную активность и в отсутствие M
2
+ [275], а также что предва-
рительная инкубация с Mg
2
+ плюс хелатирующий агент приводит
к зависящей от времени активации этого фермента [275]. Теперь
известно, что эти эффекты являются результатом присутствия в
виде примесей прочно связанных ионов металлов [274]. После уда-
ления ионов металлов образовавшийся каталитически неактивный
апофермент проявляет широкую специфичность к активации M
2
+,
причем наиболее эффективным являются Mg
2
+ и Ni
2
+ [277]. Эф-
фективность активации коррелирует со скоростью диссоциации
комплекса фермент — M
2
+. Так, Mg
2
+, который является наиболее
эффективным активатором, и отщепляется от комплекса с наиболь-

480
Г лава
10
шей скоростью [277]. Некоторые менее эффективные ионы, напри
мер Mn
2
+, Cd
2
+, Zn
2
+, взаимодействуют с фосфоглюкомутазой i
образованием двойных комплексов, которые проявляют себя Kai
металлоферменты, в противоположность двойному комплекс]
Mg
2
+ — фосфоглюкомутаза. Имеются данные, указывающие на не
большое различие в механизме катализа между металлактивируе'
мыми ферментами и металлоферментами в случае фосфоглюкому
тазы [277].
Попытки определить роль M
2
+ в реакциях, катализируемых
фосфоглюкомутазой, путем сравнения свойств различных металло-
фосфоглюкомутаз не имели успеха. Все изученные ионы металлов
давали одинаковые дифференциальные спектры при взаимодейст-
вии с апоферментом, и это взаимодействие сопровождалось неболь-
шими изменениями конформации фермента, что было показано
путем замены растворителя [278]. Дифференциальные спектры,
отвечающие образованию промежуточного комплекса (рис. 14.5),
изменяются при добавлении ионов металлов, причем степень изме-
нения этих спектров в районе тирозина обратна эффективности
активации различными M
2
+ [279].
Недавно были измерены скорости ядерной магнитной релакса-
ции протонов воды в присутствии как Мп(П)-фосфоглюкомутазы,
так и тройных комплексов этого фермента с различными субстра-
тами [279а]. Эти исследования показали, что при образовании
тройных комплексов координационные молекулы воды при Mn(II)
замещаются на прочно связывающиеся субстраты, например глю-
козофосфат или ксилозофосфат. Однако замены координационной
воды при Mn
2
+ не происходит, если образуется тройной комплекс
или с довольно прочно связанными субстратами, например с фрук-
тозофосфатом, галактозофосфатом или с неорганическим фосфа-
том, который является конкурентным ингибитором фосфоглюкому-
тазы [2796].
Эти исследования показали, что ион металла может играть как
непосредственную, так и непрямую роль в ориентации субстратов
в каталитическом центре, а также что активатор не принимает
прямого участия в каталитическом процессе. Однако, поскольку
фосфоглюкомутаза не проявляет активности в отсутствием
2
+[277],
очевидно, что для проявления каталитической активности необхо-
димо сохранение конформации активного центра, которая зависит
от присутствия M
2
+ [279].
8.2. Трансферазы
Описаны многие нуклеотидил- и пентозилтрансферазы, которым
необходима активация ионом двухвалентного металла [обычно
Mn
2
+ и (или) Mg
2
+] [280], однако нет исследований, проливающих
свет на роль иона металла в реакциях этого типа.

Металлоферменты 481
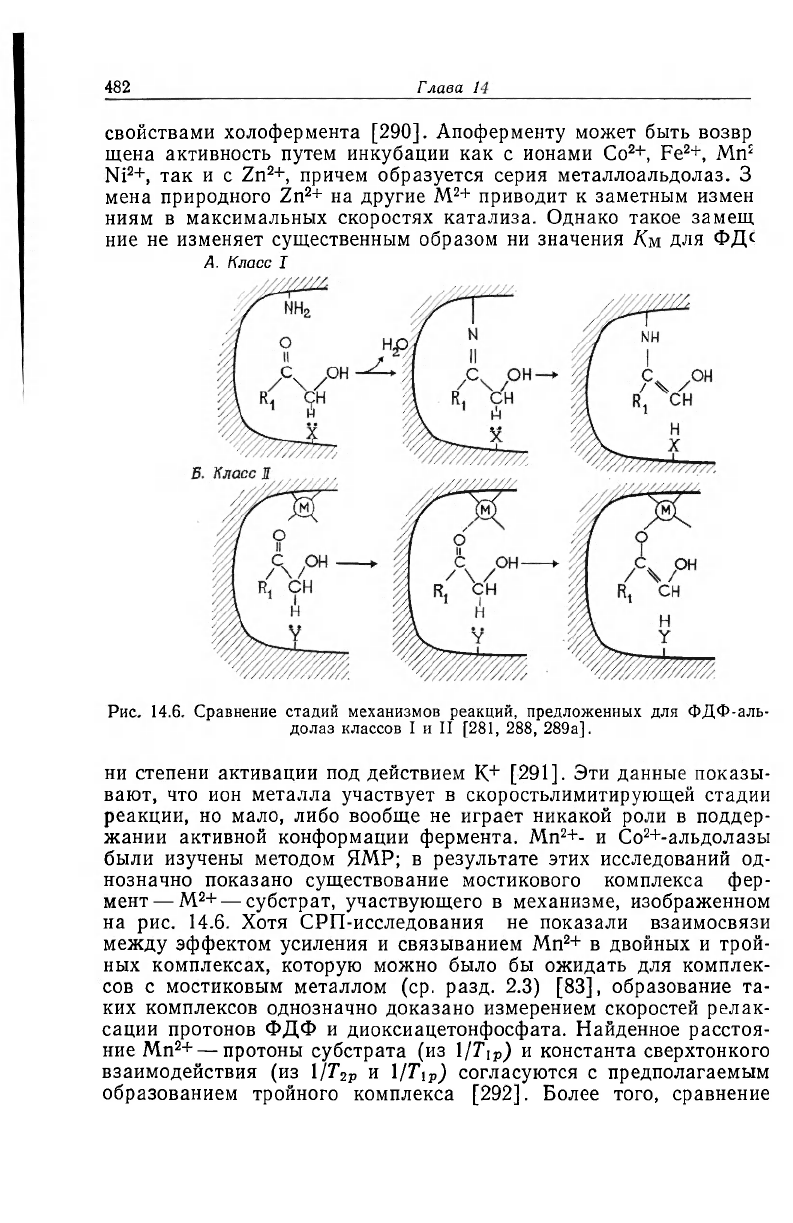
9. АЛ ЬДOJlАЗЫ
ФДФ-альдолазы, которые катализируют реакцию (28), могут
лть разделены на два основных класса.
ФДФ < > диоксиацетонфосфат
-j-
глицеральдегид-3-фосфат (28)
ласс II ФДФ-альдолаз, обнаруженный в грибах, бактериях,
рожжах и сине-зеленых водорослях, в значительной степени пи-
кируется в присутствии таких хелатирующих агентов, как ЭДТА
1,10-фенантролин [280, 281]. Подобное действие хелатирующих
гентов было объяснено участием связанных ионов металлов в ка-
ализе альдолазами класса II [281]. Это предположение подтверж-
ается тем фактом, что ФДФ-альдолаза из дрожжей содержит
вязанный цинк в соотношении примерно 2 г-атома на 1 моль фер-
[ента [282, 283]. Хотя большинство ФДФ-альдолаз класса II ведет
ебя как металлоферменты, некоторые ферменты этого класса об-
разуют менее стабильные комплексы с M
2
+ и могут быть выделены
I виде апоферментов. Так, для ФДФ-альдолаз, выделенных из Clo-
:tridium perfringens [284] и Anacystis nidulans [285], необходима
жтивация добавлением M
2
+, например Fe
2
+, Со
2
+.
В отличие от этого класса ФДФ-альдолазы класса I, характер-
гые для высших животных и растений, простейших и кишечнопо-
лостных, нечувствительны к ингибированию хелатирующими аген-
тами и не содержат связанного иона металла [280, 281]. ФДФ-аль-
долазы класса I проявляют типичную субстратзависимую
инактивацию при выдерживании комплекса фермент — диоксиаце-
тонфосфат в боргидриде [286]. Инактивация происходит в резуль-
тате восстановления основания Шиффа, которое образуется при
конденсации диоксиацетонфосфата с е-ЫН
2
-группой остатка лизина
в активном центре фермента [287]. В соответствии с этим механиз-
мом действия ФДФ-альдолаз класса I основания Шиффа играют
роль электрофильных центров и заменяют ион металла, который
играет эту роль в случае ФДФ-альдолаз класса II [281,
288]. Это предположительное сходство механизмов действия про-
иллюстрировано на рис. 14.6 и подтверждается тем, что ФДФ-аль-
долазы класса I и II катализируют сходные реакции обмена
3
H и
18
O в субстратах [288]. Сходство механизмов действия оснований
Шиффа и связанных с ферментом ионов металла, изображенное
на рис. 14.6, распространяется и на другие типы реакций, особен-
но на декарбоксилирование а-кетокислот [28, 289, 289а]. Для та-
кого сходства механизмов действия ФДФ-альдолаз необходимо,
чтобы ферменты класса II образовывали мостиковый комплекс
фермент
—-
M
2
+ — субстрат.
При удалении из ФДФ-альдолазы из дрожжей связанного цин-
ка с помощью диализа против ЭДТА получен каталитически не-
активный апофермент, молекулярные свойства которого сходны со
29—2451
482 Г лава
10
свойствами холофермента [290]. Апоферменту может быть возвр
щена активность путем инкубации как с ионами Со
2
+, Fe
2
+, Mn
2
Ni
2
+, так и с Zn
2
+, причем образуется серия металлоальдолаз. 3
мена природного Zn
2
+ на другие M
2
+ приводит к заметным измен
ниям в максимальных скоростях катализа. Однако такое замещ
ние не изменяет существенным образом ни значения Км для ФДс
А. Класс I
Рис. 14.6. Сравнение стадий механизмов реакций, предложенных для ФДФ-аль-
долаз классов I и II [281, 288, 289а].
ни степени активации под действием K
+
[291]. Эти данные показы-
вают, что ион металла участвует в скоростьлимитирующей стадии
реакции, но мало, либо вообще не играет никакой роли в поддер-
жании активной конформации фермента. Mn
2
+- и Со
2
+-альдолазы
были изучены методом ЯМР; в результате этих исследований од-
нозначно показано существование мостикового комплекса фер-
мент— M
2
+ — субстрат, участвующего в механизме, изображенном
на рис. 14.6. Хотя СРП-исследования не показали взаимосвязи
между эффектом усиления и связыванием Mn
2
+ в двойных и трой-
ных комплексах, которую можно было бы ожидать для комплек-
сов с мостиковым металлом (ср. разд. 2.3) [83], образование та-
ких комплексов однозначно доказано измерением скоростей релак-
сации протонов ФДФ и диоксиацетонфосфата. Найденное расстоя-
ние Mn
2
+ — протоны субстрата (из l/Ti
P
) и константа сверхтонкого
взаимодействия (из 1/Т
2р
и 1/Т\
р
) согласуются с предполагаемым
образованием тройного комплекса [292]. Более того, сравнение
