Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ
ДЕЙСТВИЯ ФЕРМЕНТОВ
221
Таблица
7.2
Соотношение
между
продуктами
катализируемого
а-химотрипсином
гидролиза
N-бензоилглициновых
эфиров
в 0,1 М растворе
гидроксиламина
[24, 25]
Эфир
Метиловый
Изопропиловый
Гомохолиновый
4-пиридинметило-
вый
Оксиаминолиз/Гидролиз
в присутствии
фермента
рй
6,6-6,8
0,37
0,38
0,37
0,37
в отсутствие
фермента
рН 12
0,99
0,29
1,73
3,03
Это четко указывает на наличие общего промежуточного соеди-
нения.
Второй подход состоит в измерении скорости образования
продуктов гидролиза определенного субстрата при разных кон-
центрациях акцептора. Это дает информацию о лимитирующей
стадии процесса и о природе промежуточного соединения.
Предположим, что лимитирующей стадией является образова-
ние
ацилфермента. В таком случае, поскольку акцептор реаги-
рует
с ацилферментом после лимитирующей стадии, он не может
увеличить скорость гидролиза эфира. Суммарная скорость об-
разования
продуктов
будет
такой, как показано на рис. 7.2. Если
лимитирующей стадией является гидролиз ацилфермента, то
акцептор
будет
увеличивать скорость этой реакции и, следова-
тельно, суммарную скорость образования продуктов (рис. 7.3).
Чтобы рассчитать кинетические параметры для распределе-
ния
промежуточного соединения, можно воспользоваться схе-
мой
(7.3) (для простоты предполагается, что нуклеофил N не
присоединяется к ферменту);
М
Н
2°]
Е
+ RCOOR'
E.RCOOR'
R'OH
->
RCO—Е
—
RCO
2
H
RCO-Л/
(7.3)
Применение
обычного подхода, используемого для реакций,
катализируемых химотрипсином [26], дает следующие выраже-
ния
ДЛЯ &cat И /См:
[Н
2
О]
+ fe
4
[Щ
(7.4)
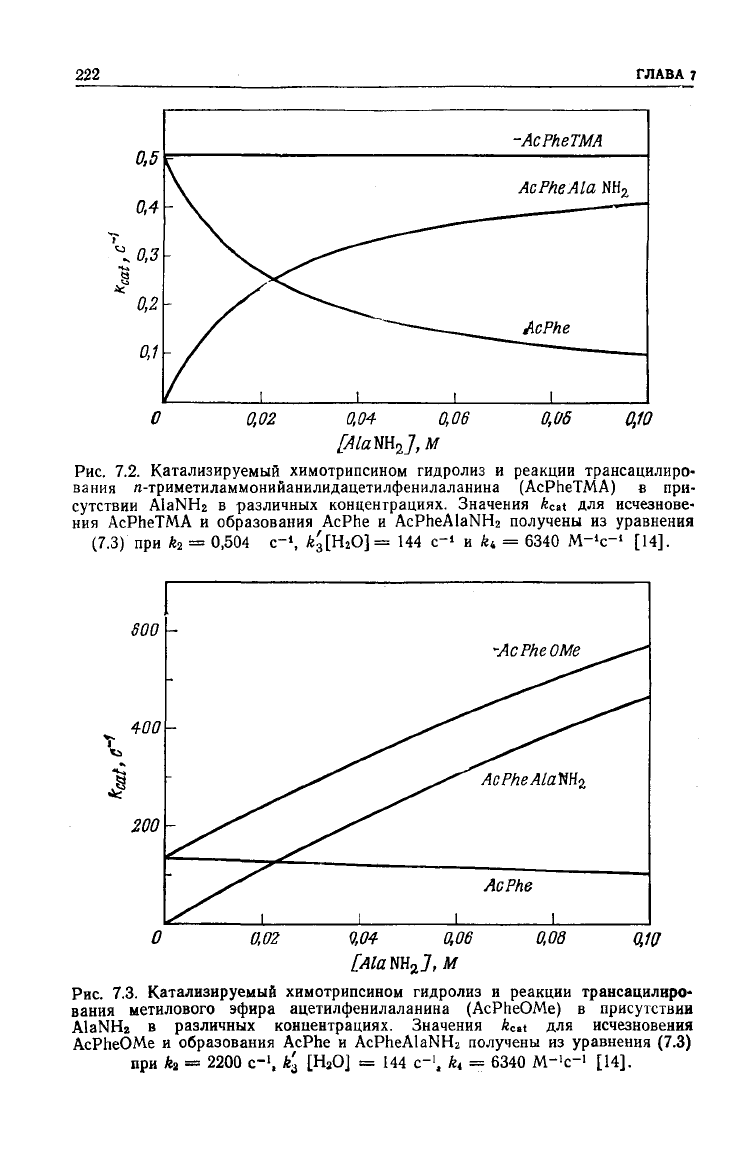
222
ГЛАВА
7
-AcPheTMA
AcPhe
Ala NH
2
0,06 0,10
Рис.
7.2. Катализируемый химотрипсином гидролиз и реакции трансацилиро-
вания
n-триметиламмонийанилидацетилфенилаланина (AcPheTMA) в при-
сутствии
AlaNH
2
в различных концентрациях. Значения k
ca
t для исчезнове-
ния
AcPheTMA и образования
AcPhe
и AcPheAlaNH
2
получены из уравнения
(7.3) при fe
2
=
0,504
с-
1
,
*з[
н
*°]
=
144 с
~'
и ki
=
6340
M
~
4
c~'
[И].
800 -
X
J
4-00 -
200 -
0,02
9,04 0,06
[Ala№
2
],M
0,08
Рис.
7.3. Катализируемый химотрипсином гидролиз и реакции трансацилиро-
вания
метилового эфира ацетилфенилаланина (AcPheOMe) в присутствии
AlaNHz в различных концентрациях. Значения
/s
C
at
для исчезновения
AcPheOMe и образования
AcPhe
и
AcPheAlaNbb
получены из уравнения (7.3)
при
к
2
=
2200
с-
1
, *з [HsO] = 144 с"
1
, k
t
=
6340
М->с-> [14].
КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ ДЕЙСТВИЯ ФГ.РМЕНТОВ
223
Для
реакции образования RCO
2
H
k
k
2
k'
3
[H
2
O]
cat
а
для образования RCO-N
*cat
=
[N\
k
2
+ k'
3
[HjO] + k
A
[N]
(7.5)
(7.6)
Значение
kc^i/KtA для исчезновения RCO
2
R' получается де-
лением
суммы
двух
значений k
C3
t [уравнения (7.5) и (7.6)] на
Км и равно kilKs. Напомним (гл. 3, разд. Е), что такое соотно-
шение
всегда справедливо для серии последовательных реакций,
следующих за стадией равновесного связывания. Это дает еще
один
способ выявления промежуточного соединения. Если реак-
ция
с участием нуклеофилов включает прямую атаку комплекса
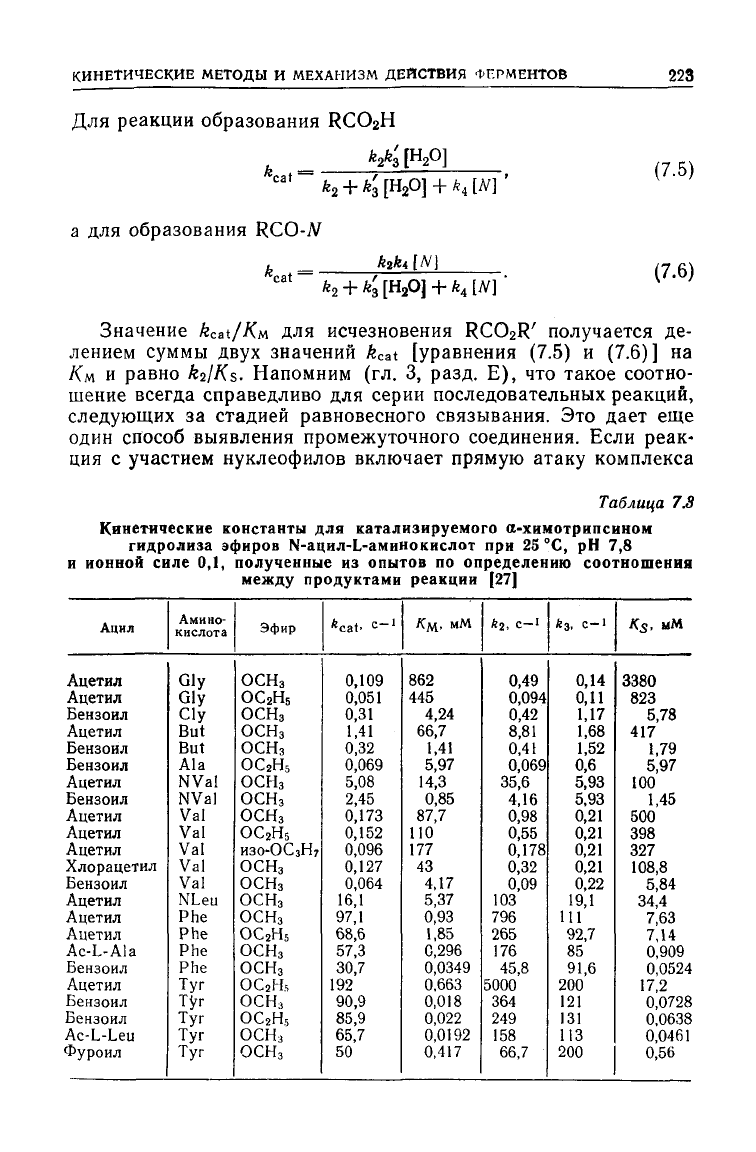
Таблица
7.S
Кинетические константы для катализируемого
о-химотрипсином
гидролиза
эфиров N-ацил-Ь-аминокислот при 25 °С, рН 7,8
и
ионной
силе 0,1,
полученные
из опытов по
определению
соотношения
между
продуктами
реакции [27]
Ацил
Ацетил
Ацетил
Бензоил
Ацетил
Бензоил
Бензоил
Ацетил
Бензоил
Ацетил
Ацетил
Ацетил
Хлорацетил
Бензоил
Ацетил
Ацетил
Ацетил
Ac-L-Ala
Бензоил
Ацетил
Бензоил
Бензоил
Ac-L-Leu
Фуроил
Амино-
кислота
Gly
Gly
Cly
But
But
Ala
NVal
NVal
Val
Val
Val
Val
Val
NLeu
Phe
Phe
Phe
Phe
Tyr
Tyr
Tyr
Tyr
Tyr
Эфир
ОСНз
ос
2
н
5
ОСНз
ОСНз
ОСНз
ОС
2
Н
5
ОСНз
ОСНз
ОСНз
ОС
2
Н
5
ИЗО-ОСЗН7
ОСНз
ОСНз
ОСНз
ОСНз
ОС
2
Н
5
ОСНз
ОСНз
OC
2
Fh
ОСНз
ОС
2
Н
5
ОСНз
ОСНз
*cat.
=-'
0,109
0,051
0,31
1,41
0,32
0,069
5,08
2,45
0,173
0,152
0,096
0,127
0,064
16,1
97,1
68,6
57,3
30,7
192
90,9
85,9
65,7
50
/С
м
,
мМ
862
445
4,24
66,7
1,41
5,97
14,3
0,85
87,7
110
177
43
4,17
5,37
0,93
1,85
0,296
0,0349
0.663
0,018
0,022
0,0192
0,417
*2.
С-1
0,49
0,094
0,42
8,81
0,41
0,069
35,6
4,16
0,98
0,55
0,178
0,32
0,09
103
796
265
176
45,8
5000
364
249
158
66,7
*з,
с-1
0,14
0,11
1,17
1,68
1,52
0,6
5,93
5,93
0,21
0,21
0,21
0,21
0,22
19,1
111
92,7
85
91,6
200
121
131
ИЗ
200
K
s
,
мМ
3380
823
5,78
417
1,79
5,97
100
1,45
500
398
327
108,8
5,84
34,4
7,63
7,14
0,909
0,0524
17,2
0,0728
0.0638
0,0461
0,56

224
ГЛАВА
7
Михаэлиса, как в реакции, представленной ниже,
ftcat/Ам
будет
функцией
концентрации N. Например, если
*
2
[Н
2
О]
—*•
RCO
2
H
RO
2
E + RCOOR'
=<=*
E.RCOOR' —
*
3
[лг]
(7.7)
>- RCO-Л/,
то для исчезновения эфира
W*M
= (
k
2
[H
2
O]
+ k
3
[N])/K
s
.
(7.8)
[Ситуация, естественно, усложняется, если нуклеофилы связы-
ваются с ферментом и оба (и нуклеофил, и
субстрат)
конкури-
руют
за один центр.]
Увеличение скорости деацилирования при добавлении нукле-
офилов
использовалось для получения константы скорости де-
ацилирования
(k
2
) в
случае
тех субстратов, для которых стадия
с константой k
3
обычно является лимитирующей.
1,4-бутанди-
ол — достаточно хороший нуклеофил, чтобы его присутствие да-
же в умеренной концентрации приводило к увеличению скорости
деацилирования до значения, большего чем k
2
[27]. Значения
некоторых констант скорости, полученных этим методом, приве-
дены в табл. 7.3.
Итак,
очевидно, что исследование соотношения
между
про-
дуктами является мощным методом обнаружения промежуточ-
ных соединений.
3. Выявление ацилфермента при гидролизе амидов
и
пептидов [14]
При
гидролизе амидов ацилфермент не накапливается и об-
наружить его довольно трудно. К счастью, для этого можно
воспользоваться методикой прямого обнаружения промежуточ-
ного соединения, применявшейся в
случае
эфирных субстратов.
Образование ацилфермента при гидролизе производных
ацетил-Ь-фенилаланина
(AcPhe) было установлено исходя из
следующих данных:
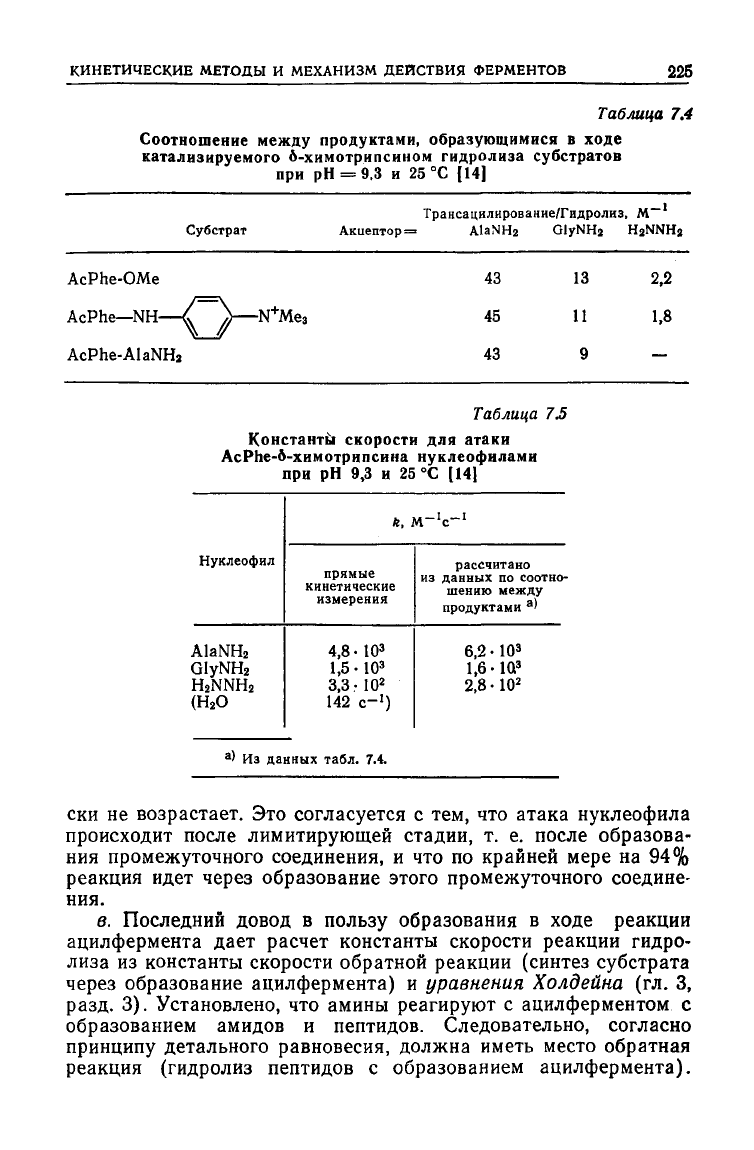
а. При гидролизе амидов в присутствии акцепторов-нукле-
офилов
получается такое же соотношение
между
продуктами,
как
и при гидролизе метилового эфира ацетил-Ь-фенилаланина
(AcPheOMe) в аналогичных условиях (табл. 7.4). Более того,
соотношение
между
продуктами оказалось таким же, какое
ожидалось исходя из прямого спектрофотометрического иссле-
дования
атаки нуклеофилами AcPhe-химотрипсина, генериро-
ванного in
situ
методом остановленной струи (табл. 7.5).
б. В условиях, когда более 94 % реагирующего амида обра-
зует
AcPhe-нуклеофил, скорость исчезновения амида практиче-
КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ
ДЕЙСТВИЯ
ФЕРМЕНТОВ
225
Таблица
7.4
Соотношение
между
продуктами,
образующимися
в
ходе
катализируемого
6-химотрипсииом
гидролиза
субстратов
при рН = 9.3 и 25 °С (14)
Трансацилирование/Гидролнз,
М~
Субстрат
Акцептор
= А1аМНг
QlyNHj
H2NNH2
AcPhe-OMe
AcPhe—NH-
AcPhe-AlaNHj
-N
+
Me
3
43
45
43
Таблица
75
13
11
9
2,2
1,8
—
Константы скорости для атаки
AcPhe-6-химотрипсина
нуклеофиламя
при рН 9,3 и 25 °С [141
Нуклеофил
AlaNH
2
GlyNH
2
H2NNH2
(Н
2
О
ft,
M-'c-
1
прямые
кинетические
измерения
4,8 • 10
3
1,5 • 10
3
3,3-10
2
142 с-
1
)
рассчитано
из
данных
по
соотно-
шению
между
продуктами
а
'
6,2 • 10
3
1,6-1Q
3
2,8 • 10
2
а
> Из
данных
табл.
7.4.
ски
не возрастает. Это согласуется с тем, что атака нуклеофила
происходит после лимитирующей стадии, т. е. после образова-
ния
промежуточного соединения, и что по крайней мере на 94%
реакция
идет через образование этого промежуточного соедине-
ния.
в. Последний довод в пользу образования в
ходе
реакции
ацилфермента дает расчет константы скорости реакции гидро-
лиза из константы скорости обратной реакции (синтез субстрата
через образование ацилфермента) и
уравнения
Холдейна
(гл. 3,
разд. 3). Установлено, что амины реагируют с ацилферментом с
образованием амидов и пептидов. Следовательно, согласно
принципу
детального равновесия, должна иметь место обратная
реакция
(гидролиз пептидов с образованием ацилфермента).

226
ГЛАВА 1
Вопрос состоит
в том,
достаточно
ли
высока скорость этой реак-
ции,
чтобы объяснить наблюдаемую скорость гидролиза.
На
этот
вопрос можно ответить, измерив (k
c
^t/KtA)s
для
реакции синте-
за пептида через стадию образования ацилфермента, определив
/Ceq
для
гидролиза этого пептида
и
затем рассчитав (k
ca
i/Kn)H
для реакции гидролиза
из
уравнения Холдейна l/C
eq
=
=
(&cat//(M)H/(&cat//CM)s].
Рассчитанное значение близко
к по-
лученному экспериментально.
4. Обоснованность выводов, полученных
при
исследовании распределения продуктов,
и
возможные источники ошибок
Ни
постоянство величины
V
ma
x, ни
постоянство соотношения
между
образующимися продуктами
еще не
доказывают присут-
ствия промежуточного соединения. Например, оказалось,
что в
случае
щелочной фосфатазы постоянство значения
Vmax
являет-
ся
артефактом,
а
кроме того, нельзя сказать
a
priori,
что
атака
комплекса
Михаэлиса акцепторами также
не
даст
постоянного
соотношения
между
образующимися продуктами.
Для
того
что-
бы
из
указанных экспериментов можно было сделать четкий
вывод
о
наличии промежуточного соединения,
их
необходимо
связать
с
измерением скоростей.
При
измерении скоростей
в
рамках стационарной кинетики наиболее благоприятной являет-
ся
такая ситуация, когда промежуточное соединение накапли-
вается. Если выполняются уравнения
(7.4) —
(7.6), можно
сде-
лать четкий вывод
о
существовании промежуточного соедине-
ния.
Чрезвычайно полезно сочетание опытов
по
установлению
распределения продуктов
с
исследованиями предстационарной
кинетики
(как это
было сделано
в
случае
химотрипсина
и ами-
дов).
Возможным источником ошибок является нежелательное
из*
менение
свойств ферментов. Химотрипсин часто рассматривают
как
раствор имидазола
и
серина. Однако белки крайне чувстви-
тельны
к
окружению;
они
могут
неспецифически связывать
ор-
ганические молекулы
и
ионы, изменяя
при
этом свои кинетиче-
ские
свойства. Первое правило, которого
следует
придержи-
ваться
при
постановке экспериментов, состоит
в
том,
что
реакции
необходимо проводить
при
строго фиксированных, одинаковых
концентрациях
фермента. Многие белки склонны
к
агрегации,
что может привести
к
изменению констант скорости. Второе
правило гласит: соотношение
между
продуктами
следует
опре-
делять путем непосредственного анализа продуктов,
а не из
косвенных данных. Например, скорость атаки ацилфермента
бензоил-Туг-химотрипсина глицинамидом (GlyNH
2
) была
в
свое

КИНЕТИЧЕСКИЕ
МЕТОДЫ И МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ 227
время определена из данных по уменьшению fecat для гидролиза
6eH3Owi-Tyr-GlyNH
2
при добавлении GlyNH2.
(GlyNH
2
ингиби-
рует
эту реакцию, поскольку реагирует с ацилферментом с об-
разованием бeнзoил-Tyr-GlyNH2.) Как оказалось, присоедине-
ние
аминов к химотрипсину приводит к увеличению k
ca
t на 30%
[14].
Это увеличение имеет тот же порядок величины, что и
ожидаемое уменьшение, обусловленное обращением реакции.
Вообще говоря, если изменения скорости ферментативных реак-
ций
невелики, эти данные нельзя считать надежными, поскольку
изменения
могут
быть обусловлены причинами кинетической
природы.
В ряде ситуаций простые правила распределения промежу-
точных соединений перестают выполняться. Если акцептор-нук-
леофил реагирует с ацилферментом до того, как успевает про-
изойти
диффузия уходящей группы от фермент-содержащего
промежуточного соединения, то распределение может зависеть
от природы уходящей группы (т. е. обусловливаться стериче-
ским
затруднением атаки и т. д.). Кроме того, измерение кон-
стант скорости атаки нуклеофилами промежуточного соедине-
ния
может привести к не совсем верным результатам вследствие
упоминавшихся выше эффектов неспецифического связывания.
В. Другие примеры обнаружения промежуточных
соединений
с помощью исследования распределения
продуктов и из кинетических данных
1, Щелочная фосфатаза
Почти
нет сомнения в том, что при гидролизе этим фермен-
том эфиров фосфорной кислоты образуется фосфорилфермент.
Фосфорилфермент
стабилен при низком рН и его можно выде-
лить [28, 29]. Исследование распределения продуктов с исполь-
зованием трис-буфера в качестве акцептора фосфата показало,
что соотношение
между
продуктами постоянно (табл. 7.6) [30,
31].
Результаты проведенных ранее кинетических исследований
должны оцениваться в свете последних данных, согласно кото-
рым выделенный фермент может содержать прочно, хотя и
нековалентно
связанный фосфат [32], а лимитирующей стадией
реакции
при высоком рН является высвобождение этого прочно
связанного
фосфата 122, 23] (правда, единого мнения относи-
тельно кинетики или стехиометрии связывания нет) [33,34]. Как
отмечалось выше, постоянство
Vmax
в реакциях гидролиза ши-
рокого круга эфиров фосфорной кислоты (табл. 7.7) [19, 20]

228
ГЛАВА
7
Таблица
7.6
Относительные значения
V
max
для катализируемого
щелочной фосфатазой гидролиза эфиров
фосфорной
кислоты [20]
Фосфат
5'АМР
Пирофосфат
З'АМР
АрАр
АТР
dATP
dGTP
UDP
6'UMP
'max
1
1
0,9
0.6
1,05
1,05
1,05
1,0
0,85
Фосфат
dCTP
Рибозо-5-фосфат
р-Глицерофосфат
Этаноламинфосфат
Глюкозо-1-фосфат
Глюкозо-6-фосфат
Гистидинфосфат
я-Нитрофенилфосфат
V
max
1,05
0,7
0,9
0,7
0,8
0,9
0,8
1,0
обусловлено, вероятно, тем, что лимитирующей стадией является
медленная диссоциация комплекса фермент — продукт.
НОСН
2
СН
2
—ОРОГ
НОСНг—С—NH
2
HOCH
2
—С—NH
2
НОСН
2
HOCHj
Трис [трис-(оксиме- О-фосфорил-трис
тил)-аминометан]
Таблица
7.7
Соотношение
между
продуктами
для катализируемого щелочной фосфатазой
гидролиза эфиров фосфорной кислоты
и
фосфоамидатов [30, 31]
Фосфат
Фенил
Крезил
Хлорфенил
га-грег-Бутил
фенил
п-Нитрофенил
о-Метокси-и-метилфенил
а-Нафтил
fl-Нафтил
п-Нитрофенил
Фосфоамидаты
Трансфосфорилиро-
вание/Гидролиз
а
)
1,42
1.41
1,38
1,37
1,37
1,40
1,40
1>40
«
1,2
б
>
1,1
б
>'
в
'
а
'
Акцептор
=
1
М
трис;
рН 8.
б
) Акцептор=2
М
трис;
рН 8,2.
в
) Срецнее
для
нескольких фосфоамидатов.

КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
229
2. Кислая фосфатаза
Реакция,
катализируемая кислой фосфатазой,— это простой
пример реакции с накоплением промежуточного фосфорилфер-
мента, распад которого является лимитирующей стадией. Ши-
рокий
круг эфиров гидролизуется кислой фосфатазой с одина-
ковым значением Vmax (табл. 7.8) [35], причем соотношение
Таблица
7.8
К
м
и
V
max
для
катализируемого
кислой
фосфатазой
предстательной
железы
гидролиза
эфиров
фосфорной
кислоты
при рН 5 и 37 °С [35]
Эфиры фосфорной
кислоты
Р-Глицерофосфат
2'AMP
Ацетилфосфат
З'АМР
п-Нитрофенилфосфат
'max
(относительная)
Таблица
7.9
Соотношение
между
продуктами
катализируемого
кислой
фосфатазой
предстательной
железы
гидролиза
эфиров
фосфорной
кислоты
[36]
Эфир
фосфорной
кислоты
я-Нитрофенилфосфат
Фенилфосфат
3'UMP
З'АМР
З-Глицерофосфат
Трансфосфорилирование/Гидролиз
Акцептор—
этанол
0,29
0,26
0,28
0,30
0,28
Акцептор—
этаноламиа
0,044
0,044
0,046
0,041
между продуктами остается постоянным (табл. 7.9); исследова-
ние
методом остановленной струи с использованием п-нитрофе-
нилфосфата показывает, что во время всплеска высвобождается
один моль n-нитрофенолята на субъединицу фермента; фермент
ковалентно модифицируется диизопропилфосфатом [36].
Быстро Медленно
Е—OH + ROPO3H ч=Ь Е—OH.ROPOgH -^- > Е—ОРО3Н ->
ROH
Е-ОН + Н
2
РО
4
-. (7.9)
230
ГЛАВА
7
3. Р-Галактозидаза: сохранение конфигурации
предполагаемого промежуточного соединения
Алкоголиз p-D-галактозидов р-галактозидазой происходит с
сохранением конфигурации у атома С-1 137, 38].
О—R
ROM
ОН
OR'
(7.Ю)
Тем самым из этого процесса исключаются простые реакции
бимолекулярного замещения (SN2), которые часто встречаются
в
органической химии, поскольку известно, что они всегда
идут
с обращением конфигурации [39].
А А
X® В • • • С—Y-+X—С • • • В+Y®
(7.11)
Сохранение конфигурации наблюдается всегда, когда имеют
место два последовательных обращения у данного углеродного
атома или если образуется промежуточный карбоний-ион, кото-
рый
может быть атакован нуклеофилом только с одной стороны.
Следовательно, сохранение конфигурации связано с наличием
многостадийной реакции, в
ходе
которой образуется промежу-
точное соединение. Согласно этому критерию, реакция с участи-
ем лизоцима также идет с образованием промежуточного со-
единения
[40, 41].
Данные,
полученные при исследовании соотношения
между
продуктами при гидролизе р-галактозидов, свидетельствуют в
пользу образования в
ходе
этой реакции промежуточного со-
единения
(табл.
7.10).
Из таблицы видно, что соотношение
между
водой и метанолом остается постоянным [42, 43]. Лими-
тирующей стадией в
случае
слабоактивированных субстратов
является образование промежуточного соединения, поскольку
Vmax
— величина переменная, а в
случае
сильноактивированных
динитросоединений
лимитирующей стадией становится гидролиз
этого промежуточного соединения, так как скорость остается
