Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
231
Таблица
7.10
Соотношение
между
продуктами
катализируемого
Р-галактозидазой гидролиза
Р-галактозидов
и
относительные
значения
V
max
при 25 °С
и рН
7,0-7,5
[42-44]
Р-Галактозид
2,4-динитрофенил
3,5-динитрофенил
2,5-динитрофенил
2-нитрофенил
3-нитрофенил
3-хлорфенил
4-нитрофенил
Фенил
4-метоксифенил
4-хлорфенил
4-бромфенил
Метил
Метанолиз/Гидролиз,
м-
1
1,97
1,96
2,08
1,99
1,94
2,14
2,13
2,02
2,2
к
тах
(ОТНОСИТ.)
1,3
1,1
1,1
1,0
0,9
0,5
0,2
0,1
0,1
0,02
0,02
0,06
Лимитирующая
стадия
Дегалактози-
дирование
То же
>
Галактозиди-
рование
То же
>
>
»
»
»
постоянной.
С таким выводом
согласуются
данные о том, что
скорость исчезновения 2,4-динитро- и 3,5-динитропроизводных
возрастает при добавлении метанола, но не менее реакционно-
способных
субстратов
(см. рис. 7.2 и 7.3). Возможный механизм
этой реакции включает образование на начальном этапе карбо-
ний-иона
[44, 45].
Г. Аминоацил-тРНК—синтетазы: обнаружение
промежуточных соединений методами
«замороженной» струи, изотопного обмена
и
с помощью стационарной кинетики
1. Механизм реакции
Эта группа ферментов катализирует образование аминоацил-
тРНК
из свободной аминокислоты (АА) и АТР. В
отсутствие
тРНК
данные ферменты
облегчают
(за несколькими исключени-
ями)
атаку аминокислот нуклеофилами и АТР пирофосфатом
[46—49]. Активация осуществляется
путем
образования проч-
ного комплекса с аминоациладенилатом, смешанным ангидри-
232
ГЛАВА
7
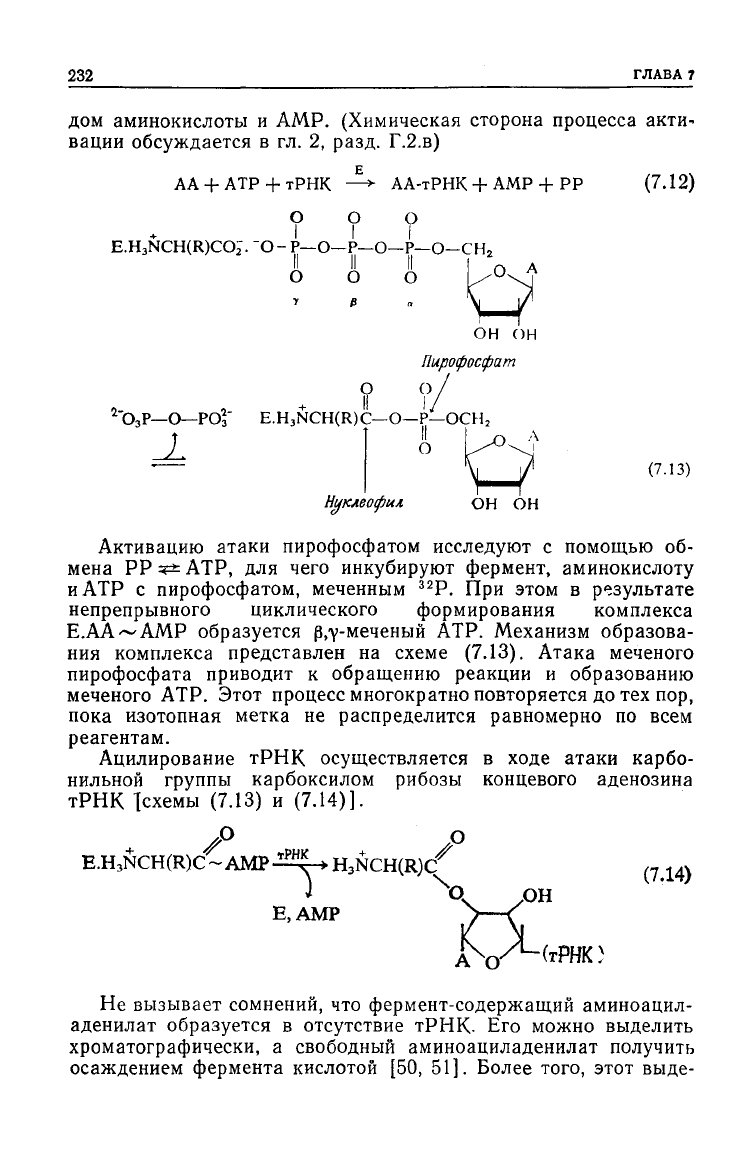
дом аминокислоты и AMP. (Химическая сторона процесса акти-
вации
обсуждается в гл. 2, разд.
Г.2.в)
АА + АТР +
тРНК
—> АА-тРНК + AMP -f РР
(7.12)
О О О
I
I I
E.H
3
NCH(R)CO2."O-P—О—Р—О—Р—О—СН
2
II
I
О О О
±
г
"О
3
Р—О—РОз"
E.H
3
NCH(R)C—О—Р—ОСН
2
(7.13)
Нуклеофил
ОН ОН
Активацию атаки пирофосфатом
исследуют
с помощью об-
мена РР
=F*=
ATP, для чего инкубируют фермент, аминокислоту
и
АТР с пирофосфатом, меченным
32
Р. При этом в
результате
непрепрывного циклического формирования комплекса
Е.АА~АМР
образуется р.у-меченый АТР. Механизм образова-
ния
комплекса представлен на
схеме
(7.13).
Атака
меченого
пирофосфата
приводит к обращению реакции и образованию
меченого АТР. Этот процесс многократно повторяется до тех пор,
пока
изотопная метка не распределится равномерно по всем
реагентам.
Ацилирование
тРНК
осуществляется в
ходе
атаки карбо-
нильной
группы карбоксилом рибозы концевого аденозина
тРНК
Тсхемы
(7.13)
и (7.14)].
E.H
3
NCH(R)C
~ AMP 22$-*
H
3
NCH(R)C
Е.АМР
.ОН
(7.14)
(тРНК}
Не
вызывает сомнений, что фермент-содержащий аминоацил-
аденилат образуется в отсутствие
тРНК-
Его можно выделить
хроматографически, а свободный аминоациладенилат получить
осаждением фермента кислотой [50, 51]. Более того, этот выде-

КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
233
ленный
комплекс
будет
переносить свою аминокислоту
на
тРНК.
Все приведенные выше данные позволяют предложить
сле-
дующий механизм:
тРНК
Е
+
АТР+АА
-^—>
Е.АА~АМР
*• АА-тРНК
+
AMP
+
Е.
(7.15)
РР
Тем
не
менее одно время казалось,
что с
предположением
об
образовании
в
ходе
реакции аминоациладенилата согласуются
не
все
данные.
Был
предложен
другой
механизм реакции
— в
присутствии
тРНК
аминоациладенилат не образуется,
а
реакция
идет
при
одновременном взаимодействии
тРНК,
аминокислоты
и
АТР
[52]. Как мы
увидим ниже, этот механизм некорректен,
хо-
тя
в
свое время казался вполне приемлемым. Кроме того, необ-
ходимо отметить,
что
наличие парциальной реакции
в
отсутст-
вие одного
из
субстратов (например, образование аминоацил-
аденилата
из
аминокислоты
и АТР в
отсутствие
тРНК)
не
озна-
чает,
что
аналогичная реакция имеет место
в
присутствии
всех
субстратов. Действительно,
в
ряде случаев показано,
что та-
кие
парциальные реакции являются артефактом.
Адекватность механизма
с
образованием аминоациладени-
лата очень просто доказать
с
помощью
трех
типов эксперимен-
тов
с
использованием метода замороженной струи, руковод-
ствуясь тремя критериями: промежуточное соединение должно
быть выделено,
оно
должно достаточно быстро образовываться
и
достаточно быстро реагировать, чтобы реакция
шла по
данно-
му пути
[53]. При
исследовании реакции
с
участием изолей-
цил-тРК—синтетазы
(IRS)
получены следующие результаты:
а.
При
смешивании предварительно образованного
и
выделен-
ного комплекса IRS. [
14
С]Пе~АМР
с
тРНК
константа скорости
первого порядка
для
переноса [
14
С] Не
на
тРНК,
измеренная
импульсным методом замороженной струи, оказалась такой
же,
как
и
fecat
для
стационарного аминоацилирования
тРНК
в ана-
логичных реакционных условиях. Таким образом, константа
скорости превращения промежуточного соединения достаточно
высока, чтобы реакция
шла с
образованием данного соединения,
и,
более того,
эта
реакция является, по-видимому, лимитирую-
щей
стадией процесса,
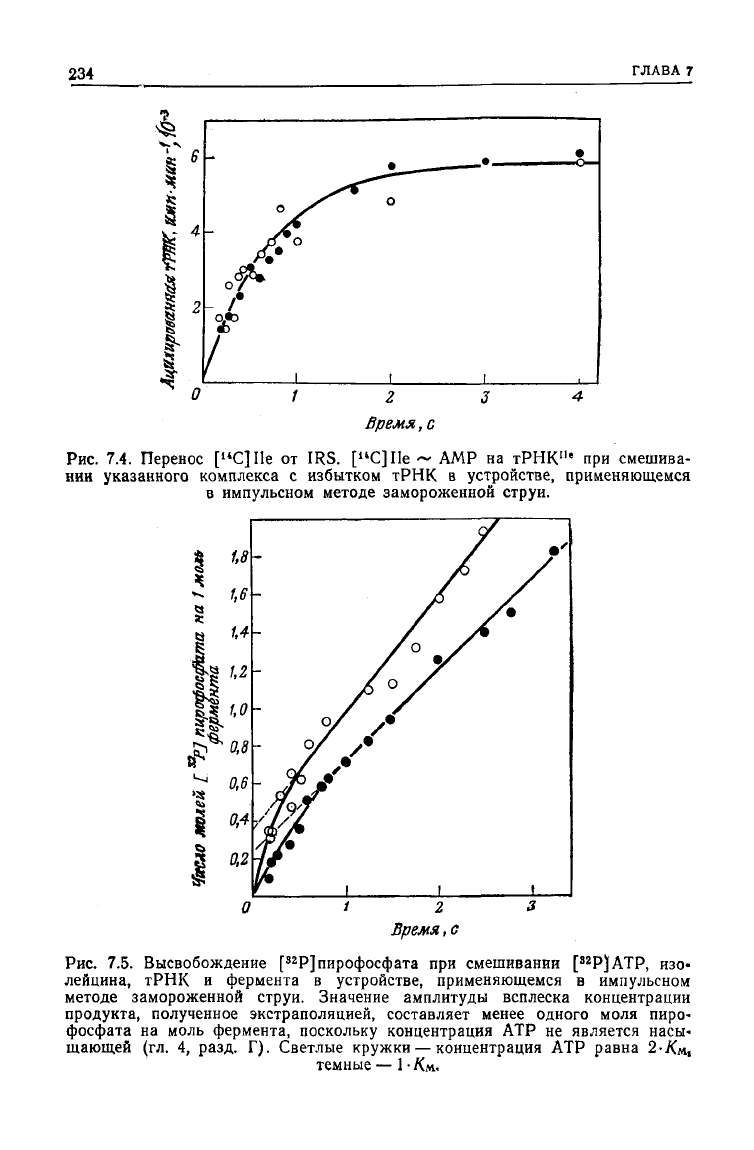
б. При
смешивании
IRS,
изолейцина,
тРНК
и
[у
32
Р]
АТР
(метка включена
в
концевой фосфат)
на-
блюдается всплеск, регистрируемый импульсным методом замо-
роженной
струи,
—
высвобождение меченого пирофосфата, кото-
рое предшествует стационарному процессу аминоацилирования
тРНК.
Это означает,
что либо
аминоациладенилат образуется
до
стадии аминоацилирования
тРНК,
и это,
следовательно, являет-
ся
доводом
в
пользу адекватности данного механизма,
либо
234
ГЛАВА
7
Рис.
7.4. Перенос
[
u
C]Ile
от IRS.
[
u
C]Ile
~ AMP на
тРНК
1
"
при смешива-
нии
указанного комплекса с избытком
тРНК
в устройстве, применяющемся
в
импульсном методе замороженной струи.
Рис.
7.5. Высвобождение [
32
Р]пирофосфата при смешивании [
32
Р)АТР, изо-
лейцина,
тРНК
и фермента в устройстве, применяющемся в импульсном
методе замороженной струи. Значение амплитуды всплеска концентрации
продукта, полученное экстраполяцией, составляет менее одного моля пиро-
фосфата на моль фермента, поскольку концентрация АТР не является насы-
щающей (гл. 4, разд. Г). Светлые кружки — концентрация АТР равна 2-Кл,
темные — 1 •
Км..
КИНЕТИЧЕСКИЕ
МЕТОДЫ И МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
235
реакция
идет по такому пути, в
ходе
которого быстро образуется
аминоацил-тРНК,
а далее
следует
медленная стадия диссоциа-
ции
комплекса IRS.Ile-тРНК [схема (7.16)].
Е + АА + АТР +
тРНК
Быстро
Медленно
*
Е.АА-тРНК •> Е + тРНК.
AMP
+ РР
(7.16)
Этот путь, существование которого предполагали многие ис-
следователи, исключается результатами третьего эксперимента
1,5
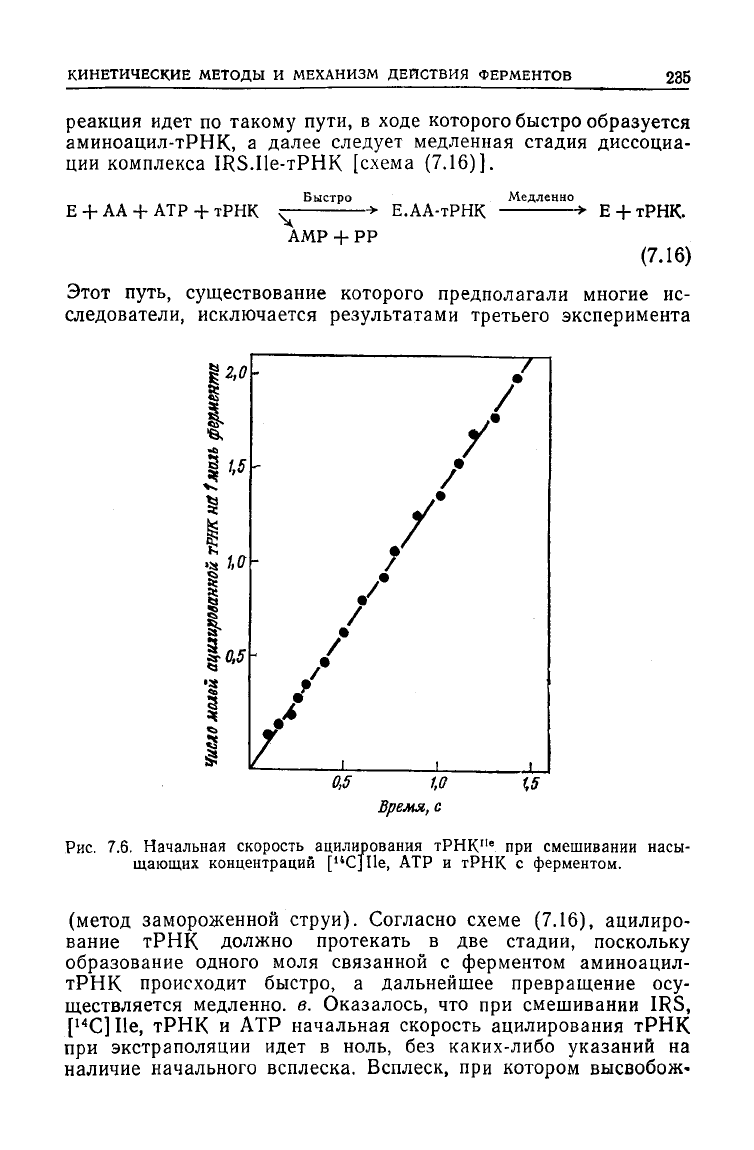
Рис.
7.6. Начальная скорость ацилирования
тРНК
Пе
при смешивании насы-
щающих концентраций [
14
С]Пе, АТР и
тРНК
с ферментом.
(метод замороженной струи). Согласно
схеме
(7.16), ацилиро-
вание
тРНК
должно протекать в две стадии, поскольку
образование одного моля связанной с ферментом аминоацил-
тРНК
происходит быстро, а дальнейшее превращение осу-
ществляется медленно, в. Оказалось, что при смешивании IRS,
[
14
С] Не,
тРНК
и АТР начальная скорость ацилирования тРНК
при
экстраполяции идет в ноль, без каких-либо указаний на
наличие начального всплеска. Всплеск, при котором высвобож-

236
ГЛАВА
7
дается пирофосфат, обусловлен образованием аминоациладени-
лата, которое предшествует переносу аминокислоты на
тРНК
(рис. 7.6).
2. Механизм корректирования биосинтеза белка
В гл. 11 говорится о том, что в процессе биосинтеза белка
клетка выбирает нужную ей аминокислоту со значительно более
высокой точностью, чем можно было бы ожидать, исходя из
структурных различий
между
аминокислотами. Эта точность
может обеспечиваться специфически катализируемым амино-
ацил-тРНК—синтетазой гидролизом аминоациладенилатного
комплекса, образуемого «ошибочной» аминокислотой, или
неправильно «нагруженной»
тРНК
151]. Примером такого рода
процесса может служить
«отказ»
валил-тРНК—синтетазы (VRS)
присоединять треонин вместо валина [54]. Этот фермент ката-
лизирует реакцию обмена РР ^ АТР в присутствии треонина и,
кроме того, образует стабильный комплекс VRS.Thr~AMP.
В присутствии
тРНК
и треонина VRS функционирует как АТР-
пирофосфатаза, гидролизуя АТР до AMP и пирофосфата и не
катализируя образование Thr-TPHK
Val
. В качестве промежу-
точного соединения в этой реакции образуется комплекс
VRS.Thr~AMP, о чем свидетельствует наличие обмена
РР^АТР.
Эксперименты с применением импульсного метода заморо-
женной струи показывают, что механизм корректирования при
ошибочном присоединении треонина основан на быстром гидро-
лизе неправильно ацилированной
тРНК.
Такую
тРНК
можно
выделить и показать, что она действительно гидролизуется с
достаточно высокой скоростью. При смешивании комплекса
VRS. [
14
C]Thr~AMP с
тРНК
Уа1
в аппарате, применяемом в ме-
тоде
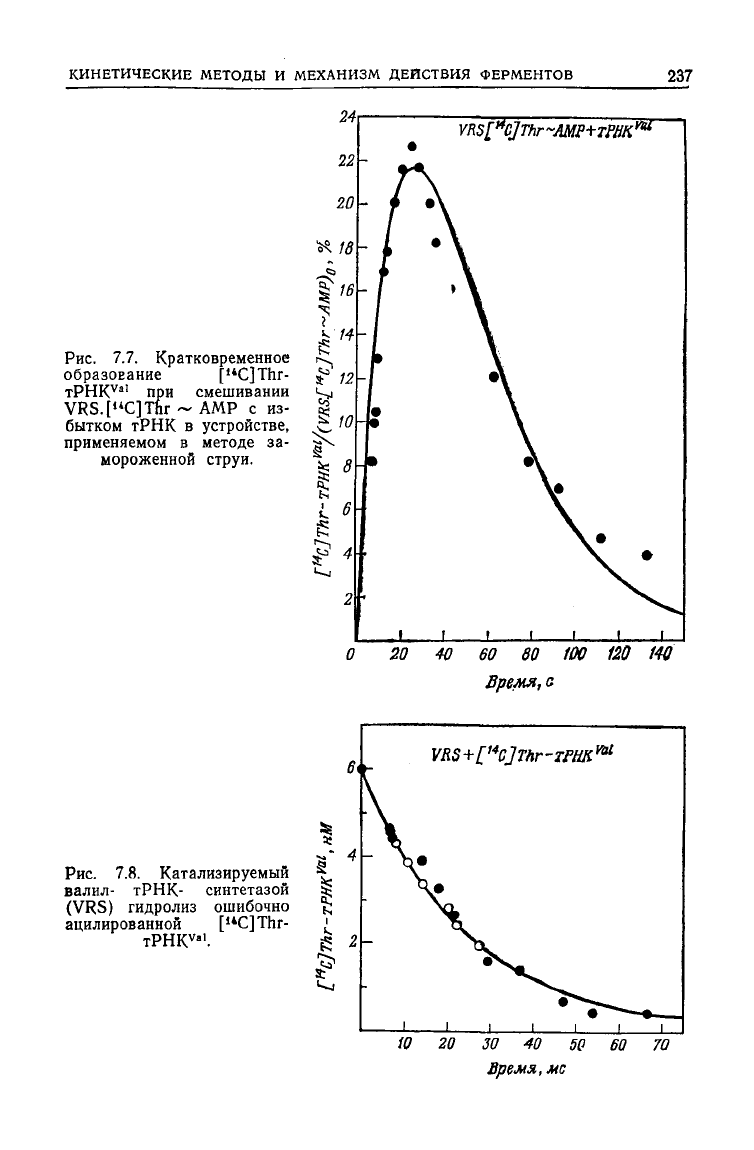
замороженной струи, наблюдается кратковременное обра-
зование [
14
С]ТЬг-тРНК
Уа|
(рис. 7.7). Это соединение можно
выделить, быстро остановив реакцию с помощью фенола и оса-
див неправильно ацилированную
тРНК
из водной фазы; такая
РНК
гидролизуется VRS с константой скорости 40 с~' (рис. 7.8).
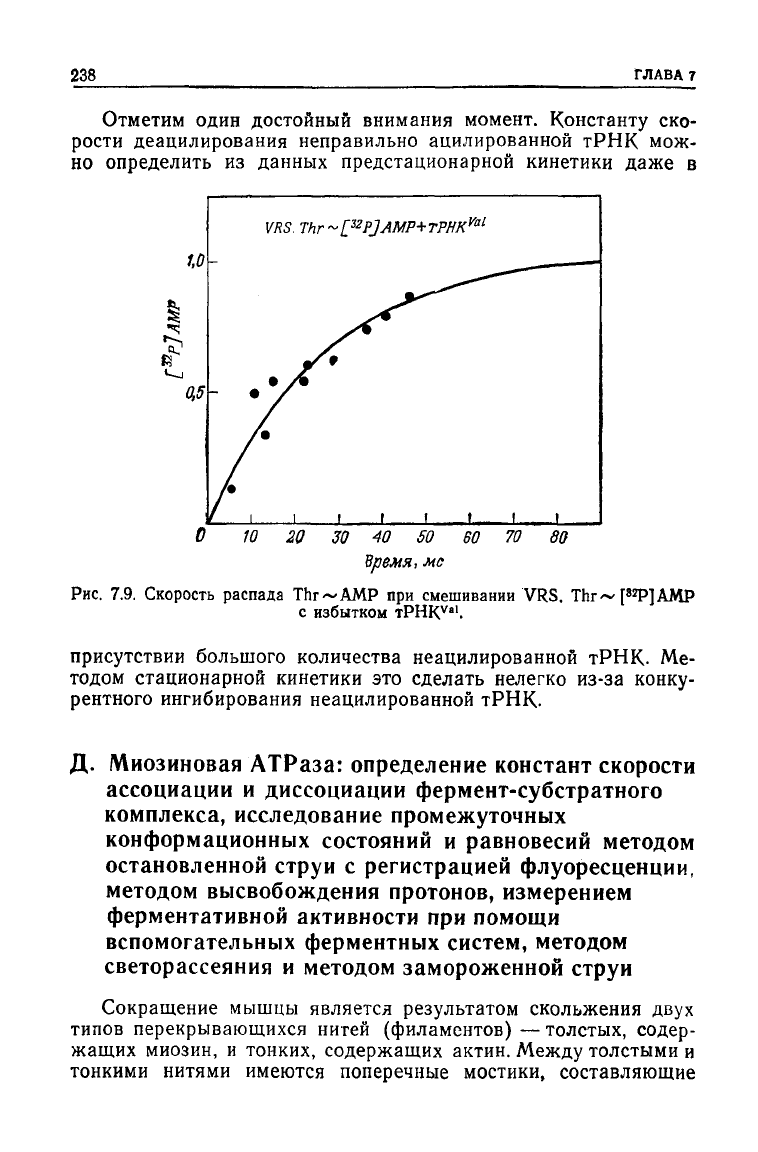
Скорость переноса треонина от комплекса VRS.Thr~AMP мож-
но
измерить независимо по скорости высвобождения AMP (ис-
пользуя соединение
VRS.Thr~
[
32
P]AMP; рис. 7.9). Сплошная
кривая
на рис. 7.8 построена исходя из результатов независимо-
го измерения констант скорости образования и гидролиза [схе-
ма (7.17)].
VRS.Thr~AMP.
T
PHK
VaI
-^—*• VRS.Thr-TPHK
Val
+ AMP
(7.17)
140с-
1
VRS+Thr + TPHK
Val
.
КИНЕТИЧЕСКИЕ
МЕТОДЫ
И
МЕХАНИЗМ
ДЕЙСТВИЯ
ФЕРМЕНТОВ
237
Рис.
7.7. Кратковременное
образование [
i4
C]Thr-
TPHK
V
"'
при
смешивании
VRS.[
u
C]Thr ~ AMP с из-
бытком
тРНК
в устройстве,
применяемом в методе за-
мороженной струи.
t
Thr
si-
i
it
22
20
18
16
14
12
10
8
6
J
/
1
P
I
Г
j
4
4
T
II
•
• V
\
» у
\
\
V
•\
\
\
\
\
\ •
i i i i i i
О 20 40 60 80 tOO 120 №
Время,
с
Рис.
7.8. Катализируемый
валил- тРНК- синтетазой
(VRS) гидролиз ошибочно
ацилированной [
14
C]Thr-
TPHK
V
".
20
30 40 50 60 70
Время,
мс
238
ГЛАВА
7
Отметим один достойный внимания момент. Константу ско-
рости деацилирования неправильно ацилированной
тРНК
мож-
но
определить из данных предстационарной кинетики
даже
в
<—j
1,0
0,5
VRS
-
' i
Thr
/
4
~
[
32
PJAMP+
ТРНК
Ш
lilt
1
1
10
20
30
40 SO
Время,
мс
60
70 80
Рис.
7.9. Скорость распада Thr ~ AMP при смешивании VRS. Thr~[
82
P]AMP
с избытком
TPHK
V
".
присутствии большого количества неацилированной тРНК. Ме-
тодом стационарной кинетики это
сделать
нелегко из-за конку-
рентного ингибирования неацилированной тРНК.
Д. Миозиновая АТРаза: определение констант скорости
ассоциации и диссоциации фермент-субстратного
комплекса, исследование промежуточных
конформационных
состояний и равновесий методом
остановленной
струи
с регистрацией флуоресценции,
методом высвобождения протонов, измерением
ферментативной активности при помощи
вспомогательных ферментных систем, методом
светорассеяния и методом замороженной
струи
Сокращение мышцы является
результатом
скольжения
двух
типов перекрывающихся нитей (филаментов) —
толстых,
содер-
жащих миозин, и тонких, содержащих актин.
Между
толстыми и
тонкими
нитями имеются поперечные мостики, составляющие

КИНЕТИЧЕСКИЕ
МЕТОДЫ И МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ 239
часть молекулы миозина. В
ходе
сокращения поперечные мости-
ки
многократно разрываются и вновь образуются. В мостиках
расположены активные центры, катализирующие гидролиз АТР.
АТРазная активность покоящейся мышцы крайне низка, а при
сокращении
она возрастает в тысячу раз. Высвобождающаяся
при
гидролизе энергия используется для мышечного сокраще-
ния.
Возникает вопрос: как связаны
между
собой химическая и
механическая энергия? Согласно существующей гипотезе, взаи-
мопревращения
этих форм энергии осуществляется посредством
конформационных
изменений в белке, связанных с гидролизом
АТР.
Активные центры миозина, присоединяющиеся к актину, рас-
положены в глобулярных участках молекулы миозина, которые
получили название Si-субъединиц. Они
могут
быть отделены от
остальной части молекулы путем протеолиза. Полученные таким
образом фрагменты более удобны для проведения кинетических
исследований, чем целая молекула миозина [55]. Механизм
гидролиза АТР с участием фрагмента Si в том виде, в каком его
сейчас представляют, довольно сложен — это последователь-
ность реакций, состоящая из семи стадий [схема (7.18)].
Несмотря
на всю свою сложность, эта схема вполне логична
[56—68].
М + АТР «=^ М.АТР ч=^ М\АТР =*=^ M**.ADP.P ^=*
^=ь M*.ADP.P «=^* M*.ADP + P *=± M.ADP ^*
M
+ ADP. П 18)
Конформационные
состояния обозначены звездочками; число
этих звездочек отражает интенсивность флуоресценции трипто-
фана.
Считается, что константы равновесия и константы скоро-
сти,
полученные при исследовании скелетных мышц кролика при
21°С и рН 8,0, имеют следующие значения: ki/k-i
=4,Ъ-Ю
3
М;
k
2
= 400 с-
1
; k-
2
<
0,0003
с-
1
; k
s
/k-
3
= 9; k
3
^ 160 С"
1
; А>
4
=
=
0,06 с-
1
;
k
5
/k-
5
>
1,5-Ю-
3
М; k
6
= 1,4 с-
1
; /е_
6
= 400 с-
1
и
k
7
/k-
7
= 2,7 • 10—
4
М [68]. Рассмотрим теперь, как была построе-
на
схема (7.18).
1. Лимитирующая стадия гидролиза АТР
Число
оборотов для гидролиза АТР с участием миозина
очень мало — всего 0,04 с~
1
. Исследования методом заморожен-
ной
струи с использованием [у
32
Р]АТР показывают, что кон-
станта скорости расщепления АТР при первом обороте фермента
равна 160 с-
1
[60]. Это означает, что в стационарном состоянии
лимитирующей является стадия, следующая за стадией химиче-

240
ГЛАВА
7
ского расщепления. На этой стадии может происходить либо
конформационное
изменение, либо медленное высвобождение
продуктов. Измерение скоростей диссоциации, которые оказа-
лись относительно высокими, показало, что имеет место конфор-
мационное изменение (разд. 2) [61]. Медленная стадия харак-
теризуется константой ki. Поскольку изменение конформации
сопровождается уменьшением интенсивности флуоресценции,
эту константу измеряют методом остановленной струи с регист-
рацией флуоресценции; кроме того, ее можно определить по
высвобождению протонов, так как на данной стадии на один
моль гидролизованной АТР высвобождается один протон [64].
Константу скорости высвобождения протонов легко определить
методом остановленной струи с регистрацией оптической плот-
ности,
используя окрашенный индикатор рН, в данном
случае
фенол красный.
2. Скорости высвобождения ADP и Р (фосфата)
Первые опыты по определению скоростей высвобождения
ADP и Р были весьма остроумными: скорость появления в рас-
творе
свободных
ADP и Р определяли с помощью сопряженных
ферментных систем и метода остановленной струи с регистра-
цией
оптической плотности [64].
а.
Высвобождение
ADP,
сопряженное
с
исчезновением
NADH
в
реакциях,
катализируемых
пируваткиназой
и
лактат-
дегидрогеназой:
ADP АТР
Фосфоенолпируват > Пируват -ргт > Лактат.
(7.19)
NADH
NAD
+
б.
Высвобождение
Р,
сопряженное
с
образованием
NADH в
реакции,
катализируемой
глицеральдегид-3-фосфат—дегидроге-
назой:
P
+ NAD+ NADH
\ /
Глицеральдегид-3-фосфат > 1,3-дифосфоглицерат
—-р^т—•
ADP АТР
-> 3-фосфоглицерат.
(7.20)
(Глицеральдегид-3-фосфат превращается в 1,3-дифосфоглице-
рат, который для предотвращения ингибирования первой реак-
ции
удаляется с помощью фосфоглицераткиназы, превращаю-
щей его в 3-фосфоглицерат.)
При
высвобождении Р или ADP всплеска концентрации не
наблюдается, так что либо оба продукта медленно отщепляются
