Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


смещении равновесия в сторону прямой реакции, при увеличении концентраций реагентов - в сторону обратной
реакции. Смещение равновесия может быть вызвано изменением концентраций, температуры и давления.
Пусть система с обратимой реакцией
aA + bB dD + eE (8-59)
находится в состоянии равновесия. Введем в систему некоторое количество вещества А. Тогда концентрации
всех веществ перестанут быть равновесными и примут значения С
А
, С
В
, С
D
и C
E
. Рассмотрим уравнение
b
B
a
A
e
E
d
D
CC
CC
X
(8-68)
и сопоставим его с уравнением (8-62)
ba
ed
[B][A]
[E][D]
K
Поскольку С
А
> [A], константа равновесия К > X. Для того чтобы в системе вновь установилось равновесие,
должно произойти смещение в сторону реакции, идущей с уменьшением концентраций веществ А и В, т.е. в
сторону прямой реакции, сопровождающейся расходованием этих веществ. Аналогично, удаление из системы
некоторого количества вещества В вызовет смещение равновесия в сторону процесса, при котором вещество В
образуется, т.е. в сторону обратной реакции.
Влияние температуры на смещение равновесий рассмотрим на примере обратимой одностадийной реакции
типа (8-59). В этом случае, как следует из уравнения (8-62), константа равновесия
2
1
k
k
K
где k
1
и k
2
- константы скорости прямой и обратной реакции. Повышение температуры увеличивает скорость как
прямой, так и обратной реакции, но не в одинаковое число раз. В результате при изменении температуры
значение константы равновесия будет изменяться, в выражении (8-62) правая часть перестанет равняться
левой, и равновесие нарушится. Если значение К увеличится, равновесие сместится в сторону прямой реакции,
так как уменьшение концентраций А и В приводит к увеличению правой части выражения (8-62). Уменьшение
значения К вызовет смещение равновесия в сторону обратной реакции, сопровождающейся уменьшением
концентраций D и Е.
В соответствии с (8-44) константы скорости прямой и обратной реакций выражаются уравнениями:
RT
E
11
a
eAk
,
RT
E
22
a
eAk
,
где
a
E
и
a
E
- энергии активации прямой и обратной реакции. Отсюда
RT
EE
2
1
aa
Ae
k
k
K
,
где
2
1
A
A
A
Но, согласно (8-37), разность энергий активации прямой и обратной реакций равна тепловому эффекту процесса
ΔН, откуда
RT
ΔH
AeK
Пусть прямая реакция для процесса (8-59) экзотермична (ΔН<0). Тогда показатель степени
RT
ΔH
больше
нуля, и повышение температуры сопровождается уменьшением значения К, что указывает на смещение
равновесия в сторону обратной реакции, идущей с поглощением тепла и, следовательно, с понижением
температуры. Если прямая реакция эндотермична (ΔН>0), то величина
RT
ΔH
отрицательна; в этом случае
повышение температуры приводит к увеличению константы равновесия, то есть к смещению равновесия в
сторону прямой реакции, при протекании которой теплота выделяется, а температура системы повышается.
Например, для обратимой реакции
COCl
2
CO +Cl
2
; ΔН
298
= 108,97 кДж
131

повышение температуры смещает равновесие в сторону прямой реакции, а понижение температуры - в сторону
обратной реакции.
Изменение давления существенно смещает равновесия в тех случаях, когда во взаимодействии участвуют
газообразные соединения, так как при протекании подобных реакций часто наблюдается изменение давления.
Реакции, сопровождающиеся увеличением числа молекул газов, протекают с повышением давления; реакции, в
результате которых число молекул газом уменьшается, сопровождаются понижением давления.
Пусть в системе протекает реакция
mA
(г)
nВ
(г)
(8-69)
Поскольку давление газа пропорционально его концентрации, константа равновесия реакции (8-69) может быть
выражена через парциальные давления газов, участвующих во взаимодействии:
m
A
n
B
p
p
K
(8-70)
При увеличении давления газовой смеси в r раз давления этих газов составят:
;rpp
AA
BB
rpp
Отношение этих давлений, взятых в степенях m и n,
Kr
p
p
r
)(rp
)(rp
X
mn
m
A
n
B
mn
m
A
n
B
, (8-71)
где К - константа равновесия реакции (8-69). Если n>m, т.е. реакция сопровождается увеличением давления, то
K<X. В этом случае равновесие сместится в сторону процесса, идущего с понижением давления реакционной
смеси, т.е. в сторону обратной реакции. Если n<m, то K>X, а равновесие при повышении давления сместится в
сторону прямой реакции.
Сопоставляя результаты влияния изменения концентраций, температуры и давления на смещение
равновесия, можно заключить, что во всех случаях наблюдается противодействие системы произведенному
изменению. Так, при повышении концентрации одного из веществ равновесие смещается в сторону реакции, при
которой это вещество расходуется. Повышение температуры сопровождается смещением равновесия в сторону
процесса, идущего с поглощением теплоты и понижением температуры. Повышение давления приводит к
смещению равновесия в сторону процесса, сопровождающегося понижением давления. Закономерности
смещения равновесия выражает принцип Ле Шателье (1884), который может быть сформулирован следующим
образом:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие,
то равновесие смещается в сторону процесса, ослабляющего оказанное воздействие.
Введение в систему катализатора не вызывает смещения равновесия, так как катализатор одинаково
изменяет скорость как прямой, так и обратной реакции. С помощью катализатора, таким образом, невозможно
увеличить выход того или иного вещества в химическом процессе. Однако катализатор ускоряет переход
системы в состояние равновесие.
Проиллюстрируем принцип Ле Шателье на примере обратимой реакции синтеза аммиака:
N
2
+ 3H
2
2NH
3
; ΔН
298
= -92,38 кДж
Отвечающая этому процессу прямая реакция экзотермична и сопровождается уменьшением давления, так как
при ее протекании из четырех молекул азота и водорода образуются две молекулы аммиака. Это равновесие
можно сместить в сторону образования аммиака, оказывая на систему следующие воздействия:
1) увеличивая концентрацию азота или водорода;
2) уменьшая концентрацию аммиака;
3) повышая давление в системе;
4) понижая температуру.
Соответственно синтез аммиака проводят при максимально высоких давлениях и не слишком высокой
температуре (450 – 500 ˚С). При более низких температурах синтез аммиака не осуществляют: равновесие при
этом устанавливалось бы слишком медленно. Для сокращения времени достижения равновесия также
используют катализатор - железо с некоторыми добавками.
От истинного химического равновесия следует отличать ложные равновесия - состояния системы, в случае
которых концентрации взаимодействующих веществ остаются практически постоянными в связи с тем, что
скорости прямой и обратной реакций очень малы. Для системы в состоянии ложного равновесия ΔG ≠ 0;
изменение концентраций в такой системе не является обратимым. Примером системы в состоянии ложного
равновесия может служить смесь водорода и кислорода при стандартных условиях. Состав такой смеси
практически не изменяется во времени. Если температуру повысить до 500 ˚С, реакция образования воды
начнет протекать с заметной скоростью, в результате чего концентрации водорода и кислорода уменьшатся.
Если систему вновь вернуть к стандартным условиям, прежние значения концентраций не восстановятся: ложное
равновесие не является динамическим.
9. РАСТВОРЫ
132

9.1. Общая характеристика растворов
Одним из важных объектов, изучаемых химией, являются растворы.
Растворы - это гомогенные системы, состоящие из двух и более компонентов.
Растворы могут быть газообразными (например, воздух), твердыми (например, сплав золота и серебра) и
жидкими. Наибольшее распространение и значение имеют, несомненно, жидкие растворы. Именно этой группе
растворов посвящен данный раздел. Компоненты, образующие раствор, подразделяют на растворитель (один из
компонентов) и растворенные вещества (остальные компоненты). Понятия "растворитель" и "растворенное
вещество" в значительной мере условны. В качестве растворителя выбирают обычно тот компонент, который
находится в том же агрегатном состоянии, что и раствор. Если этому критерию отвечают несколько компонентов,
то растворителем считают то вещество, которого больше. Исключением является вода, которую обычно
принимают за растворитель даже тогда, когда ее меньше, чем других жидких компонентов.
Поскольку состав раствора переменен, важнейшей характеристикой раствора является его концентрация.
Концентрация раствора определяет количественное соотношение между его компонентами и указывает
содержание растворенного вещества в единице массы или объема растворителя или раствора. Если раствор
содержит несколько растворенных веществ, то каждому из них соответствует определенная концентрация.
Существует несколько способов выражения концентрации растворов, из которых важнейшими являются
следующие:
1. Молярность - отношение количества растворенного вещества к объему раствора
VM
m
V
ν
С
1
11
1
, (9-1)
где m
1
, M
1
и ν
1
- масса, молярная масса и количество растворенного вещества. В системе СИ единица
молярности - моль/м
3
, однако химики предпочитают выражать молярную концентрацию в молях на литр.
Молярность раствора обозначают также буквой М, перед которой пишут численное значение молярности. Так,
запись 0,25 М H
2
SO
4
соответствует раствору, в литре которого содержится 0,25 моля серной кислоты.
2. Нормальность раствора - отношение количества эквивалента растворенного вещества к объему раствора
VM
m
V
ν
N
Э
11
1
, (9-2)
где М
Э
- эквивалентная масса растворенного вещества. Нормальность обозначают также буквой н, которой
предшествует число, равное нормальности раствора (например, 0,01 н КОН).
3. Массовая доля - отношение массы растворенного вещества к массе раствора
m
m
ω
1
(9-3)
Массовая доля выражается либо в долях единицы, либо в процентах.
4. Объемная доля - отношение объема растворенного вещества к сумме объемов компонентов раствора
Vi
V
1
1
(9-4)
5. Молярная доля - отношение количества данного компонента к суммарному количеству всех компонентов
раствора
...
10
1
1
x
(9-5)
6. Моляльность - отношение количества растворенного вещества к массе растворителя. Моляльность
обычно относят к 1 кг (1000 г) растворителя и рассчитывают по формуле
01
1
0
1
m
mM
1000m
m
1000
C
, (9-6)
где m
1
и m
0
-массы растворенного вещества и растворителя, М
1
- молярная масса растворенного вещества.
По своим свойствам растворы занимают промежуточное положение между смесями и химическими
соединениями. Со смесями растворы сближают:
1) переменный состав, изменяющийся в более или менее широких пределах;
2) наличие у раствора свойств, присущих компонентам; так, например, натрий одинаково взаимодействует с
водой и раствором сахарозы или хлорида натрия.
С химическими соединениями растворы сближает:
1) гомогенность;
2) наличие у растворов свойств, отсутствующих у компонентов; например, бесцветная вода и бесцветный
безводный сульфат меди образуют раствор голубого цвета;
3) наличие тепловых эффектов при образовании раствора, которые могут быть как положительными, так и
отрицательными; например, при растворении в воде серной кислоты температура раствора повышается, а при
растворении нитрата аммония - понижается.
133
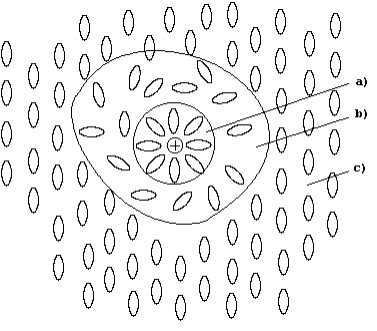
Двойственный характер свойств растворов объясняет гидратная (сольватная) теория растворов, основы
которой были заложены в работах Д. И. Менделеева и развиты впоследствии И. А. Каблуковым и В. А.
Кистяковским. Эта теория может быть сведена к следующим положениям:
1. При образовании раствора растворитель и растворенное вещество вступают в химическое
взаимодействие, образуя непрочные соединения, называемые сольватами, а в случае воды - гидратами.
Сольваты (гидраты) образуются в результате межмолекулярного взаимодействия, за счет образования
водородных связей и ковалентных связей по донорно-акцепторному механизму. Чаще всего связь в сольватах
имеет смешанный характер. В результате любой раствор является сложной гомогенной системой из частиц
растворителя, растворенного вещества и продуктов их взаимодействия, образование которой сопровождается
нарушением структуры растворителя (рис. 61).
2. Реакции сольватации (гидратации) заметно обратимы, и равновесия в растворах легко смещаются. В
результате раствор сохраняет свойства растворителя и растворенного вещества.
3. Образование сольватов (гидратов) обусловливает появление у растворов свойств, отсутствующих у
компонентов раствора; в частности, гидратированные ионы могут иметь иную окраску, чем те же ионы в
кристалле вещества.
4. Тепловые эффекты, которыми сопровождается образование раствора, связаны с фазовыми переходами
при образовании раствора и с протеканием процессов сольватации. Тепловой эффект, отвечающий
растворению моля вещества в бесконечно большом количестве растворителя, называется энтальпией
растворения (ΔН
раств
). Например, для серной кислоты ΔН
раств
составляет -96,2 кДж/моль, для нитрата аммония она
равна 25,8 кДж/мол.
Поскольку растворы образуются самопроизвольно, в процессе растворения вещества свободная энергия
системы должна понижаться, т.е.
ΔG
раств
< 0
В соответствии с уравнением (8-29)
ΔG
раств
=ΔН
раств
- ТΔS
раств
(9-7)
где ΔS
раств
- изменение энтропии при образовании раствора.
Рис. 61. Схематическое строение жидкого раствора:
а) зона сольватированной частицы растворенного вещества;
b) зона деструктированного растворителя;
c) зона структурированного растворителя.
Энтальпийный и энтропийный члены в уравнении (9-7) можно представить как сумму двух слагаемых, одно
из которых связано с фазовым переходом, а другое - с процессом сольватации
ΔН
раств
= ΔН
фп
+ ΔН
сольв
, (9-8)
ΔS
раств
= ΔS
фп
+ ΔS
сольв
(9-9)
В уравнениях (9-8) и (9-9) ΔН
сольв
и ΔS
сольв
- отрицательные величины, так как при образовании сольватов энергия
системы понижается, а упорядоченность ее возрастает, тогда как ΔН
фп
и ΔS
фп
- величины положительные,
поскольку переход растворенного вещества в раствор сопровождается разрушением структуры этого вещества и
повышением неупорядоченности системы. В результате значения ΔН
раств
и ΔS
раств
могут быть как
положительными, так и отрицательными. При этом, если ΔН
раств
> 0, раствор образуется лишь в тех случаях,
когда ΔS
раств
> 0. При растворении кристаллических веществ
ΔН
фп
= -Е
кр
,
где Е
кр
- энергия кристаллической решетки, являющаяся положительной величиной.
134

5. Образование раствора сопровождается изменением объема системы сравнительно с суммой объемов
растворителя и растворенного вещества. При этом величина
)V(V-VV
10pраств
может быть как
положительной, так и отрицательной. Так, объем раствора, содержащего 50 г воды и 50 г этилового спирта,
составляет при стандартных условиях 109,9 мл, тогда как сумма объемов спирта и воды равна 113,5 мл.
Образование раствора в этом случае сопровождается сжатием. Насыщенный раствор нитрата аммония
содержит 68,19 масс.% NH
4
NO
3
; объем 100 г такого раствора равен 75,8 мл, а сумма объемов компонентов
составляет 73,0 мл, т.е. образование раствора сопровождается расширением системы.
Раствор, для которого энтальпия растворения и изменение объема равны нулю, называется идеальным
раствором.
Способность того или иного вещества переходить в раствор характеризует растворимость этого вещества.
По способности к взаимной растворимости пáры веществ можно разделить на вещества с неограниченной
растворимостью, например, этиловый спирт и вода, смешивающиеся в любых соотношениях, и вещества с
ограниченной растворимость, например, вода и диэтиловый эфир. Для последней группы веществ
количественной мерой растворимости является концентрация насыщенного раствора.
Насыщенным раствором называется раствор, находящийся в динамическом равновесии с избытком
растворяемого вещества.
Для выражения растворимости может быть использован любой способ выражения концентрации
(молярность, массовая доля, молярная доля и т.д.); часто для этой цели используют коэффициент
растворимости k, равный массе растворенного вещества, образующей насыщенный раствор со 100 г
растворителя при данной температуре. В зависимости от значения коэффициента растворимости вещества
подразделяют на четыре группы:
1) легкорастворимые вещества, k>10 (например, H
2
SO
4
, NaOH, KNO
3
в водных растворах);
2) умеренно растворимые вещества, 10>k>1 (например, Н
3
ВО
3
, Ba(NO
3
)
2
, HgCl
2
в водных растворах);
3) малорастворимые вещества, 1>k>0,01 (например, PbCl
2
, Ag
2
SO
4
, TlCl);
4) практически нерастворимые вещества, k<0,01 (например, Cu(OH)
2
, BaSO
4
, AgI).
Следует отметить, что абсолютно нерастворимых веществ в природе не существует.
Растворимость вещества зависит от ряда факторов:
1. Природа растворителя и растворенного вещества
В зависимости от этого фактора растворимость изменяется в чрезвычайно широких пределах. Так,
например, при стандартных условиях растворимость хлорида калия в воде составляет 35,9 г на 100 г
растворителя, тогда как растворимость того же вещества в бензоле практически равна нулю; в то же время в 100
г воды растворяется 0,002 г нафталина (С
10
Н
8
), а в 100 г бензола - 67,5 г. К сожалению, до настоящего времени
нет единой теории, позволяющей количественно прогнозировать влияние природы веществ на растворимость. В
этом плане более или менее удачно соблюдается правило: "Подобное растворяется в подобном". В
соответствии с этим правилом вещества, образованные полярными молекулами или ионами, лучше
растворяются в полярных растворителях, а вещества, молекулы которых неполярны, - в неполярных
растворителях.
2. Температура
Влияние температуры на растворимость зависит от агрегатного состояния растворяемого вещества.
В случае газов энтальпия фазового переход из газообразного состояния вещества в растворенное весьма
мала. В силу этого процесс растворения газов в жидкостях в соответствии с уравнением (9-8) является
экзотермическим. Равновесие
вещество газообразное
вещество растворенное; ΔН<0
в соответствии с принципом Ле Шателье при повышении температуры смещается в сторону обратного процесса,
что приводит к понижению растворимости газа. Так, например, при стандартном давлении (1,013
.
10
5
Па)
растворимость диоксида углерода в воде составляет при 0
о
С 0,35 г а при 15
о
С - 0,20 г на 100 г воды.
Влияние температуры на растворимость жидкостей в жидкостях весьма своеобразно. Для одной и той же
пары растворитель - растворенное вещество в определенных температурных интервалах возможно как
повышение, так и понижение растворимости с ростом температуры. Так, никотин (C
10
H
14
N
2
) неограниченно
растворим в воде при температурах ниже 61
о
С и выше 208
о
С. В интервале 61 < t
o
C < 208 вода и никотин
образуют систему из двух жидких фаз, представляющих два взаимно насыщенных раствора. Например, при 80
о
С один из этих растворов будет содержать 9,8 масс.%, а другой - 74,2 масс.% никотина. Температура,
соответствующая переходу ограниченной растворимости в неограниченную, называется критической
температурой растворения (верхней и нижней). Известны пáры жидкостей с одной критической температурой
растворения (например, вода и анилин неограниченно растворимы при температурах, превышающих 160
о
С) и
вообще не имеющие критической температуры растворения (например, вода и диэтиловый эфир).
Растворимость твердых веществ в жидкостях с повышением температуры обычно повышается, причем
иногда очень значительно. Так, коэффициент растворимости борной кислоты - Н
3
ВО
3
- в воде при изменении
температуры от 0
о
С до 100
о
С изменяется от 2,8 до 38,0 г. Однако для некоторых веществ повышение
растворимости с ростом температуры незначительно. Например, для хлорида натрия в температурном
интервале 0÷100
о
С коэффициент растворимости изменяется от 35,7 до 39,4 г. Известны вещества,
растворимость которых понижается с повышением температуры. Такими веществами являются, в частности,
сульфат и хромат кальция. Иногда температурная кривая растворимости проходит через максимум. Так,
максимальная растворимость Na
2
SO
4
10H
2
O (53 г соли на 100 г воды) отвечает 32
о
С; дальнейшее повышение
135
температуры сопровождается понижением растворимости. Подобные явления наблюдаются обычно тогда, когда
при нагревании имеет место изменение состава твердой фазы, находящейся в равновесии с раствором, в
результате потери части или всей кристаллизационной воды.
3. Давление
Давление особо сильно влияет на растворимость газа в жидкостях. Действительно, поскольку в системе
жидкость - газ растворение газа сопровождается значительным уменьшением объема системы, повышение
давления способствует увеличению растворимости газа. Количественно зависимость между давлением газа и
его растворимостью выражается законом Генри:
При постоянной температуре масса газа, растворяющегося в данном объеме жидкости,
пропорциональна парциальному давлению газа над жидкостью.
Закон Генри является приближенным законом; наиболее строго ему следуют растворы малорастворимых
газов при невысоких давлениях. Так, например, при 298 К коэффициент растворимости азота в воде составляет
при 2,0·10
6
Па 0,00125 г, а при 4,0
.
10
6
Па - 0,00246 г.
Поскольку сжимаемость жидкостей и твердых веществ очень мала, давление слабо влияет на изменение
растворимости этих веществ в жидкостях. Лишь в условиях очень высоких давлений (порядка 10
8
- 10
10
Па)
влияние этого фактора становится ощутимым. Поскольку ΔV
раств
может быть и отрицательной, и положительной,
величиной, следует ожидать, что повышение давления может и повышать (если ΔV
раств
<0), и понижать (если
ΔV
раств
>0) растворимость. Действительно, в случае нитрата аммония, для которого ΔV
раств
>0, повышение
давления от 10
5
до 10
9
Па сопровождается понижением растворимости в два раза.
При контакте насыщенного раствора с растворяемым веществом процессы растворения и кристаллизации
протекают с одинаковой скоростью (ΔG = 0), в силу чего при неизменяющихся условиях насыщенный раствор
может существовать сколь угодно долго без изменения его концентрации. Однако для ряда веществ можно
получить растворы, концентрация которых выше концентрации насыщенного раствора. Такие растворы
называют пересыщенными растворами. Так, например, при нагревании кристаллического Na
2
S
2
O
3
.
5H
2
O
тиосульфат натрия растворяется в кристаллизационной воде. Если такой раствор медленно охладить до
первоначальной температуры, кристаллизации тиосульфата натрия не наблюдается, так как последний образует
пересыщенный раствор. В отличие от насыщенного, пересыщенный раствор не является равновесной системой.
В этом случае система находится в неустойчивом (метастабильном) состоянии, для которого ΔG>0. Поэтому
даже при незначительном воздействии (встряхивание сосуда, внесение в раствор крупинки растворенного
вещества) избыток растворенного вещества выкристаллизовывается из раствора, который при этом становится
насыщенным.
9.2. Разбавленные растворы неэлектролитов.
Коллигативные свойства растворов
Как указывалось в разделе 9.1, в связи с высокой сложностью взаимодействия в системах растворитель -
растворенное вещество общую теорию растворов до сих пор не удалось создать. Наиболее простые
закономерности должны быть присущи идеальному раствору, для которого ΔН
раств
и ΔV
раств
равны нулю, а
химическое взаимодействие компонентов отсутствует. Из реальных растворов к идеальному раствору
приближаются разбавленные растворы неэлектролитов. Изучение этой группы растворов показало, что
некоторые свойства их не зависят от природы растворенного вещества, а определяются лишь концентрацией
раствора и природой растворителя. Подобные свойства получили название коллигативных свойств растворов. К
коллигативным свойствам относятся давление насыщенного пара над раствором, температуры кипения и
замерзания раствора, а также осмотическое давление раствора.
1. Давление насыщенного пара над раствором
Для веществ, способных переходить без разложения в газообразное состояние, одним из важных
физических свойств является давление насыщенного пара этого вещества. Пусть такое вещество в твердом
или жидком состоянии, находясь в замкнутом сосуде, контактирует с газовой фазой. В этом случае на
поверхности раздела фаз будут протекать процессы испарения или сублимации и конденсации или
десублимации. Спустя некоторое время такая система придет в состояние равновесия при определенном
давлении пара, обеспечивающем равенство скоростей прямого и обратного процессов. Таким образом, при
постоянной температуре давление насыщенного пара для данного вещества есть величина постоянная.
Поскольку процесс испарения эндотермичен, повышение температуры будет сопровождаться повышением
давления насыщенного пара. Диаграммы, выражающие зависимость между температурой и давлением
насыщенного пара, называются диаграммами состояния вещества. На рис. 62 схематически изображена
диаграмма состояния вещества, существующего в кристаллическом, жидком и газообразном состояниях,
построенная в координатах Т, р.
Как следует из рис. 62, диаграмма состоит из трех полей. Поле 1 включает множество значений р и Т,
отвечающих газообразному состоянию вещества, поля 2 и 3 отвечают условиям, при которых система
однофазна, а вещество находится в жидком (поле 2) или твердом (поле 3) состоянии. Линии, разграничивающие
указанные поля, соответствуют значениям р и Т, при которых система двухфазна. Так, кривая АО отвечает
условиям, при которых в состоянии равновесия находятся твердое вещество и его пар, кривая ОВ - жидкость и
пар, кривая OD - твердое вещество и жидкость. Точка О соответствует температуре и давлению, при которых в
состоянии равновесия находятся пар, жидкость и кристаллы данного вещества (тройная точка). Так, для воды
тройная точка отвечает температуре 273,15 К и давлению водяного пара, равному 610 Па.
136

Т'
зам
Т
2
Т
1
Т
0
зам
Т
0
кип
Т'
кип
p
внеш
p
D
X
H
O
N
Y
O'
A
K
Q
R
K'
F
E
B
B'
G
L
SM
1
2
3
R'
R
1
'
.
.
U
1
U
Рис. 62. Давление пара над растворителем и раствором
При изменении температуры и давления число фаз системы может изменяться. Число параметров, которые
можно изменять независимо друг от друга без изменения числа фаз, называют числом степеней свободы.
Последнее связано с числом компонентов и фаз системы правилом фаз Гиббса:
С + Ф = К + 2,
где С - число степеней свободы, Ф - число фаз, К - число компонентов. Если система однокомпонентна,
С = 3 – Ф
Правило фаз позволяет определить число степеней свободы для любой точке диаграммы состояния. Так,
для точки R’ (рис. 62) К=1, Ф=1, откуда С=2; действительно, для этого состояния температуру и давление можно
в определенных пределах менять независимо друг от друга, а система будет оставаться однофазной (например,
при переходе из точки R’ в точку R
1
’). Для точки U K = 1, Ф = 2 и, следовательно, С = 1. Для этой точки можно
произвольно изменять лишь один параметр (либо р, либо Т), а второй параметр должен изменяться строго
определенным образом, чтобы точка U
1
попала на кривую ОВ. Наконец, для тройной точки О число степеней
свободы равно нулю; в этом случае изменение хотя бы одного параметра приводит к превращению трехфазной
системы в двухфазную или однофазную.
Пусть в чистый растворитель вводят растворимое в нем нелетучее соединение. В результате концентрация
этого вещества в растворе возрастает от нуля до некоторой величины, а концентрация растворителя
уменьшается. В соответствии с принципом Ле Шателье равновесие
испарение
раствор пар
конденсация
должно сместиться в сторону процесса, сопровождающегося понижением концентрации растворенного вещества
и повышением концентрации растворителя, т.е. процесса конденсации. Давление насыщенного пара при этом
уменьшится. Отсюда следует, что давление пара над раствором ниже давления пара над чистым
растворителем. Соответственно на диаграмме состояния (рис. 62) кривая давления насыщенного пара над
раствором пройдет ниже кривой ОВ (кривая О΄В΄).
Взаимосвязь между давлением насыщенного пара и концентрацией раствора отражает первый закон Рауля
(1887).
Относительное понижение давления насыщенного пара над раствором равно молярной доле
растворенного вещества:
10
1
0
10
νν
ν
p
pp
, (9-10)
где р
0
и р
1
- давление насыщенного пара над растворителем и раствором, ν
0
и ν
1
- количества (число молей)
растворителя и растворенного вещества. Преобразование уравнения (9-10) приводит к формуле
10
0
01
νν
ν
pp
(9-11)
Давление пара над раствором равно, таким образом, давлению пара над чистым растворителем, умноженным
на молярную долю растворителя.
137

Первый закон Рауля строго применим лишь для идеальных растворов. Однако ему достаточно точно
следуют разбавленные растворы нелетучих неэлектролитов.
2.Температуры замерзания и кипения растворов
Вещества, существующие в кристаллическом, жидком и газообразном состояниях, характеризуются
определенными температурами кипения и замерзания (кристаллизации). Эти характеристики непосредственно
связаны с давлением насыщенного пара над соответствующим соединением.
Температура кипения жидкости - это температура, при которой давление насыщенного пара над жидкостью
становится равным внешнему давлению. При этой температуре переход жидкости в пар происходит не только с
поверхности жидкости, но и во всем ее объеме, вследствие чего в жидкой фазе наблюдается непрерывное
образование и рост пузырьков пара, всплывающих и разрушающихся. На рис. 62 кипению жидкости
соответствует температура Т
0
кип
, при которой давление пара над жидкостью (кривая ОВ) становится равным
внешнему давлению р
внеш
. При постоянном давлении температура кипения зависит от природы жидкости. Так,
при стандартном давлении вода кипит при 100
о
С, бензол - при 80,1
о
С, этанол - при 78,4
о
С.
Поскольку давление насыщенного пара над раствором меньше, чем над растворителем, растворы кипят при
более высоких температурах, чем чистый растворитель. Так, при температуре Т
0
кип
(рис. 62) давление пара над
раствором (отрезок GF) будет меньше внешнего давления (отрезок EF), и раствор кипеть не будет. Чтобы
раствор закипел, его необходимо нагреть до температуры Т΄
кип
, при которой давление насыщенного пара
достигнет внешнего давления.
Температурой замерзания жидкого вещества является температура, при которой твердая и жидкая фазы
этого вещества находятся в состоянии равновесия и могут сосуществовать сколь угодно долго. Необходимым
условием равновесия между жидкой и твердой фазой является равенство значений давления насыщенного пара
над жидкостью (р
ж
) и кристаллическим твердым веществом (р
к
); если условие р
к
= р
ж
не соблюдается, фаза с
большим давлением пара переходит в фазу с меньшим давлением пара. Так, на рис. 62 равновесие между
твердой и жидкой фазами будет иметь место при температуре Т
0
зам
. Если смесь твердой и жидкой фаз нагреть до
температуры Т
1
(Т
1
>T
зам
) давление пара над твердой фазой (отрезок НК') станет больше давления пара над
жидкой фазой (отрезок LK') и твердая фаза расплавится; при температуре Т
2
(Т
2
<T
0
зам
) р
ж
(отрезок NQ) больше р
к
(отрезок MQ), и жидкость замерзнет.
Заметим, однако, что если температуру жидкости понижать очень медленно, то ее можно охладить до
температуры более низкой, чем температура замерзания, без изменения агрегатного состояния
(переохлажденная жидкость). Точно так же при медленном нагревании кристаллического вещества можно
получить перегретое твердое вещество, температура которого выше температуры замерзания вещества.
Переохлажденная жидкость и перегретое твердое вещество метастабильны: даже незначительное воздействие
на них приводит к переходу системы в стабильное состояние - жидкое (Т > T
0
зам
) или кристаллическое (Т < T
0
зам
).
На рис. 62 состояниям переохлажденной жидкости и перегретого твердого вещества соответствуют кривые OY и
OX.
Пусть в раствор, охлажденный до температуры замерзания чистого растворителя Т
0
зам
, поместили кристалл
твердого растворителя. В такой системе давление насыщенного пара над твердой фазой (отрезок OR на рис. 62)
будет больше давления пара над раствором (отрезок SR), и твердый растворитель перейдет в жидкое
состояние. Для того чтобы между раствором и кристаллами твердого растворителя имело место равновесие,
систему необходимо охладить до температуры Т΄
зам
(Т΄
зам
<T
0
зам
), при которой давление пара над раствором и
кристаллическим растворителем станут одинаковыми (отрезок O΄K). Таким образом, растворы замерзают при
более низких температурах, чем чистый растворитель.
Ф. Рауль, изучая влияние концентрации раствора и природы растворителя на замерзание и кипение
растворов, установил закономерность, называемую вторым законом Рауля:
Повышение температуры кипения и понижение температуры замерзания раствора пропорционально
числу частиц растворенного вещества в данной массе растворителя и не зависит от природы
растворенного вещества.
Математически второй закон Рауля выражается уравнениями:
ΔТ
кип
= EC
m
, (9-12)
ΔТ
зам
= КС
m
,
(9-13)
где ΔТ
кип
и ΔТ
зам
- повышение температуры кипения и понижение температуры замерзания раствора, С
m
-
моляльная концентрация раствора, Е (эбулиоскопическая константа) и К (криоскопическая константа) -
коэффициенты пропорциональности, зависящие от природы растворителя. Так, для воды эбулиоскопическая и
криоскопическая константы равны соответственно 0,516 и 1,86, а для бензола - 2,57 и 5,12.
Второму закону Рауля подчиняются лишь разбавленные растворы неэлектролитов.
На втором законе Рауля основаны эбулиоскопический и криоскопический методы определения
молекулярных масс растворенных веществ. Подставив в уравнения (9-12) и (9-13) значение С
m
из уравнения (9-
6) и решив их относительно М
1
, имеем:
кип0
1
1
Тm
1000Em
M
, (9-14)
138

зам0
1
1
Tm
1000Km
M
(9-15)
где m
1
и М
1
- масса и молекулярная масса растворенного вещества, m
0
- масса растворителя.
Если закипевший раствор продолжать нагревать, растворитель испаряется, концентрация раствора
увеличивается, а температура кипения повышается. Это продолжается до тех пор, пока раствор не станет
насыщенным и не начнется кристаллизация растворенного вещества. После этого изменение концентрации
раствора прекратится, а температура кипения перестанет изменяться. Насыщенные растворы, таким образом,
кипят при постоянной температуре.
Если охлаждать не слишком концентрированный раствор, из него выделяются кристаллы твердого
растворителя (например, льда). Концентрация раствора при этом увеличивается, а температура замерзания
понижается. Этот процесс продолжается до тех пор, пока концентрация раствора не достигнет некоторой
величины, зависящей от природы растворенного вещества и растворителя. После этого произойдет
отвердевание всего раствора с образованием смеси кристаллов растворителя и растворенного вещества. Такая
смесь называется эвтектикой (от греческого eutektos - "легко плавящийся"). Концентрация раствора и
температура, отвечающие образования эвтектики, называют эвтектическими. Так, для хлорида натрия
эвтектическая концентрация составляет 24,42%, а эвтектическая температура равна - 21,2 С. Эвтектическая
температура является самой высокой температурой, при которой растворитель и растворенное вещество могут
совместно существовать в кристаллическом состоянии. Если охлаждать раствор, концентрация которого выше
эвтектической, то начинается кристаллизация соли, концентрация понижается до эвтектической, после чего
образуется эвтектика.
На рассмотренном явлении основано использование охлаждающих смесей для получения и поддержания
низких температур. Пусть кристаллы льда смешаны с кристаллическим хлоридом натрия. Лед и хлорид натрия
не могут существовать при температуре выше -21,2 С. В силу этого лед начинает плавиться. Плавление льда
сопровождается поглощением теплоты и понижением температуры смеси. Разумеется, таким образом нельзя
получить температуру ниже эвтектической. Максимальное понижение температуры определяется свойствами
растворителя и растворенного вещества, а также составом смеси. Например, смесь, содержащая 43 масс.%
льда и 57 масс. % K
2
CO
3
, позволяет понизить температуру до - 46 С, а смесь твердого диоксида углерода
("сухой лед
") и этилового спирта - до -80 С.
3. Осмос и осмотическое давление
Если привести в соприкосновение раствор и растворитель или два раствора с различными концентрациями,
то в системе начнет протекать процесс диффузии, приводящий к выравниванию концентраций этих растворов.
Процесс диффузии протекает самопроизвольно, так как он сопровождается возрастанием энтропии системы, и
носит двусторонний характер: выравнивание концентраций достигается за счет диффузии молекул как
растворенного вещества, так и растворителя.
Иначе протекает процесс выравнивания концентраций, если растворитель и раствор отделить друг от друга
мембраной, проницаемой для молекул растворителя, но непроницаемой для молекул растворенного вещества
(полупроницаемая мембрана). Схема подобного эксперимента приведена на рис. 63.
В сосуд 1 с чистым растворителем погружен заполненный раствором сосуд 2, дно которого является
полупроницаемой мембраной (3). В такой системе уменьшение разности концентраций в сосудах 1 и 2 может
осуществляться только за счет проникновения растворителя из сосуда 1 в сосуд 2. Объем раствора в сосуде 2
при этом увеличивается, и уровень жидкости в градуированной трубке 4 поднимается.
4
3
2
1
h
Рис. 63. Осмометр: 1 – сосуд с растворителем; 2 – сосуд с раствором; 3 – полупроницаемая мембрана;
4 – градуированная трубка.
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и
растворитель или два раствора с различной концентрацией называется осмосом. Осмос можно
рассматривать как одностороннюю диффузию растворителя через полупроницаемую мембрану. В качестве
полупроницаемых мембран используют пленки из природных и синтетических полимеров (оболочка мочевого
пузыря животных, пленки из нитроцеллюлозы и т.д.).Очень прочные полупроницаемые перегородки получают из
пористого фарфора, обработанного последовательно растворами CuSO
4
и K
4
[Fe(CN)
6
]; в порах фарфора при
этом осаждается гексацианоферрат меди Cu
2
[Fe(CN)
6
], сообщающий материалу свойство полупроницаемости.
139

Столб жидкости в трубке 4 оказывает на раствор в сосуде 2 внешнее (гидростатическое) давление,
препятствующее осмосу: под действием внешнего давления растворитель просачивается через мембрану из
сосуда 2 в сосуд 1 (обратный осмос). При определенной высоте столба жидкости h в системе устанавливается
динамическое равновесие, после чего объем раствора перестает изменяться.
Мера стремления системы растворитель - полупроницаемая мембрана - раствор к равномерному
распределению растворенного вещества называется осмотическим давлением раствора. Осмотическое
давление равно внешнему давлению, которое необходимо приложить к раствору, чтобы привести его в
равновесие с чистым растворителем, отделенным от раствора полупроницаемой мембраной.
В середине XIX столетия было установлено, что осмотическое давление растворов прямо пропорционально
абсолютной температуре и обратно пропорционально разбавлению раствора. Г. Вант-Гофф обратил внимание
на аналогию этих закономерностей с газовыми законами Гей-Люссака и Бойля-Мариотта и сформулировал
закон, позволяющий теоретически рассчитывать осмотическое давление.
Осмотическое давление раствора равно давлению, которое оказывало бы растворенное вещество,
находящееся в газообразном состоянии и занимающее объем, равный объему раствора (Вант-Гофф, 1887).
В соответствии с законом Вант-Гоффа для расчета осмотического давления можно использовать уравнение
состояния идеального газа, которое применительно к осмотическому давлению примет вид
CRTRT
V
, (9-16)
где - осмотическое давление в Па, С - концентрация растворенного вещества в моль/м
3
. Если концентрацию
выражать в моль/л, то уравнение (9-16) приобретет вид
1000CRT
(9-17)
Закону Вант-Гоффа подчиняются только разбавленные растворы неэлектролитов.
Следует отметить, что хотя осмотическое и газовое давление подчиняются одному и тому же уравнению с
одинаковым значением постоянной R, механизм их не имеет ничего общего: давление газа - результат
соударения молекул газа со стенками сосуда, тогда как осмотическое давление проявляется в системе из двух
растворов, разделенных полупроницаемой мембраной.
9.3. Растворы электролитов
9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
В начале XIX столетия, после изобретения А. Вольта первого химического источника электрического тока,
было обнаружено, что водные растворы ряда химических соединений (кислот, щелочей, солей) способны
проводить электрический ток. Первоначально предполагалось, что это явление обусловлено тем, что кислоты,
основания и соли под действием электрического тока распадаются на ионы - положительно и отрицательно
заряженные частицы, способные направленно перемещаться в электрическом поле. Вещества, растворы
которых проводят электрический ток, были названы электролитами (в переводе с греческого - "расщепляемые
электричеством").
После открытия законов Рауля и Вант-Гоффа было обнаружено, что эти законы не применимы к растворам
электролитов: водные растворы кислот, щелочей и солей кипят при более высоких, а замерзают при более
низких температурах, чем это следует из закона Рауля; их осмотическое давление превышает величину,
рассчитанную по уравнению Вант-Гоффа. Растворы электролитов, таким образом, ведут себя так, как будто
действительное число частиц в этих растворах больше, чем в растворах неэлектролитов той же молярности.
Стремясь распространить уравнения, описывающие коллигативные свойства растворов неэлектролитов на
растворы электролитов, Вант-Гофф предложил ввести в уравнения (9-10), (9-12), (9-13) поправочный множитель
i, названный изотоническим коэффициентом. В уравнениях
= iCRT; ΔТ
кип
= iEC
m
; ΔТ
зам
= iKC
m
(9-17)
коэффициент i в случае неэлектролитов равен единице, а в случае электролитов превышает единицу. Было
установлено, что значение i зависит от природы электролита и концентрации раствора; при разбавлении
раствора изотонический коэффициент возрастает, стремясь к целым числам (например, к двум для хлорида
натрия, к трем для хлорида кальция и т.д.).
В 1887 г. С. Аррениус показал, что особенности растворов электролитов могут быть объяснены, если
предположить, что электролиты распадаются на ионы не под действием электрического тока, а непосредственно
в процессе растворения. С. Аррениусом была разработана теория электролитической диссоциации, сводящаяся
к следующим основным положениям:
1. Электролиты в растворе самопроизвольно распадаются на ионы. Процесс распада электролита на ионы
под действием растворителя называется электролитической диссоциацией (ионизацией). Растворители,
вызывающие ионизацию растворенного вещества, называются ионизирующими. Кроме воды, ионизирующими
растворителями являются жидкий фтороводород, жидкий аммиак, в меньшей мере метанол, этанол, муравьиная
кислота и другие вещества. Поскольку при диссоциации молекула электролита образует не менее двух ионов,
число частиц при диссоциации увеличивается, что и приводит к отклонению свойств раствора от законов Вант-
Гоффа и Рауля.
140
