Гюннер Э.А., Шульгин В.Ф. Общая химия
Подождите немного. Документ загружается.


2. Изотонический коэффициент Вант-Гоффа представляет собой отношение действительного числа частиц в
растворе, равному сумме чисел молекул и ионов (N΄), к числу частиц, соответствующему значению концентрации
раствора (N)
N
NN
N
N
i
ионмол
(9-18)
3. Процесс электролитической диссоциации обратим: наряду с диссоциацией в системе протекает
моляризация - образование молекул растворенного вещества из ионов. Так, в растворе электролита XY
устанавливается равновесие
XY X
+
+ Y
-
(9-19)
которое может быть смещено в сторону как прямой, так и обратной реакции в соответствии с принципом Ле-
Шателье. Этим объясняется, в частности, изменение коэффициента i при разбавлении раствора. Количественно
процесс диссоциации характеризует степень электролитической диссоциации (ионизации). Степень
электролитической диссоциации (α) - это отношение числа молекул электролита, распавшихся на ионы (N
расп
), к
первоначальному числу молекул растворенного вещества (N)
N
N
расп
(9-20)
Таким образом, степень электролитической диссоциации равна доле молекул электролита, распавшихся
на ионы, и, соответственно, изменяется от нуля до единицы (или от 0 до 100%).
В зависимости от наблюдаемого значения степени электролитической диссоциации в растворах,
содержащих 0,1 моль/л растворенного вещества, электролиты подразделяются на три группы:
1. Сильные электролиты (α > 30%). К сильным электролитам в водных растворах относятся многие
неорганические кислоты (например, HCl, HNO
3
, H
2
SO
4
) гидроксиды щелочных и щелочноземельных металлов и
почти все соли.
2. Слабые электролиты (α < 3%). Слабыми электролитами являются большинство органических кислот
(например, уксусная), некоторые неорганические кислоты (например, HClO, H
3
BO
3
), аммиак и амины, а также
некоторые соли (HgCl
2
, HgBr
2
).
3. Электролиты средней силы (3 < α < 30%). Примерами таких электролитов могут служить фосфорная
(Н
3
РО
4
), щавелевая (Н
2
С
2
О
4
), хлоруксусная (ClСН
2
СООН) кислоты.
Теория электролитической диссоциации объяснила причины неподчинения растворов электролитов законам
Рауля и Вант-Гоффа. Однако эта теория в изложенной выше форме не учитывала влияние на процесс
диссоциации ряда факторов, а потому оказалась применимой не для всех групп электролитов. Чтобы
определить границы приложения этой теории, рассмотрим современные представления о механизме ионизации
электролитов в растворах.
Распаду на ионы могут подвергаться вещества как с ионной, так и с полярной связью. Если вещество имеет
ионную кристаллическую решетку и, следовательно, надмолекулярную структуру, то процесс образования
раствора электролита сводится к разъединению ионов кристалла и распределению их по всему объему
раствора. Этот процесс связан с химическим взаимодействием ионов поверхностного слоя кристалла с
молекулами растворителя, например, воды. В результате в раствор переходят не свободные, а
сольватированные ионы, свойства которых существенно отличаются от свойств соответствующих ионов в
кристалле или в газовой фазе. Поскольку ионы в данном случае не образуются в результате ионизации молекул
(электролит имеет надмолекулярную структуру), а лишь разъединяются, именно этот процесс уместно называть
электролитической диссоциацией. В результате процесс моляризации в подобных системах протекать не может,
а степень диссоциации утрачивает физический смысл и становится кажущейся величиной, обеспечивающей
экспериментально наблюдаемое значение изотонического коэффициента раствора.
Для веществ, образованных полярными молекулами, наблюдается иной механизм распада на ионы. В этом
случае между молекулами растворенного вещества и полярными молекулами ионизирующего растворителя
имеет место межмолекулярное диполь-дипольное взаимодействие. При этом молекулы растворителя
ориентируются так, как это показано на рис 64. В результате полярность связи в молекулах электролита
возрастает вплоть до разрыва полярной связи и образования сольватированных ионов. Этот процесс уместно
назвать процессом ионизации, так как он сопровождается образованием ионов, отсутствующих в растворяемом
веществе. Таким образом, в растворе хлорида натрия будет протекать процесс электролитической диссоциации,
а в растворе хлороводорода - процесс ионизации.
+
-
+
+
+
+
+
+
-
-
-
-
-
-
+
-
+
+
+
+
+
+
-
-
-
-
-
-
+
+ +
+
+
+
+
-
-
-
-
-
-
-
Рис. 64. Ионизация полярной молекулы
Сольватация (в случае воды - гидратация) ионов является весьма сложным физико-химическим процессом,
в котором реализуются различные виды взаимодействия. Так, катионы в водных растворах могут
гидратироваться по донорно-акцепторному механизму, выступая в качестве акцепторов электронных пар атомов
141

кислорода воды. Образовавшиеся аквакомплексы дополнительно гидратируются за счет водородных связей.
Кроме того они могут взаимодействовать с водой по ион-дипольному механизму, определенным образом
ориентируя и поляризуя окружающие частицу молекулы воды. Так, катион водорода Н
+
в растворе практически
мгновенно присоединяет молекулу воды, образуя ион гидроксония Н
3
О
+
, имеющий форму тригональной
пирамиды. Этот ион быстро присоединяет еще три молекулы воды, образуя три водородные связи НО, и
превращается в ион [H
9
O
4
]
+
, который дополнительно взаимодействует с растворителем по ион-дипольному
механизму. По аналогичной схеме гидратируются и другие катионы. Анионы в водных растворах акцепторные
свойства не проявляют; они гидратируются в основном за счет образования водородных связей и путем ион-
дипольного взаимодействия.
Вторым фактором, который теория Аррениуса не учитывает, является электростатическое взаимодействие
ионов: отталкивание одноименно заряженных ионов и притяжение ионов с противоположным знаком заряда
существенно влияет на свойства растворов электролитов, причем тем сильнее, чем больше концентрация ионов
в растворе.
В результате теории Аррениуса наиболее строго следуют только слабые электролиты, в растворах которых
содержатся как молекулы, так и ионы электролита, а электростатическое взаимодействие между ионами
невелико, так как их концентрация мала.
9.3.2. Теория растворов слабых электролитов.
9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
Поскольку в растворах слабых электролитов имеет место процесс ионизации растворенного вещества, долю
распавшихся на ионы молекул электролита предпочтительнее называть степенью ионизации, а не степенью
электролитической диссоциации. Рассмотрим факторы, влияющие на степень ионизации слабого электролита.
1. Природа электролита
Различные электролиты при одинаковых концентрациях и температурах могут весьма существенно
отличаться по степени ионизации. Например, для одноосновных кислот СН
3
СООН, HClO и HCN в децимолярных
растворах при 25 ˚С степень ионизации составляет 1,32, 0,054 и 0,007% соответственно.
2. Концентрация раствора
С увеличением разбавления (уменьшением концентрации) раствора степень ионизации слабого
электролита увеличивается (закон разбавления В.Оствальда). Действительно, разбавление раствора
сопровождается понижением его осмотического давления, что приводит к смещению равновесия (9-19) в сторону
процесса ионизации, поскольку этот процесс сопровождается увеличением числа частиц и, следовательно,
осмотического давления. Так, для уксусной кислоты понижение концентрации от 0,1 до 0,0001 моль/л
сопровождается повышением степени ионизации от 1,32% до 42%.
3. Температура
Повышение температуры обычно сопровождается увеличением степени ионизации. Однако известны
вещества, для которых при повышении температуры степень ионизации проходит через максимум. Причины
этого явления будут рассмотрены в разделе 9.3.2.2.
Степень ионизации может быть определена разными методами. Чаще всего ее устанавливают путем
измерения либо изотонического коэффициента, либо электропроводности раствора.
Как указывалось в разделе 9.2.1, изотонический коэффициент раствора равен отношению экспериментально
установленного значения коллигативного свойства к величине, рассчитанной по уравнениям Вант-Гоффа и
Рауля
m
экспэксп
KC
T
CRT
i
, (9-21)
где
- осмотическое давление, ΔТ - повышение температуры кипения или понижение температуры замерзания
раствора.
Пусть в данном объеме раствора растворено N молекул растворенного вещества, степень ионизации
которого равна α. Если из каждой распавшейся молекулы электролита образуется n ионов, то число
распавшихся на ионы молекул будет равно αN, число образовавшихся ионов - nαN, а число неионизированных
молекул электролита - N(1-α). В соответствии с (9-18)
)1n(1
N
Nn)-N(1
N
NN
i
ионмол
,
откуда
1-n
1-i
(9-22)
Таким образом, измерив понижение температуры замерзания, повышение температуры кипения или
осмотическое давление раствора, можно по уравнениям (9-21) и (9-22) рассчитать степень ионизации
электролита.
Второй способ определения степени ионизации основан на измерении электропроводности раствора
электролита. Электропроводность раствора - это величина, обратная его электрическому сопротивлению.
Различают удельную и эквивалентную электропроводность растворов. Удельная электропроводность () - это
электропроводность 1 см
3
раствора, заключенного между параллельными электродами площадью 1 см
2
;
размерность удельной электропроводности - Ом
-1
·см
-1
. При разбавлении раствора удельная электропроводность
понижается. Эквивалентная электропроводность (λ) - это электропроводность раствора, содержащего 1 моль
142

эквивалента растворенного вещества и заключенного между параллельными электродами, отстоящими друг от
друга на 1 см; размерность эквивалентной электропроводности - см
2
·Ом
-1
·моль
-1
. Удельная и эквивалентная
электропроводности связаны соотношением:
N
1000κ
λ
где N - нормальность раствора. При разбавлении раствора эквивалентная электропроводность повышается,
стремясь к некоторой постоянной для данного электролита величине, называемой эквивалентной
электропроводностью при бесконечном разбавлении (λ
∞
) и отвечающей полной ионизации содержащегося в
растворе электролита, т.е. ситуации, когда степень ионизации равна единице. Cтепень ионизации прямо
пропорциональна эквивалентной электропроводности и может быть рассчитана по уравнению
λ
λ
α
(9-23)
Значения λ
∞
для слабых электролитов трудно определить экспериментально, так как даже при очень высоких
разбавлениях слабые электролиты не подвергаются полному распаду на ионы. Так, уксусная кислота
диссоциирует на 99% в растворе, концентрация которого равна 2
.
10
-7
моль/л. Однако λ
∞
легко рассчитать, так как
она представляет сумму так называемых ионных проводимостей (подвижностей) ионов, образующих электролит,
которые не зависят от того, в состав какого вещества эти ионы входят:
λ
∞
=
кат
+
ан
где
кат
и
ан
- подвижности катиона и аниона. Подвижности ионов определены достаточно точно для большого
числа ионов, что позволяет рассчитывать значения λ
∞
для самых разнообразных электролитов.
Например, для ионов Н
+
и СН
3
СОО
-
подвижности равны при 25 ˚С 350 и 41 см
2
·Ом
-1
·моль
-1
, откуда
λ
∞
(СН
3
СООН) составляет 391 см
2
·Ом
-1
·моль
-1
.
9.3.2.2. Равновесия в растворах слабых электролитов.
Поскольку процессы ионизации обратимы, они подчиняются закону действия масс и могут быть
количественно охарактеризованы соответствующими константами равновесия. Остановимся на важнейших из
них.
1. Константа ионизации.
Константой ионизации электролита называют константу равновесия обратимой реакции распада
электролита на ионы.
Пусть электролит X
m
Y
n
ионизируется по уравнению
X
m
Y
n
mX
a+
+ nY
b-
(9-24)
Константа ионизации этого электролита
]YX[
][Y][X
K
nm
n-bma
(9-25)
Например, для уксусной кислоты в соответствии с уравнением ионизации
СН
3
СООН ↔ Н
+
+ СН
3
СОО
-
(9-26)
константа ионизации
COOH][CH
]COO][CH[H
K
3
-
3
1,74·10
-5
(9-27)
Если электролит ионизируется ступенчато, то каждой стадии процесса соответствует своя константа
ионизации. Так, для ортофосфорной кислоты ионизация протекает в три стадии:
Н
3
РО
4
Н
+
+ Н
2
РО
4
;
]PO[H
]PO][H[H
K
43
42
1
= 7,1·10
-3
;
H
2
PO
4
-
H
+
+ HPO
2
4
;
]POH[
]][HPO[H
K
-
42
-2
4
2
6,2·10
-8
;
HPO
2
4
H
+
+ PO
3
4
;
][HPO
]PO][H[
K
-2
4
-3
4
3
5,0·10
-13
Суммирование уравнений ступенчатой ионизации фосфорной кислоты дает общее уравнение ионизации этого
соединения
Н
3
РО
4
3Н
+
+ РО
3
4
143
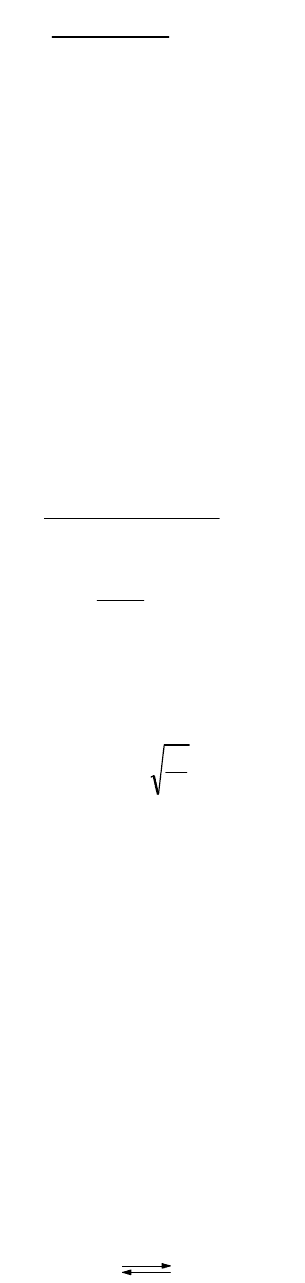
Константа равновесия, отвечающая этому уравнению, называется общей константой ионизации; она равна
произведению ступенчатых констант ионизации
321
43
-3
4
3
KKK
]POH[
][PO][H
K
Поскольку с увеличением отрицательного заряда аниона затрудняется отщепление каждого последующего иона
водорода,
К
1
> К
2
> K
3
Эта закономерность всегда соблюдается при ступенчатой ионизации.
Как и всякая константа равновесия, константа ионизации не зависит от концентрации, но зависит от природы
электролита и температуры. Для большинства слабых электролитов с повышением температуры константа
ионизации увеличивается (например, для растворов аммиака). Однако для некоторых соединений (уксусная,
пропионовая кислоты) кривая температурной зависимости константы ионизации проходит через максимум.
Это явление может быть объяснено изменением гидратации ионов и неионизированных молекул при
изменении температуры. Так, для уксусной кислоты значения константы ионизации при 0 ˚С, 25 ˚С и 50 ˚С
составляют 1,64·10
-5
, 1,74·10
-5
и 1,57·10
-5
.
Константа ионизации связана со степенью ионизации. Пусть для электролита X
m
Y
n
, ионизирующегося по
уравнению (9-24), концентрация раствора равна С, а степень ионизации - α. Тогда концентрация распавшегося
электролита составит αС, а неионизированного - С(1 - α). Учитывая, что при ионизации одной молекулы X
m
Y
n
образуется m ионов X
a+
и n ионов Y
b-
, имеем:
[X
a+
] = m αC; [Y
b-
] = n αC; [X
m
Y
n
] = C(1- α)
или, в сответствии с (9-25),
1
Cnm
K
nm1-nmnm
(9-28)
Для бинарных электролитов, распадающихся на два иона,
-1
C
K
2
(9-29)
Уравнения (9-28) и (9-29) являются аналитическим выражением закона разбавления Оствальда, рассмотренного
в разделе 9.2.2.1.
Если α много меньше единицы, то уравнение (9-29) принимает вид:
2
CK
или
C
K
(9-30)
Как следует из уравнения (9-30), α увеличивается с уменьшением концентрации, а при изменении температуры
изменяется пропорционально корню квадратному из константы ионизации, т.е. может и увеличиваться и
уменьшаться.
Ионные равновесия в растворах слабых электролитов можно смещать, вводя в систему сильные
электролиты, содержащие ион, отщепляемый слабым электролитом. Например, если к раствору уксусной
кислоты добавить ацетат натрия, практически нацело диссоциирующий по уравнению
CH
3
COONa = Na
+
+ CH
3
COO
-
концентрация ацетат-иона в растворе возрастет. Поскольку константа ионизации не зависит от концентрации,
увеличение концентрации ионов CH
3
COO
-
будет сопровождаться уменьшением концентрации ионов водорода,
т.е. смещением равновесия (9-26) в сторону процесса моляризации. Таким образом, одноименные ионы
подавляют ионизацию слабых электролитов.
Аналогично, вводя в систему ионы, связывающие какой-либо ион, отщепляемый слабым электролитом,
можно сместить равновесие в сторону ионизации этого электролита. Так, например, добавляя к раствору
уксусной кислоты сильное основание, отщепляющее ионы гидроксила, которые связывают ионы водорода,
можно сместить равновесие (9-26) вправо до практически полной ионизации уксусной кислоты.
2. Ионное произведение растворителя.
Растворители (H
2
O, NH
3
, HCN, HF и др.), вызывающие распад растворенных веществ на ионы, обычно
являются самоионизирующимися веществами, в какой-то мере распадающимися на положительно и
отрицательно заряженные ионы). К этим процессам также применим закон действия масс. Так, вода, хотя и
весьма незначительно, распадается на ионы по уравнению
Н
2
О + Н
2
О Н
3
О
+
+ ОН
-
(9-31)
или в упрощенной форме
144

Н
2
О Н
+
+ ОН
-
(9-32)
(уравнение (9-32), разумеется, условно: негидратированный протон в водных растворах сколько-нибудь долго не
существует). Константа ионизации воды
]OH[
]][OH[H
K
2
-
(9-33)
Поскольку ионизации подвергается ничтожно малая часть молекул воды (примерно одна из 550 млн),
равновесную концентрацию воды можно считать постоянной; тогда уравнение (9-33) приобретает вид:
]][OH[HK
OH
2
(9-34)
Если в воду ввести электролит, отщепляющий ионы водорода, то равновесие реакции (9-32) сместится:
концентрация ионов гидроксила при этом уменьшится во столько же раз, во сколько раз увеличилась
концентрация ионов водорода, а произведение концентраций этих ионов не изменится. Таким образом, для воды
и водных растворов произведение концентраций ионов водорода и гидроксила есть величина постоянная. В
любом водном растворе всегда присутствуют и ионы Н
+
, и ионы ОН
-
, концентрации которых связаны
соотношение (9-34). Константа
OH
2
K
называется ионным произведением воды. Значение
OH
2
K
зависит от
температуры. Поскольку реакция (9-32) эндотермична (ΔН˚
298
= 57,3 кДж/моль), с повышением температуры
OH
2
K
возрастает. Так, при 25˚С
OH
2
K
= 1,008·10
-14
10
-14
при 50˚С - 5,5·10
-14
, а при 100˚С - 5,9·10
-13
.
Используя ионное произведение воды, можно определить понятия нейтральный, кислый, щелочной водный
раствор следующим образом:
Нейтральными растворами называются растворы, для которых концентрации ионов водорода и гидроксила
равны
[H
+
] = [OH
-
] =
OH
2
K
= 10
-7
моль/л.
Кислыми растворами называются растворы, для которых
[H
+
] > 10
-7
моль/л; [OH
-
] < 10
-7
моль/л.
Щелочными растворами называются растворы, для которых
[H
+
] < 10
-7
моль/л ; [OH
-
] > 10
-7
моль/л.
Поскольку значения концентраций ионов Н
+
и ОН
-
в растворе зачастую весьма малы, для количественной
оценки кислотности или щелочности раствора удобно использовать не концентрацию водородных ионов, а так
называемый водородный показатель
pH = -lg[H
+
] (9-35)
Для нейтральных растворов рН = 7, для кислых растворов рН < 7, а для щелочных растворов рН > 7. Чем
меньше значение рН, тем выше кислотность и ниже щелочность среды.
Значение рН среды может быть определено различными методами, простейшим из которых является
индикаторный метод. Индикаторами называются вещества, изменяющие свою окраску в определенном
интервале значений рН. Ниже приведены интервалы перехода некоторых широко используемых индикаторов с
указанием изменения окраски при возрастании рН:
метиловый желтый (2,9 - 4,0; красный - желтый);
метиловый оранжевый (3,1 - 4,4; красный - желтый);
метиловый красный (4,2 - 6,2; красный - желтый);
бромтимоловый синий (6,0 - 7,6; желтый - синий);
фенолфталеин (8,2 - 10,0; бесцветный - малиновый);
тимолфталеин (9,3 - 10,5; бесцветный - синий).
Как видно из приведенных примеров, каждый индикатор меняет окраску в небольшом интервале значений
рН. Однако, смешивая несколько индикаторов, можно получить реактивы, называемые универсальными
индикаторами, которые позволяют приближенно оценивать рН самых разных растворов. Так, смесь
приведенных выше шести индикаторов дает возможность определить значения рН с точностью до единицы в
интервале 2,0 - 10,0; окраска универсального индикатора при этом изменяется от розовой (рН = 2,0) до
фиолетовой (рН = 10,0).
145

Ионными произведениями могут быть охарактеризованы и другие самоионизирующиеся растворители.
Уравнения ионизации и ионные произведения для некоторых из них приведены ниже:
1) жидкий фтороводород
3HF H
2
F
+
+ HF
2
; K
HF
= 2,010
-11
(при 18˚С);
2) жидкий сероводород
2H
2
S H
3
S
+
+ HS
-
; K
SH
2
= 3,010
-35
(при -70˚С);
3) жидкий аммиак
2NH
3
NH
4
+
+ NH
2
-
; K
3
NH
= 2,110
-33
(при -50˚С).
3. Произведение растворимости малорастворимых электролитов.
Если растворимость электролита A
m
B
n
очень мала, допустимо считать, что степень ионизации его в
образующемся растворе равна единице, в результате чего в системе устанавливается равновесие между
кристаллическим электролитом и его насыщенным раствором:
A
m
B
n
(к) mA
a+
(p) + nB
b-
(p)
(9-36)
Константа равновесия реакции (9-36) называется произведением растворимости и обозначается символом ПР.
Поскольку вещества, образующие твердые фазы, не входят в уравнение закона действия масс,
nbma
BA
][B][AПР
nm
(9-37)
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций ионов,
отщепляемых электролитом, является постоянной величиной.
Пусть в растворе A
m
B
n
концентрации ионов А и В равны С
А
и С
В
моль/л. Между С
А
, С
В
и ПР возможны три
вида соотношений:
1) С
А
·С
В
= ПР; такой раствор будет насыщенным, т.е. способным сколь угодно долго контактировать с избытком
A
m
B
n
без изменения состава жидкой фазы;
2) С
А
·С
В
< ПР; раствор будет ненасыщенным, т.е. способным растворить еще какое-то количество A
m
B
n
;
3) С
А
·C
B
> ПР; раствор будет пересыщенным (метастабильное состояние).
Произведение растворимости связано с растворимостью электролита (s, моль/л). Если в растворе
отсутствуют другие электролиты, отщепляющие ионы А
а+
и B
b-
, то, в соответствии с (9-36) и (9-37), [A
a+
] = ms, [B
b-
]
= ns, откуда
nmnm
BA
snmПР
nm
(9-38)
Ниже приведены примеры произведений растворимости некоторых электролитов:
;101,78s]][Cl[AgПР
102
AgCl
;101,14s]][I[PbПР
9322
PbI
2
2952
3
4
32
)(POCa
102,0108s][PO][CaПР
243
При введении в систему электролитов, отщепляющих одноименные ионы, растворимость малорастворимого
электролита понижается, так как равновесие (9-36) при этом смещается в направлении образования осадка. В
этом случае растворимость будет определяться концентрацией иона, ставшей в результате смещения
равновесия меньше концентрации этого иона в насыщенном растворе.
Зная произведения растворимости, можно решать ряд задач, имеющих прикладное значение. Пусть,
например, нужно определить растворимость в воде иодида свинца и изменение растворимости этого соединения
при введении в систему иодида калия в количестве 0,1 моль/л.
В соответствии с (9-38) растворимость PbI
2
3
PbI
4
ПР
s
2
3
9.
4
101,1
6,5·10
-4
моль/л
В растворе, содержащем KI, растворимость PbI
2
будет равна концентрации ионов Pb
2+
:
2
PbI
2
][I
ПР
][Pbs
2
Концентрация ионов иода в растворе слагается из ионов I
-
образовавшихся при растворении PbI
2
и при
диссоциации KI. Первое слагаемое в этой сумме много меньше второго и им можно пренебречь. Тогда
146
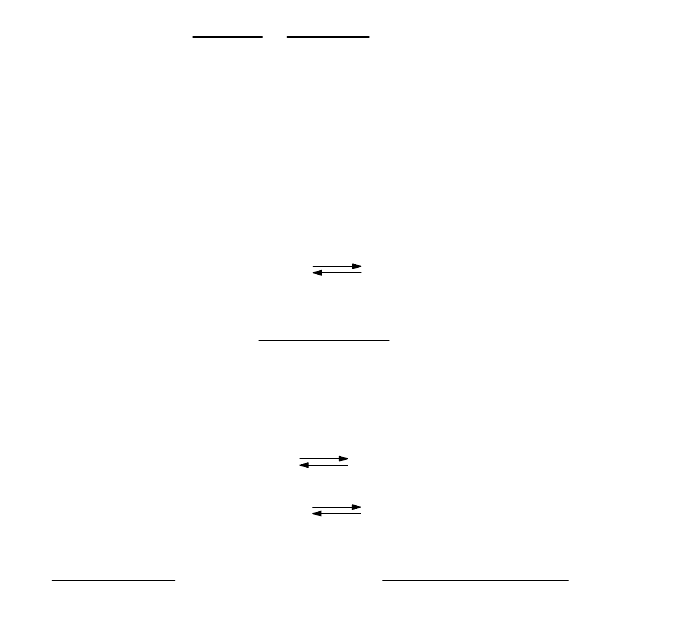
7
2
9
2
KI
PbI
101,1
0,1
101,1
C
ПР
s
2
моль/л
Таким образом, после добавления иодида калия растворимость иодида свинца уменьшилась в 5900 раз.
4. Константа устойчивости комплексного иона.
Комплексные ионы (комплексы) диссоциируют в растворах как слабые электролиты, и этот процесс
подчиняется закону действия масс. Для количественной характеристики устойчивости комплексного иона
используют константу равновесия реакции образования комплекса из центрального атома и лигандов, т.е.
процесса, обратного реакции диссоциации комплекса. Эта величина, называемая константой устойчивости
комплексного иона, обозначается символом К
уст
. Например, для комплекса [Ag(NH
3
)
2
]
+
, диссоциирующего по
уравнению
[Ag(NH
3
)
2
]
+
Ag
+
+ 2NH
3
,
константа устойчивости
7
3
2
3
уст
101,62
]][NH[Ag
])[Ag(NH
K
2
Комплексы, содержащие несколько лигандов, диссоциируют ступенчато; в этом случае каждой ступени
диссоциации отвечает своя ступенчатая константа устойчивости (β). Так, [Ag(NH
3
)
2
]
+
диссоциирует
двуступенчато:
Ag(NH
3
)
2
Ag(NH
3
)
+
+ NH
3
и
Ag(NH
3
)
+
Ag
+
+ NH
3
Cсоответственно ступенчатые константы комплекса определяются уравнениями:
;106,92
]][NH[Ag
])[Ag(NH
β
3
3
3
1
3
33
23
2
102,34
]][NH)[Ag(NH
])[Ag(NH
β
Общая константа устойчивости равна произведению ступенчатых констант устойчивости
К
уст
= β
1
β
2
.
...
9.3.3. Теория сильных электролитов.
Рассмотренные в разделе 9.3.2. закономерности, присущие слабым электролитам, не могут быть
распространены на растворы сильных электролитов. В частности, сильные электролиты не подчиняются закону
разбавления Оствальда: рассчитанные по уравнениям (9-28) и (9-29) константы диссоциации сильных
электролитов не являются постоянными величинами и зависят от концентрации раствора. Так, для хлорида
натрия значения константы диссоциации при концентрациях, равных 0,1, 1,0 и 4,0 моль/л, составляют 0,27, 1,25 и
12,0, т.е. монотонно возрастают с увеличением концентрации раствора.
Теория, объясняющая поведение растворов сильных электролитов, была разработана П. Дебаем и Э.
Хюккелем (1923). В основе этой теории лежат следующие положения:
1. Реальная степень диссоциации сильных электролитов не зависит от концентрации и равна единице.
2. В растворах сильных электролитов имеет место электростатическое межионное взаимодействие. В
результате вокруг каждого иона образуется атмосфера из ионов противоположного знака: в непосредственной
близости от катиона появляются преимущественно анионы и наоборот. Поскольку каждый ион одновременно
входит в состав ионной атмосферы другого иона, межионное взаимодействие препятствует перемещению ионов
в растворе, что влияет на физические свойства системы. Так, при пропускании через раствор электрического
тока анионы будут тормозить перемещение катионов к катоду, а катионы - перемещение анионов к аноду. В
результате наблюдаемая электропроводность раствора будет меньше величины, отвечающей полной
диссоциации электролита в растворе.
3. Непосредственное измерение степени диссоциации сильного электролита дает не истинную, а кажущуюся
степень диссоциации
α
каж
≤ α
ист
= 1
Это положение непосредственно следует из предыдущего.
Первоначально полагали, что в растворах сильных электролитов вообще нет ионных агрегатов. Однако
позже было установлено, что в концентрированных растворах может иметь место ассоциация ионов. Агрегаты,
образованные гидратированными ионами, называют ионными парами. Естественно, ионные пары по строению,
свойствам и механизму образования не тождественны молекулам слабых электролитов.
Как указывалось выше, растворы сильных электролитов не подчиняются закону действия масс. Выделить и
количественно охарактеризовать каждый из факторов, обусловливающих это явление, не представляется
возможным. Однако можно учесть суммарное влияние всех этих факторов, введя в теорию растворов
представление об активности (Г. Льюис, 1907).
147
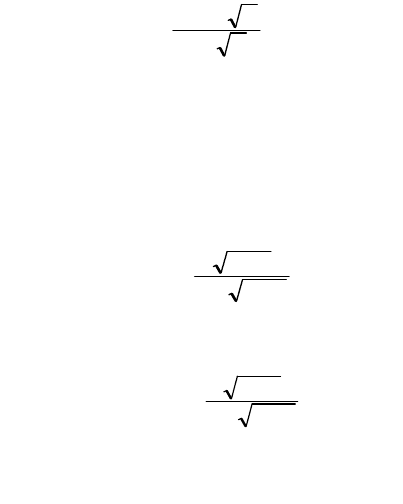
Активность - это эффективная концентрация частицы, т.е. концентрация, соответственно которой
эта частица проявляет себя в растворе.
Уравнения, базирующиеся на законе действия масс, могут быть распространены на растворы сильных
электролитов, если концентрации частиц, входящих в эти уравнения, заменить их активностями. Активность (а)
связана с концентрацией уравнением
а = f
.
C
С - концентрация иона, соответствующая полной диссоциации электролита, f - так называемый коэффициент
активности, величина, суммарно отражающая результат взаимодействия всех силовых полей, возникающих в
растворе. Коэффициенты активности в общем случае устанавливают экспериментально. В очень разбавленных
растворах (С < 0,01 моль/л) коэффициенты активности мало зависят от природы иона и определяются только
зарядом этого иона и ионной силой раствора. Ионной силой раствора (μ) называется полусумма произведений
концентраций всех ионов, присутствующих в растворе, на квадрат заряда этих ионов (z)
μ = 0,5ΣС
i
z
i
2
(9-39)
Ионная сила и коэффициент активности для разбавленных растворов связаны уравнением
μ1
μ0,5z
lg
2
f
(9-40)
Рассчитаем в качестве примера активности ионов в 0,01М растворе сульфата калия. В соответствии с
уравнением
K
2
SO
4
= 2K
+
+ SO
2
4
концентрации ионов калия и сульфат-иона в растворе составляет 0,02 и 0,01 моль/л, а ионная сила
03,0)201,0102,0(5,0
22.
Тогда
0,0738;
0,031
0,03
10,5)(K lg
2
f
0,844;)(K
f
0,01688)(K
a
моль/л;
;295,0
0,031
0,03
2-0,5)(SO lg
2-2
4
f
0,507;)(SO
2-
4
f
00507,0)(SO
-2
4
a
моль/л
Коэффициенты активности зависят от концентрации электролита и от температуры. Концентрационная
зависимость коэффициента активности весьма сложна. В случае разбавленных и умеренно концентрированных
растворов (С < 0,5 моль/л) коэффициент активности растет при разбавлении раствора, приближаясь к единице.
Однако в концентрированных растворах может наблюдаться обратное явление: коэффициент активности при
увеличении концентрации раствора возрастает и даже становится больше единицы. Например, для растворов
гидроксида калия наименьшее значение коэффициента активности, равное 0,728, отвечает раствору,
содержащему 0,500 моль/л КОН; уменьшение концентрации до 0,050 моль/л сопровождается повышением
коэффициента активности до 0,824, тогда как при изменении концентрации от 0,500 до 4,00 моль/л коэффициент
активности возрастает от 0,728 до 1,35. Увеличение коэффициента активности при разбавлении связано с
ослаблением межионного взаимодействия в результате увеличения среднего расстояния между частицами.
Причины, вызывающие возрастание коэффициента активности для концентрированных растворов, до
настоящего времени не ясны. На коэффициент активности влияет также температура; с повышением
температуры коэффициент активности в случае разбавленных растворов понижается, в случае
концентрированных - повышается.
Метод активностей позволяет дать количественное описание свойств значительно более широкой
совокупности растворов, чем классическая теория электролитической диссоциации. Однако не следует
забывать, что коэффициент активности - эмпирический коэффициент, в силу чего этот подход носит
формальный характер и, позволяя решать разнообразные практические задачи, мало что дает для понимания
сущности процессов, протекающих в растворах.
9.3.4. Обменные реакции в растворах электролитов.
9.3.4.1. Типы обменных реакций в растворах электролитов.
Теория электролитической диссоциации показала, что реакции в растворах электролитов фактически
являются реакциями между ионами, на которые распадаются растворенные вещества. В связи с
148

электростатическим взаимодействием разноименно заряженных частиц подобные реакции обычно
характеризуются низкими энергиями активации и высокими скоростями. В большинстве своем ионные реакции
обратимы, хотя зачастую очень сильно смещены в направлении образования продуктов реакции (практически
необратимые процессы). Можно выделить две группы реакций в растворах электролитов: обменные реакции,
протекающие без изменения степени окисления элементов, и окислительно-восстановительные реакции,
сопровождающиеся изменением степени окисления элементов. В настоящем разделе рассмотрен вопрос об
обменных реакциях в растворах электролитов.
В зависимости от того, какие продукты образуются в результате связывания ионов, можно выделить четыре
группы реакций обмена в растворах.
1. Реакции, сопровождающиеся образованием растворимых слабых электролитов. Для процессов этого типа
взаимодействие сводится к связыванию ионов в молекулы растворимого, но слабо диссоциирующего
соединения (воды, слабых кислот и т.д.). Например, взаимодействие между ацетатом натрия и хлороводородной
кислотой
CH
3
COONa + HCl = CH
3
COOH + NaCl
после учета диссоциации сильных электролитов (CH
3
COONa, HCl, NaCl) сводится к уравнению:
CH
3
COO
-
+ H
+
= CH
3
COOH
Образующимся слабым электролитом может быть также вода или слабо диссоциирующие соли. Так, реакциям
NaOH + HCl = NaCl + H
2
O
и
Hg(NO
3
)
2
+ 2KCl = HgCl
2
+ 2KNO
3
соответствуют ионные уравнения
H
+
+ OH
-
= H
2
O,
Hg
2+
+ 2Cl
-
= HgCl
2
2. Реакции, сопровождающиеся образованием малорастворимых соединений (солей, оснований, кислот и
др.). Ниже приведены примеры подобных реакций:
AgNO
3
+ NaCl = AgCl↓ + NaNO
3
или
Ag
+
+ Cl
-
= AgCl↓;
CuCl
2
+ 2NaOH = Cu(OH)
2
↓ + 2NaCl
или
Cu
2+
+ 2OH
-
= Cu(OH)
2
↓;
Na
2
WO
4
+ H
2
SO
4
= H
2
WO
4
↓ + Na
2
SO
4
или
WO
2
4
+ 2H
+
= H
2
WO
4
↓
3. Реакции, сопровождающиеся выделением газообразных продуктов. Примером подобных реакций может
служить взаимодействие сульфида натрия с хлороводородной кислотой:
Na
2
S + 2HCl = 2NaCl + H
2
S↑
или
S
2-
+ 2H
+
= H
2
S↑
4. Реакции, сопровождающиеся образованием комплексных ионов. Ниже приведены примеры подобных
реакций:
Hg(NO
3
)
2
+ 4KI = K
2
[HgI
4
] +2KNO
3
или
Hg
2+
+ 4I
-
= [HgI
4
]
2-
;
BeCl
2
+ 4NaF = Na
2
[BeF
4
] + 2NaCl
или
Be
2+
+ 4F
-
= [BeF
4
]
2-
Обобщая сказанное, можно сформулировать следующее правило:
Реакции обмена в растворах электролитов протекают тогда, когда их продуктами являются слабые
электролиты, малорастворимые соединения, выделяющиеся газы или комплексные ионы.
Зачастую слабыми электролитами или малорастворимыми соединениями являются не только продукты
реакции, но и взаимодействующие вещества. В этом случае для установления направления смещения
149

равновесия необходимо рассчитать константу равновесия соответствующего процесса. Так, например, ионное
уравнение реакции
KCN + CH
3
COOH HCN + CH
3
COOK
имеет вид:
CN
-
+ CH
3
COOH HCN + CH
3
COO
-
, (9-40)
так как HCN и CH
3
COOH - слабые кислоты, константы ионизации которых равны 7∙10
-10
и 1,8∙10
-5
соответственно.
Константа равновесия реакции (9-40)
COOH]][CH[CN
]COO[HCN][CH
K
3
3
(9-41)
Умножим числитель и знаменатель правой части уравнения (9-41) на равновесную концентрацию ионов
водорода. Тогда
4
10
5
HCN
COOHCH
102,6
107
101,8
K
K
[CH3COOH]
]][CH3COO[H
]][CN[H
[HCN]
K
3
Высокое значение константы равновесия свидетельствует о том, что равновесие (9-40) смещено в сторону
прямой реакции.
В качестве второго примера рассмотрим реакцию
Cu(OH)
2
↓ + 2HCl = CuCl
2
+ 2H
2
O
или
Cu(OH)
2
↓ + 2H
+
= Cu
2+
+ 2H
2
O (9-42)
В этом случае одним из реагентов является малорастворимое соединение Cu(OH)
2
, а одним из продуктов
взаимодействия - вода, являющаяся очень слабым электролитом. Для реакции (9-42) константа равновесия
2
2
][H
][Cu
K
, (9-43)
так как Cu(OH)
2
- малорастворимое соединение, а концентрацию воды в водном растворе можно считать
постоянной. Умножим числитель и знаменатель уравнения (9-43) на [OH
-
]
2
:
2
OH
Cu(OH)
22
22
2
2
K
ПР
][OH][H
]][OH[Cu
K
,
где
2
Cu(OH)
ПР
- произведение растворимости гидроксида меди, равное 2,2∙10
-20
, а
OH
2
K
ионное
произведение воды. Отсюда
8
214
20
102,2
)(10
102,2
K
Растворение гидроксида меди в сильных кислотах, таким образом, будет протекать практически необратимо.
Сравнительно с молекулярными, ионные уравнения значительно информативнее, так как в них фигурируют
частицы, реально участвующие во взаимодействии. Так, например, составление ионных уравнений позволяет
ответить на вопрос, почему реакции
HCl + NaOH = NaCl + H
2
O,
HNO
3
+ KOH = KNO
3
+ H
2
O,
HClO
4
+
2
1
Ba(OH)
2
=
2
1
Ba(ClO
4
)
2
+ Н
2
О
имеют одинаковый тепловой эффект (-57,32 кДж/моль при ст. усл.), хотя во взаимодействие вступают разные
кислоты и основания. Действительно, во всех рассмотренных случаях в системах протекает один и тот же
процесс, описываемый ионным уравнением
H
+
+OH
-
= H
2
O; ΔH˚ = -57,32 кДж/моль
Точно так же реакции
AgNO
3
+ HCl = AgCl↓ + HNO
3
,
AgClO
4
+ NaCl = AgCl↓ + NaNO
3
,
AgClO
3
+ NH
4
Cl = AgCl↓ + NH
4
ClO
3
имеют одинаковый тепловой эффект, так как все они сводятся к одному ионному уравнению
150
