Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Комплексы, металлов с белками 281
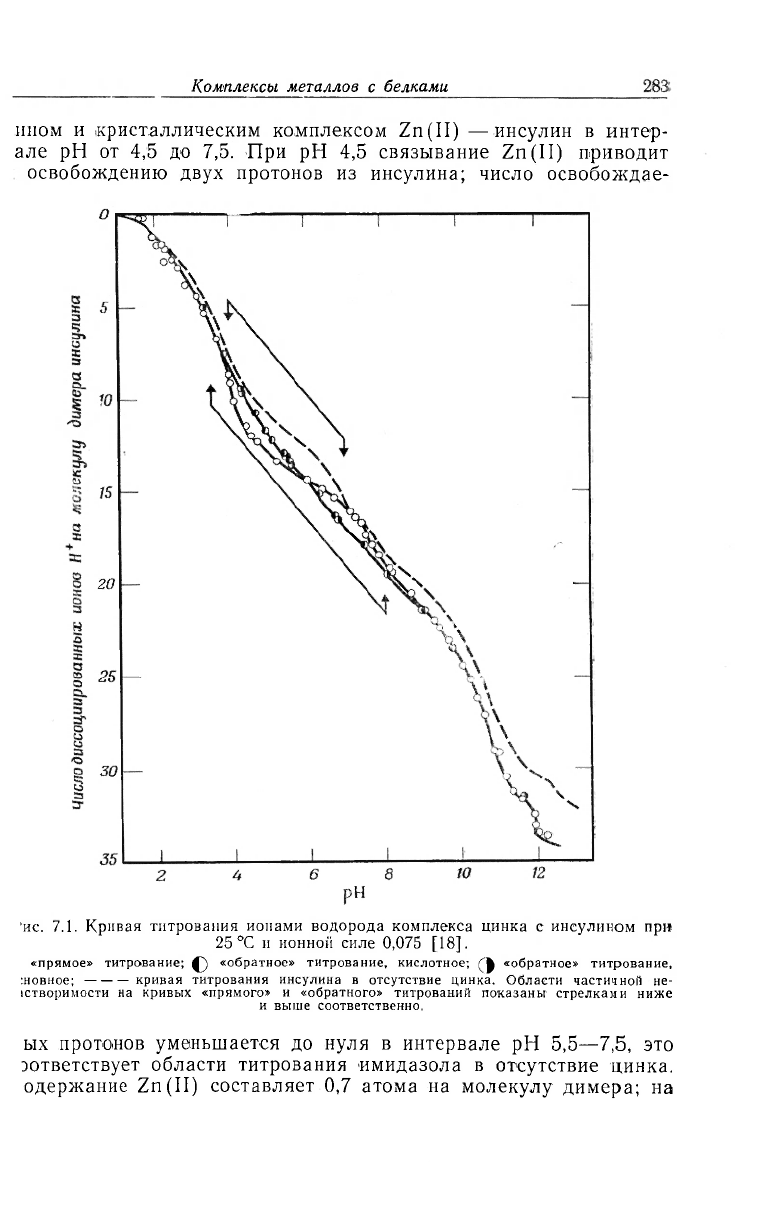
ином и !кристаллическим комплексом Zn(II) —инсулин в интер-
але рН от 4,5 до 7,5. При рН 4,5 связывание Zn(II) приводит
освобождению двух протонов из инсулина; число освобождае-
'ис. 7.1. Кривая титрования ионами водорода комплекса цинка с инсулином при
25
0
C и ионной силе 0,075 [18].
«прямое» титрование; ¢) «обратное» титрование, кислотное; ф «обратное» титрование,
:новное; кривая титрования инсулина в отсутствие цинка. Области частичной не-
(створимости на кривых «прямого» и «обратного» титрований показаны стрелками ниже
и выше соответственно.
ых протонов уменьшается до нуля в интервале рН 5,5—7,5, это
эответствует области титрования имидазола в отсутствие цинка,
одержание Zn(II) составляет 0,7 атома на молекулу димера; на

284
i лава 2
этом основании можно заключить, 'что каждый атом Zn(II) CBS
зан с тремя остатками имидазола и тремя молекулами воды [19'
(Уместно отметить, что первоначальное заключение — два ими;
азола на один атом цинка — основывалось на ошибочном опр<
делении содержания цинка, которое предполагалось равным одш
му атому Zn на молекулу димера.)
Марккер с сотр. [20, 21] выразили сомнение в том, что цин
координируется с имидазольными группами, и предложили BMI
•сто этого гексамерную модель, в которой каждые два атома Zn(I)
связаны с CT-NH
2
-TpynnaMH из В-цепи каждого из трех димеро
Их модель основывалась на имеющихся реитгеноструктурнь
данных, согласно которым предполагали, что каждая элемента]
ная ячейка содержит три молекулы димера, имеющие ось вращ<
ния третьего порядка [21], и на химических данных, которые н<
казали, что модификация a-NH
2
-rpynn В-цепей сохраняет молек;
лярную массу постоянной при связывании Zn(II) [20]. Однан
Брилл и Венейбл [19], впоследствии повторно анализируя да!
ные прямого титрования Тэнфорда, указали, что а-ЫН
2
-группы \
могут быть центрами связывания Zn(II), так как при рН 7,3 (nf
этом значении рН a-NH
2
-rpynnbi в отсутствие цинка в значител
ной степени протонированы) не меньше протонов связывает<
кристаллическим комплексом Zn(II)—инсулин, чем самим инс
.лином (рис. 7.1). Кроме того, они показали, что кривая прямо!
титрования комплекса Zn(II)—инсулин удовлетворительно соо
ветствовала модели, в которой каждый из двух атомов цинка
гексамере связан с тремя имидазольными группами, причем ко
•станта связывания второго атома цинка (10
13
) была больше, чс
константа связывания первого (Ю
9
).
Последние рентгеноструктурные данные, полученные при ра
решении 2,8 А [22], хорошо согласуются с химическими данным
Эти данные показали, что каждая элементарная ячейка компле
са Zn(II) —инсулин содержит три димера инсулина, которые ра
положены в виде шестимерной структуры вокруг оси симметр!
третьего порядка и связаны двумя ионами цинка. Каждый ж
Zn(II) связан с тремя Вю-имидазольными группами (по одной -
каждого димера) и еще с тремя дополнительными группами, пре
варительно идентифицированными как молекулы воды; распол
жение координирующих атомов не создает правильного октаэдр
Теперь стала также понятна причина, по которой a-NH
2
-rpynr
В-цепи 'были ошибочно определены как лиганды цинка [20]. П
видимому, она состоит в том, что в положении 1 В-цепи диме{
гексамера очень тесно контактируют между собой, почти сплете!
вместе; такой контакт был бы затруднен при модификации a-NI-
групп.
И, наконец, в свете имеющихся рентгеноструктурных данш
полезно вновь рассмотреть полученные константы связывай

285
Zn(II) с инсулином. Кооперативность связывания легко объясня-
ется тем, что уменьшение энтропии, связанное с переводом беспо-
рядочно агрегированных димеров не содержащего Zn(II) инсули-
на в гексамерную конфигурацию, обусловлено связыванием пер-
зого атома Zn(II) [19], !второй же атом Zn(II) практически
трисоединяется к только что возникшему грыс-имидазольному
центру. Хотя еще не имеется удовлетворительной модели второго
центра связывания Zn(II), наблюдаемую константу связывания
IO
13
разумно сопоставить со значением IO
10
, найденным для свя-
зывания Zn(II) с бмс-имидазольным лигандом [23].
4.3. Комплексы иона меди с окситоцином и вазопрессином
Окситоцин и вазопреесин близки по структуре к полипептид-
дым гормонам (рис. 7.2), которые обнаружены в гипоталамусе и
задней доле гипофиза млекопитающих и некоторых низших орга-
12 3
S—Cys—Туг—I Ieu
I I
S-Cys-Asn-Qln
[6 5 4
Pro—Leu—Gly-амид
7 а
окситоцин
12 3
S—Cys—Tyr—Phe
I " I
S—Cys—Asn—Qln
16 5 4
Pro—Lys—Gly-амид
7 8
лизинпроизводное вазопрессина
3
MC. 7.2. Первичные структуры окситоцина и лизинпроизеодкого вазопрессина.
!измов. В то время как можно спорить по поводу того, относить
ш гормоны к большим пептидам или малым белкам, в их реак-
щонной способности по отношению к Cu(II) проявляются особен-
юсти, свойственные белкам.
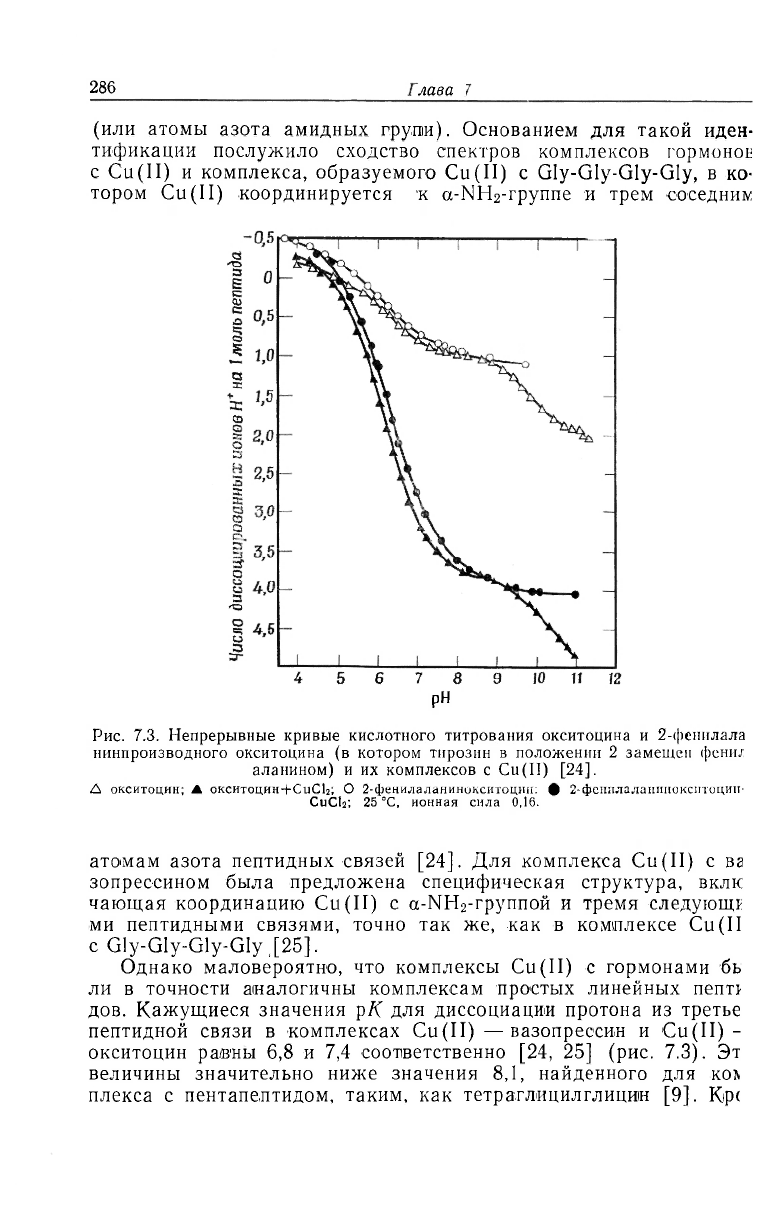
Оба гормона обладают высоким сродством к Cu(II) [24, 25],
)бразуя при рН 8 комплекс розового цвета с единственной поло-
:ой поглощения в видимой области при 525 нм. Титрование
(II)-комплексов окситоцина (рис. 7.3) и вазопрессина [25] по-
сазывает, что связывание иона меди сопровождается выделением
[етырех протонов — одного из a-NH
2
-npynnbi (положение 1) и
рех протонов из других групп, которые при рН 8 обычно прото-
шрованы. Участие ;а-ЫН
2
-группы в авязывании подтверждается
-ем, что Cu(II) не образует никакого комплекса с дезаминиро-
!анным окситоцином, в котором a-NH
2
-rpynna замещена водоро-
дом, а также с N-ацетиллизинвазопрессином, в котором CT-NH
2
-
руппа анетилирована [25]. То, 'что фенольные гидроксилы не
'частвуют в связывании, было доказано тем, что замена тирозина
ia фенилаланин никак не влияла на комплексообразование
рис. 7.3). Три дополнительные группы, депротонируемые Cu(II),
>ыли идентифицированы как атомы азота из пептидных связей
286
i лава 2
(или атомы азота амидных груши). Основанием для такой иден-
тификации послужило сходство спектров комплексов гормонов
с Cu(II) и комплекса, образуемого Cu(II) с Gly-Gly-Gly-Gly, в ко-
тором Cu(II) координируется к a-NH
2
-rpynne и трем соседним
рН
Рис. 7.3. Непрерывные кривые кислотного титрования окситоцина и 2-фенилала
нинпроизводного окситоцина (в котором тирозин в положении 2 замещен фени-г
аланином) и их комплексов с Cu(II) [24].
Д онситоцин; Jh окситоцин+СиС1
2
; О 2-фенилаланинокситоцнн: 9 2-феннлаланинокситоцин-
CuCI
2
; 25 °С, ионная сила 0.16.
атомам азота пептидных связей [24]. Для комплекса Cu(II) с ва
зопрессином была предложена специфическая структура, вклк
чающая координацию Cu(II) с а-1\Н
2
-группой и тремя следующг
ми пептидными связями, точно так же, как в комплексе Cu(II
с Gly-Gly-Gly-Gly ,[25].
Однако маловероятно, что комплексы Cu(II) с гормонами бь
ли в точности аналогичны комплексам простых линейных пепп
дов. Кажущиеся значения рК для диссоциации протона из третье
пептидной связи в комплексах Cu(II) —вазопрессин и Cu(II)-
окситоцин равны 6,8 и 7,4 соответственно [24, 25] (рис. 7.3). Эт
величины значительно ниже значения 8,1, найденного для ко\
плекса с пентапептидом, таким, как тетраглпцилглицин [9]. Kpt

Комплексы, металлов с белками
287
? того, наклон кривых титрования как комплекса Cu(II) с окси-
•цином (рис. 7.3), так и комплекса Cu(II) с вазопрессином [25]
>и рН примерно 6,5 указывал на кооперативное участие трех
'птидных атомов азота противоположно их ступенчатому вовле-
•нию в комплексообразование, наблюдаемому для линейных пеп-
[дов [9]. Принцип «все или ничего» в комплексах с гормонами —
о факт, установленный на основании спектральных данных,
зторые показывают, что частицы, образующиеся при всех значе-
гях рН выше 6, спектрально почти идентичны конечному ком-
тексу [24, 25]. Возможное объяснение этих данных состоит в
)М, что в кольцевую структуру этих гормонов входит один и
злее пептидный (или амидный) атом азота, который по отноше-
ию к CT-NH
2
-Tpynne расположен благоприятнее, чем в линейных
гптидах. Такое влияние конформации означает, что атомы азота
ептидных связей, участвующие в координации вместе с O-NH
2
-
эуппой, не обязательно должны быть смежными с ней. Так, не-
авно выполненные ЯМР-исследования показали, что комплекс
u(II) с окситоцином — трансаннулярный, в котором в координа-
ии с Cu(II) участвуют a-NH
2
-rpynna и атомы азота пептидных
вязей из положения 6 цистеина, из положения 2 тирозина и из
оложения 5 аспарагина [26].
4.4. Взаимодействие метмиоглобина кашалота
с ионами меди и цинка
Метмиоглобин (метМЬ) кашалота был первым белком, трех-
[ерная структура которого была установлена методом рентгено-
труктурного анализа [27]. Вследствие этого он вскоре стал мо-
.елью для интерпретации взаимодействий металлов с белками,
!есколько аспектов химии миоглобина непосредственно касаются
го взаимодействия с ионами металлов.
Единственная полипептидная цепь метМЬ (рис. 7.4) представ-
[яет выеокоупорядоченную структуру с молекулярной массой
7 000, содержащую 75% а-спирали, которая легко и обратимо
искручивается под действием ионов H+ при рН около 4,5. Связь
: гемом осуществляется посредством координации железа к гисти-
шну (F
8
), ионного взаимодействия между карбоксильными груп-
тами боковых цепей гема и положительно заряженными группа-
ми белка, а также посредством неполярного взаимодействия меж-
Iy протопорфириновым кольцом гема и неполярными боковыми
цепями аминокислот. Денатурация сопровождается изменением
:пектра гема и ориентацией в сторону растворителя 4—6 гистиди-
новых боковых цепей, которые в нативном состоянии нереакцион-
носпособны ни по отношению к ионам H+, ни к карбоксиметили-
рованию [28].
Совершенно очевидно, что метмиоглобин претерпевает обра-
тимую денатурацию в присутствии ионов Cu(II) и Zn(II); это

Комплексы металлов с белками
289
ствует из изменения в спектре тема [29], из выраженной нерас-
)римости комплекса иона металла с белком [29], из размаски-
зки имидазольных остатков [29] и, наконец, из уменьшения со-
эжания а-спирали ИЗО]. Движущей силой денатурации, по-ви-
мому, является то, что денатурированная форма имеет более
сокое сродство к металлу, чем нативная структура _[29]. Одна-
денатурация проявляется только при значениях v
m
выше 1
9] и первый ион металла, по-видимому, связывается с центром
тивной структуры [29, 31].
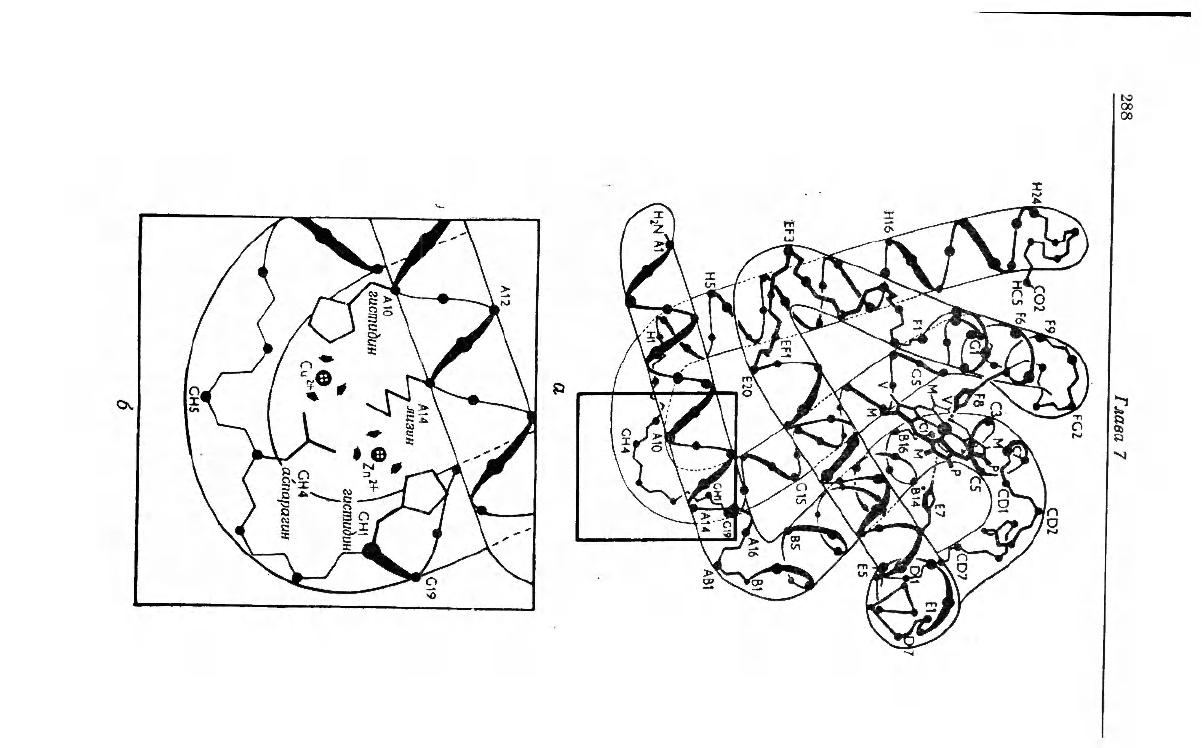
Места присоединения первых ионов Cu(II) и Zn(II) к натив-
|й структуре при рН б были определены 'кристаллографически
1]. Интересно, что хотя связывание Cu(II) и Zn(II) конкуриру-
щее [21], первые ионы Cu(II) и Zn(II) присоединяются к час-
тно совпадающим, но не идентичным центрам (рис. 7.4). Так,
[евидно, что когда Zn(II) присоединяется к имидазольному ос-
1тку His-GHi, он находится очень близко (но не прямо связы-
1ется) с Lys-Aj
4
и с Asn-GH
4
. Cu(II) же связывается с His-Аю и
этом соседствует с Lys-Ai
4
и Asn-GH
4
, причем различия меж-
Y этими двумя металлами главным образом обусловлены их раз-
ичными стереохимическими требованиями. Несмотря на то что
отношении координации с иными группами, чем имидазольные,
езультаты ренггеноетруктурных исследований не однозначны,
анные о связывании [29] заставляют предположить участие в
вязывании [по крайней мере с Cu(II)] других доноров электро-
ов. Данные о связывании при рН 6,8 можно интерпретировать
ледующим образом: значение Km для первого иона Cu(II) равно
:,5-10
5
, в то время как внутреннее сродство Cu(II) к имидазолу
(авно только IO
4
. Маловероятно, чтобы вся дополнительная стаби-
низация возникала только за счет карбонильных атомов кислоро-
Ia аспарагина, к тому же результаты титрования (рис. 7.5) неод-
нозначны в отношении участия в связывании лизина. Эта неод-
нозначность еще больше усиливается, если учесть, что центры
связывания первых ионов Cu(II) при рН выше 7 изменяются, что
следует из увеличения вытеснения протонов первыми ионами
Cu(II) и также из данных ЭПР [32].
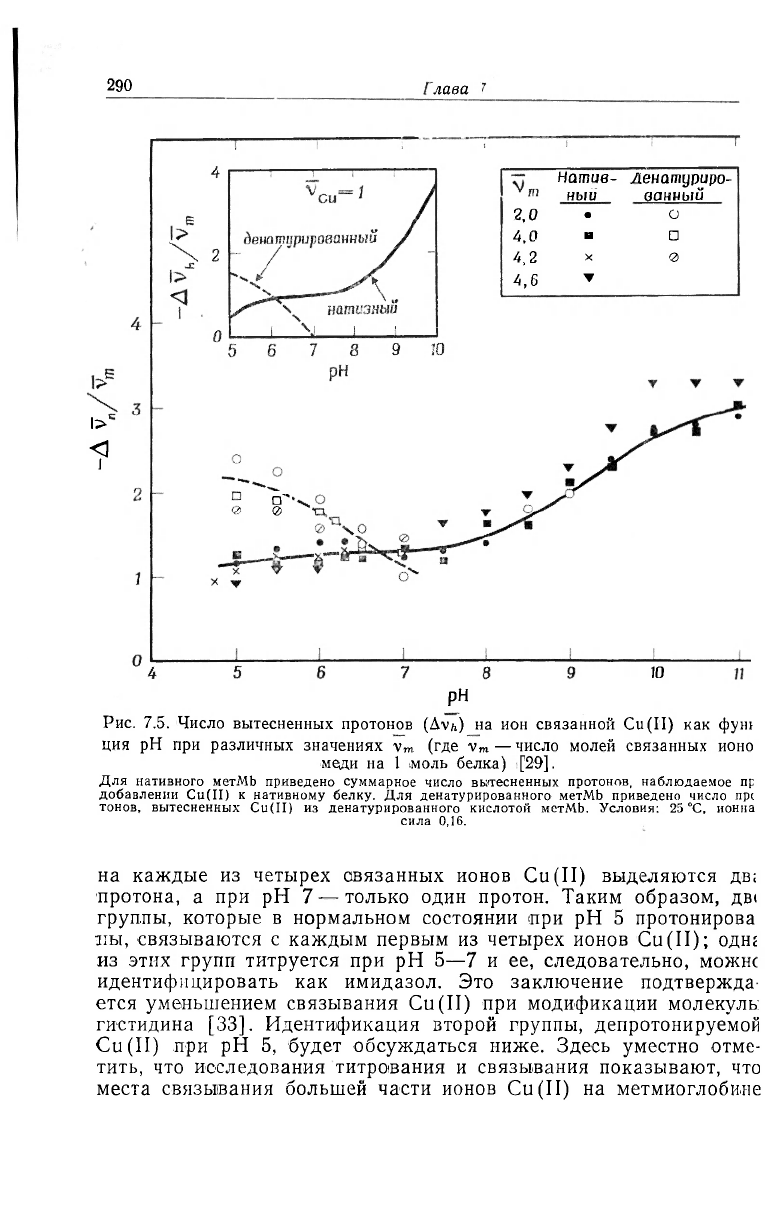
Изучение титрования особенно полезно для выяснения природы
мест связывания Cu(II) в денатурированном состоянии [29]. Вы-
теснение протонов Cu(II) из денатурированного кислотой метмио-
глобина показано на рис. 7.5. Согласно этим данным, при рН 5
Рис. 7.4. (¢2) Изображение молекулы миоглобина в виде диаграммы по Дикер-
сону [56] и (б) увеличенное изображение части молекулы миоглобина, ограни-
ченной прямоугольником на рис. а, показывающее отношения между ионами
Cu(II) и Zn(IiI) и потенциальными связывающими группами [31].
19—2451
290
i лава 2
1>
<1
I
Натив-
HblU
Ленатуриро-
ванный
2,0
•
о
4,0
а
•
4,2
X
0
4,6
T
tf"
0
Ю
рН
Рис. 7.5. Число вытесненных протонов (Av^) на ион связанной Cu(II) как фут
ция рН при различных значениях v
m
(где V
m
— число молей связанных ионо
меди на 1 моль белка) [29].
Для нативного метМЬ приведено суммарное число вытесненных протонов, наблюдаемое пр
добавлении Cu(II) к нативному белку. Для денатурированного метМЬ приведено число пр(
тонов, вытесненных Cu(II) из денатурированного кислотой метМЬ. Условия: 25 °С, ионна
сила 0,16.
на каждые из четырех авязанных ионов Cu(II) выделяются дв;
•протона, а при рН 7 — только один протон. Таким образом, дв(
группы, которые в нормальном состоянии при рН 5 протонирова
иы, связываются с каждым первым из четырех ионов Cu(II); однг
из этих групп титруется при рН 5—7 и ее, следовательно, можнс
идентифицировать как имидазол. Это заключение подтвержда
ется уменьшением связывания Cu(II) при модификации молекуль:
гистидина [33]. Идентификация второй группы, депротонируемой
Cu(II) при рН 5, будет обсуждаться ниже. Здесь уместно отме-
тить, что исследования титрования и связывания показывают, что
места связывания большей части ионов Cu(II) на метмиоглобине

Комплексы металлов с белками
291
до и после кислотной денатурации остаются одними и теми же.
а'ким образом, вытеснение меньшего числа протонов Cu(II) из
ативного метМЬ при рН 5 (рис. 7.5) можно объяснить присоеди-
гнием иона Cu(II) к двум группам, которые в нормальном со-
гоянии при рН 5 протонированы, а также обычным поглощением
ротона, сопровождающим размаскировку при денатурации ос-
овного имидазола [29].
Вторая группа, из которой Cu(II) вытесянет протон при рН5—
, по-видимому, представляет собой атом азота пептидной связи,
отя кажущееся значение рК диссоциации этой группы в комплек-
ах метМЬ ниже, чем в модельных комплексах [34]. Лизины мож-
0 не считать источником протонов, так как их гуанидирование
е влияет на связывание с Cu(II) [29]. Участие в связывании
томов азота пептидных связей особенно подтверждается спектра-
ми поглощения в видимой области комплексов Cu(II) с апомио-
лобином, которые показывают, что при рН 5,5 вместе с каждым
:мидазольным остатком в связывании должен участвовать по
райней мере еще один лиганд сильного поля [35]. Кроме того,
1 данные титрования (рис. 7.5), и спектральные данные [35] по-
дзывают, что число пептидных связей, участвующих в связыва-
ши с Cu(II), увеличивается по мере того, как рН повышается
!ыше 8. Однако следует отметить, что по крайней мере при рН 11
)дно из первых четырех мест связывания Cu(II), по-видимому,
юлжно содержать концевую a-NH
2
-rpynny [34].
Возможное связывание Cu(II) с имидазолом и атомом азота
тептидной связи при нейтральных значениях рН предполагает еди-
ный механизм для индуцируемой Cu(II) денатурации метМЬ, так
как было показано, что структурные требования a-спирали несов-
местимы с таковыми в аналогичных комплексах Cu(II) [36]. Од-
нако Zn(II), который, как известно, мало склонен к координации
с атомами азота пептидных связей, также денатурирует метМЬ,
вызывая изменения и в спектрах гема [37], и в содержании а-спи-
рали [30]. Кроме того, исследование модифицированного миогло-
бина предполагает, что изменения в спектрах гема и уменьшение
содержания a-спирали не обязательно должны быть связаны [33].
В этом отношении уместно отметить, что связывание ионов Cu(II)
и Zn(II) с имидазолом гемового звена F
8
считается критической
стадией в денатурации миоглобина [33, 37].
Не решены также другие аспекты взаимодействия металлов
с миоглобином. Среди них следует назвать взаимозависимость
между очевидным максимальным числом центров связывания при
нейтральных значениях рН (приблизительно 7 как для меди, так
и для цинка) и присутствием 12 гистидиновых остатков в белке.
Таким образом, некоторые имидазольные группы, по-видимому,
недоступны для реакции с ионом металла, несмотря на то, что
белок денатурируется, или по крайней мере они очень мало реак-
19*

292
i лава 2
ционноспособны по сравнению с другими. В этом примере так<
подразделение по реакционной способности на два класса, во
можно, отражает локальную последовательность аминокислс
[38].
4.5. Комплексы ионов меди с сывороточным альбумином
Оптические свойства Cu(II) позволяют получить более точну:
картину !взаимодействия сывороточного альбумина с Cu(II), че
та, которая получена для его взаимодействия с Zn(II), включа
и явно сложную картину основного центра связывания Cu(II).
Вскоре после начала исследований взаимодействия Cu(II)
сывороточным альбумином [4, 39] стало ясно, что первые ион!
Cu(II) связываются более прочно, чем последующие [40]. Прел
положение о том, что в состав сильного центра, авязывающег
Cu(II), входит O-NH
2
-Tpynna, было подтверждено работой, пока
завшей, что один эквивалент Cu(II) блокирует реакцию a-NH
групп с 2,4-динитрофторбензолом [41]. Выполненные позднее тит
рометрические исследования показали, что одна координирующа
группа наиболее сильного связывающего центра имеет р/(
а
при
близительно 8 [35]. Кроме того, тот факт, что комплекс Cu(II
с сывороточным альбумином состава 1 : 1 имеет полосу поглоще
ния при 525 им, а также то, что первый ион Cu(II) при рН 9 вы
тесняет два протона, показывают, что наряду с a-NH
2
-rpynnoi
в состав сильного центра связывания входят еще два атома азот;
пептидных связей и, возможно, еще какой-то четвертый координи
рующий атом. Расположение сильного центра связывания Cu (И
,
среди первых 24 аминокислотных остатков и расшифровка их по
следовательности на N-конце как Asp-Thr-His-Lys позволила идеи
тифицировать четвертую лигандную группу как имидазол [42]
На этом основании предположили, что, так же как в спектральнс
идентичном комплексе Cu(II) с Gly-Gly--His, в сильном связыва
нии Cu(II) с сывороточным альбумином участвуют также имид
азольная группа His-3, a-NH
2
-rpynna и два расположенных межд}
ними атома пептидных связей. (Предложенная модель сильного
центра связывания Cu(II) в -сывороточном альбумине показана -на
рис. 7.6. Корректность отнесения координирующих групп, по-ви-
димому, подтверждается тем, что первый связанный ион Cu(II)
защищает при ал-килировании и a-NH
2
-rpynny, и His-3 [43], а так-
же тем, что комплекс Cu(II) с сывороточным альбумином состава
1 : 1 имеет такие же оптические и вращательные свойства, как
комплекс с пептидом Asp-Thr-His-Lys [43]. Нет никаких данных,
подтверждающих участие в комплексообразовании e-NH
2
-rpynnbi
Lys-4.
Меньше известно о связывании последующих ионов Cu(II)
с сывороточным альбумином при нейтральных значениях рН. При
