Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Карбоксипептидаза А и другие пептидазы
513
112°, а не 109,5°, как в правильном тетраэдре. Это указывает на то,
что структура пептидных единиц несколько искажена. По извест-
ным координатам атомов для каждого остатка были рассчитаны
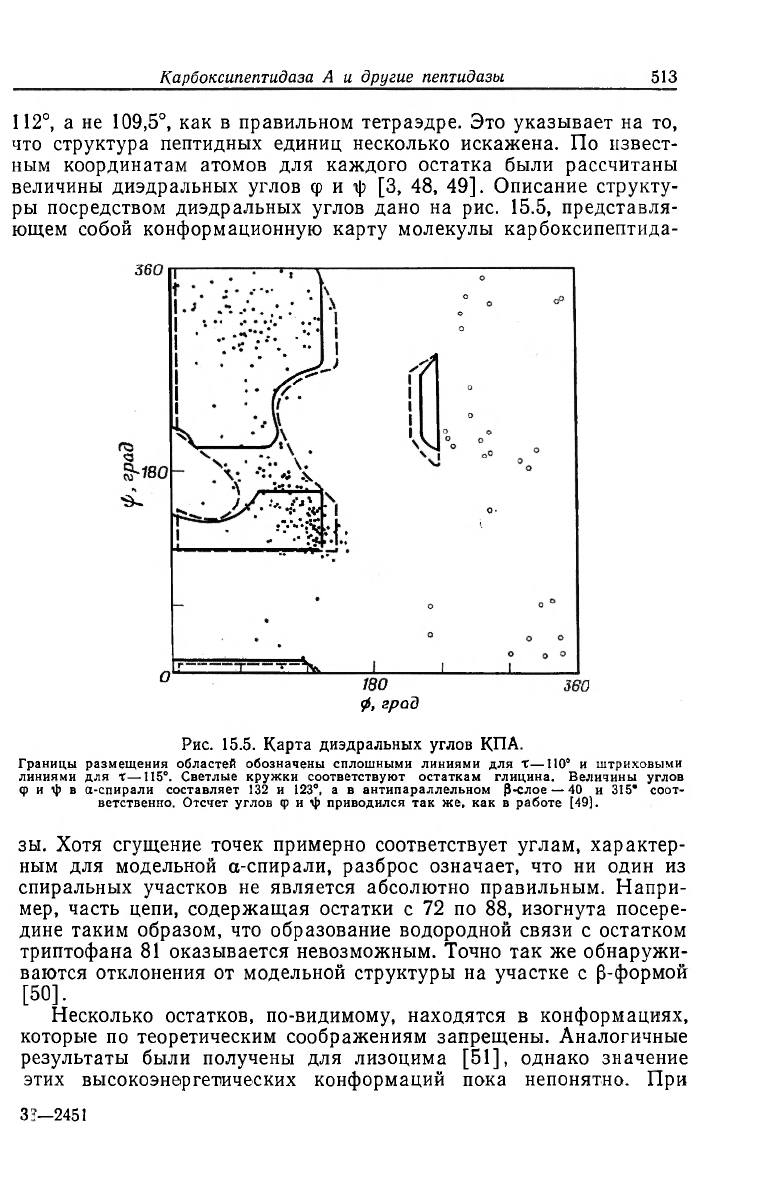
величины диэдральных углов ф и -ф [3, 48, 49]. Описание структу-
ры посредством диэдральных углов дано на рис. 15.5, представля-
ющем собой конформационную карту молекулы карбоксипептида-
ф, град
Рис. 15.5. Карта диэдральных углов КПА.
Границы размещения областей обозначены сплошными линиями для X—110° и штриховыми
линиями для X—115°. Светлые кружки соответствуют остаткам глицина. Величины углов
Ф и i|) в а-спирали составляет 132 и 123°, а в антипараллельном Р-слое — 40 и 315* соот-
ветственно. Отсчет углов ф и \|> приводился так же, как в работе [49].
зы. Хотя сгущение точек примерно соответствует углам, характер-
ным для модельной а-спирали, разброс означает, что ни один из
спиральных участков не является абсолютно правильным. Напри-
мер, часть цепи, содержащая остатки с 72 по 88, изогнута посере-
дине таким образом, что образование водородной связи с остатком
триптофана 81 оказывается невозможным. Точно так же обнаружи-
ваются отклонения от модельной структуры на участке с р-формой
[50].
Несколько остатков, по-видимому, находятся в конформациях,
которые по теоретическим соображениям запрещены. Аналогичные
результаты были получены для лизоцима [51], однако значение
этих высокоэнергетических конформаций пока непонятно. При
35—2451

514
Г лава 10
встраивании остатка гистидина 196, являющегося лигандом цинка,
в карту электронной плотности оказалось необходимым ввести ис-
каженную ^ис-пептидную связь между серином 197 и тирозином
198. Поскольку это первый пример образования ^ис-пептпдной свя-
зи у остатка, отличающегося от пролина, к нему следует отнестись
с некоторой осторожностью. С другой стороны, возможно, что та-
кой способ образования связи имеет значение для активности фер-
мента.
Распределение остатков внутри и снаружи молекулы согласу-
ется с данными для других глобулярных белков. Гидрофобные
остатки предпочтительнее располагаются внутри молекулы, а заря-
женные группы — снаружи [52]. Поскольку участок в (3-формс на-
ходится главным образом внутри глобулы, в нем обнаружено мно-
го гидрофобных аминокислот, в том числе лейцина и фенилалани-
на. Всего в контакте с водой не принимают участия 78 остатков.
Из них 22 могут образовывать водородную связь с атомами пептид-
ной связи или близлежащих остатков, и, по-видимому, эта возмож-
ность почти во всех случаях реализуется [3, 52]. Два остатка трип-
тофана (63 и 147) и один остаток тирозина (238) спрятаны внутри
молекулы КПА. Остальные остатки этих аминокислот находятся в
частичном контакте с растворителем. Существование водородной
связи между ОН-группой Туг-238 и карбонильной группой Glu-270,
вероятно, имеет некоторое значение для конформационного изме-
нения с участием Glu-270 при связывании субстрата, как описано
ниже. Четыре из десяти остатков пролина расположены у N-концов
спиральных участков, а три — у концов наиболее длинных цепей в
слое с p-структурой. Во внутренней части молекулы находятся три
карбоксильные группы, принадлежащие остаткам 104, 108 и 292.
Конечно, справедливость этого утверждения зависит от того, на-
сколько правильно установлен тот факт, что они являются свобод-
ными и не участвуют в образовании амидных связей. Карбоксиль-
ная группа Glu-292 образует солевой мостик с Arg-272, так что ее
заряд локально нейтрализован. Детальное изучение карт электрон-
ной плотности обнаружило неизвестный ранее факт внедрения в
молекулу карбоксипептидазы десяти молекул воды [52].
2.2. Активный центр
2.2.1. Конформация белка
Структура активного центра образована теми атомами фермен-
та, расстояния которых от природных субстратов не превышают
расстояния, на котором действуют силы Ван-дер-Ваальса. Если
учесть все остатки вблизи молекулы глицилтирозина, а также те
остатки, близость которых к ацилтрипептиду, находящемуся в «вы-
емке» поверхности, постулируется из модельных опытов (рис. 15.3),

Карбоксипептидаза А и другие пептидазы 515
то можно заключить, что в образовании активного центра участву-
ют следующие сегменты цепи: 69—72, 125—127, 142—145, 155, 163,
164, 194—203, 243, 247—256, 268—270 и 275—279. Боковые цепи
остатков 70, 126, 143, 195, 197, 200, 202, 249, 252—253 и 275—276
направлены в сторону, противоположную месту присоединения суб-
страта, и, по-видимому, не контактируют с ним непосредственно.
Остатки 194—203 и 268—270 входят в слой с p-структурой, кото-
рый образует одну из стенок участка связывания глицилтирозина.
Остальные остатки, за исключением лигандов цинка 69 и 72, нахо-
дятся в извилистой правой части молекулы, показанной на
рис. 15.3. Верхняя часть полости, в которой помещается тирозиль-
ная боковая цепь глицилтирозина, образована остатками 243 и
246—250, а остальная ее часть — остатками 155 и 253—256. Левая
часть выемки, являющейся участком связывания, образована сег-
ментом 275—279 (рис. 15.3), а правая — сегментами 125—127,
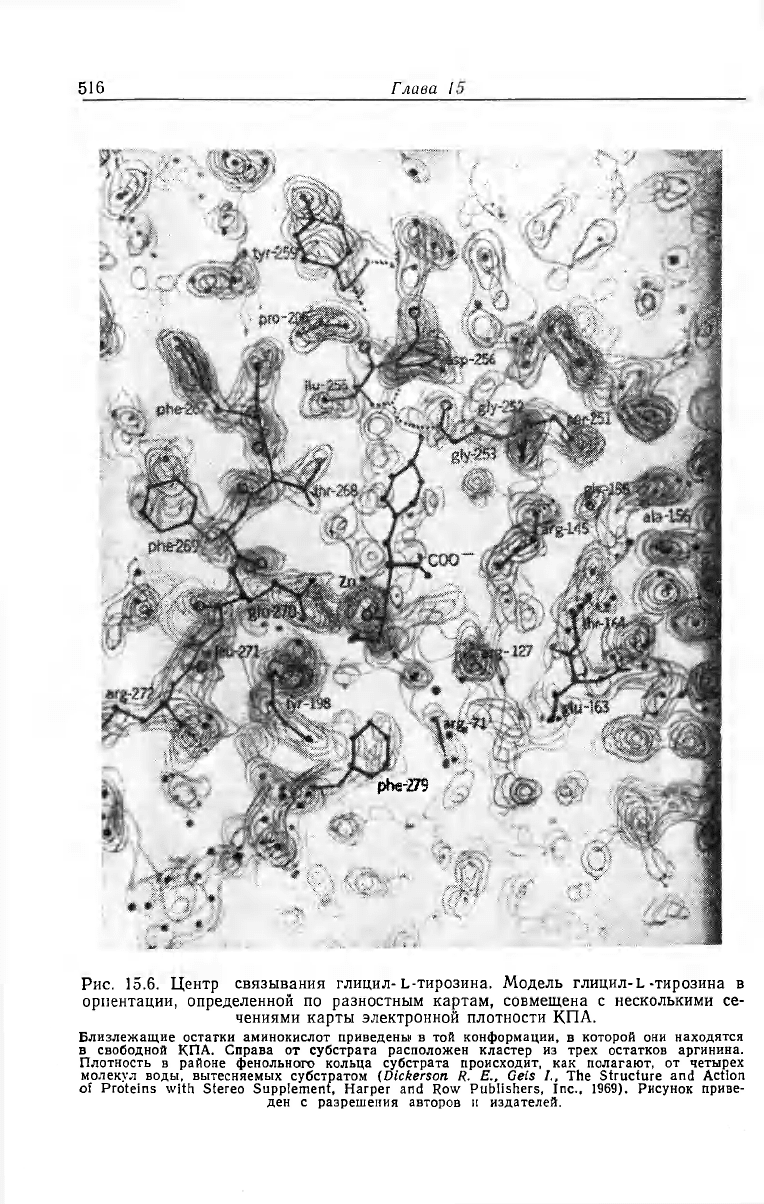
142—145 и 163—164. На рис. 15.6 карта электронной плотности в
районе связывания субстрата совмещена с изображениями глицил-
тирозина и части контактирующих остатков.
Большая часть центра присоединения субстрата не имеет регу-
лярной вторичной структуры. За исключением нескольких сегмен-
тов в p-форме и нескольких остатков в начале одной из спираль-
ных частей (255—256), подавляющее большинство остатков нахо-
дятся в «неупорядоченных» участках. Конформационная карта
остатков активного центра подтверждает то, что только незначи-
тельная их часть имеет значения ср и я|з, близкие к наблюдаемым в
а-спиральной структуре.
2.2.2. Цинк
В присоединении цинка к карбоксипептидазе участвуют три
белковых лиганда: His-69, Glu-72 и His-196. Связи гистидин—цинк
осуществляются через атом азота в положении Ni кольца. Кроме
того, лиганды принимают участие и в других взаимодействиях.
Атом азота N
3
в His-69 образует водородную связь с остатком
Asp-142, а атом азота N
3
в His-196 соединен такой же связью с мо-
лекулой воды. На предварительных картах вблизи атома цинка
была обнаружена повышенная электронная плотность, не относя-
щаяся к белку. С помощью карт, построенных по рассчитанным
значениям фаз, удалось установить, что она принадлежит един-
ственному небелковому лиганду металла. Поскольку величина
электронной плотности соответствовала атому кислорода, было
предположено, что он является молекулой воды или ОН-ионом.
Понятно, что некоторые молекулы КПА вместо воды могут связы-
вать Cl
-
, однако малая величина электронной плотности свидетель-
ствует о том, что их число невелико. Расположение лигандов отно-
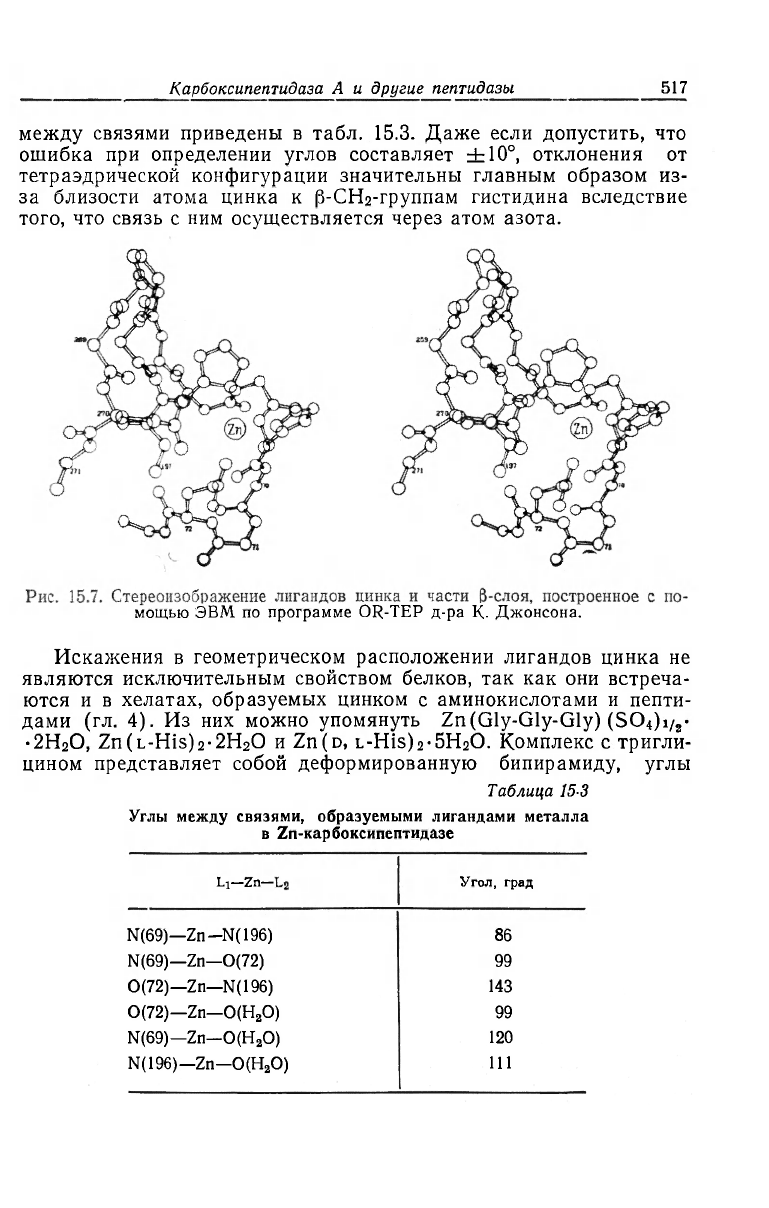
сительно атома цинка показано на рис. 15.7, а значения углов
33*
516
Г лава
10
pbe-ZTf
Рис. 15.6. Центр связывания глицил-L-тирозина. Модель глицил-L -тирозина в
ориентации, определенной по разностным картам, совмещена с несколькими се-
чениями карты электронной плотности КПА.
Близлежащие остатки аминокислот приведены в той конформации, в которой они находятся
в свободной КПА. Справа от субстрата расположен кластер из трех остатков аргинина.
Плотность в районе фенольнсиго кольца субстрата происходит, как полагают, от четырех
молекул воды, вытесняемых субстратом (Dickerson R. E., Geis /., The Structure and Action
of Proteins with Stereo Supplement, Harper and Row Publishers, Inc., 1969). Рисунок приве-
ден с разрешения авторов и издателей.
Карбоксипептидаза А и другие пептидазы 517
между связями приведены в табл. 15.3. Даже если допустить, что
ошибка при определении углов составляет ±10°, отклонения от
тетраэдрической конфигурации значительны главным образом из-
за близости атома цинка к |3-СН
2
-группам гистидина вследствие
того, что связь с ним осуществляется через атом азота.
мощью ЭВМ по программе OR-TEP д-ра К. Джонсона.
Искажения в геометрическом расположении лигандов цинка не
являются исключительным свойством белков, так как они встреча-
ются и в хелатах, образуемых цинком с аминокислотами и пепти-
дами (гл. 4). Из них можно упомянуть Zn(Gly-Gly-Gly)(SO
4
)IZj-
•2Н
2
0, Zn(b-His)
2
-2H
2
0 и Zn(D, L-His)
2
-5H
2
0. Комплекс с тригли-
цином представляет собой деформированную бипирамиду, углы
Таблица 15-3
Углы между связями, образуемыми лигандами металла
в Zn-карбоксипептидазе
Li—Zn— Угол, град
N(69)—Zn-N(196)
86
N(69)—Zn—0(72)
99
0(72)—Zn—N(196) 143
0(72)—Zn—O(H
2
O) 99
N(69)—Zn-O(H
2
O)
120
N(196)—Zn—O(H
2
O)
111

518
Г лава
10
между связями в которой отличаются от идеальных на 20° [53]
В соединениях с гистидином четыре азотных лиганда образуют
тетраэдр с угловыми искажениями около 10°. Кроме того, с цин-
ком связаны два атома кислорода [54, 55].
2.3. Комплекс КПА с глицилтирозином
Фермент-субстратный комплекс глицилтирозина и КПА был
изучен кристаллографически при атомном разрешении с помощью
разностного фурье-метода [1—3]. Это оказалось возможным бла-
годаря чрезвычайно низкой скорости превращения глицилтирози-
на. В растворе £
К
ат имеет порядок 1 мин
-1
, тогда как в кристалли-
ческом состоянии величина периода полупревращения соизмерима
со временем съемки дифракционной картины. В кристаллическом
комплексе обнаружен только один тип связывания глицилтирозина
с ферментом. Взаимодействия, наблюдаемые в этом комплексе, лег-
ли в основу предполагаемого механизма действия КПА (разд.
3.5.1) [2].
Обычно в кристаллографии белков для расчетов по
разностному методу Фурье используются коэффициенты
to (I Fes
I
— JexpCiaE)*. Поскольку вклад, соответствующий
структуре нативного фермента, вычитается, то суммирование ря-
дов Фурье позволяет получить изображение различий между струк-
турами E и ES. Если некоторые атомы белка смещаются в резуль-
тате комплексообразования, то на их месте появляются участки
с отрицательной электронной плотностью. На предварительных
разностных картах комплекса с глицилтирозином при разрешении
2,8 А хорошо наблюдалось расположение атомов тирозильной
группы. Однако глицильный остаток субстрата, который на
рис. 15.6 и 15.8 находится над атомом цинка, особенно его карбо-
нильная группа, был виден плохо. Причиной этого могло быть то,
что при связывании субстрата электронная плотность небелкового
происхождения вблизи атома цинка замещалась на эквивалент-
ную ей. Были рассмотрены две возможные ориентации глицильной
части субстрата. Более вероятная из них предполагает образова-
ние связи между атомом металла и кислородом карбонильной
группы [2].
Для того чтобы более надежно определить ориентацию моле-
кулы глицилтирозина, был проведен новый обсчет дифференциаль-
ной карты. В общем случае можно ожидать, что карта, рассчитан-
*
I FE S
I—амплитуда рассеивания для кристаллов, содержащих субстрат,
I
F
E
I
— амплитуда рассеивания для кристаллов «свободного» фермента, ав—фа-
зовый угол, рассчитанный методам изоморфного замещания. Множитель ш харак-
теризует вес отдельного члена.
а
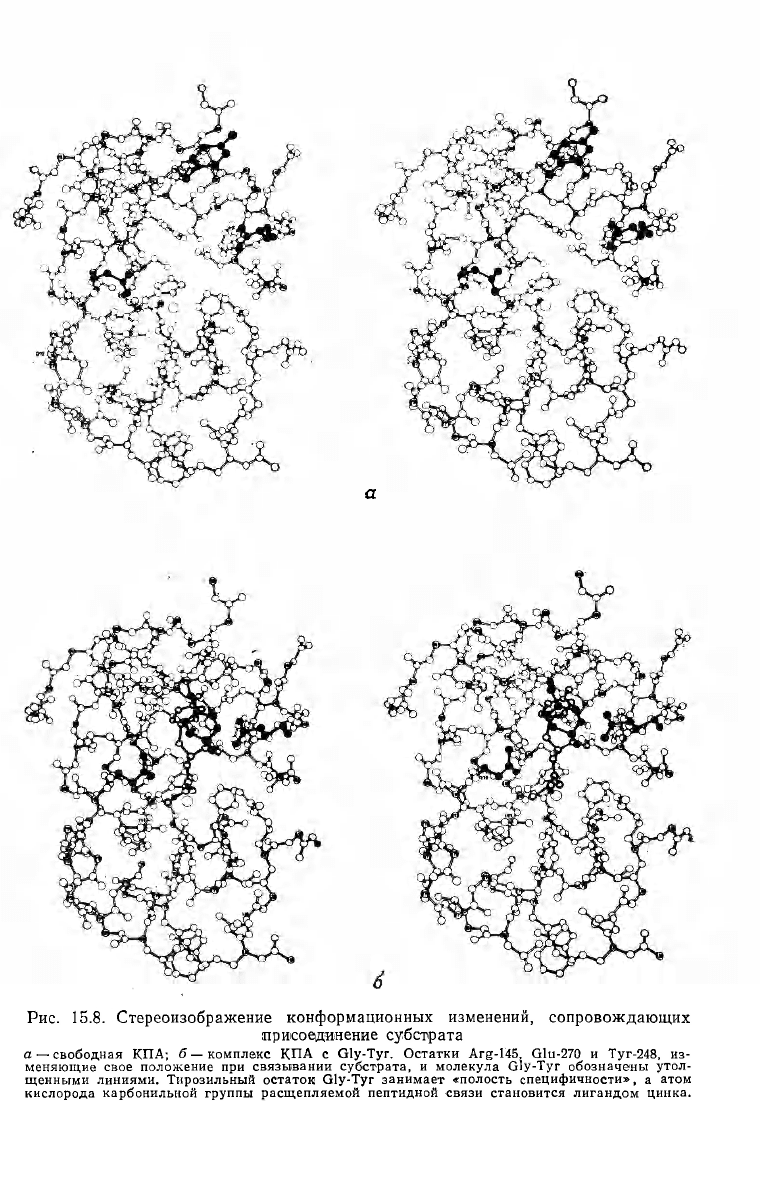
Рис. 15.8. Стереоизображение конформационных изменений, сопровождающих
присоединение субстрата
а — свободная КПА; б — комплекс КПА с Gly-Tyr. Остатки Arg-145, Glu-270 и Туг-248, из-
меняющие свое положение при связывании субстрата, и молекула Gly-Tyr обозначены утол-
щенными линиями. Тирозильный остаток Gly-Tyr занимает «полость специфичности», а атом
кислорода карбонильной группы расщепляемой пептидной связи становится лигандом цинка.

520
Г лава
10
ная по коэффициентам ( I^es |— |/
7
Pacc
4
I) ехр (га
ра
ссч) *, обнаружит
расположение всех атомов комплекса с субстратом, для которых
оно будет иным, чем в нативной структуре. К сожалению, из-за
того, что только часть молекул (х) в кристалле связана с субстра-
том, карта, основанная на этих коэффициентах, содержала бы
плотности, соответствующие всем атомам той доли молекул
(1
—
х), которые не образовали комплекс, за исключением опущенных
при расчете структуры, а именно, молекулы воды в полости, и
плотность небелкового происхождения вблизи атома цинка. По-
этому коэффициенты, соответствующие доле свободного фермента,
были также вычтены. Таким образом, в новом модифицированном
варианте расчета [3] коэффициенты были равны
(I Fes
I
—*
I
F
vacc4
\
— (1-х)
|
F
e
|) ехр (Шрассч)
•
Контакты фермента с субстратом, обнаруженные на окончатель-
ной карте, представлены на рис. 15.6 и 15.8. Существенные взаимо-
действия между глицилтирозином и белком можно разбить на пять
групп.
1. Фенольная боковая цепь остатка тирозина занимает полость
на поверхности фермента, вытесняя оттуда несколько молекул во-
ды. Соответствие фенольной группы и этой полости неидеально, что
согласуется с наличием довольно широкой специфичности в отно-
шении этой части субстрата, которая может быть ароматической
или разветвленной алифатической. Вблизи ароматического цикла
находятся остатки Ile-243, Ile-247, 11е-255 и Asp-256 (рис. 15.6).
2. Карбоксильная группа субстрата присоединена к гуанидино-
вым группам Arg-145 посредством двух водородных связей.
3. Фенольный атом кислорода в Туг-248 находится на расстоя-
нии, меньшем длины водородной связи, от NH-группы пептидной
связи субстрата. Расстояние это равно 2,7 А при точности ±1,0 А.
4. Атом кислорода карбонильной группы субстрата занимает
по отношению к атому цинка примерно то же положение, что и мо-
лекула воды или ион OH
-
в свободном ферменте. Хотя атом кис-
лорода карбонильной группы субстрата виден очень плохо, его
локализация подтверждается расположением плотностей, соответ-
ствующих атомам азота аминогруппы и C
a
в субстрате. Кроме то-
го, на картах нет других сгущений электронной плотности, которые
можно было бы приписать карбонильной группе. Атом углерода
этой группы расположен на расстоянии 3,5 А от атома кислорода,
принадлежащего остатку Glu-270.
5. Аминогруппа субстрата связана с остатком Glu-270 через мо-
лекулу воды. Это взаимодействие считается «непродуктивным»
(разд. 3.5.1). По-видимому, оно не является электростатическим,
* IFpaссч] и сХрассч — амплитуда рассеивания и фазовый угол, рассчитанные
по положению атомов.

Карбоксипептидаза А и другие пептидазы
521
поскольку из экспериментов по ингибированию вытекает, что с
КПА связывается только анионная форма глицилтирозина [56].
Образование фермент-субстратного комплекса происходит в ре-
зультате ряда конформационных изменений в структуре белка. Са-
мые значительные из них затрагивают остатки 248, 270 и 145 и
видны из сравнения рис. 15.8, а и б. Гуанидиновая группа остатка
Arg-145 перемещается примерно на 2 А в результате поворота вок-
руг связи Cp—C
v
. Кислородные атомы карбоксильной группы ос-
татка Glu-270 смещаются примерно на 2 А вдоль оси у вследствие
поворотов вокруг связей C
a
—Cp и Cp—C
y
(на рис. 15.8, б карбо-
ксильная группа переворачивается и сдвигается вверх по отноше-
нию к наблюдателю). Более других изменяет свое положение оста-
ток Туг-248. Кислородный атом боковой цепи этой аминокислоты
сдвигается на 12 А в результате поворота приблизительно на 120°
вокруг связи C
a
—Cp и небольшого смещения пептидного скелета.
Фенольное кольцо остатка Туг-248 поворачивается по направлению
к субстрату, заключая С-концевой участок в полость. В своем но-
вом положении этот остаток близок к расщепляемой пептидной
связи. Движение остатков Arg-145 и Туг-248, вероятно, взаимосо-
гласовано посредством нескольких менее значительных перемеще-
ний. В свободном ферменте остатки Туг-248 и Arg-145 соединены
системой водородных связей, в которой принимают участие остат-
ки 155, 154 и 249. После присоединения глицилтирозина взаимо-
действия в парах Arg-145—Glu-155 и Gln-249—Туг-248 нарушают-
ся и пептидная цепь на участке 247—249 несколько изменяет свое
положение.
Присоединение субстрата превращает заполненную молекулами
воды полость в сравнительно гидрофобный участок. Остаток
Leu-203 выступает внутрь полости, тогда как в свободном фермен-
те он взаимодействует с другими аминокислотами, образующими
Р-структуру. Однако вода удаляется из полости лишь частично, и
три или четыре ее молекулы остаются внутри после присоединения
тирозильной группы субстрата. Поскольку в этом участке происхо-
дит связывание боковых групп гидрофобных С-концевых остатков
и субстраты с такими остатками гидролизуются быстрее всего
(рис. 15.2), то эту полость можно назвать участком специфичности.
При этом надо иметь в виду, что другие участки связывания также
влияют на специфичность.
Константа диссоциации комплекса глицилтирозина с КПА при
25
0
C равна Ы0~
3
M (табл. 15.4). Соответствующая ей величина
AG составляет —4,1 ккал/моль, что меньше суммы вкладов всех
наблюдаемых взаимодействий [57, 58]. Часть энергии связывания
предположительно используется для перевода субстрата и (или)
фермента в напряженные, т. е. энергетически невыгодные конфор-
мации [59—62] (разд. 3.5.1). Таким образом, благоприятные фер-
мент-субстратные взаимодействия служат источником энергии для

522
Г лава
10
конформационных изменений белка. Так как остаток Туг-248, по-
видимому, существен для пептидазной активности (разд. 3.3), а его
правильное расположение по отношению к субстрату достигается в
результате структурной перестройки, вызываемой присоединением
субстрата, то взаимодействие КПА — глицилтирозин служит хоро-
шим примером «индуцированного соответствия» фермента субстра-
ту [63, 64].
2.4. Дополнительные структурные исследования*
2.4.1. Моделирование
Для увеличения взаимодействия с ферментом можно увеличить
размер пептидного субстрата, исходя из известной специфичности
КПА в отношении связывания [2, 3]. Одна из моделей фермент-
субстратного комплекса, в котором субстратом является КБЗ-А1а-
Ala-Туг, показана на рис. 15.3. После того как остаток Туг-248 из-
менил свое положение, пептидная связь Ala-Ala находится по
отношению к нему на расстоянии, при котором возможно образо-
вание водородной связи. Ее существование объясняет большую ре-
акционную способность пептидов с NH-группой в ближайшем от
конца положении по сравнению с пептидами, у которых в положе-
нии Si (рис. 15.9) находится N-метильный [66] или р-аланильный
остаток [67]. Остальная часть субстрата располагается в «выем-
ке» на поверхности КПА, что согласуется с тем, что в контакте с
белком могут находиться до пяти аминокислотных звеньев субстра-
та [31]. Положение бензильного остатка КБЗ-группы вблизи аро-
матического остатка Phe-279 и атома кислорода карбоксильной
группы третьей от конца аминокислоты субстрата вблизи гуани-
диновой группы остатка Arg-71 согласуется с известным влиянием
заместителей на величину Км [31].
Можно отметить, что моделирование подтверждает и некоторые
известные особенности стереоспецифичности КПА [3, 52], если до-
пустить, что молекула субстрата в кинетически важном комплексе
расположена так же, как молекула глицилтирозина. Так, если суб-
страты, замещенные в области С-конца (КБЗ-01у-тиазолидинкар-
боновая кислота [68], КБЗ-Gly-Pro [69]), поместить таким обра-
зом, что группа R оказывается в полости, COO
-
— вблизи Arg-145,
a C=O-вблизи атома цинка, то возникают стерические помехи
со стороны остатков 11е-247 и Туг-248. Пептиды, оканчивающиеся
* В настоящее время проводится кристаллографическое изучение комплекса
КПА и Phe-Gly-Phe-Gly [65]. Карты электронной плотности отчетливо указывают
на существование связи между карбонильной группой субстрата и атомом цинка.
Кроме того, ион цинка заметно смещается (примерно на 0,6 А) при связывании
этого субстрата.
