Лекции по дисциплине - Технология изделий интегральной техники
Подождите немного. Документ загружается.

21
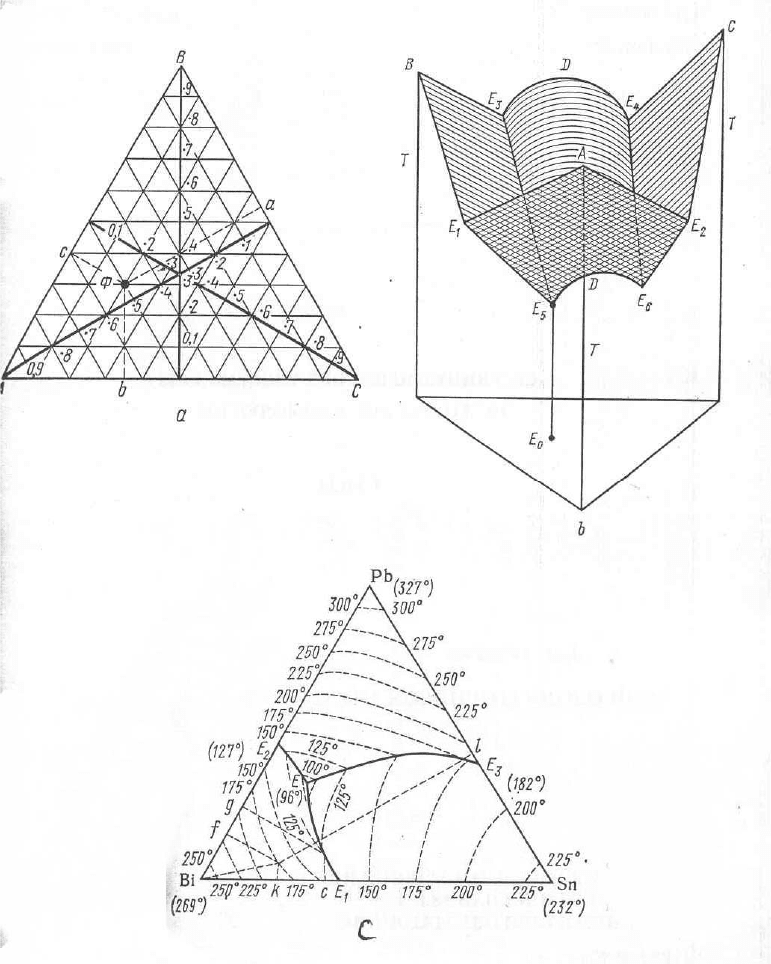
О диаграммах состояния тройных систем. В случае тройных систем A – B – C
можно пользоваться треугольными диаграммами Гиббса (рис. 2.15). Для
определения точки Ф опускают перпендикуляры на стороны диаграммы (рис. 2.15,
а). Высота перпендикуляра в долях высоты треугольника показывает концентрацию
компонента, символ которого помещен в вершине треугольника. Значение свойства
задается двумя способами: 1) высотой перпендикуляра (например, Е
0
Е
5
на рис. 2.15,
b) к данной точке; 2) кривыми, отражающими на диаграмме геометрические места
точек с равными свойствами (так, например, на географической карте изображаются
изогипсы). На рис. 2.15, с показана диаграмма плавкости системы Bi – Pb – Sn.
Рис. 2.15. Симметричная тройная диаграмма состояния по Гиббсу:
а – нахождение фигуральной точки;
b – диаграмма состояния в трех измерениях с построением
поверхности свойства;
с – диаграмма плавкости для системы Bi – Pb – Sn с
нанесенными на ней изотермами и эвтектическими линиями
22
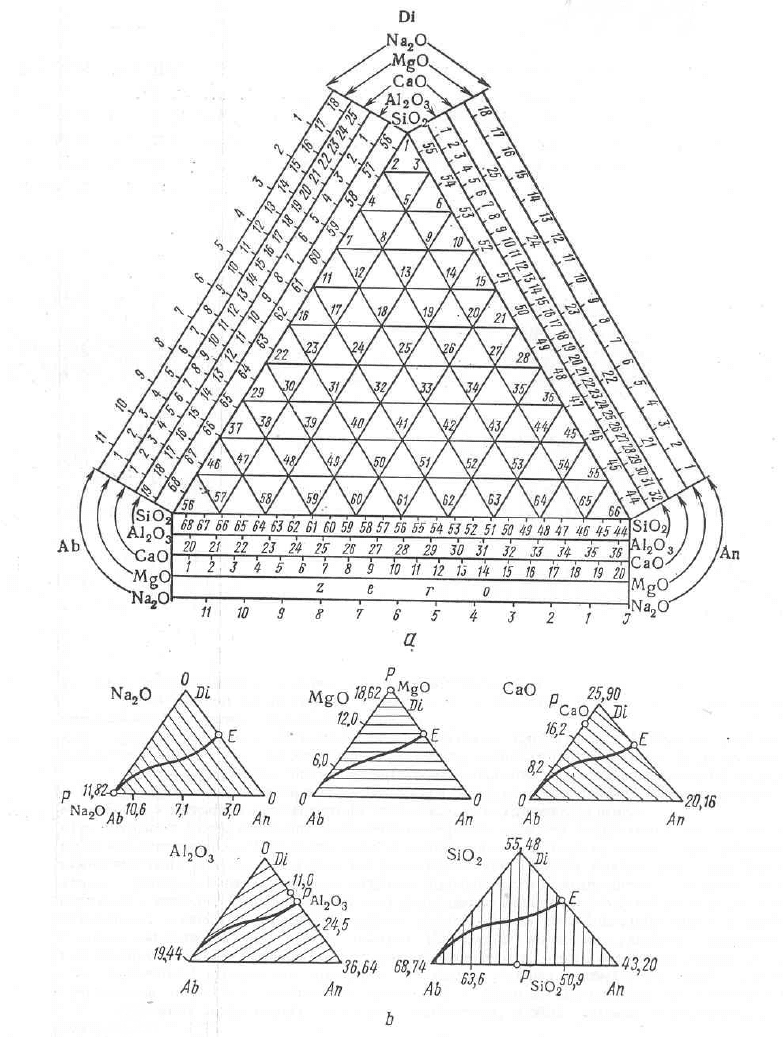
На рис. 2.15, b компоненты B и C образуют дистектическую диаграмму с
эвтектиками Е
3
и Е
4
. Компоненты А и В, а также А и С образуют эвтектические
диаграммы с эвтектиками Е
1
и Е
2
и, наконец, возникают тройные эвтектики Е
5
и Е
6
. В
случае, когда компоненты диаграммы А – В – С простые соединения,
несимметричная диаграмма (рис. 2.16) никаких преимуществ перед симметричной
не имеет. Но если это сложные соединения, то введение несимметричной
диаграммы дат существенное преимущества.
Рис. 2.16. Несимметричная тройная диаграмма состояния для системы
альбит – анортит – диопсид. На сторонах диаграммы отложено
содержание каждого простого оксида в процентах:
a – общий вид диаграммы;
b – эквиконцентрационные линии на пяти простых оксидов.
23
Поясним сказанное на примере системы альбит – анортит – диопсид
(соответственно Ab – An – Di, на рис. 2.16). Состав альбита: ⋅⋅
223 2
6Na O Al O SiO ;
анортита: ⋅⋅
23 2
2CaO Al O SiO ; диопсида:
⋅
⋅
2
2MgO CaO SiO . Таким образом, система
слагается из пяти оксидов: Na
2
O, MgO, CaO, Al
2
O
3
, и SiO
2
. Химический анализ
содержание именно простых оксидов, а не сложных соединений – компонентов
тройной диаграммы. Поэтому, определив химический состав, приходится делать
сложные пересчеты для нахождения фигуральной точки. Положение значительно
упрощается с использованием метода несимметричной диаграммы по Ормонту (рис.
2.16, а).
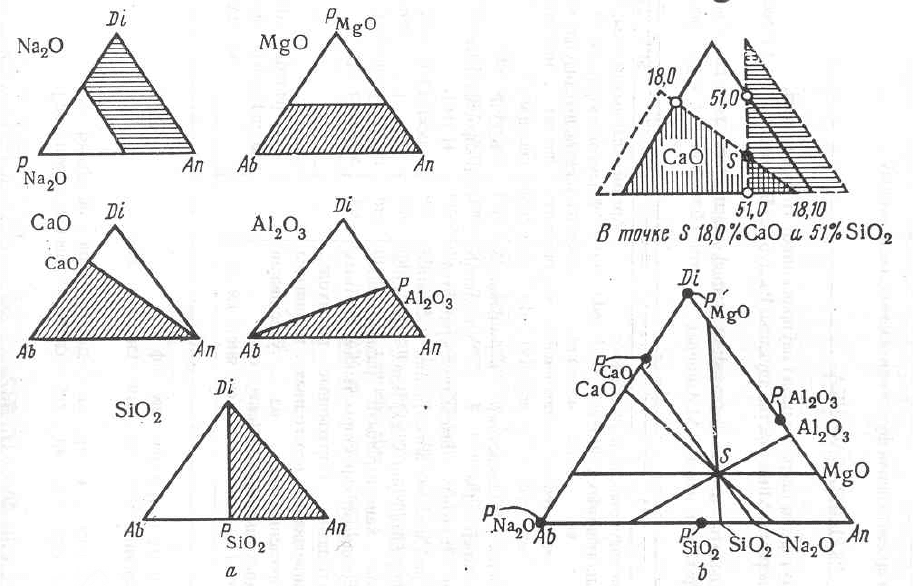
Математический анализ показал, что концентрация любого простого оксида
может быть представлена эквиконцентрационными углами к сторонам диаграммы
(рис. 2.16, а). Отложив на сторонах последней концентрационный масштаб и
используя шаблоны, стороны которых направлены под углами, отвечающими
эквиконцентрационным линиям (рис. 2.17, а), можно без всякого расчета найти по
положению точки ее состав в простых оксидах. Напротив, по химическому составу
можно немедленно найти фигуральную точку (рис. 2.17, b). Для этой цели нужно,
оказывается, знать содержание не всех (в нашем примере пять), а только некоторых
(двух, для надежности трех) простых оксидов, ибо в идеальном случае все прямые
должны пересечься в точке S. Можно установить надежность химического анализа
(также графическим путем) и т.д.
Рис. 2.17. Построение и применение шаблонов для нахождения
фигуральной точки по содержанию простых веществ и
определение содержания простых веществ по положению
фигуральной точки:
а – построение шаблонов; b – применение шаблонов для
расчетных цепей.
24
Так как в производстве диэлектриков часто используются сложные составы,
применение несимметричной диаграммы может облегчить работу и исследователя,
и технолога. Возникает возможность непосредственно связать химический и
фазовый состав с ходом температур плавления, механических, оптических,
электрических и магнитных свойств фигуральных точек, значительно сократить
количество аналитических определений.
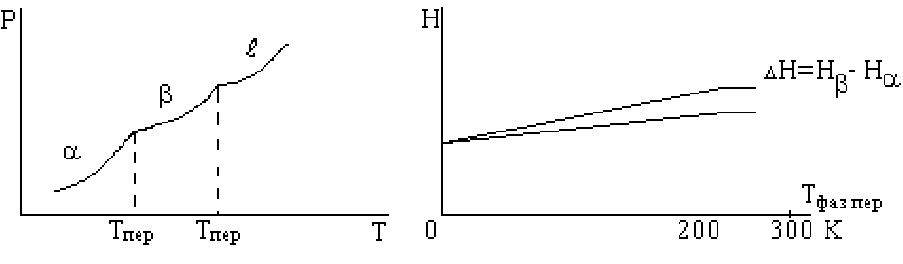
25
2.5. Фазовые переходы
Переходы из одного фазового состояния в другое при изменении параметров
системы.
Фазовые переходы первого рода (испарение, конденсация, плавление,
кристаллизация, переходы из одной кристаллической модификации в другую).
Напомним, что кристаллическое состояние веществ классифицируется по
семи сингониям (триклинная, моноклинная, ромбическая, тетрагональная,
тригональная или ромб…., гексагональная, кубическая) при этом расположение
атомов в этих сингониях характеризуется 14 типами решеток (решетки Браве).
Степень упаковки атомов в этих решетках различна:
Простая кубическая f = 0,52
Объемно центрировая кубическая f = 0,68
Гранецентрированная кубическая f = 0,74
Гексагональная плотная упаковка f = 0,74
Из этих данных следует очень важный вывод, при полиморфных
превращениях (изменение типа кристаллической решетки) происходит изменение
объема и следовательно физико-химических свойств материалов.
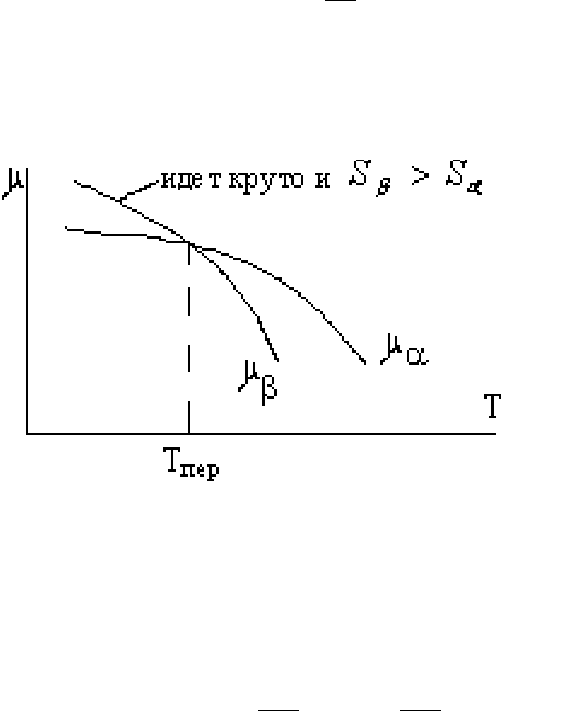
При переходах первого рода в точке перехода сосуществует две фазы.
A
α
−> B
β
а) переход осуществляется при определенной температуре T
пер
б) при переходе изменяются скачком первые производные энергии: энтальпии,
энтропии, объема (следовательно значит и плотности)
Фазовые переходы второго рода.
При переходах второго рода первые производные свободной энергии,
энтальпии, энтропии, объема, плотности изменяются монотонно.
Титанат бария – кубическая структура –> тетрагональный типичный
пьезоэлектрик.
MnO – антиферромагнетик при 117 К переходит в парамагнитную фазу.
1. Согласно классификации фазовых превращений, предложенной в 1933 г.
Эрипреситом, превращения подразделяются на превращения (переходы) I и II
родов.

26
Переходы первого рода характеризуются тем, что первые производные
термодинамического потенциала
μ
по температуре и давлению изменяются
скачкообразно
S
T
μ
∂
=
−
∂
V
p
μ
∂
=
∂
,
здесь S – энтропия, V – объем
Так как термодинамический потенциал при фазовых переходе меняется
непрерывно определяется выражением
UTS pV
μ
=
−+
то энергия U также должна изменяться скачком. Так как
12 1 2 1 2 2 1 2 1 2 1
()()()()()U U TS S pV V H H TS S
μ
μ
−= − − − + − = − − − , то теплота перехода
21 21
()qH H TS S
=
−= −
равна произведению температуры на разность энтропии фаз, т. е.
скачкообразное изменение или поглощение теплоты.
Важным является непрерывное изменение термодинамического потенциала.
Функция
1
μ
(Т) и
2
μ
(Т) не изменяют особенностей вблизи точки фазового перехода,
при этом с обеих сторон точки фазового перехода имеются минимумы
термодинамического потенциала.
Этой особенностью объясняется возможность перегрева или переохлаждения
фаз в случае фазовых переходов в системе.
Определим взаимосвязи между скачками термодинамических функций S
Δ
и
VΔ . После дифференцировании по температуре соотношение Функция
1
μ
(Р,Т) =
2
μ
(Р,Т)
с учетом выражения для S, V и q получим
12
12 21
()
SS
pq
TVV TVV
−
∂
==
∂− −
.
Эта известная формула Клайперона-Клаузиса. Она позволяет определить
изменение давлений, находящихся в равновесии фаз при изменении температуры
либо изменении температуры перехода между двумя фазами при изменении
давления. Скачкообразное изменение объема приводит к отсутствию определенной
связи между структурой и системой фаз, преобразующихся при фазовом переходе
первого рода, которые в связи с
этим изменяются скачком.
Типичными для фазовых переходов первого рода являются переходы между
агрегатными состояниями вещества, аллотропическими превращения многие
фазовые превращения в многокомпонентных материалах.
Принципиальное отличие фазовых переходов второго рода от фазовых
переходов первого рода заключается в следующем: переходы второго рода
характеризуются как непрерывностью изменения термодинамического потенциала,
так и непрерывностью изменения производных термодинамического потенциала
μ
.
27
Химическое равновесие
Термодинамическая функция – функция состояния, определяющая изменение
термодинамических потенциалов при изменении числа частиц в системе. Другими
словами
μ
– есть функция, которая определяет направление и предел
самопроизвольного перехода компонента из одной фазы в другую при
соответствующих превращениях и условиях (T, P, V, S, n
i
).
Термодинамические потенциалы связаны с друг другом следующими
соотношениями
F = U – TS
H = U + pV
G = F + pV
уд
μ
- количество вещества в граммах;
моль
μ
- количества вещества в молях;
моль уд
M
μ
μ
=⋅
М – молекулярный вес соответствующего вещества.
Для теории твердых растворов, на которых работают все приборы
микроэлектроники огромное значение имеет развитый Гиббсом метод химических
потенциалов. Химическое равновесие можно определить с помощью химических
потенциалов.
Химический потенциал характеризуется энергией, приходящейся на 1 атом
0
G
N
μ
=
μ
- химический потенциал; G – энергия Гиббса;
N
o
– число Авогадро, N
А
– L =
23
100222,6 ⋅ моль
-1
т. е.
α
μ
(Р,Т) =
β
μ
(Р,Т)
Обе кривые характеризуют монотонное убывание
μ
с температурой,
определяя значение энтропии фаз
S
T
β
β
μ
∂
−=
∂
и
S
T
α
α
μ
∂
−=
∂
.

28
2.6. Термодинамические диаграммы
Функцией состояния называется такая физическая характеристика системы,
изменение которой при переходе системы из одного состояния в другое не зависит
от вида соответствующего этому переходу термодинамического процесса, а целиком
определяется значениями параметров начального и конечного состояний.
Важнейшие функции состояний:
1. Внутренняя энергия E. Внутренней энергией E называется энергия
системы, зависящая только от её термодинамического состояния
()
внеш
kn
EW W W=− + ,
W – полная энергия системы;
n
W – кинетическая энергия макроскопического движения системы;
внеш
n
W – потенциальная энергия, связанная с действием на систему внешних
силовых полей.
QEA
=
Δ+
Первый закон термодинамики.
Количество теплоты, сообщенное системе, расходуется на изменение её
внутренней энергии и на совершение системой работы против внешних сил.
Второй закон термодинамики:
a) невозможен процесс, единственным результатом которого является
совершение работы, эквивалентной количеству теплоты, полученной от
нагревателя;
b) невозможен процесс, единственным результатом которого является
передача энергии в форме теплоты от холодного тела к горячему.
Для изолированной системы, находящейся в равновесии, энтропия должна
быть минимальной
min
Q
S
T
=
.
Для неизолированной системы при постоянной температуре (изотермический
процесс)
Q
S
T
Δ=
.
Напомним, что
Свободная энергия Гельмгольца (
F)
FETS
=
−
F – свободная энергия, изохорно-изотермический потенциал.
Свободная энергия Гиббса
ZGFPVETSPV==+ =− +

29
Z – термодинамический потенциал, изобарно-изотермический
потенциал.
Следствие.
При постоянных температуре и давлении свободная энергия Гиббса системы,
находящейся в равновесии будет минимальной, а при отклонениях от равновесия
,
() 0
TP
G
δ
≥ .
2. Энтальпия
H (теплосодержание, тепловая функция) – это функция
состояния термодинамической системы, равная сумме её внутренней энергии и
произведения давления на объём системы
HEPV
=
+ .
3. Энтропия
S. Энтропией называется функция S состояния системы,
дифференциал которой в элементарном обратном процессе равен отношению
бесконечно малого количества теплоты, сообщённого системе, к абсолютной
температуре системы:
Q
dS
T
δ
=
.
4. Изобарно-изотерический потенциал G. Характеристической функцией и
термодинамическим потенциалом является функция состояния системы
GEPVTSHTS
=
+−=⋅.
Это изобарно-изотермический потенциал (изобарный потенциал,
термодинамический потенциал Гиббса).
5. Изохорно-изотермический потенциал
FETS
=
−
Функция Гельмгольца (изохорный потенциал, свободная энергия)
2.6.1. Диаграмма состояния (диаграмма равновесия, фазовая диаграмма)
Любая термодинамическая система может в зависимости от условий
находится в 4-х агрегатных состояниях: плазма, газ, жидкость, твёрдое тело.
Геометрическое изображение равновесных состояний термодинамической
системы при различных значениях параметров (
T, p, x
i
– концентрации компонентов,
мольного объёма
V и др.) называется диаграммой состояния.
Диаграмма состояния даёт информацию о фазовом составе системы в
зависимости от параметров
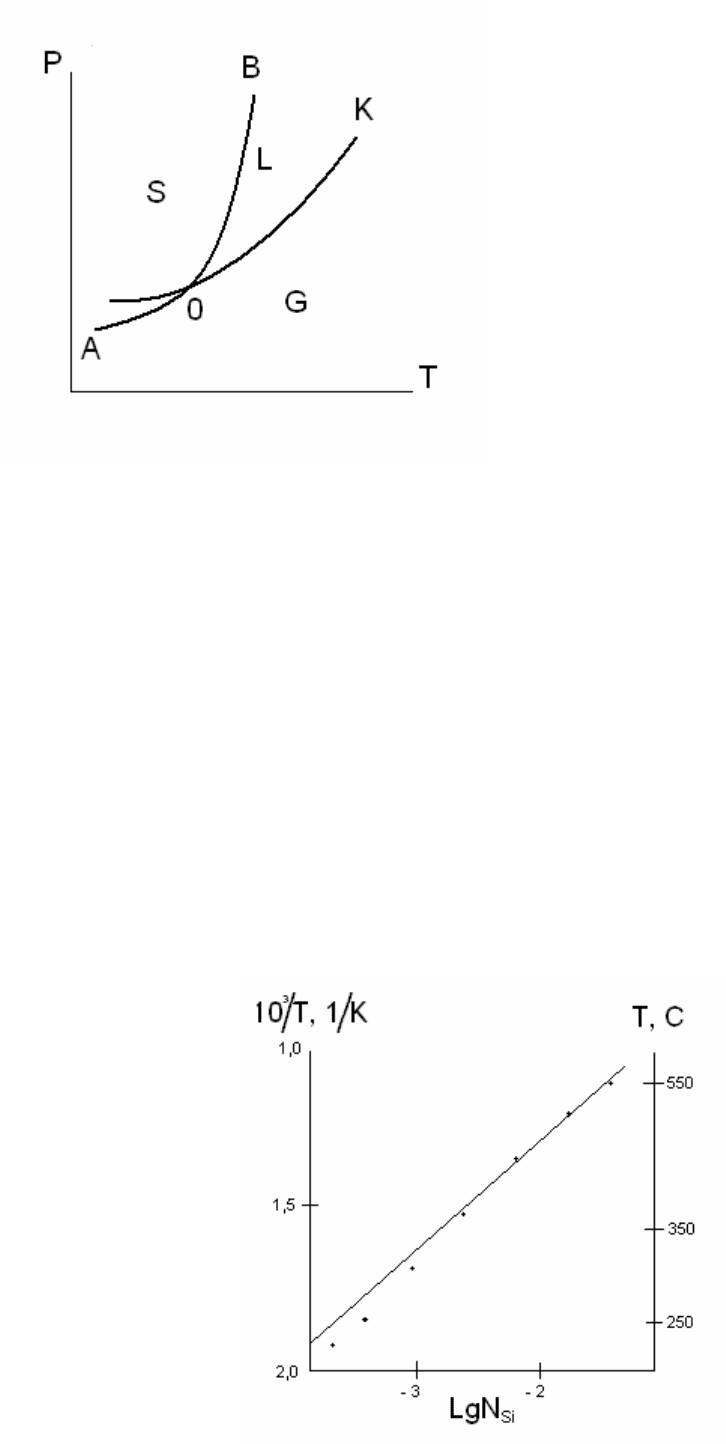
30
O – равновесие трёх фаз, тройная
точка;
OA – кривая возгонки или сублимации;
OK – кривая испарения;
OB – кривая плавления;
A, K, B – критические точки, в точке K
исчезает различие G – L, в B – L – S, в A
– S – G.
Полиморфные превращения (алмаз – графит) усложняют диаграмму
состояния. У
SiO
2
– 11 полиморфных превращений в технологическом варианте
синтеза изделий микроэлектроники, при этом изменяется не только тип
кристаллической решётки, но и мольный объём
V.
2.6.2. Растворимость
Концентрация вакансий от 1 до 10
23
. 10
23
– число атомов в единице объёма.
S – энтропия, увеличивается значительно.
При равновесии 0
TP
G
δ
=
GHTS
=
−
В результате можно показать, что число вакансий увеличивается с
температурой.
