Басниев К.С. Энциклопедия газовой промышленности
Подождите немного. Документ загружается.


1
ОБЩИЕ
СВЕДЕНИЯ
1.7.2.2.6.3. В жидкой фазе
Методы,
позволяющие оценить вязкость в жид-
кой
фазе, менее многочисленны и менее точны; не-
редко
отклонения от экспериментальных значений
(тоже очень редких) составляет 50%.
Специальные корреляции (Van
Welsen
и др.,
Medani и т.д.) в форме:
Q
=
Аехр(-
К)
используются для расчета вязкости чистых компо-
нентов, после чего вязкость смеси получается из
закона
смешения в форме:
log
(xj = £х, log (х,)
где:
х- кинематическая (или динамическая) вязкость.
Следующая
таблица предлагает некоторые ве-
личины, вычисленные (пакетом Газпак) для сжи-
женных природных газов в состоянии насыщения
(на кривой кипения).
Замечание:
Для чистого жидкого метана в состоянии насы-
щения
была
установлена следующая корреляция
при
100 <Т< 190 К:
/-7
ц'(СН
4
) = £ар'
где
р
- плотность
(кг/м
3
),
ц
- динамическая вязкость (10"
6
Па
•
с),
при
этом:
во = 0,107 42 10
3
а, = -0,698 27
аг = -0,252 62 х 10"
3
% =
0,607
81 х 10"
s
гц - 0,246 50 х 10"
7
а
5
= -0,479 33 х 10"
10
ag = -0,293 10 х 10-
12
ay = 0,584 31 х 10"
15
.
Она позволяет получить значения ц(СН
4
) с по-
грешностью порядка нескольких процентов.
1.7.2.2.7.
Влагосодержание природного
газа,
образование
гидратов
1.7.2.2.7.1.
Влагосодержание природного газа
При низких давлениях (Р < 0,5 МПа) влагосодер-
жание природного газа при насыщении может быть
легко
получено с помощью законов Дальтона и Ра-
уля (см. §
1.7.2.1.4.)
в рамках модели совершенного
газа:
Рн,о -
У
Ps
H<0
(T) - давление насыщенных паров воды при
температуре Т,
*н,о ~ мольная доля воды в жидкой фазе (х = 1, ес-
ли жидкость состоит только из воды),
Ун,о ~ мольная доля воды в паровой фазе,
р
н,о - парциальное давление воды в паровой фазе,
Р - общее давление;
откуда:
[Н.О]
=
Ун,оМн,о 0,804 х
V
0
где
[Н
2
О]
-влагосодержание в условиях насыще-
ния,
выраженное в
мг/м
э
(н),
Мн,о
~ молекулярная масса воды
(=18,015 г/моль),
Ps
HiO
(T)
- давление насыщенных паров воды при
температуре Т, для насыщенного газа
эта температура является также точ-
кой
росы "газ-вода" при рассматривае-
мом
давлении газа Р (замечание:
поми-
мо
этого существует точка росы
"газ-уг-
леводороды").
При средних и, тем более, при высоких давле-
ниях необходимо обращаться к уравнению состоя-
ния,
способному учесть специальные свойства
воды (существенный дипольныи момент, водород-
ные связи), или к эмпирической методике, осно-
ванной на экспериментальных данных.
Часто используется корреляция Букачека,
бази-
рующаяся на величине влагосодержания метана
при
насыщении. Она записывается в виде:
где:
Р - абсолютное давление (бар),
А и В - коэффициенты.являющиеся функциями
температуры; для
-40°С
< f <
40°С:
А = 4 926,5 ехр (0,073 74Г- 0,000
307Г
2
)
В = 44,87 ехр (0,053 57f- 0,000 199J
2
)
Температура,
К
Метан
Газ1
Р, МПа
кг/м
3
Р.МПа
кг/м
3
110
0.0885
1 190
0,091
1470
120
0,192
940
0,188
1 160
130
0,369
760
0,350
940
140
0,644
630
0,595
770
150
1,044
530
0,944
650
Плотность
метана
и
газа-1 (GNL)
на
кривой кипения (в кг/м
3
), вычисленная
с
помощью
пакета
Газпак.
124
1
ОБЩИЕ СВЕДЕНИЯ
Темп.
ь
0
0,01
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
Давл.
А
КПВ
,0006109
,0006113
.0006567
,0007056
,0007577
,0008131
,0008721
,0009349
,0010016
,0010724
,0011477
,0012276
,0013123
,0014022
,0014974
,0015983
,0017051
,0018181
,0019376
,0020640
,0021975
,002339
,002487
,002645
,002810
,002985
,003169
,003363
,003567
,003782
,004008
,004246
,004496
,004759
,005034
,005324
,005628
,005947
,006281
.006632
,006999
,007384
Удельный объем,
м^/кг
Жидкая
фаза
1,0002
1,0002
1,0002
1,0001
,0001
,0001
,0001
,0001
,0002
,0002
,0003
1,0004
1,0004
1,0005
1,0007
1,0008
1,0009
1,0011
1.0012
1,0014
1,0016
1,0018
1,0020
1,0022
1,0024
1,0027
1,0029
1,0032
1,0035
1,0037
1,0040
1,0043
1,0046
1,0050
1,0053
1,0056
1,0060
1,0063
1,0067
1,0071
1,0074
1,0078
Газовая
фаза
10\
206278
206136
192 577
179 889
168 132
157 232
147 120
137 734
129 017
120 917
113 386
106 379
99 857
93 784
88124
82 848
77 926
73 333
69 044
65 038
61 293
57 791
54
514
51447
48
574
45 883
43 360
40 994
38 774
36 690
34
733
32 894
31 165
29 540
28 011
26 571
25 216
23 940
22 737
21 602
20 533
19 523
Внутренняя энергия,
Жидкая
фаза
"t
-0,03
0,00
4,15
8,36
12,56
16,77
20,97
25,19
29,38
33,59
37,80
42,00
46,20
50,41
54,60
58,79
62,99
67,18
71,38
75,57
79.76
83,95
88,14
92,32
96,51
100,70
104,86
109,06
113.25
117,42
121,60
125,78
129,96
134,14
138,32
142,50
146,67
150,85
155,03
159,20
163,38
167,56
кДж/кг
Субли-
мация
2375,4
2 375,3
2 372,6
2 369,7
2 366,9
2 364,1
2 361,3
2 358,4
2 355,6
2 352,8
2 350,0
2 347,2
2 344,3
2 341,5
2 338,7
2 335,9
2 333,1
2 330,3
2 327,4
2 324,6
2 321,8
2 319,0
2 316,2
2 313,3
2
310,5
2 307,7
2
304,9
2
302,1
2
299,3
2
296,4
2 293,6
2 290,8
2 288,0
2 285,2
2 282,4
2 279,5
2 276,7
2 273,9
2 271,1
2 268,2
2 265,4
2 262,6
Газовая
фаза
и
я
2
375,3
2 375,3
2 376.7
2 378,1
2 379,5
2 380,9
2 382,3
2 383,6
2 385,0
2 386,4
2 387,8
2 389,2
2 390,5
2 391,9
2 393,3
2 394,7
2 396,1
2 397,4
2 398,8
2 400,2
2 401,6
2 402,9
2 404,3
2 405,7
2 407,0
2 408,4
2 409,8
2411,1
2 412,5
2 413,9
2 415,2
2 416,6
2 418,0
2 419,3
2 420,7
2 422,0
2 423,4
2 424,7
2 426,1
2 427,4
2 428,8
2 430,1
Энтальпия
Жидкая
фаза
hi
-0,02
0,01
4,16
8,37
12,57
16,78
20,98
25,20
29,39
33,60
37,80
42,01
46,20
50,41
54,60
58,80
62,99
67,19
71,38
75,58
79,77
83,96
88,14
92,33
96,52
100,70
104,89
109,07
113,25
117,43
121,61
125.79
129,97
134,15
138,33
142,50
146,68
150,86
155,03
159,21
163,39
167,57
кДж/кг
Субли-
мация
2501,4
2 501,3
2 499,0
2 496,7
2 494,3
2 491,9
2 489,6
2 487,2
2 484,8
2 482,5
2 480,1
2 477,7
2 475,4
2 473,0
2 470,7
2 468,3
2 465,9
2
463,6
2 461,2
2 458,8
2 456,5
2 454,1
2 451,8
2 449,4
2 447,0
2 444,7
2 442,3
2 439,9
2 437,6
2 435,2
2 432,8
2 430,5
2 428,1
2 425,7
2 423,4
2 421,0
2 418,6
2 416,2
2 413,9
2411,5
2 409,1
2 406,7
Газовая
фаза
h
g
2501,3
2 501,4
2 503,2
2 505.0
2 506,9
2 508,7
2 510,6
2 512,4
2 514,2
2 516,1
2 517,9
2 519,8
2 521,6
2 523,4
2 525,3
2 527,1
2 528,9
2 530,8
2 532,6
2 534,4
2 536,2
2 538,1
2 539,9
2 541,7
2 543,5
2 545,4
2 547,2
2 549,0
2 550,8
2 552,6
2 554,5
2 556,3
2 558,1
2 559,9
2 561,7
2 563,5
2 565,3
2 567,1
2 568,9
2 570,7
2 572,5
2 574,3
;
Энтропия,
кДж/(кг(С
Жидкая
фаза
si
-0,0001
0,0000
0,0152
0,0305
0,0457
0,0610
0,0761
0,0912
0,1062
0,1212
0,1362
0,1510
0,1658
0,1806
0,1953
0,2099
0,2245
0,2390
0,2535
0,2679
0,2823
0,2966
0,3109
0,3251
0,3393
0,3534
0,3674
0,3814
0,3954
0,4093
0,4231
0,4369
0,4507
0,4644
0,4781
0,4917
0,5053
0,5188
0,5323
0,5458
0,5592
0,5725
Субли-
мация
9,1566
9,1562
9.1147
9,0730
9,0316
8,9904
8,9496
8,9090
8,8688
8,8289
8,7892
8,7498
8,7107
8,6718
8,6332
8,5949
8,5569
8,5191
8,4816
8,4443
8,4073
8,3706
8,3341
8,2979
8,2618
8,2261
8,1905
8,1552
8,1202
8,0854
8,0508
8,0164
7,9822
7,9483
7,9146
7,8811
7,8478
7,8147
7,7819
7,7492
7,7167
7,6845
Газовая
фаза
s
o
9,1565
9,1562
9,1299
9,1035
9,0773
9,0514
9,0257
9,0003
8,9751
8,9501
8,9253
8,9008
8,8765
8,8524
8,8285
8,8048
8,7814
8,7582
8,7351
8,7123
8,6897
8,6672
8,6450
8,6229
8,6011
8,5794
8,5580
8,5367
8,5156
8,4946
8,4739
8,4533
8,4329
8,4127
8,3927
8,3728
8,3531
8,3336
8,3142
8,2950
8,2759
8,2570
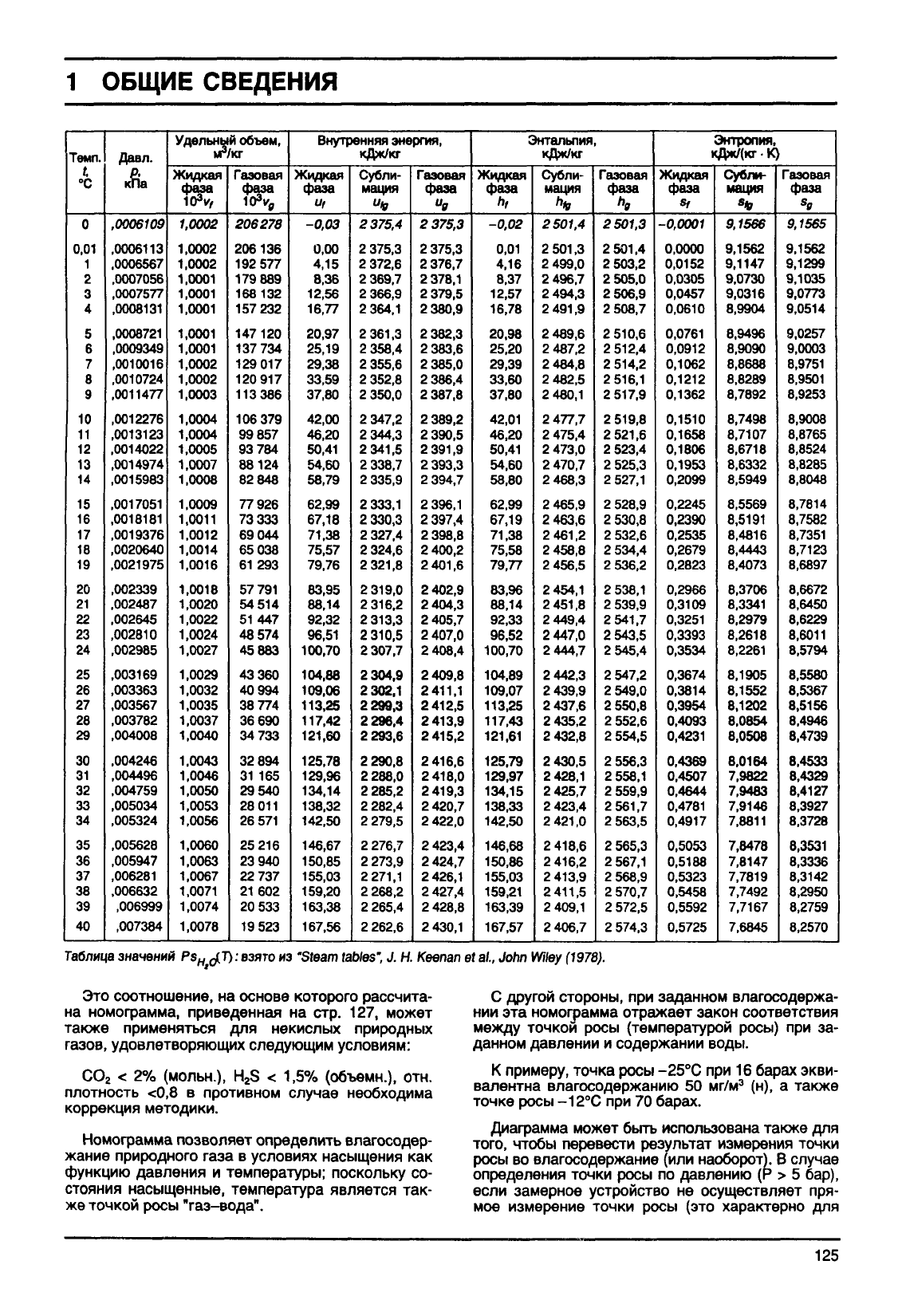
Таблица
значений Ps
H
^7): взято из "Steam tables; J. Н. Кеепап et al., John
Wiley
(1978).
Это
соотношение,
на основе
которого
рассчита-
на
номофамма, приведенная на стр. 127, может
также
применяться для некислых природных
газов,
удовлетворяющих следующим условиям:
СО
2
< 2% (мольн.), H
2
S < 1,5% (объемн.), отн.
плотность
<0,8 в противном случае необходима
коррекция
методики.
Номофамма
позволяет определить влагосодер-
жание
природного
газа
в условиях насыщения как
функцию
давления и температуры; поскольку со-
стояния
насыщенные, температура является так-
же
точкой росы
"газ-вода".
С
другой
стороны,
при заданном влагосодержа-
нии
эта
номограмма
отражает
закон
соответствия
между
точкой росы (температурой росы) при за-
данном
давлении и содержании воды.
К
примеру,
точка росы
-25°С
при 16 барах
экви-
валентна влагосодержанию 50
мг/м
3
(н), а также
точке
росы -12°С при 70 барах.
Диафамма
может быть использована также для
того,
чтобы перевести результат измерения точки
росы
во влагосодержание (или
наоборот).
В случае
определения
точки росы по давлению (Р > 5 бар),
если
замерное устройство не осуществляет пря-
мое
измерение точки росы (это характерно для
125
1 ОБЩИЕ СВЕДЕНИЯ
Темп.
0,01
0
-2
-4
-6
-В
-10
-12
-14
-16
-18
-20
-22
-24
-26
-28
-30
-32
-34
-36
-38
-40
Давл.
кПа
0,6113
0,6108
0,5176
0,4375
0,3689
0,3102
0,2602
0,2176
0,1815
0,1510
0,1252
0,1035
0,0853
0,0701
0,0574
0,0469
0,0381
0,0309
0,0250
0,0201
0,0161
0,0129
Удельный
объем,
иг/кг
Твердая
1,0908
1,0908
1,0904
1,0901
1,0898
1,0894
1,0891
1,0888
1,0884
1,0881
1,0878
1,0874
1,0871
1,0868
1,0864
1,0861
1,0858
1,0854
1,0851
1,0848
1,0844
1,0841
Газовая
фаза
v
e
206,1
206,3
241,7
283,8
334,2
394,4
466,7
553,7
658,8
786,0
940,5
1 128,6
1358,4
1640,1
1986,4
2 413,7
2
943,
3
600,
4 419,
5
444,
6 731,
8
354,
Внутренняя энергия,
кДж/кг
Твердая
фаза
-333,40
-333,43
-337,62
-341,78
-345,91
-350,02
-354,09
-358,14
-362,15
-366,14
-370,10
-374,03
-377,93
-381,80
-385,64
-389,45
-393,23
-396,98
-400,71
-404,40
-408,06
-411,70
Субли-
мация
2 708,7
2 708,8
2 710,2
2 711,6
2 712,9
2
714,2
2 715,5
2 716,8
2 718,0
2 719,2
2 720,4
2 721,5
2 722,7
2 723,7
2 274,8
2 725,8
2 726,8
2 727,8
2 728,7
2 729,6
2 730,5
2 731,3
Газовая
фаза
и
а
2 375,3
2 375,3
2 372,6
2369,8
2 367,0
2 364,2
2 361,4
2 358,7
2 355,9
2 353,1
2 350,3
2 347,5
2 344,7
2 342,0
2 339,2
2 336,4
2 333,6
2 330,8
2 328,0
2 325,2
2 322,4
2 319,6
Энтальпия
кДж/кг
Твердая
фаза
-333,40
-333,43
-337,62
-341,78
-345,91
-350,02
-354,09
-358,14
-362,15
-366,14
-370,10
-374,03
-377,93
-381,80
-385,64
-389,45
-393,23
-396,98
-400,71
-404,40
-408,06
-411,70
Субли-
мация
2 834,8
2 834,8
2 835,3
2 835,7
2 836,2
2 836,6
2 837,0
2 837,3
2 837,6
2 837,9
2 838,2
2 838,4
2 838,6
2 838,7
2 838,9
2 839,0
2 839,0
2 839,1
2 839,1
2 839,1
2 839,0
2 838,9
Газовая
фаза
Пд
2 501,4
2 501,3
2 497,7
2 494,0
2 490,3
2 486,6
2 482,9
2 479,2
2 475,5
2 471,8
2 468,1
2 464,3
2 460,6
2 456,9
2 453,2
2 449,5
2 445,8
2
442,1
2 438,4
2 434,7
2 430,9
2 427,2
t
Твердая
фаза
-1,221
-1,221
-1,237
-1,253
-1,268
-1,284
-1,299
-1,315
-1,331
-1,346
-1,362
-1,377
-1,393
-1,408
-1,424
-1,439
-1,455
-1,471
-1,486
-1,501
-1,517
-1,532
Энтропия,
<Дж/(кг.К
Субли-
мация
10,378
10,378
10,456
10,536
10,616
10,698
10,781
10,865
10,950
11,036
11,123
11,212
11,302
11,394
11,486
11,580
11,676
11,773
11,872
11,972
12,073
12,176
)
Газовая
фаза
9,156
9,157
9,219
9,283
9,348
9,414
9,481
9,550
9,619
9,690
9,762
9,835
9,909
9,985
10,062
10,141
10,221
10,303
10,386
10,470
10,556
10,644
Таблица
значений Ps
H
^Т)
-.взятоиз
"Steam
tables",
J. H. Keenan etal.,
John
Wiley
(1978).
всех гигрометров, которые устроены не по принци-
пу охлаждающего зеркала и показания которых
даются не в °С), используется закон соответствия,
который позволяет конвертировать замеряемую
величину (в общем случае это парциальное давле-
ние
воды
или, более точно, фугитивность) в ре-
зультат, выражаемый в °С.
Применение
этого закона
(обычно
конструкторы
используют описанную выше модель совершенно-
го
газа,
за исключением специальных случаев)
позволяет
получить
величину влагосодержания,
соответствующую величине, измеряемой в °С. Та-
ким
образом, использование диаграммы позволяет
получить
точку
росы
для природного
газа
(при за-
данном давлении).
1.7.2.2.7.2.
Гидратообразование
В зависимости от условий давления и темпера-
туры
газ, насыщенный водой, может образовывать
твердые вещества, такие как лед или еще чаще -
гидраты природного
газа:
природный газ + вода *=* гидраты
(газообразное
(жидкость) (твердое тело)
состояние)
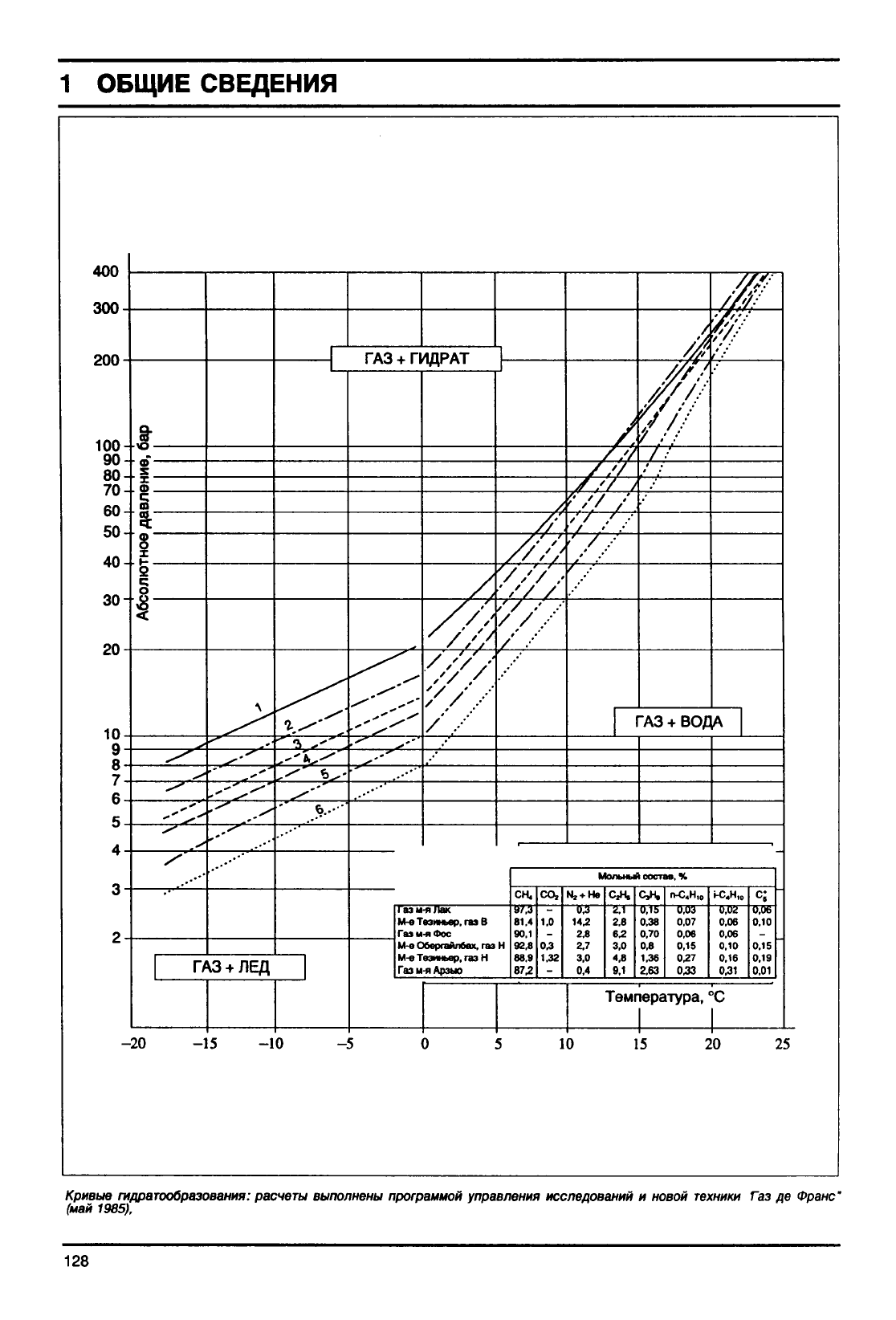
Область существования гидратов ограничена на
плоскости (Р, Т) кривой гидратообразования (см.
нижеследующие
два рисунка
кривых
гидратообра-
зования различных природных газов).
Предупреждение
образования подобных
твердых формирований заключается прежде все-
го
во введении ингибиторов (метанол, гликоль),
воздействие которых заключается в смещении
равновесия газ-гидрат, так что образование гидра-
та
становится возможным при более низких темпе-
ратурах (при заданном давлении), либо при более
высоких
давлениях (при заданной температуре).
Расчеты влагосодержания природных газов
(или
точки
росы
при заданном влагосодержании),
а
также расчеты, относящиеся к образованию и
предупреждению
гидратов, реализованы с по-
мощью пакета Газпак.
126

1 ОБЩИЕ СВЕДЕНИЯ
100 000
70000
50 000
30
000
20 000
14 000
10000
7000
5000
3
000
2
000
1400
1
000
700
500
-50
-40
-30 -20 -10
10
20 30 40 50 60 70 80
I
со
о
о"
О
О,
I
m
300
200
140
100
70
50
30
20
14
10
5
3
2
ВЛАГОСОДЕРЖАНИЕ
НАСЫЩЕННОГО
ПРИРОДНОГО
ГАЗА
• Эта сетка изобар пригодна для любого некислого
природного газа (мольная доля СО2 <
2%,
H2S <
1.5%),
относительна
плотность
которого меньше ОД
Погрешность ± 3%.
Пунктирные изобары соответствуют мвтастабильному
равновесию. При устойчивом равновесии со
льдом
или
гидратом влагосодвржаиив немного
ГАЗ
+ ЛЕ/!
ГАЗ
+
ГИДРАТ
ш
50
000
30
000
М-е
Тезиньер,газ Н
Гаэм-яАрзью
100
000
70000
При заданном давлении соответствующая изобара
определяет
область
устойчивости гидрата в
зависимости от влагосодержания газа и его
температуры. Например, здесь стрелка указывает
40
бар.
-50
-40
-30 -20 -10
10
20 30 40 50 60 70 80
Температура,
"С
Влагосодвржанив
насыщенного природного газа,
127
1 ОБЩИЕ СВЕДЕНИЯ
400
300-
200-
1ОП
QO
-
80-
70-
60-
•50-
40-
зо-
20-
10-
9-
8-
7.
6-
5-
4-
о
О
1
2_
Ф
S
дав
ютное
с;
У
•
.
ГДЧ J. Г1
ЛПРДТ
ь..-'
ГАЗ
+ ЛЕД
-20
-15 -10
...•••
у/
/
А
//
'
///
V//
///у
г
/
/
/
t
1
'
у
*
у
Гаэм-яЛак
М-е
Теэиньер, газ
В
Гаэм-яФос
М-е
Обергайлбах,
газ Н
М-е
Теэиньер, газ
Н
Газм-яАрзыо
/
'/
/
//
У // /
/*
/ J '
'
/ / /
//'
/
1
/.
/
;'
/
;
/
"A3
/i
//А
••••
Г
+
ВОДА
-
Мольный состав,
%
СН«
57)3
81.4
90,1
92,8
88.9
87,2
со.
-
1.0
-
од
1.32
-
-5
0 5
Ыг
+ Не
ОД
14Д
2,8
2,7
3.0
0,4
ел
2.1
2.8
82
3,0
4.8
9.1
Темг
ел
0,15
0.38
0.70
03
1.3Ь
2.63
rvC,H,
0
0,03
0.07
0,06
0,15
0.27
ОДЗ
юратура,'
10
15
0,02
0,06
0.06
0,10
0,16
0.31
'С
20
c
i
0,06
0.10
_
0.15
0.19
0.01
25
Кривые
гидратообразования:
расчеты
выполнены программой управления исследований
и
новой
техники Газ де
Франс"
(май 1985),
128
1
ОБЩИЕ
СВЕДЕНИЯ
ОБОЗНАЧЕНИЯ:
Экспериментальные
результаты
Расчеты методом
Перриша-Праусница
Расчеты
по
соотношению
Хаммершмидта
Температура,
"С
Мольный состав
(%): С1
:81,60
С2:2,70
СЗ
: 0,36
С4:0,15
8 9 10 11 12
C
+
s
: 0,09
N
z
:
14.2
СО
2
:0,9
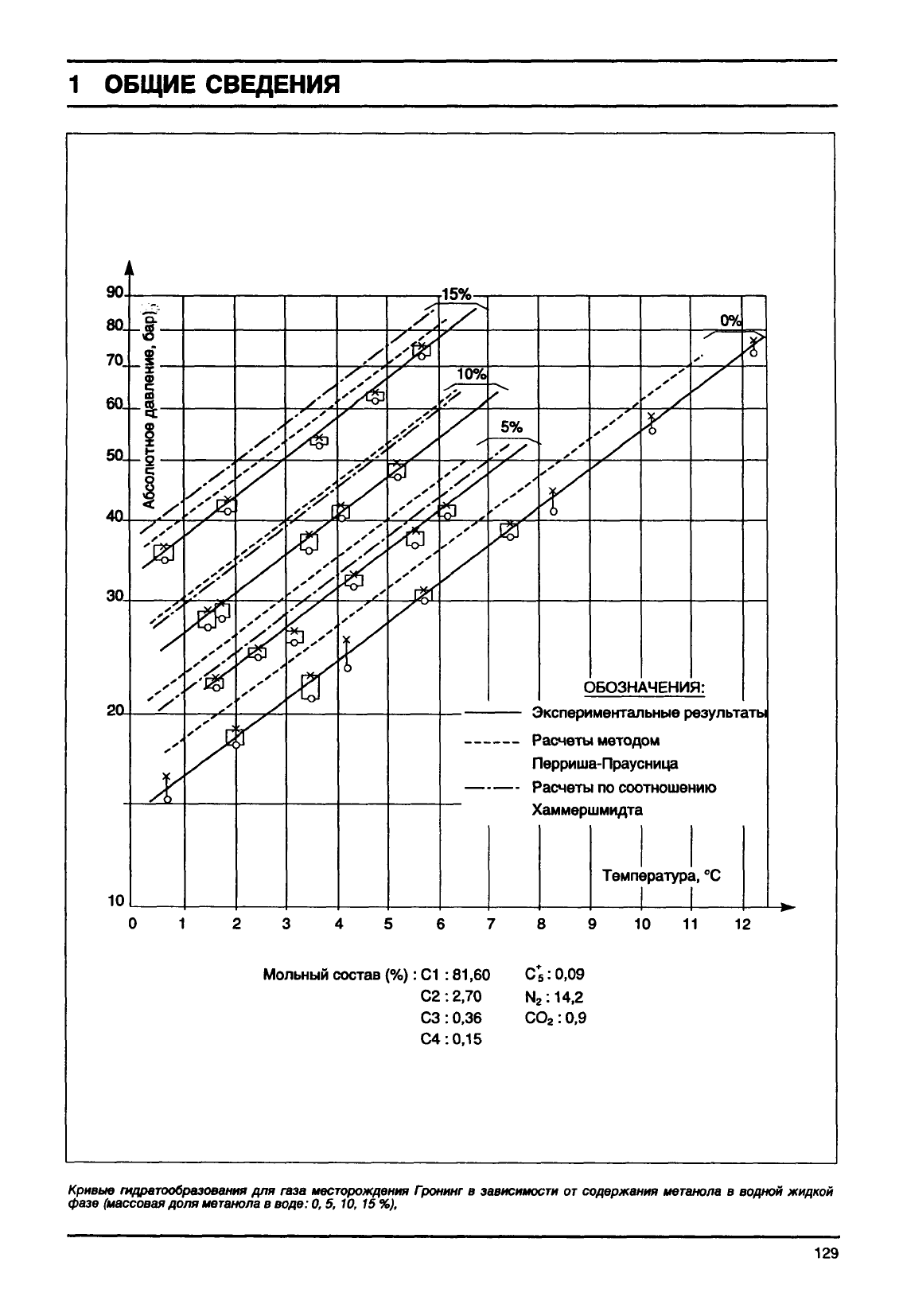
Кривые
гидратообразования
для
газа
месторождения
Гронинг
в
фазе
(массовая
доля
метанола
в
воде:
0,
5,
10, 15
%),
зависимости
от
содержания
метанола
в
водной
жидкой
129

1
ОБЩИЕ СВЕДЕНИЯ
1.8.
ХИМИЯ
1.8.1.
Теория атома и
химические
связи
1.8.1.1.
Строение
атома
Атом
состоит из центрального ядра, в котором
сосредоточена практически вся его масса. Ядро
несет положительный заряд и окружено облаком
электронов,
отрицательных электрических частиц,
имеющих в сумме заряд, противоположный заряду
ядра.
Электроны вращаются слоями вокруг ядра; их
масса
очень
мала
по сравнению с массой атома.
Масса
одного электрона т = 9,11
•
10"
м
г (в покое),
а его заряд -в = 1,60
•
10"
19
Кулон.
Атомное ядро состоит из
двух
типов частиц:
—
протонов,
число которых равно числу электро-
нов,
они несут положительный заряд (+е) и име-
ют массу, равную 1,66
•
10"
24
г;
—
нейтронов,
не имеющих электрического заряда,
масса
которых близка к массе протонов (гп =
=
1,6627
Ю-
24
г).
Атомное ядро характеризуется:
—
атомным
номером Z, равным числу его прото-
нов,
которое меняется от 1 (для водорода) до
109
1
;
— массовое число А рассматриваемого элемента,
равное Z + N, где N - число нейтронов. Масса
ядра в точности равна (Z + N)
•
М, где М есть
масса
протона.
Элементы, атомный номер которых одинаков,
но число нейтронов неодинаково, называются изо-
топами.
Например, никель имеет 28 протонов, но
может содержать 30, 32, 33 или 36 нейтронов.
1.8.1.1.1.
Атомная
масса,
грамм-атом
По определению единицей массы атома (и)
является
1/12 массы атома углерода-12; она равна:
и=1,660 565
5-Ю-
24
г
Атомная
масса есть отношение массы атома
элемента к 1/12 массы атома углерода-12. Так,
атомная масса водорода равна: Н = 1,007 94, а мас-
са
атома равна
1,00794
•
и (см. таблицу атомных
масс).
Грамм-атом представляет собой массу N
атомов рассматриваемого элемента. N
является
числом Авогадро и равно 6,023
-10
23
.
1
В оригинальном
тексте
последние элементы таблицы
Менделеева
с номерами
105-109
имеют названия, явля-
ющиеся
соответствующими именами числительными на
латинском
языке, например, элемент 109 называется
как
"уннилениум" ("унни" - девять) и т.п. В отечествен-
ной литературе подобные названия не используются.
(Прим.
перев.)
1.8.1.1.2.
Молекулярная
масса,
моль
Молекулярной массой вещества
является
отно-
шение массы молекулы этого вещества к
1
/12 мас-
сы атома углерода-12; следовательно, она форми-
руется атомными массами элементов, входящих в
состав молекулы.
Пример:
молекула HjS содержит один атом
серы и два атома водорода, молекулярная масса
равна:
2-1,008 + 32,066 = 34,082
Грамм-молекула или моль вещества есть неко-
торая масса этого вещества, которая выражается
в граммах числом, равным молекулярной массе
рассматриваемого
вещества.
Пример:
1
моль H
2
S равен 34,082 г.
1.8.1.2.
Электронная структура
атома
Электроны вращаются вокруг ядра.
Область
пространства,
в которой можно встретить данный
электрон,
называется
атомной
орбитой.
Квантовая
механика показывает, что "положение", или, более
точно, состояние отдельного электрона в атоме
определяется четырьмя целыми числами, назван-
ными квантовыми числами.
1.8.1.2.1.
Главное квантовое число
Главное
квантовое число п характеризует уро-
вень энергии электрона, который называется эле-
ктронным слоем. Эти слои обозначаются заглав-
ными буквами К, L, М и т.д. соответственно после-
довательным значениям числа л: 1, 2, 3 и т.д.
1.8.1.2.2.
Вторичное квантовое число
Вторичное квантовое число /определяет форму
орбиты,
а вместе с числом л и среднее расстояние
от электрона до ядра. Оно может принимать значе-
ния 0,1, 2 ... л - 1, которые соответствуют энерге-
тическим
состояниям, называемым подслоями и
обозначаемым буквами s, p, d, f, когда / имеет зна-
чение 0,1, 2, или 3.
1.8.1.2.3.
Магнитное квантовое число
Магнитное
квантовое число m определяет угло-
вую ориентацию орбиты в пространстве. Оно мо-
жет принимать значения между -/и +/. Каждый
подслой содержит фиксированное число кван-
товых
ячеек,
определяемое величиной я?
(см.
сле-
дующую таблицу).
130

1
ОБЩИЕ СВЕДЕНИЯ
Слой
И
1
2
3
Обозначение
К
L
М
Подслой
М
0
0
1
0
1
2
Обозначение
1s
2s
2р
3s
Зр
3d
Квантовые
ячейки
(/л)
0
0
п
I
0
- 1
0
1
Г
~
2
-1
0
1
2
Число
электронов в
слое
2
СМ
(О
2
'
6
10
8
18
Электронная
формула
1S
1
"
2
2
s
12
2р
1в
3
s
1
"
2
Зр
1
"
6
3d
1
"
10
Распределение
электронов
по
трем
первым слоям в
атоме.
1.8.1.2.4.
Спиновое квантовое число
Спиновое квантовое число s определяет на-
правление вращения электрона вокруг самого
себя;
возможны лишь два его значения:
1/2 либо
-1/2
Принцип исключения
Паули
указывает, что два
электрона из одного атома не могут иметь одина-
ковую тетраду (л, /, m, s) квантовых чисел.
Исходя из этих сведений можно определить рас-
пределение электронов по различным электрон-
ным слоям; в вышеприведенной таблице представ-
лены
распределения, соответствующие трем пер-
вым слоям.
1.8.1.3.
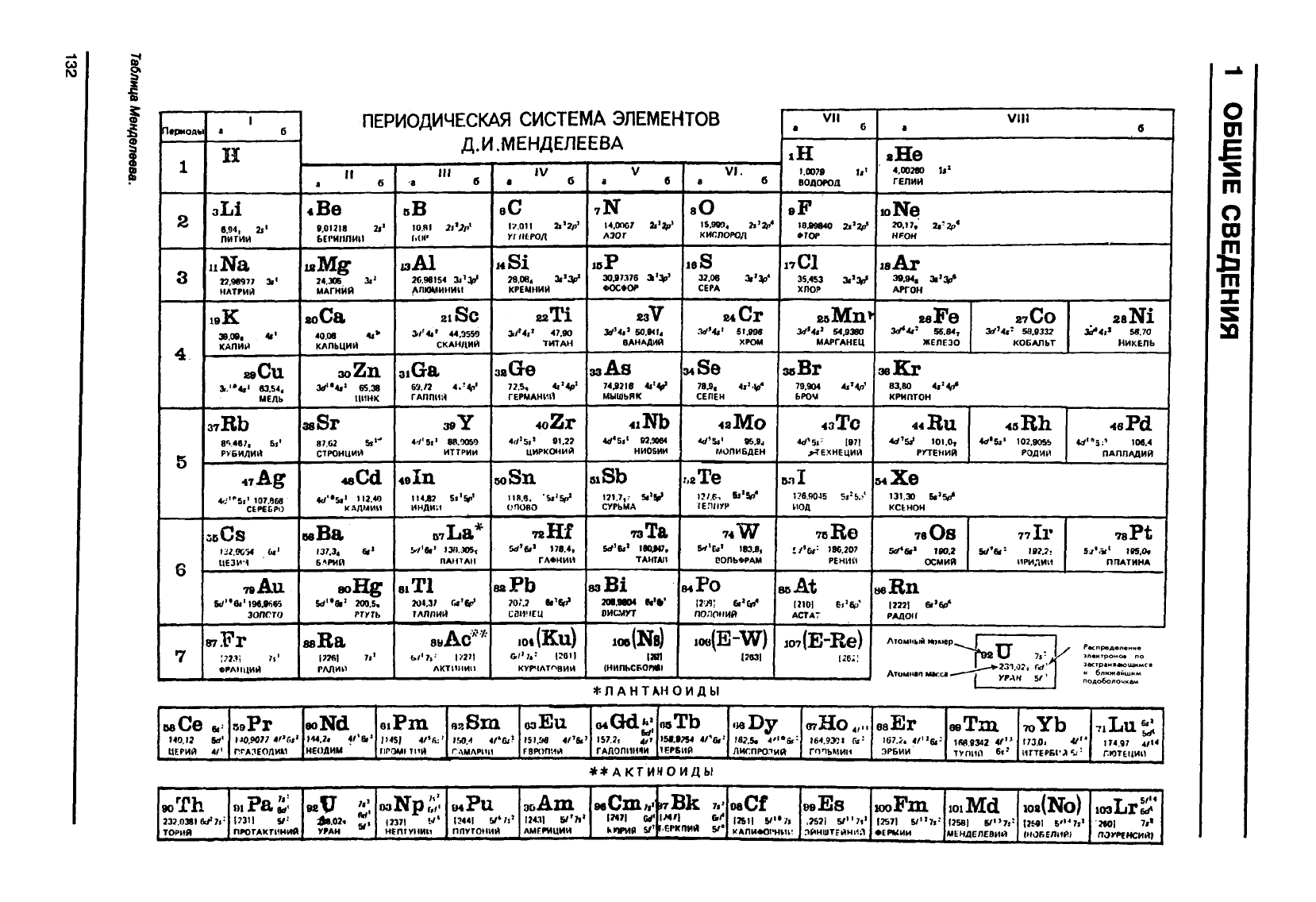
Периодическая
классификация
элементов
(таблица
Менделеева,
1869)
Периодическая таблица содержит семь строк,
указывающих число электронных слоев вокруг
ядра. Каждая строка составляет один период. Чис-
ло элементов, соответствующих каждому периоду,
зависит
от возрастающей емкости электронных
слоев. Последний слой пока не заполнен.
Периодическая таблица, используемая в насто-
ящее время, состоит из 18 вертикальных рядов, ко-
торые объединены в 9
групп,
занумерованных рим-
скими
цифрами. Каждая цифра соответствует чис-
лу электронов на внешней орбите
(валентные
электроны).
Элементы
одного ряда имеют сход-
ные химические свойства.
Первые семь групп разделены на две подгруппы
А и В:
— подгруппы А: от I-A до
Vll-А
характеризуются
пустым или заполненным подслоем &,
— подгруппы В: от
III-B
до
VII-B,
а также группа
VIII,
состоящая из элементов рядов 8, 9 и 10,
являются
переходными
элементами,
соответст-
вующими заполнению подслоя d.
1.8.1.4. Понятие химической связи
Связи формируются за счет взаимодействий
электронов внешних слоев соседних атомов. Су-
ществуют различные типы связей, основными из
которых являются следующие.
1.8.1.4.1.
Ионная
связь
Это электростатическая связь, которая уста-
навливается между двумя ионами противополож-
ного
знака: многие атомы
металлов
легко теряют
один или несколько электронов, образуя катионы
(Na+,
Са
2
*), другие атомы способны легко их
присо-
единять, образуя анионы (Cl~, F-, S
2
~).
Пример:
соли металлов, такие как NaCI, имею-
щие кристаллическую структуру (ионные кристал-
лы).
1.8.1.4.2.
Ковалентная
связь
Устанавливается
путем объединения электро-
нов внешних слоев. В простейшей двухэлектрон-
ной
связи каждый атом предоставляет по одному
электрону для образования дублета. Связь назы-
вается кратной, если она формируется нескольки-
ми
дублетами.
Ковалентная связь
является
более сильной, чем
ионная.
Пример:
Н
2
(простая связь), СО
2
(двойная связь).
131
Период*
1
2
3
4
5
о
7
i
• б
II
3
Li
6.04,
Ъ'
литии
nNa
22.98977
3>'
НАТРИЙ
19
К
39,09,
«f
1
КАЛИЙ
l.'*4t'
83.54,
МЕЛЬ
37
Rb
8Ч.467
а
5i'
РУБИДИЙ
47
Ag
4c
"Si
1
107.868
СЕРЕБРО
3oCS
ШЭИ'*
7»
All
5с/"в|'|9в.»*60
ЭОПСТО
87^Г
ФРАНЦИЙ
ПЕРИОДИЧЕСКАЯ
СИСТЕМА
ЭЛЕМЕНТОВ
Д.И.МЕНДЕЛЕЕВА
4
Be
9.01218
2f'
БЕРИЛЛИИ
«Mg
24,305
3i'
МАГНИЙ
aoCa
40.08
4j»
КАЛЬЦИЙ
зо
Zn
З*"*
1
65.38
ЦИНК
seSr
87.62
S>*'
СТРОНЦИЙ
48Cd
4rf'*Sl' 112.4a
кллмии
мВа
137.3,
6I
1
БЛРИП
8oHg
Srf
1
**
1
200.5.
РТУТЬ
ssRa
12261
7i'
РЛЛИИ
a '" 6
oB
10.Я1 2l'V
Mil
1
к, Al
26.98154
3i'V
АЛЮМИНИИ
ai
Sc
3./'4i' 44.0559
СКАНДИЙ
siGa
6Э./2
4,'V
ГАЛЛИЙ
ЗвУ
4rf'5i' 88.9059
ИТТРИИ
40
III
114.8? 5|'5я'
ИНДИИ
e
7
La*
•yl'W
13П.М5,
ЛАНТАН
eiTl
204.37
Сл'&
ТАЛЛИЙ
A rt**
suiiC
(,('7»
:
17271
АКТПНИ11
. '
V
6
e
C
Г/.011
2»'2/>'
yi трол
,4
Si
28.08,
Jl'V
КРЕМНИИ
«Ti
3./'4»'
47.90
ТИТАН
38
Ge
72.5, 4.'4р'
ГЕРМАНИЙ
40Zr
4rt'5i'
91.2?
ЦИРКОНИЙ
50
Sll
пв.в. SI'S/I
1
ОПОВО
7«Hf
Od'bl"
178.4,
ГАФНИИ
в«РЬ
20Л2
ll^tif
CBItlCU
.o«(Ku)
b/'7.
:
|MI|
КУР
1
1АТГ>ВИИ
V
a 6
7
N
I4.0H67 2i'V
АЭОГ
,
B
P
30.97.176
4'V
ФОСФОР
M
v
3rf'4i
l
5O.«41,
ВАНАДИЙ
зз
AS
74.9218
4|'4р>
МЫШЬЯК
«iNb
td'Sl
1
93.9064
НИ05ИИ
siSb
121.7,-
5lV
СУРЬМА
та Та
Sd'ts'
180*47,
ТАНТАЛ
83Bi
208,9804
U'V
0ИС.МУТ
io*(N8)
(НИПЬСБОП*!
VI.
а б
аО
15.99Я, 2i'a>
4
КИСЛОРОД
32.06 3t'Jp
4
СЕРА
84
СГ
М'Аг
1
51.996
ХРОМ
34
Se
78.9,
4i'V
СЕЛЕН
48
МО
4</'5.'
95.9,
МОЛИБДЕН
Г)8
Те
ТЕЛЛУР
74W
Srf'bi
1
183Л,
РОПЬФРАМ
84РО
!2-л;
ь"бУ
ПОЛОНИЙ
,o«(E-W)
IJB3I
VII
а б
1.0079
1|<
ВОДОРОД
»F
18.99840
2i'2/f
ФТОР
17С1
35.453
3t'V
ХЛОР
8бМП
34*41'
54,9380
МАРГАНЕЦ
збВг
79.904
4i'V
ЬРОМ
43ТС
4d'5l
;
I97I
^ТЕХНЕЦИЙ
D.il
1?e.90J5
ЪГЬ/
ИОД
76
RG
ty*6f
:
1B6.207
РЕНИИ
8,
At
12101
б.'бр"
АСТАТ
i
O7
(E-Re)
126::
а
аНе
4.00260
11
1
ГЕЛИИ
VIII
б
«>Ne
20,17,
Ъ'2р
г
HFOH
is
Аг
39.94,
*>^
АРГОН
«.Fe
3d*U'
S5.84,
ЖЕЛЕЗО
87
СО
3rf'4i' 58.9332
КОБАЛЬТ
28
Ni
3rf*4«'
58.70
НИКЕЛЬ
звКг
83,80 4.
!
V
КРИПТОН
44
RU
4rf
7
5j" 101.0,
РУТЕНИЙ
45
Rll
4rf'5»'
102.905b
РОДИИ
4ePd
Ad
x
"i?
106.4
ПАЛЛАДИЙ
м
Хе
131.»
Ь'вр*
КСЕНОН
7вОв
И'61
1
180.2
ОСМИЙ
771Г
W'6,- 192.2,
ИРИЛМИ
,
8
Pt
Ъ1*Ы
Х
19S.0*
ППАТИНА
тЯ11
1222]
б!
1
^
РАДОН
Люммый мпмер^.^
Атимгчп маги '
J »-231,02i firf'
|
УРАН
S/'
•
, Распределение
электромоа по
застраивающимся
и ближайшим
подоболочкам
* Л А Н Т АН 0 И Д Ы
ввСе
в.
МО.
12
W
se
Pr
И0.9О77
Н'Сл'
aoNd
144.2.
V'
6
*'
eiPm
|H5| 4/'(u'
90Th
232.03816^71
=
Ш
X CV вй'
17311
5>
:
rwNp
u,<
12371
M
1
HEПIУНИИ
яг
Sm
1ГЮ.4 4^*01?
M
Pu
13441 5/';i'
ПЛУТОНИЙ
wEu
I5I.M 4''b'
FBPOniM
э&Ат
124Я1
W'Tl
1
АМЕРИЦИИ
04
Gd^
1
,
157.2,
«I
ГАЛОПИНИИ
ro
Tb
I5I.9254
4/'
l
O'
1ЕРБИЙ
**АКТИНОИДЫ
ввСхП/!
1
|M7|
ft/
1
МПРИЙ M'
^Bk v
1.СРКЛИЙ 5/'
«eDy
162,5. 4'"6.
:
ЛИСПРОЛИЙ
oaCf
12Ы1
S/'*7»
КАПИФОШ1Н:
етНО
4
,м
164.9301
Г«
:
ГППЬМИМ
ев
Er
167./.
4f"6l
:
ЗРБИИ
ев
Tm
168.9342
V\'
ТУ mm
6
'"'
то
Yb
173.0.
«"
ИГТЕРБ1'Л
с
--
:
99
Ев
,2521
«"71'
ЗИНШТЕЙНИЛ
iooFm
|2S7|
5/"7»
;
ФЕРМИИ
Ю1
Md
I25B1
W"7>
:
МЕНДЕЛЕВИЙ
io.(No)
(2MI
S'"7s'
(ПОВЕЛИМ!
viLus;
174.97
t/4
Г.ЮТЕЦИП
looLr&d
1
2601
7I
1
ПО/PS НСИЙ)
О
01
S
m
о
го
S
m
1 ОБЩИЕ СВЕДЕНИЯ
Атомный
номер
89
13
95
51
47
18
33
85
7
56
97
4
83
5
35
48
20
98
6
58
55
17
24
27
29
96
66
99
68
50
63
26
100
9
87
64
31
32
72
2
67
1
49
53
77
36
57
103
3
71
12
Название
Актиний
Алюминий
Америций
Сурьма
Серебро
Аргон
Мышьяк
Астат
Азот
Барий
Берклий
Бериллий
Висмут
Бор
Бром
Кадмий
Кальций
Калифорний
Углерод
Церий
Цезий
Хлор
Хром
Кобальт
Медь
Кюрий
Диспрозий
Эйнштейний
Эрбий
Олово
Европий
Железо
Фермий
Фтор
Франций
Гадолиний
Галлий
Германий
Гафний
Гелий
Гольмий
Водород
Индий
Иод
Иридий
Криптон
Лантан
Лоуренсий
Литий
Лютеций
Магний
Обозначение
Ас
AI
Am
So
Ag
Ar
As
At
N
Ba
Bk
Be
Bi
В
Br
Cd
Ca
Cf
С
Се
Cs
Cl
Cr
Co
Cu
Cm
Dy
Es
Er
Sn
Eu
Fe
Fm
F
Fr
Gd
Ga
Ge
Hf
He
Ho
H
In
I
Ir
Kr
La
Lr
U
Lu
Mg
Относительная
атомная масса (1)
227,0278
26,98154
(243)
121,75
±3
107,8682±3
39,948
74,9216
(210)
14,0067
137,33
(247)
9,01218
208,9804
10,81
79,904
112.41
40,08
(251)
12,01115
140.12
132,9054
35,453
51,996
58,9332
63,546
±3
(247)
162.50
±3
(252)
167,26
±3
118,69
±3
151,96
55,847
±3
(257)
18,998403
(223)
157,25
±3
69.72
72,59
1 3
178,49
±3
4,00260
164,9304
1,00794
±3
114,82
126,9045
192,22
±3
83,80
138,905513
6.941
± 3
174.967
24,305
Атомный
номер
25
101
80
42
60
10
93
28
41
102
79
76
8
46
15
78
82
94
84
19
59
61
91
88
86
75
45
37
44
62
21
34
14
11
16
38
73
43
52
65
81
90
69
22
74
92
23
54
70
39
30
40
Название
Марганец
Менделеевий
Ртуть
Молибден
Неодим
Неон
Нептуний
Никель
Ниобий
Нобелий
Золото
Осмий
Кислород
Палладий
Фосфор
Платина
Свинец
Плутоний
Полоний
Калий
Празеодим
Прометий
Протактиний
Радий
Радон
Рений
Родий
Рубидий
Рутений
Самарий
Скандий
Селен
Кремний
Натрий
Сера
Стронций
Тантал
Технеций
Теллур
Тербий
Таллий
Торий
Тулий
Титан
Вольфрам
Уран
Ванадий
Ксенон
Иттербий
Иттрий
Цинк
Цирконий
Обозначение
Мп
Md
Hg
Mo
Nd
Ne
Np
Ni
Nb
No
Au
Os
О
Pd
P
Pt
PD
Pu
Po
К
Pr
Pm
Pa
Ra
Rn
Re
Rh
Rb
Ru
Sm
Sc
Se
Si
Na
S
Sr
Та
Тс
Те
Tb
Tl
Th
Tm
Ti
W
U
V
Xe
Yb
Y
Zn
Zr
Относительная
атомная масса (1)
24,9380
(258)
200,59
± 3
95,94
144,2413
20,179
237,0482
58,69
92,9064
(259)
196.9665
190,2
15,9994
± 3
106,42
30,97376
195,08
±3
207,2
(244)
(209)
39,0983
140,9077
(145)
231,0359
226,0254
(222)
186,207
102,9055
85,467
±3
101,0713
150,3613
44,9559
78,96
1 3
28,0855
13
22,98977
32,064
87,62
180,9479
(98)
127,6013
158,9254
204,383
232,0381
168,9342
47,881
3
183,8513
238,0289
50,9415
131,2913
173,0413
88,9059
65,38
91,22
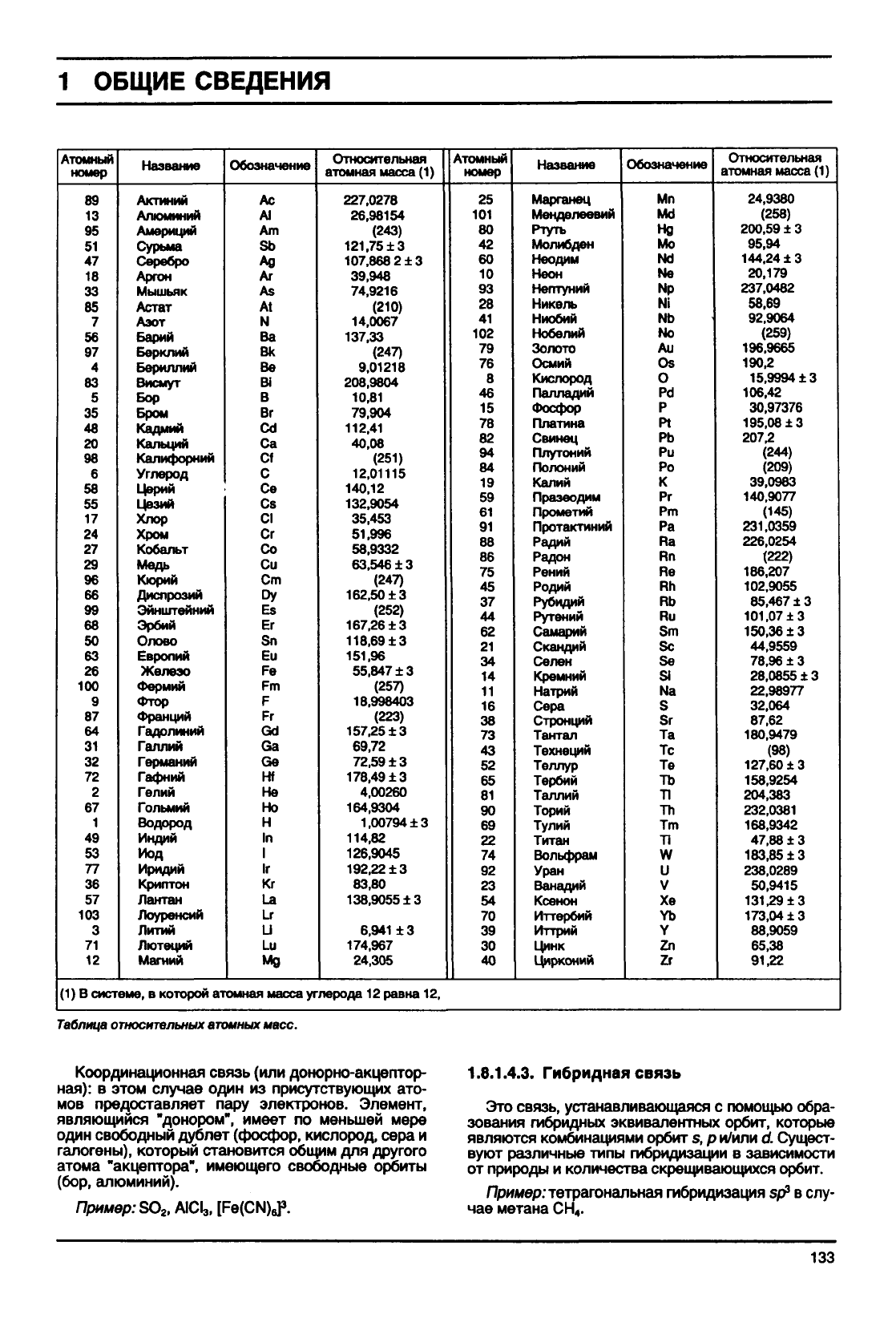
(1)
В
системе,
в которой атомная масса углерода 12 равна 12,
Таблица
относительных
атомных
масс.
Координационная связь (или донорно-акцептор-
ная): в этом
случае
один из присутствующих ато-
мов предоставляет пару электронов.
Элемент,
являющийся "донором", имеет по меньшей мере
один свободный
дублет
(фосфор, кислород, сера и
галогены), который становится общим для другого
атома "акцептора", имеющего свободные орбиты
(бор,
алюминий).
Пример: SO
2
.
AICI3,
[Fe(CN)ep.
1.8.1.4.3.
Гибридная
связь
Это связь,
устанавливающаяся
с помощью обра-
зования гибридных
эквивалентных
орбит, которые
являются
комбинациями орбит s, p
и/или
d. Сущест-
вуют
различные
типы гибридизации в зависимости
от природы и количества скрещивающихся орбит.
Пример:
тетрагональная
гибридизация sp* в слу-
чае метана СН
4
.
133
