Басниев К.С. Энциклопедия газовой промышленности
Подождите немного. Документ загружается.

1 ОБЩИЕ СВЕДЕНИЯ
Орбиты sp
3
получаются как комбинация одной
орбиты 2s и трех
чистых
орбит Зр:
— в фундаментальном состоянии электронная
структура углерода имеет вид:
т
^s
QD
2s
1111
i i
Р
Р Р
— в состоянии гибридизации в результате
скрещи-
вания орбит 2s и 2р углерод имеет четыре экви-
валентных орбиты:
1
s 4 орбиты
sp*
1s
itinim
4
орбиты sp
3
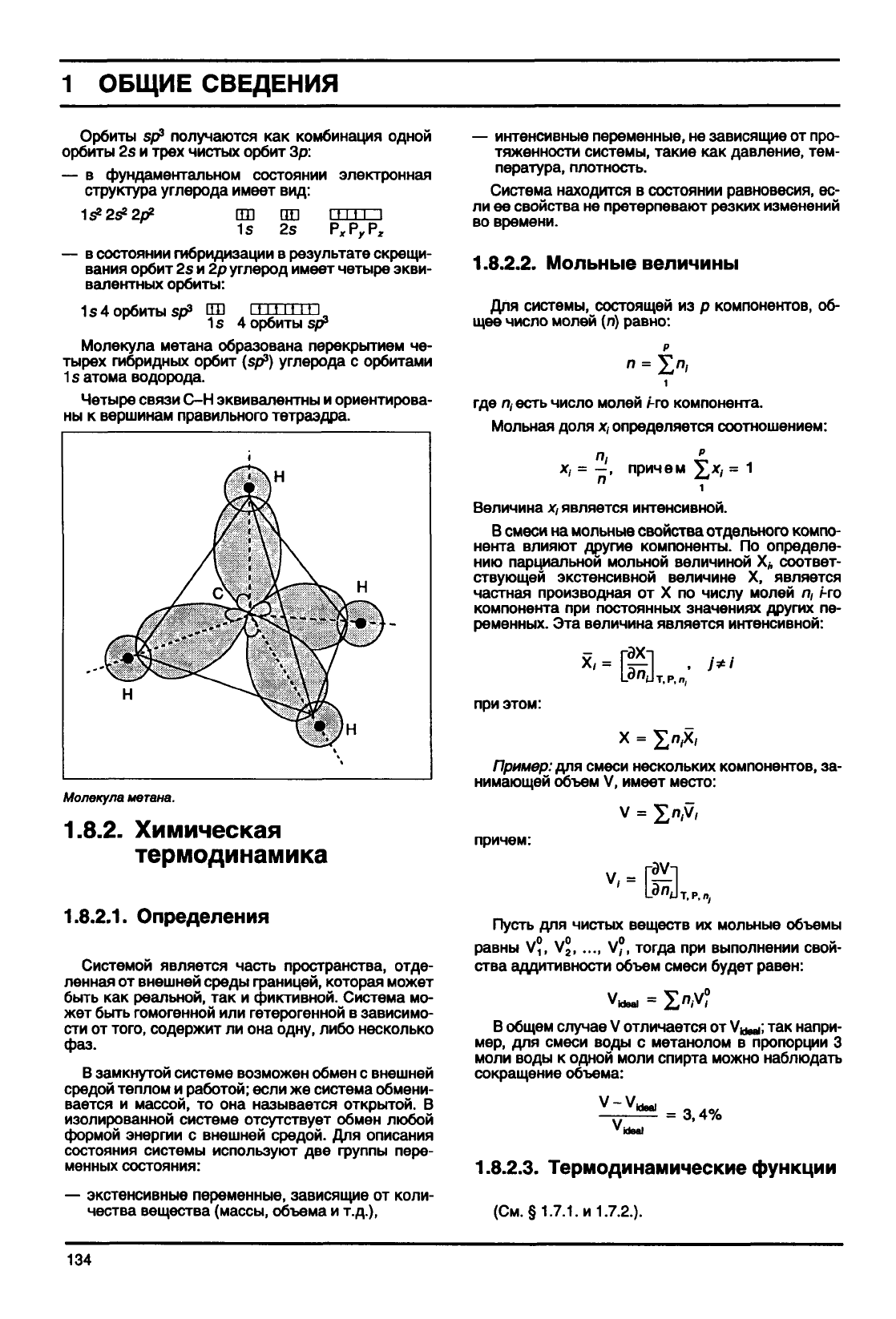
Молекула
метана образована перекрытием че-
тырех гибридных орбит
(spp)
углерода с орбитами
1 s атома водорода.
Четыре связи С-Н эквивалентны и ориентирова-
ны к вершинам правильного тетраэдра.
Молекула
метана.
1.8.2.
Химическая
термодинамика
1.8.2.1. Определения
Системой
является часть пространства, отде-
ленная от внешней среды границей, которая может
быть
как реальной, так и фиктивной. Система мо-
жет
быть
гомогенной или гетерогенной в зависимо-
сти
от того, содержит ли она одну, либо несколько
фаз.
В замкнутой системе возможен обмен с внешней
средой
теплом и работой; если же система обмени-
вается и массой, то она называется открытой. В
изолированной системе отсутствует обмен любой
формой энергии с внешней средой. Для описания
состояния системы используют две группы пере-
менных состояния:
— экстенсивные переменные, зависящие от коли-
чества вещества (массы, объема и
т.д.),
— интенсивные переменные, не зависящие от про-
тяженности системы, такие как давление, тем-
пература,
плотность.
Система
находится в состоянии равновесия, ес-
ли ее свойства не претерпевают резких изменений
во времени.
1.8.2.2.
Мольные величины
Для системы, состоящей из р компонентов, об-
щее
число молей (л) равно:
где п,
есть число молей /-го компонента.
Мольная доля х, определяется соотношением:
х, = —, причем = 1
Величина х, является интенсивной.
В смеси на
мольные
свойства отдельного компо-
нента
влияют
другие компоненты. По определе-
нию парциальной мольной величиной X* соответ-
ствующей экстенсивной величине X, является
частная производная от X по числу молей п, /-го
компонента при постоянных значениях других пе-
ременных. Эта величина является интенсивной:
при
этом:
X/ =
Й,,Р,
Л
;
X
= 5>
Пример:
для смеси нескольких компонентов, за-
нимающей
объем V, имеет место:
v
=
5>
причем:
Пусть для
чистых
веществ их
мольные
объемы
равны
V°, V° V°, тогда при выполнении свой-
ства аддитивности объем смеси будет равен:
В общем случае V отличается от V^; так напри-
мер,
для смеси
воды
с метанолом в пропорции 3
моли
воды
к одной моли спирта можно наблюдать
сокращение
объема:
V-V*
=
3,4%
1.8.2.3.
Термодинамические функции
(См.
§1.7.1.
и
1.7.2.).
134

1 ОБЩИЕ СВЕДЕНИЯ
Соединения
Нг(газ)
Гс
{(графит)
СО (газ)
СОг(газ)
НгО(газ)
СН4(газ)
СНзОН (газ)
Энтальпия
(кДж/моль)
0
0
-110,58
-393,64
-242,55
-
74,84
-238,78
Энтропия
(Дж
•
моль"
1
К"
1
)
130,63
5,742
197,811
213,737
188,79
166,25
126,74
То
Мольная удельная теплоемкость
р-в+
(Дж
•
моль-
1
•
К"
1
)*
а
27.29
0,109
24,45
24,4
44,16
30,01
12,452
4,311
Р
3,26
38,954
0,435
4,102
9,04
10,71
76,72
128,77
Г
0,50
- 1,482
-31,636
-
0,460
- 8,54
0,335
1,448
4,537
-298,15К(25°С)-(г)газ.
8
-
-17,391
-
-
-
-
-18,01
-44,12
Область
пригодности по
температуре
298-ЗОООК
298-
863К
863
- 4 073 К
298-2
500 К
298-2
500 К
298-2
500 К
298-2
000 К
298-1000
К
Величины
термодинамических
характеристик
некоторых
элементов
и соединений,
представляющих
интерес
в газовой
промышленности
(согласно балл и Knacke).
1.8.2.4.
Термодинамические функции
простых веществ
(См.
§1.7.2.).
1.8.2.4.1.
Химический потенциал
совершенного
газа
Для одной моли совершенного газа уравнение
состояния может
быть
записано в форме:
Если
подставить это выражение в уравнение,
описывающее изменение химического потенциала
ц
в зависимости от давления, то можно получить:
если Р
о
= 1 атм или 1013 25 Па, то ц(Т, Р
о
) обозна-
чается через ц? и называется стандартным хими-
ческим потенциалом.
Если
выразить давление в паскалях, то выраже-
ние для химического потенциала может
быть
запи-
сано в форме:
ц(Т, Р) = ц? + RT In Р, [Р] = Па
1.8.2.4.2.
Химический потенциал
реального
газа
Введение новой функции (/), называемой фуги-
тивностью, позволяет сохранить для химического
потенциала ту же форму, что и в
случае
совершен-
ного
газа:
давлении 101 325 Па
(1
атм), если бы он был совер-
шенным; в этом
случае
f
Q
»1.
Кроме
того для
реальных
газов вводится коэф-
фициент фугитивности
(<р),
такой что:
Ф=р
Чем ближе газ к совершенному, тем ближе
<р
к еди-
нице,
то есть:
limm = lim - = 1
т
р-»о р
Для реального газа уравнение состояния можно
записать в виде:
PV ж ZRT
где
Z
является
коэффициентом сжимаемости дан-
ного
газа.
Кроме
этого имеет место:
RT
In
f = fVdP
Из этих
двух
соотношений легко показать, что:
р
1.8.2.5.
Термодинамические функции
газовых
смесей
\t^ - химический потенциал, который соответство-
вал бы данному газу при заданной температуре и
1.8.2.5.1.
Смесь совершенных газов
Парциальным давлением Р/ Аго компонента в
смеси
л,, Пг,...,
Л/
молей совершенных газов, зани-
мающих объем V при температуре Т, называется
135

1 ОБЩИЕ СВЕДЕНИЯ
давление, которое имел бы этот
газ,
если бы нахо-
дился один в объеме V при той же температуре; та-
ким
образом, выполняется:
P,V-=n,RT
(см.
§1.7.2.1.4.)
причем:
п,
Р, = _'Р =
Х
,Р
Общее давление смеси равно сумме парциаль-
ных давлений (закон Дальтона):
Химический потенциал /-го компонента задает-
ся как:
если стандартным
является
состояние совершен-
ного
газа в чистом виде, то Р°
-1,
откуда:
ц, =
ц°+т-|п
Р,
1.8.2.5.2.
Смесь
реальных
газов
Общее выражение для химического потенциала
компонента
/
в смеси
реальных
газов имеет следу-
ющий вид:
ч
где
f, играет такую же роль, как Р, для совершен-
ных
газов.
Если
принять в качестве стандартного состояние
совершенного газа при 101 325 Па, когда f, =
f,
- 1,
то выражение для ц, примет вид:
H, =
H?
+
RTIn
f,
Помимо этого можно определить коэффициент
фугитивности
(q>^
для каждого компонента, так что:
f.
<P,= fy причем ^9,= 1
1.8.2.6.
Растворы
1.8.2.6.1.
Идеальные растворы
(закон
Рауля)
Химический потенциал компонента / в идеаль-
ном растворе задается в виде:
ц, =
tf+RT
In х,
где
ц°
является
химическим потенциалом в стан-
дартном состоянии, которое соответствует чисто-
му компоненту
(х,
• 1).
Для идеального раствора, находящегося в
равновесии со своим
паром,
химический потенциал
каждого
компонента в обеих
фазах
одинаков, то
есть:
Мжида
« (й/)п
и далее:
In x, =
1.5
чистому веществу (х, » 1, Р/ = Р
;
), то несложно
вывести закон
Рауля:
Р,« Р°,х,
В идеальной смеси парциальное давление пара
(Pi произвольного компонента пропорционально
его
мольной доле в жидкой фазе, причем коэффи-
циент пропорциональности равен давлению пара
чистого компонента при рассматриваемой темпе-
ратуре.
Рисунок, представленный ниже, демонстрирует
нейнью изменения парциальных давлении (Р, и
Рг) в зависимости от состава бинарной идеальной
смеси.
ли
, р Т-const
Идеальная бинарная смесь.
1.8.2.6.2.
Разбавленные растворы
(закон
Генри)
Разбавленным
является
раствор, в котором со-
держание одного компонента очень близко к 1
(х,
«•
1) - этот компонент
является
растворителем,
а содержание других компонентов, являющихся
растворенными веществами, очень близко к нулю.
В таком растворе давление паров /-го растворенно-
го
вещества пропорционально его мольной доле x
h
Коэффициент пропорциональности (Ан)/ (коэффи-
циент Генри) зависит только от температуры и от
природы растворителя:
?
Если
принять для обеих фаз одно и то же стан-
дартное состояние, например, соответствующее
при
х,—^0
Это есть формулировка закона Генри. Он может
применяться и для
газа,
растворенного в слаболе-
тучей
жидкости, тогда его давление в паровой фа-
зе
пропорционально его мольной концентрации в
растворе.
Для реальной бинарной смеси при
малых
концен-
трациях растворенного вещества растворитель
подчиняется закону
Рауля,
а растворенное вещест-
во - закону Генри.
Разбавленный раствор близок по свойствам к
идеальному раствору, причем их сходство тем
больше, чем больше степень разбавления.
1.8.2.6.3.
Реальные растворы. Понятие актив-
ности
В концентрированных растворах вместо моль-
ных концентраций (х^) вводят новую величину (а),
называемую активностью, такую что:
ц, = ц; + RT In a,
136
1
ОБЩИЕ СВЕДЕНИЯ
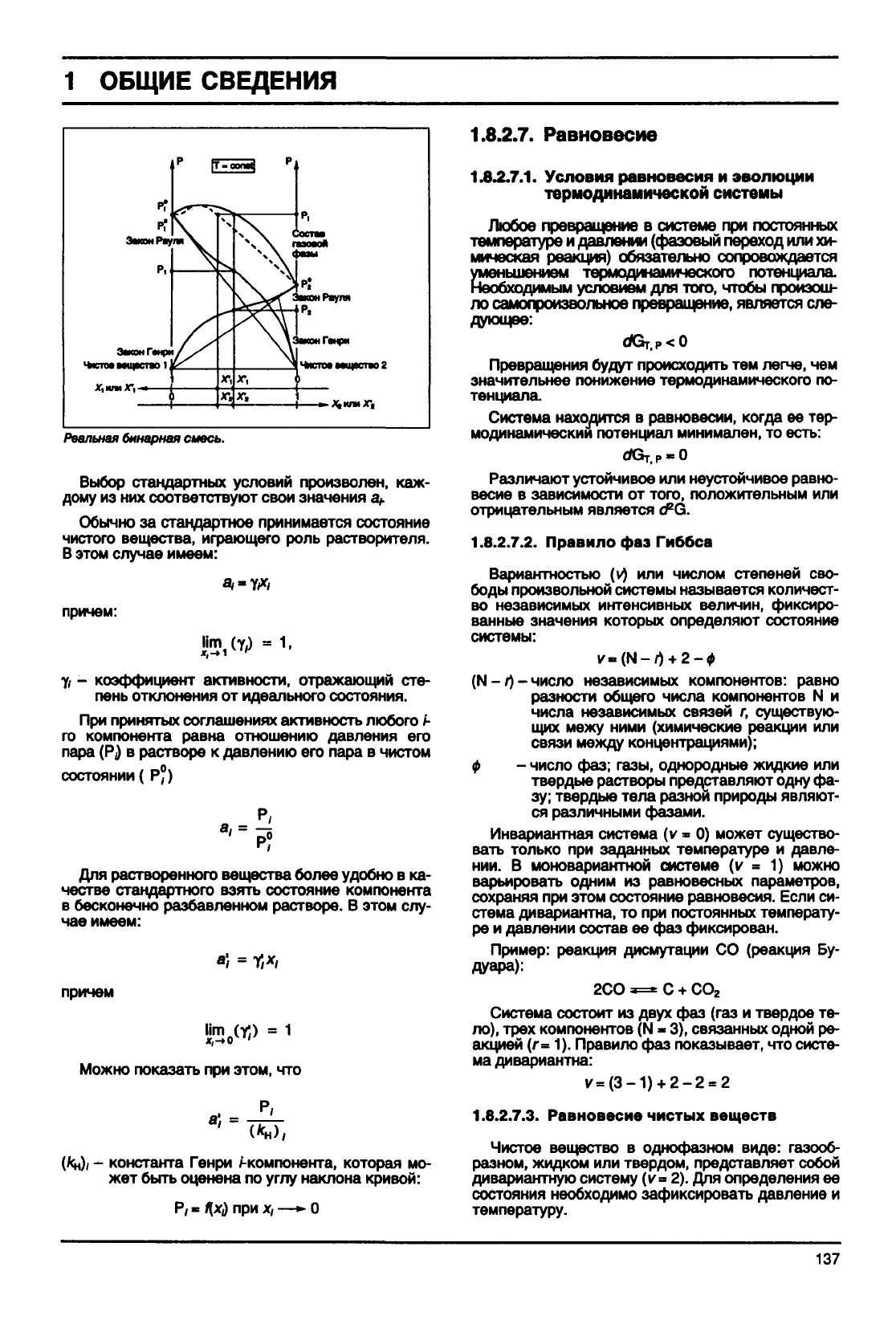
Закон
Генри у
ЧиСТОв
ВМЦвСТЯО 1 J
X,
или
Состав
Реальная
бинарная смесь.
Выбор стандартных условий произволен, каж-
дому из них соответствуют свои значения а,.
Обычно
за стандартное принимается состояние
чистого
вещества, играющего роль растворителя.
В этом
случае
имеем:
причем:
1.
У/ - коэффициент активности, отражающий сте-
пень отклонения от идеального состояния.
При принятых соглашениях активность любого А
го
компонента равна отношению
давления
его
пара (Pi в растворе к давлению его пара в чистом
состоянии
( Р°)
Для растворенного вещества более удобно в ка-
честве стандартного взять состояние компонента
в бесконечно разбавленном растворе. В этом слу-
чае имеем:
=
Г,*,
причем
1
Можно
показать при
этом,
что
' (*н),
(/(н),
- константа Генри /-компонента, которая мо-
жет
быть
оценена по углу наклона
кривой:
Р/ * ЛМ при х, —*• О
1.8.2.7.
Равновесие
1.8.2.7.1.
Условия равновесия и эволюции
термодинамической
системы
Любое превращение в системе при постоянных
температуре и давлении (фазовый переход или хи-
мическая реакция) обязательно сопровождается
уменьшением термодинамического потенциала.
Необходимым условием для
того,
чтобы
произош-
ло самопроизвольное превращение,
является
сле-
дующее:
dGr.p<0
Превращения будут происходить тем легче, чем
значительнее понижение термодинамического по-
тенциала.
Система находится в равновесии, когда ее тер-
модинамический
потенциал минимален, то есть:
-О
Различают
устойчивое или неустойчивое равно-
весие в зависимости от
того,
положительным или
отрицательным
является
cPG.
1.8.2.7.2. Правило фаз Гиббса
Вариантностью (v) или числом степеней сво-
боды произвольной системы называется количест-
во независимых интенсивных величин, фиксиро-
ванные
значения которых определяют состояние
системы:
(N-г)-число
независимых компонентов: равно
разности
общего числа компонентов N и
числа независимых связей г, существую-
щих межу ними (химические реакции или
связи
между концентрациями);
<р
- число фаз;
газы,
однородные жидкие или
твердые растворы представляют одну фа-
зу;
твердые
тела
разной природы
являют-
ся различными фазами.
Инвариантная система (v = 0) может существо-
вать
только при заданных температуре и давле-
нии.
В моновариантной системе (v = 1) можно
варьировать одним из равновесных параметров,
сохраняя при этом состояние равновесия.
Если
си-
стема дивариантна, то при постоянных температу-
ре
и давлении состав ее фаз фиксирован.
Пример:
реакция дисмутации СО (реакция Бу-
дуара):
2СО 3=^ С + СО
2
Система состоит из
двух
фаз (газ и твердое те-
ло),
трех компонентов (N - 3), связанных одной ре-
акцией
(г = 1). Правило фаз показывает, что систе-
ма дивариантна:
1.8.2.7.3.
Равновесие чистых веществ
Чистое вещество в однофазном виде: газооб-
разном,
жидком или твердом, представляет собой
дивариантную систему (v* 2). Для определения ее
состояния необходимо зафиксировать давление и
температуру.
137
1
ОБЩИЕ СВЕДЕНИЯ
Если
в
равновесии находятся
две
фазы одного
вещества, система моновариантна
(v« 1).
Если
за-
фиксировать давление,
то
температура однознач-
но определяется. Связь между этими переменны-
ми
дается уравнением Клапейрона:
dP
ДН
<ЭТ
TAV
АН -
скрытая теплота изменения состояния,
AV -
разница мольных объемов двух
фаз.
При равновесии жидкость-пар (испарение)
мольный объем жидкой фазы
(VJ
пренебрежимо
мал
по
сравнению
с
мольным объемом пара
(V
B
).
Если
считать,
что
пар является насыщенным
со-
вершенным
газом,
можно получить:
AV
рт
В этом случае уравнение Клапейрона можно
запи-
сать
как:
———
= —I
(уравнение Клаузиуса-Клайперона)
ОТ R-T
2
I
Тмраоетало
I
Г (Тройная тачка)
Гаа
К
(Крит»
мекая
тачка;
Тиаирвтура
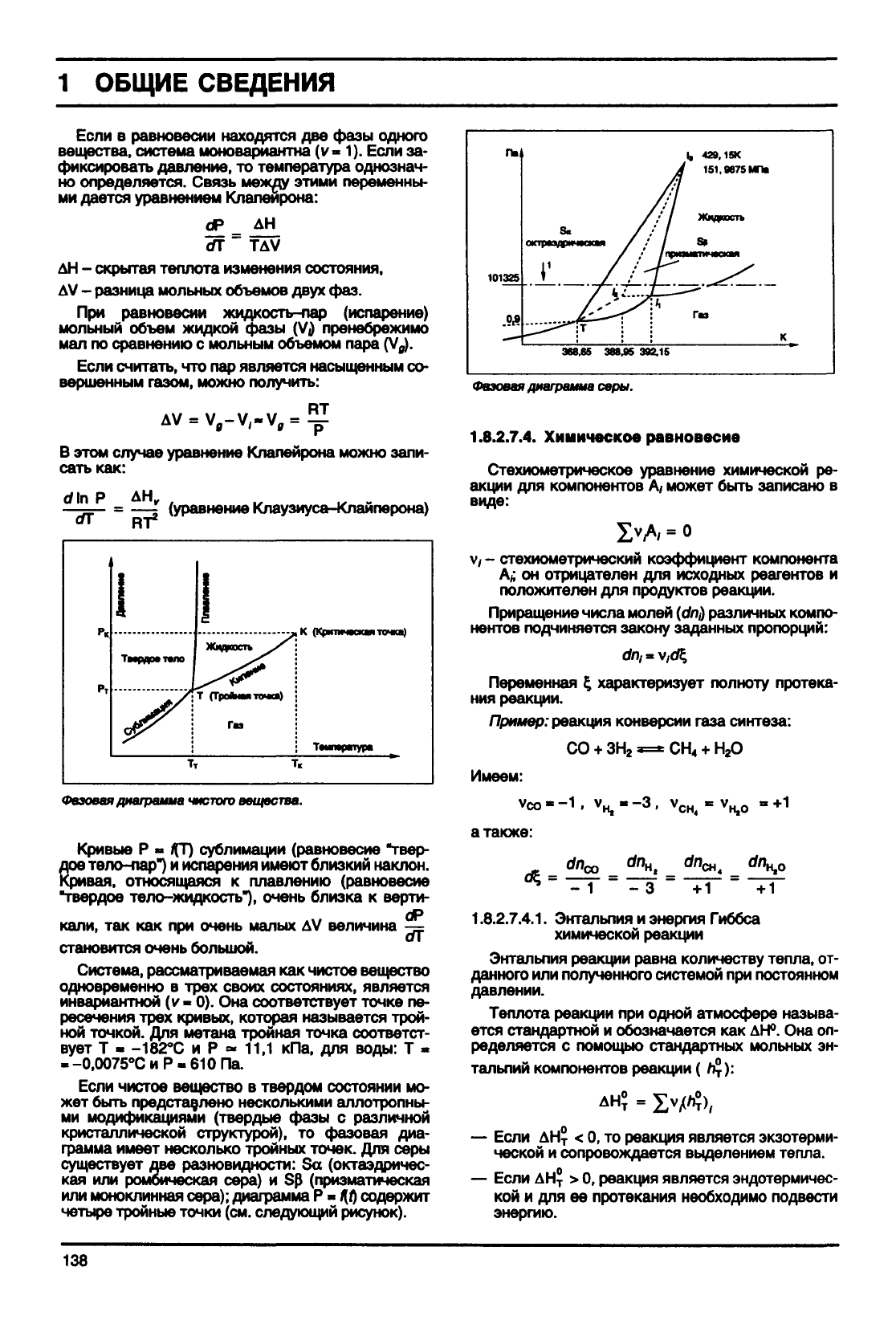
Фазовая диаграмма
чистого
вещества.
Кривые
Р »
f{J) сублимации (равновесие "твер-
дое тело-пар")
и
испарения имеют близкий наклон.
Кривая,
относящаяся
к
плавлению (равновесие
"твердое тело-жидкость"), очень близка
к
верти-
кали,
так как при
очень
малых
AV
величина
-=
становится очень большой.
Система, рассматриваемая
как
чистое вещество
одновременно
в
трех своих состояниях, является
инвариантной
(v- 0). Она
соответствует точке
пе-
ресечения трех кривых, которая называется
трой-
ной
точкой.
Для
метана тройная точка соответст-
вует
Т »
-182°С
и Р « 11,1 кПа, для
воды:
Т «
«-0,0075°СиР«610Па.
Если
чистое вещество
в
твердом состоянии
мо-
жет быть представлено несколькими аллотропны-
ми
модификациями (твердые фазы
с
различной
кристаллической структурой),
то
фазовая
диа-
грамма
имеет несколько тройных точек.
Для
серы
существует
две
разновидности:
Set
(октаэдричес-
кая
или
ромбическая сера)
и Sp
(призматическая
или моноклинная сера); диаграмма
Р -
ЭД
содержит
четыре тройные точки
(см.
следующий рисунок).
Па
101325
Р.8.
——'
'
//
октраэдри'
некая
/ / /
/
/ /ПК
36845
А
1
^ь
.ypf
\
•
38845 392.15
1,
429,15К
Л 151,9675
МП»
Жидкость
S»
«••in
«Kirn
Газ
К
Фазовая
диаграмма
серы.
1.8.2.7.4.
Химическое равновесие
Стехиометрическое уравнение химической
ре-
акции
для
компонентов
А/
может быть записано
в
виде:
V/ -
стехиометрический коэффициент компонента
А^ он
отрицателен
для
исходных реагентов
и
положителен
для
продуктов реакции.
Приращение числа молей (dn) различных
компо-
нентов подчиняется закону заданных пропорций:
dn,
=
\,d%
Переменная
%
характеризует полноту протека-
ния реакции.
Пример:
реакция конверсии газа синтеза:
СО
+ ЗН
2
^ СН
4
+
Имеем:
vco--1.
'-3.
V
CH
4
=
V
H,O -
+1
а также:
_
н
dn
Ht
+
1
+
1
1.8.2.7.4.1.
Энтальпия
и
энергия Гиббса
химической
реакции
Энтальпия реакции равна количеству тепла,
от-
данного
или полученного системой при постоянном
давлении.
Теплота реакции
при
одной атмосфере называ-
ется стандартной
и
обозначается
как АН
0
. Она оп-
ределяется
с
помощью стандартных мольных
эн-
тальпий компонентов реакции (/>?):
АН?
=
2>/Л?),
—
Если
АН° < 0, то
реакция является
экзотерми-
ческой
и
сопровождается выделением тепла.
—
Если
ДН? > 0,
реакция является эндотермичес-
кой
и для ее
протекания необходимо подвести
энергию.
138

1
ОБЩИЕ
СВЕДЕНИЯ
Замечание:
В таблицах термодинамических констант встре-
чается стандартная энтальпия образования хими-
ческого соединения (АН°) из
отдельных
элементов.
Принято соглашение, что энтальпия элементов,
взятых
в наиболее устойчивом состоянии при Т
о
=
«298,15
К (25°С), равна нулю. В итоге, энтальпия
химического соединения при
298,15
К равна эн-
тальпии его образования при той же температуре.
Изменение
энтальпии в зависимости от темпе-
ратуры определяется соотношением Кирхгофа:
АН?
=
причем
т.
а
изменение стандартной энтропии (
Д
S
T
) в зави-
симости от температуры находится из уравнения:
•J¥
d\
где:
($!•„),
представляет собой стандартную энтальпию
Аго компонента при
298,15
К и одной атмосфере.
Из
выражений для АН? и AS? можно опреде-
лить
изменение энергии Гиббса реакции в зависи-
мости от температуры:
AG?
= AH?-TAS?
откуда:
AG?
=
AH?
o
-TAS?
o
+
Г
, „
Замечание:
Если в рассматриваемом интервале температур
происходит изменение фазового состояния при
температуре
перехода T
h
необходимо
учитывать
соответствующие изменения энтальпии (L,) и энт-
ропии (AS,) = —'.
'/
1.8.2.7.4.2.
Закон действующих масс
В
условиях
термодинамического равновесия
для химической реакции, в которой участвуют
компоненты А* выполняется:
AG = 5>
Л
= О
причем:
ц, =
(n?),+
RTlna,
(ц?)
t
-химический потенциал компонента А, в чис-
том
состоянии, а,- его активность при равновесии.
Учитывая
выражения для ц„ условия равнове-
сия можно записать в следующей форме:
при
этом:
Слагаемое
Х
У
А^)/ является стандартной
энергией
Гиббса реакции: AG°.
Если ввести константу действующих масс К?:
можно прийти к фундаментальному соотношению:
Величина К? является безразмерным числом,
которое зависит
только
от температуры и от стан-
дартных состояний каждого компонента реакции.
1.8.2.7.4.3.
Различные выражения
закона
действующих масс
1.8.2.7.4.3.1.
Для
реальных
газов
Если в качестве стандартного состояния
выбрать
идеальный газ в чистом виде, то для ре-
ального
газа
активность равна его фугитивности:
откуда:
либо:
так
что:
где:
К,
= (л
Г,
1
)
(я Ь P
AV
Av =
Рассмотрим
константу равновесия К„ введен-
ную через
мольные
концентрации:
и
если положить, что:
то константа равновесия для
реальных
газов мо-
жет
быть
записана как произведение трех вели-
чин:
1.8.2.7.4.3.2.
Для совершенных газов
Обычно
в качестве стандартного принимается
совершенное состояние чистого
газа
при одной ат-
мосфере (Р° = 101 325 Па), а константа равновесия
К
р
вводится через парциальные давления газов (PJ:
я - символ произведения.
1.8.2.7.4.3.3.
Для
растворов
В §
1.8.2.6.3.
мы видели, что активность компо-
нента в реальном растворе пропорциональна его
мольной доле (х,), как бы ни
было
выбрано
стан-
дартное состояние:
Полагая,
что К
т
= лу]\ можно записать констан-
ту К
а
для химических реакций, протекающих в
жидкой
среде, в следующем виде:
139

1 ОБЩИЕ СВЕДЕНИЯ
Если речь идет об идеальном растворе (у, = 1),
константа К, совпадает с константой К„ опреде-
ленной через
мольные
доли:
К. = К
х
= кх
1
1
(К,= 1)
Для разбавленных растворов
обычно
заменяют
мольные
доли на молярные концентрации с, и ис-
пользуют константу равновесия К^
К
с
=
где:
С, = X,-
1000р
0
М
о
где
М
о
- молярная масса растворителя, а р
0
- его
плотность в г/см
3
.
1.8.2.7.4.4.
Зависимость константы равновесия от
температуры и давления
Существует возможность качественного пред-
сказания
влияния
различных факторов (темпера-
туры, давления или состава) на направление сме-
щения
равновесия, исходя из принципа ослабления
Ле-Шателье,
который гласит, что "любое изменение
одного из параметров равновесия смещает равно-
весие
в таком направлении, в котором эффект из-
менения
данного параметра ослабляется".
1.8.2.7.4.4.1.
Влияние
температуры
Изменение
константы равновесия реакции в за-
висимости от температуры подчиняется закону
Вант-Гоффа:
d
In
К? АН?
оТ
RT
2
( К
т
не зависит от давления).
Этот закон показывает, что для экзотермичес-
кой
реакции (ДК° < 0) возрастание температуры
смещает
равновесие
влево
(log K° убывает), то
есть в направлении эндотермическом, так
чтобы
ослабить изменения,
вызванные
извне. Таким об-
разом,
повышение температуры
вызывает
эндо-
термические
реакции, а понижение температуры -
реакции
экзотермические в соответствии с прин-
ципом Ле-Шателье.
1.8.2.7.4.4.2.
Влияние давления
Влияние давления практически никогда не ощу-
щается,
за исключением систем, содержащих
газо-
вую фазу. Его воздействие на смещение равнове-
сия может
быть
определено исходя из закона дей-
ствующих масс для газообразной системы,
выраженного через
мольные
доли:
=
7г? при
Av =
v,
При малых давлениях газы близки к совершен-
ным (К, —*• 1) и влияние давления передается
только
через множитель P~
iv
(К, зависит лишь от
температуры).
Следует различать 3 случая:
— если Av < 0, возрастание давления смещает
равновесие в направлении образования про-
дуктов реакции;
— если Av a 0, давление не оказывает никакого
воздействия на реакцию, которая протекает
без
изменения объема;
— если Av > 0, то возрастание давления приводит
к
затуханию реакции.
В соответствии с принципом Ле-Шателье возра-
стание
давления приводит к смещению равнове-
сия в направлении сокращения числа молей
газа.
При
высоких
давлениях К
х
зависит от изменений
множителя Р~
ЛУ
, а также от К,, так как отклонения
от идеального состояния становятся значительны-
ми.
Эти два эффекта могут протекать одинаково
успешно как в одном направлении, так и в противо-
положных направлениях.
Пример:
влияние давления на степень диссоци-
ации
метана при 973 К
(700°С):
СН
4
*=* С + 2Н
2
К
0
=10,27
(при 973 К)
Пусть в исходном состоянии имеется один
моль
метана
и
пусть
а - степень диссоциации СН
4
(доля
диссоциированных молей) в равновесии, тогда
имеем:
"сн
4
=
1-е
1-а
Лн,
= 2а
2а
л = HQH +
Л
Н
= 1 + а (сумма всех молей газовой
фазы).
Применяя закон действующих масс,
запишем:
.. к
0
(V
s
4а
2
" W *сн. Т^а
2
причем:
К
=
(Фн,)
2
^^.
(Ф,-
коэффициент фугитивности).
Величины
К,, К„ аил,
вычисленные
для
давлений от
1
до 50 атм, приводятся в следующей
таблице:
Давление
(атм)
(*)
1
50
1
К")
1,216
7,6
0,156
(**)
0,125
a
0,809
0,191
(**)
0,174
п
1,809
1,191
(")
0,174
С)1атм
=
101
325Па.
(") Расчеты для совершенных газов.
140
1 ОБЩИЕ СВЕДЕНИЯ
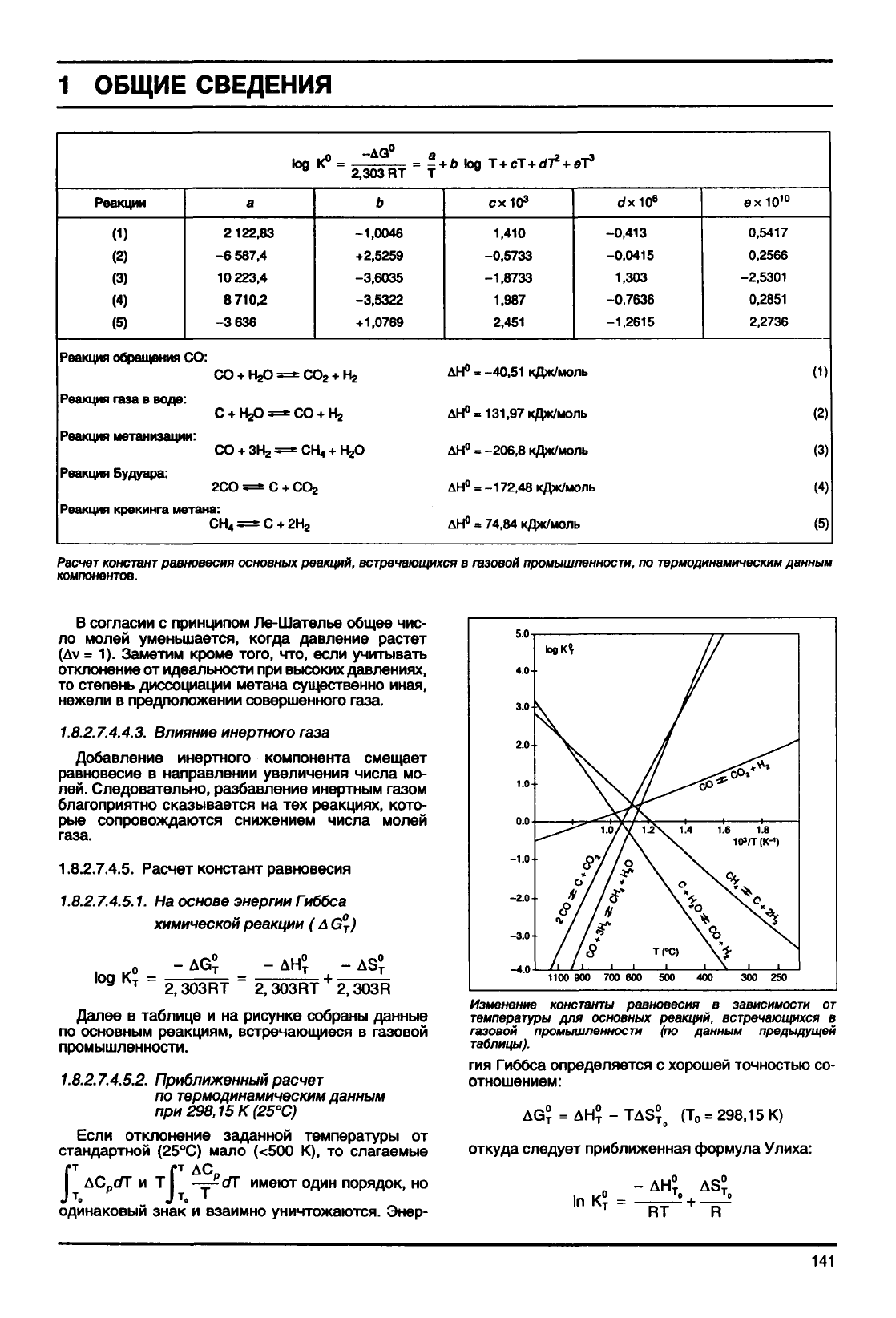
Реакции
(1)
(2)
(3)
(4)
(5)
Реакция обращения СО:
Реакция
газа
в воде:
Реакция метанизации:
Реакция Будуара:
а
2122,83
-6 587,4
10 223,4
8 710,2
-3 636
СО + Н^
с
+
н^
со
+
зн^
2СО —С
Реакция крекинга метана:
tog
K°
i=*CO
2
*СО + г
-сни
+ СО,
h2H
2
-AG°
a
2,303
RT T '
Ь
-1,0046
+2,5259
-3,6035
-3,5322
+1,0769
<2
.
Нг
О
•b
tog T + cT+d^ + eT
3
схЮ
3
1,410
-0,5733
-1,8733
1,987
2,451
АН
0
> -40,51 кДж/моль
ДН°-131,97кДж/моль
АН
0
=
-206,8
кДж/моль
АН
0
=
-172,48
кДж/моль
АН
0
=
74,84
кДж/моль
dxiO
8
-0,413
-0,0415
1,303
-0,7636
-1,2615
ехЮ
10
0,5417
0,2566
-2,5301
0,2851
2,2736
(1)
(2)
(3)
(4)
(5)
Расчет
констант
равновесия основных реакций,
встречающихся
в газовой
промышленности,
по
термодинамическим
данным
компонентов.
В согласии с принципом Ле-Шателье общее чис-
ло молей уменьшается, когда давление растет
(Av
=1).
Заметим
кроме того, что, если
учитывать
отклонение от идеальности при
высоких
давлениях,
то степень диссоциации метана существенно иная,
нежели
в предположении совершенного
газа.
1.8.2.7.4.4.3.
Влияние
инертного
газа
Добавление инертного компонента
смещает
равновесие в направлении увеличения числа мо-
лей.
Следовательно, разбавление инертным
газом
благоприятно сказывается на тех реакциях, кото-
рые сопровождаются снижением числа молей
газа.
1.8.2.7.4.5.
Расчет констант равновесия
1.8.2.7.4.5.1.
На основе энергии
Гиббса
химической реакции ( Л G°
T
)
"
т
2.303RT 2.303RT
2.303R
Далее
в таблице и на рисунке собраны данные
по основным реакциям, встречающиеся в газовой
промышленности.
1.8.2.7.4.5.2.
Приближенный
расчет
по термодинамическим данным
при
298,15
К (25°С)
Если отклонение заданной температуры от
стандартной (25°С) мало
(<500
К), то слагаемые
и
Т | ~=^ оТ имеют один порядок, но
4.0-
3.0
<
2.0
1.0-
0.0
-1.0
-2.0-
-3.0
-4.0-1
ЮдК°
т
- \
Г/
/ /8
/| /1
1100
900
.6/V 1
/о
/Г
1 1
700
600
/
/
2\^ 1.4
\*
V
т(°с) N
| |
500
400
/
1.6
ъ
\
Рг*
1.8
ч
N
i i
300
250
Изменение
константы
равновесия в
зависимости
от
температуры
для основных реакций,
встречающихся
в
газовой
промышленности
(по данным предыдущей
таблицы).
гия Гиббса определяется с хорошей точностью со-
отношением:
AG? = АН? -
TAS
To
(Т
о
=
298,15
К)
откуда следует приближенная формула Улиха:
одинаковый знак и взаимно уничтожаются. Энер-
In
К? =
-ДН°
RT
141

1
ОБЩИЕ
СВЕДЕНИЯ
Пример:
синтез метанола из СО и Н:
СО + 2Н
г
=
СН
3
ОН
^ = -90.86 кДж/моль
- -222.33 кДж/моль
Строгое соотношение для константы равнове-
сия К? в зависимости от температуры имеет вид:
|од к
о
=
3990,77
+ 2411 1 х
10
-з
т
_
- 2,155
2x10"V-7,555
5log T + 8,9993
При использовании аппроксимации
Улиха:
log
KV°
=
при
Т = 550 К
log
К
0
= -3,1887, то есть К
0
= 6,48
•
1ГГ
1
log
К'
0
= -2,9839, то есть К'
0
= 1,04
•
1
(Г
1
1.8.2.7.4.5.3.
Расчеты
на основе значений кон-
стант
и
стандартной
энергии Гиббса
при 298,15 К
Если
в рассматриваемом интервале температур
выполняется
ДН?*ДН°
о
,
соотношение Вант-Гоф-
фа приводит к:
Пример:
реакция Будуара: 2СО *=* СО
2
+ С
— при Т = 298,15 К:
ДН? =-172,48 кДж/моль
то есть:
К° =7,1 хЮ
20
log
К° = 20,85
— при 1000 К:
"98~T66oJ
=
~
0
'
33
то есть:
Истинная величина, вытекающая из
данных
по-
следней таблицы, равна 0,54
1.8.2.7.4.6. Совместное равновесие
Для определения равновесного состава слож-
ной системы, в которой протекает множество хи-
мических реакций, наиболее часто используются
два основных метода:
—
"стехиометрический"
метод,
основанный
на ре-
шении системы алгебраических уравнений, опи-
сывающей всю совокупность независимых хи-
мических реакций и материальный
баланс
хи-
мических элементов в системе. Число рассмат-
риваемых уравнений в общем
случае
равно чис-
лу веществ, находящихся в равновесии, плюс
единица;
— метод, основанный на минимизации энергии
Гиббса системы. Этот метод имеет следующие
особенности:
• не требуются никакие гипотезы относительно
природы химических реакций, достаточно
знать лишь природу компонентов, способных
образоваться в условиях равновесия, и соот-
ветствующие термодинамические условия;
• число уравнений системы, подлежащей реше-
нию,
относительно мало и равно числу хими-
ческих элементов;
• введение нового элемента апостериори не от-
ражается на принципе расчетов.
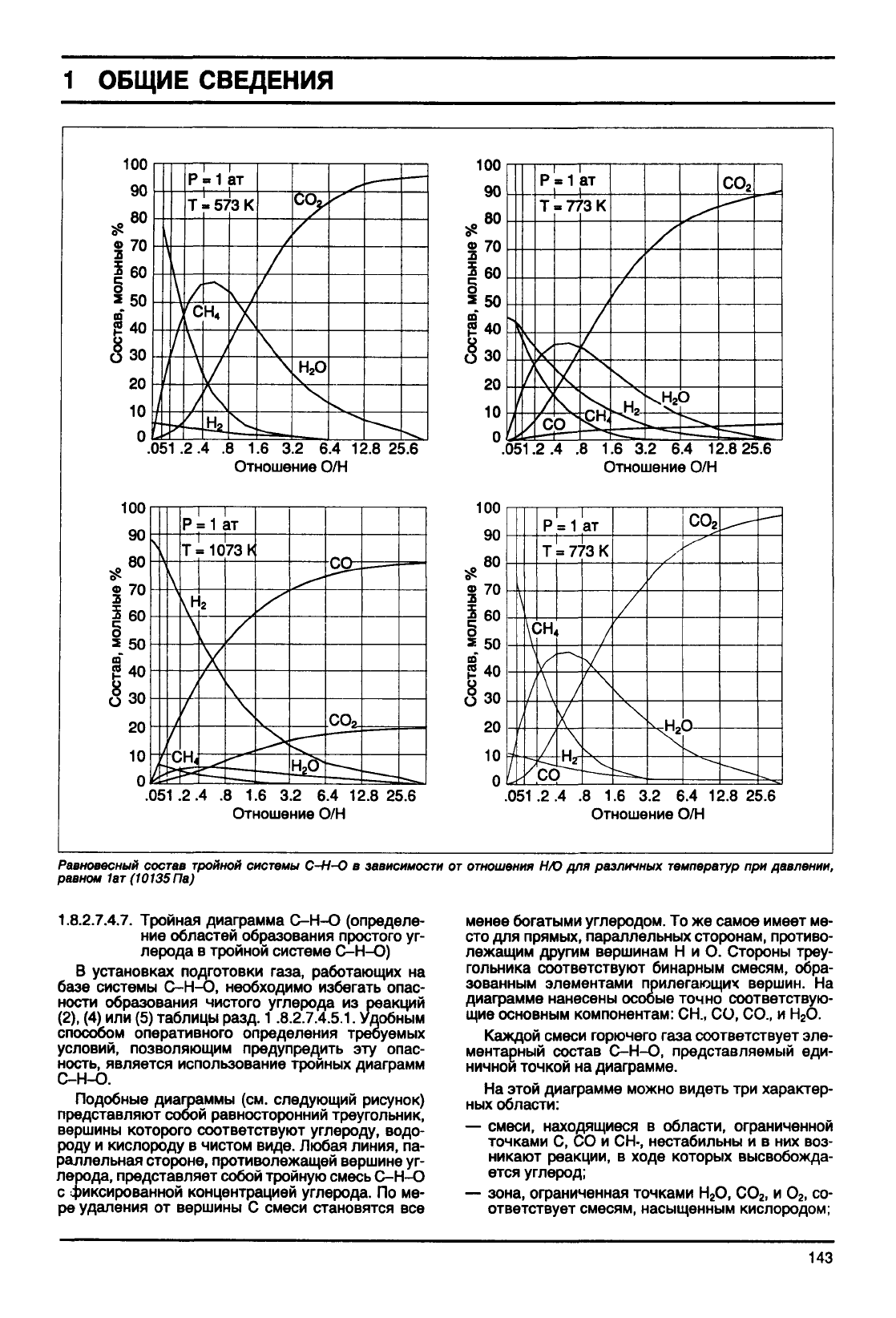
Примеры:
—
Расчет
равновесного состава тройной системы
С.Н.О.
(применение алгебраического метода).
В области температур и давлений, представля-
ющих интерес в газовой промышленности, в равно-
весии присутствуют шесть основных компонентов:
С, СО
2
, СО, СН
4
, Н
2
О, и Н
2
. Их связывают три неза-
висимые реакции. Произвольным образом
выбраны следующие реакции:
'^ СН
4
+ Н
2
О метанизация СО/Н
2
СО + Н
2
О
2СО
=
СН
2
+ Н
2
конверсия СО
С + СО
2
реакция Будуара
Система содержит две
фазы
(газ + твердое те-
ло), по правилу фаз имеет место:
v= (6-3) + 2-2 = 3
Это тривариантная система, следовательно,
для определения состояния достаточно зафикси-
ровать три параметра.
Можно выбрать, например, температуру, давле-
ние и отношение О/Н, тогда решение алгебраичес-
кой
системы позволяет определить изменение
равновесного состава газовой
фазы
в зависимости
от этих трех параметров (см. следующий рисунок).
—
Расчет
равновесного состава эквимолекуляр-
ной смеси вода-метанол (метод минимизации
энергии
Гиббса системы).
На следующем
далее
рисунке представлены за-
висимости
состава сухих газов при равновесии в
зависимости
от температуры для различных
давлений в интервале от 1 до 70 бар.
При заданном давлении для образования мета-
на из метанола благоприятными оказываются низ-
кие
температуры и высокие давления, в соответст-
вии с принципом Ле Шателье, примененным к сле-
дующей общей реакции метанизации метанола:
4СН
3
ОН
« ЗСН
4
+ СО
2
+
2Н
2
О
ДН° = -74.4 кДж/моль
142
1 ОБЩИЕ СВЕДЕНИЯ
/
(
к
\
1
/
/
/
р
т
/
\
\
/
— —
=
1
IT
-573
К
н
4
/
/
\
\ /
/
•
/
\
\
со.
/
Н
2
О
Ч
-
—
.
— —
.051.2.4
.8 1.6 3.2 6.4 12.8 25.6
Отношение
О/Н
100
90
| 70
| 60
= 50
m
g 40
6 30
20
10
0
\
\
>
у
/
-/с
(&
р
т
=
\
н
\
/
щ
= 1 ат
=
1073 К
2
у
f \
~*£
/
\
\
- —
1
—
V
>
,
N^
СОг.
— —
- —
• —
•
=
.051.2.4
.8 1.6 3.2 6.4 12.8 25.6
Отношение
О/Н
/
I/
p
T
Y
К
)
—
=
1
-77
\
ат
'3K
A
/
ч
N
/
N
. H
2
• •-
1
——
/
^H
2
O
co
2
.—-
—
.051.2.4
.8 1.6 3.2 6.4
12.8
25.6
Отношение
О/Н
100
90
*"
«70
| 60
§50
40
30
20
10
0
Р
4
!
\
p
T
\Or1i
\
\
/
\
/
^cc
= 1
ат
=
773 К
/
\
/
А.
' \
ч
•
/
\
/
СО
2
„——
.051.2.4
.8 1.6 3.2 6.4 12.8 25.6
Отношение
О/Н
Равновесный
состав
тройной
системы
С-Н-О в
зависимости
от
отношения
НЮ для различных
температур
при давлении,
равном
1ат (10135
Па)
1.8.2.7.4.7.
Тройная диаграмма С-Н-О (определе-
ние
областей образования простого уг-
лерода в тройной системе
С-Н-О)
В установках подготовки
газа,
работающих на
базе
системы С-Н-О, необходимо избегать опас-
ности образования чистого углерода из реакций
(2),
(4) или (5) таблицы разд. 1
.8.2.7.4.5.1.
удобным
способом оперативного определения требуемых
условий, позволяющим предупредить эту опас-
ность, является использование тройных диаграмм
С-Н-О.
Подобные диаграммы (см. следующий рисунок)
представляют собой равносторонний треугольник,
вершины которого соответствуют углероду, водо-
роду и кислороду в чистом виде. Любая линия, па-
раллельная стороне, противолежащей вершине уг-
лерода,
представляет собой тройную смесь С-Н-О
с
фиксированной концентрацией углерода. По ме-
ре
удаления от вершины С смеси становятся все
менее
богатыми углеродом. То же самое имеет ме-
сто для прямых, параллельных сторонам, противо-
лежащим
другим вершинам Н и О.
Стороны
треу-
гольника соответствуют бинарным смесям, обра-
зованным элементами прилегающих вершин. На
диаграмме
нанесены особые точно соответствую-
щие
основным компонентам: СН., СО, CO., и Н
2
О.
Каждой
смеси горючего
газа
соответствует эле-
ментарный состав С-Н-О, представляемый еди-
ничной точкой на диаграмме.
На этой диаграмме можно видеть три характер-
ных области:
—
смеси,
находящиеся в области, ограниченной
точками
С, СО и СН-, нестабильны и в них воз-
никают реакции, в ходе которых высвобожда-
ется
углерод;
— зона, ограниченная точками Н
2
О, СО
2
, и О
2
, со-
ответствует смесям, насыщенным кислородом;
143
