Басниев К.С. Энциклопедия газовой промышленности
Подождите немного. Документ загружается.

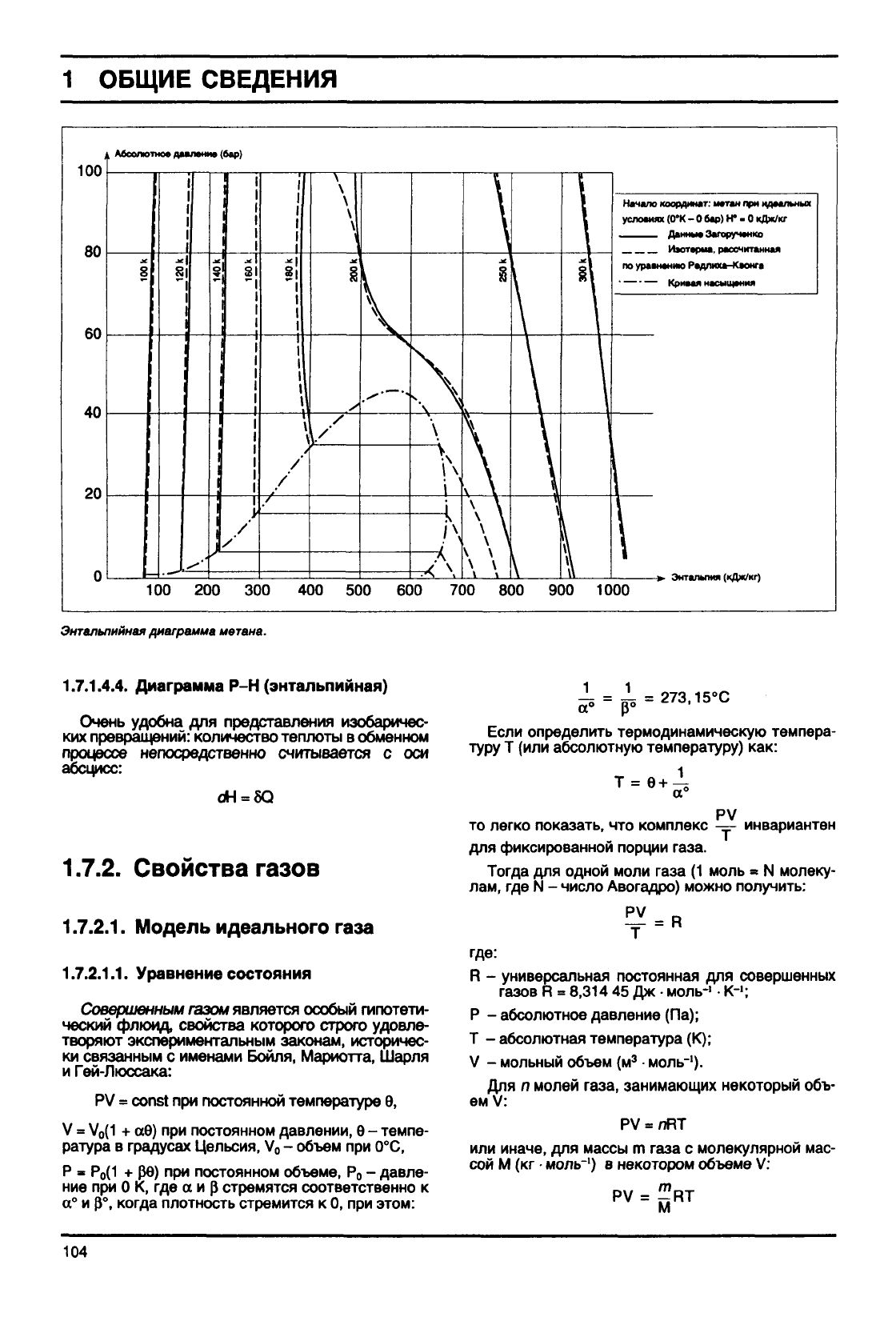
1
ОБЩИЕ СВЕДЕНИЯ
L
Абсолютно* давление (бор)
Начало координат: метан при идеальных
условиях
(0*К
- 0 бар) Н* • 0
кДж/кг
Данные
Затору
тике
Изотерма,
рассчитанная
по уравнению Редлиха-Квонга
Кривая насыщения
100 200 300 400 500 600 700 800 900 1000
*. Энталыпм
(кДж/кг)
Энтальпийная
диаграмма
метана.
1.7.1.4.4.
Диаграмма Р-Н (энтальпийная)
Очень
удобна для представления изобаричес-
ких
превращений: количество теплоты в обменном
процессе
непосредственно считывается с оси
абсцисс:
1.7.2.
Свойства газов
1.7.2.1.
Модель идеального
газа
1.7.2.1.1.
Уравнение состояния
Совершенным
газом является особый гипотети-
ческий
флюид, свойства которого строго удовле-
творяют экспериментальным законам, историчес-
ки
связанным с именами Бойля, Мариотта, Шарля
и
Гей-Люссака:
PV = const при постоянной температуре 9,
V = V
o
(1 + а0) при постоянном давлении, 6 - темпе-
ратура в градусах Цельсия, V
o
- объем при 0°С,
Р ж Р
о
(1 + ре) при постоянном объеме, Р
о
- давле-
ние при 0 К, где аир стремятся соответственно к
а° и р°, когда плотность стремится к 0, при этом:
^ =
£«273.15-0
Если
определить термодинамическую темпера-
туру Т (или абсолютную температуру) как:
т..4
PV
то легко показать, что комплекс -=- инвариантен
для фиксированной порции газа.
Тогда для одной моли газа (1 моль = N молеку-
лам,
где N - число Авогадро) можно получить:
PV
=
R
где:
R - универсальная постоянная для совершенных
газов
R = 8,314 45 Дж
•
моль-
1
•
Кг
1
;
Р -абсолютное давление (Па);
Т - абсолютная температура (К);
V - мольный объем (м
3
•
моль*
1
).
Для п молей газа, занимающих некоторый объ-
ем V:
PV = nRT
или иначе, для массы m газа с молекулярной мас-
сой
М (кг
•
моль~') в некотором объеме V:
PV
= [?RT
104

1
ОБЩИЕ СВЕДЕНИЯ
Физически,
модель
совершенного
газа
подразу-
мевает отсутствие всякого взаимодействия между
молекулами в
газе;
она позволяет легко оценивать
приближенно свойства газа при
малых
давлениях
и
высоких температурах (вдали от критической
точки и от области фазового перехода).
1.7.2.1.2.
Термодинамические свойства
совершенных газов
Использование уравнения состояния совершен-
ных газов в соотношениях §
1.7.1.3.3
приводит к
следующим свойствам совершенных
газов.
1.7.2.1.2.1.
Соотношение Клапейрона
I = Р и л = -V
удельные
теплоемкости совер-
шенного
газа (обозначенные
через пиг) являются функция-
ми
только температуры
^| =0
т
=
0
ЭР
л
1.7.2.1.2.2. Соотношение Майера
C°-C°
=
1.7.2.1.2.3. Функции состояния
dll
=
C°dT
dH =
C°dT
,odT
Р "Т
,odV
,dP
' Р
1.7.2.1.2.4. Законы Джоуля
Законы Джоуля выводятся из последних соотно-
шений,
устанавливающих, что внутренняя энергия
и
энтальпия совершенного газа зависят только от
температуры.
В итоге, термодинамические свойства могут
быть
вычислены
с помощью соотношений:
Н
0
(Т)-Н°(Т
0
)
=
S°(P
0
,T)-S°(P
»
т
°>
•
J(T
Чтобы
полностью определить Н°(Т) и
S°(P,T),
на-
до зафиксировать величину постоянных
Н°(Т
0
)
и
S
0
(P
0
,T
0
):
широко распространено следующее до-
пущение:
Н°(Т
0
)
= 0
для совершенного газа при
Г
о
= 0 К и МПа
(или 1 атм)
Однако эти соглашения не являются универ-
сальными, поэтому прежде, чем пользоваться раз-
личными таблицами, необходимо убедиться в соот-
ветствии принятых соглашений.
Пример одной из таблиц дан ниже.
На основе
данных,
взятых из таблицы, может
быть
рассчитано любое другое свойство с по-
мощью установленных ранее соотношений:
U°(T) = Н°(Т) - RT
G°(P, Т) = Н°(Р, Т) -
TS°(P,
Т)
и
в частности:
G
0
(P,T)-G°(P
0
,T)
= RT In f |-
ит.д.
1.7.2.1.3.
Приложение:
цикл
Карно совершенного
газа
Такой цикл состоит из
двух
изотерм и
двух
ади-
абат.
Цикл
Карно.
1.7.2.1.3.1.
Адиабатический процесс
0
.T)
=
J-
R^
=
-
R
Ш
^
S°(P,T)-S
0
(P
Существуют многочисленные
таблицы
основных
свойств
различных веществ( С°, Н°(Т) и т.д.) в со-
вершенном состоянии.
либо.заменяя величины С° и С° своими средними
постоянными значениями и интегрируя:
либо
У
^О
PV = const, где у = —j
С°
Р
т
Т = const
105
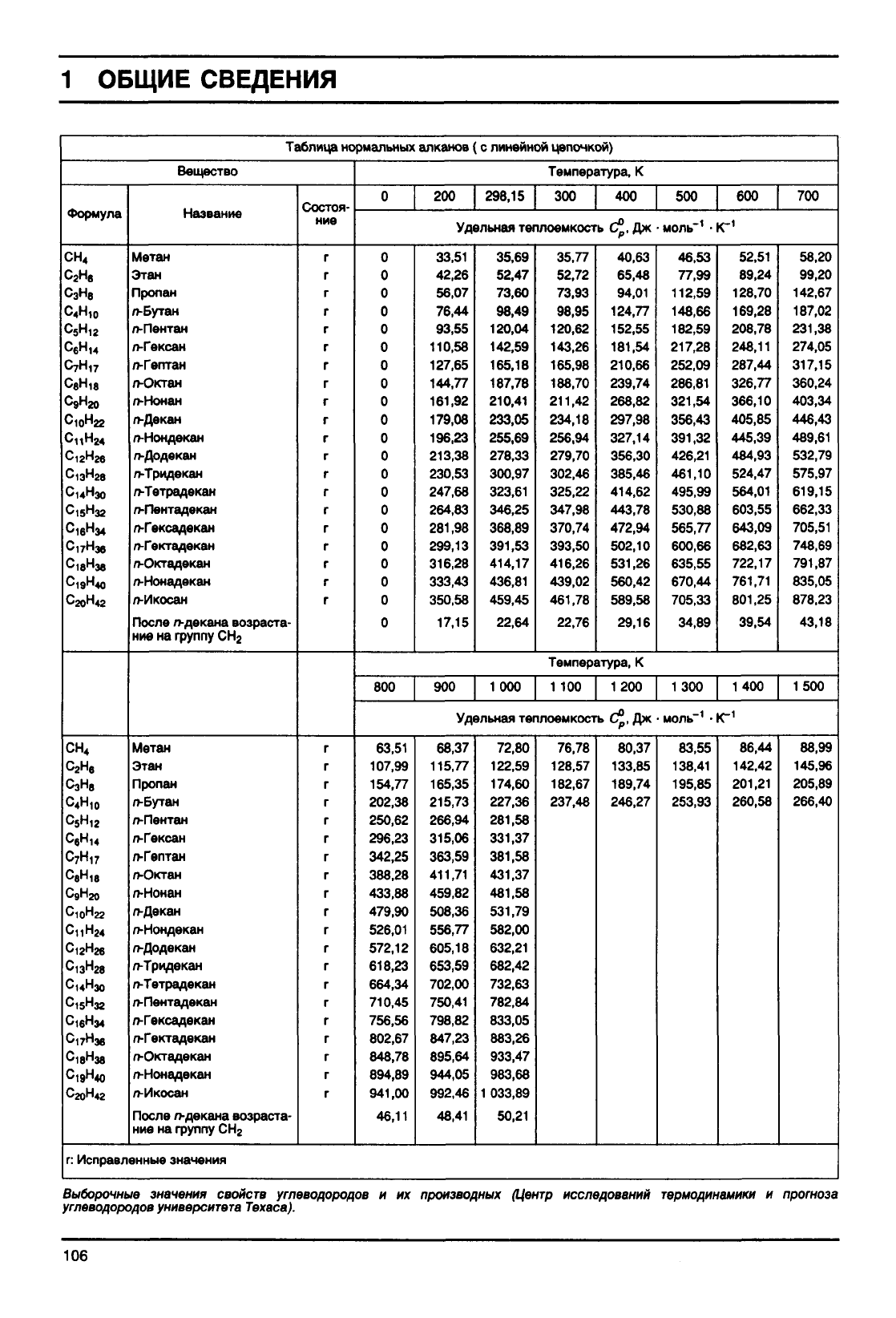
1 ОБЩИЕ
СВЕДЕНИЯ
Таблица
нормальных
алканов
Вещество
Формула
СН
4
С
2
Н
в
С
3
Н
в
С4Н10
С5Н12
СбН,4
С7Н17
С
8
Н
18
СвНго
С
10
Нг2
C
1t
H
2
4
С^Нгв
С1эНгв
С
14
Нзо
С,
5
Нзг
С
16
Нз4
С^Нзв
С
18
Нзв
С
19^40
Сго
н
4г
СН
4
С
г
Н
в
С
э
Н
в
с
4
н
10
С
5
Н
12
CjH
14
С7Н17
с
в
н
1в
СдНго
СюНгг
СцН
г4
С1
2
Нгв
С13Н28
С
и
Нэо
С,5Нзг
С
16
Нэ4
С
17
Нэв
С
18
Нзв
С
19
Н
40
С2оН
4
г
Название
Метан
Этан
Пропан
л-Бутан
л-Пентан
л-Гексан
л-Гептан
о-Октан
л-Нонан
л-Декан
л-Нондекан
л-Додекан
л-Тридекан
л-Тетрадекан
л-Пентадекан
л-Гексадекан
л-Гектадекан
л-Октадекан
л-Нонадекан
л-Икосан
После
л-декана
возраста-
ние
на
группу
СН
2
Метан
Этан
Пропан
л-Бутан
л-Пентан
л-Гексан
л-Гептан
л-Октан
л-Нонан
л-Декан
л-Нондекан
л-Додекан
л-Тридекан
л-Тетрадекан
л-Пентадекан
л-Гексадекан
л-Гектадекан
л-Октадекан
л-Нонадекан
л-Икосан
После
л-декана
возраста-
ние
на
группу
СН
2
Состоя-
ние
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
г
с
линейной
цепочкой)
Температура,
К
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
200
298,15
300
400
Удельная
теплоемкость
С^, Дж
33,51
42,26
56,07
76,44
93,55
110,58
127,65
144,77
161,92
179,08
196,23
213,38
230,53
247,68
264,83
281,98
299,13
316,28
333,43
350,58
17,15
35,69
52,47
73.60
98,49
120,04
142,59
165,18
187,78
210,41
233,05
255,69
278,33
300,97
323,61
346,25
368,89
391,53
414,17
436,81
459,45
22,64
35,77
52.72
73.93
98,95
120,62
143,26
165,98
188,70
211,42
234,18
256,94
279,70
302,46
325,22
347,98
370,74
393,50
416,26
439,02
461,78
22,76
40,63
65,48
94,01
124,77
152.55
181,54
210,66
239,74
268,82
297,98
327,14
356,30
385,46
414,62
443,78
472,94
502,10
531,26
560,42
589,58
29,16
500
•
моль"
1
•
46,53
77,99
112,59
148,66
182,59
217,28
252,09
286,81
321,54
356,43
391,32
426,21
461,10
495,99
530,88
565,77
600,66
635,55
670,44
705,33
34,89
600
кг
1
52,51
89,24
128,70
169,28
208,78
248,11
287,44
326,77
366,10
405,85
445,39
484,93
524,47
564,01
603,55
643,09
682,63
722,17
761,71
801,25
39,54
700
58,20
99,20
142,67
187,02
231,38
274,05
317,15
360,24
403,34
446,43
489,61
532,79
575,97
619,15
662,33
705,51
748,69
791.87
835,05
878,23
43,18
Температура,
К
800
63,51
107,99
154,77
202,38
250,62
296,23
342,25
388.28
433,88
479,90
526.01
572,12
618,23
664,34
710,45
756,56
802,67
848,78
894,89
941,00
46,11
900
1000
1 100
1200
Удельная
теплоемкость (?
р
,
Дж
68,37
115,77
165,35
215,73
266,94
315,06
363,59
411,71
459,82
508,36
556,77
605,18
653,59
702,00
750,41
798,82
847,23
895,64
944,05
992,46
48,41
72,80
122,59
174,60
227,36
281,58
331,37
381,58
431,37
481,58
531,79
582,00
632,21
682,42
732,63
782,84
833,05
883,26
933,47
983,68
1
033,89
50,21
76,78
128,57
182,67
237,48
80,37
133,85
189,74
246,27
1300
•
моль"
1
•
83,55
138,41
195,85
253,93
1400
КГ
1
86,44
142,42
201,21
260,58
1500
88,99
145,96
205,89
266,40
г:
Исправленные
значения
Выборочные
значения
свойств
углеводородов
и их
производных
(Центр
исследований
термодинамики
и
прогноза
углеводородов
университета
Техаса).
106

1 ОБЩИЕ СВЕДЕНИЯ
1.7.2.1.3.2. Изотермический процесс
Т = const => PV = const
Характеристики обмена теплом и работой в та-
ком
процессе подытожены ниже в таблице.
Путь
1-2
2-3
3-4
4-1
Природа
процесса
Изотерма
Т,
Адиабата
Изотерма
Т
2
Адиабата
Обмен энергией
Теплота (Q)
Р
2
-RT,,n-
0
-RT
2
m£
0
Работа (W)
Рг
+
RT,ln
—
p
i
Г
1
C,rfT
+
RT
2
ln^
Энергетический кпд имеет значение
W
12
1.7.2.1.4.
Идеальная смесь
совершенных газов
Модель совершенного газа применяется для
каждой составляющей смеси и для смеси в целом:
P
(
V = л,ЯТ
где:
Р,- парциальное давление компонента
\,
л,-
число молей компонента
/в
смеси.
Таким образом, в идеальной смеси предполага-
ется отсутствие взаимодействия составляющих на
молекулярном уровне, причем как между однотип-
ными молекулами, так и между молекулами раз-
ных видов.
Это приводит к тому, что свойства смеси пред-
ставляются через свойства компонентов аддитив-
ным образом.
1.7.2.1.4.1.
Закон Дальтона
Р = £Р,, откуда следует Р, = у,Р,
И/
здесь:
у. =
—
- мольная доля компонента i в
газо-
л
вой смеси.
H°
m
CD
=
Аналогично:
S°
m
(P,
T) = 5> [S?(P, T) - R In (у,) ],
где
второй
член
отражает возрастание энтропии
из-за
необратимости системы.
>)
=
2y,[F°
+
RTIn
(у,)],
(У,)]-
1.7.2.1.4.2. Законы
Рауля
и Генри
Если
применить концепцию совершенного газа к
растворам (идеальным растворам), то:
где:
Х| - мольная доля компонента
/
в жидкой фазе;
P.JJ) - давление насыщенных паров чистого ком-
понента / в жидком состоянии при темпе-
ратуре Т.
Отсюда получаем константу равновесия:
.о _ У/ _
' " х, " Р
Этот закон обеспечивает хорошую аппроксима-
цию только при низких давлениях и может приме-
няться только, если температура ниже критичес-
кой
температуры рассматриваемого компонента:
Т<Т
е(
(если Т > Т
ы
, то Р°(Т) неопределено).
Закон Генри, полученный экспериментально,
формально является обобщением закона
Рауля:
это предельный закон, применимый для разбав-
ленных
растворов газа (д) в растворителе (s):
(х
д
- мольная доля газа в растворе).
Величина Н
д
, (константа Генри) зависит от сосу-
ществующих веществ (газ и растворитель); она оп-
ределяется при давлении насыщенных паров
P
S(7
(T),
если применим закон
Рауля.
1.7.2.2.
Свойства реальных газов
1.7.2.2.1.
Общие сведения.
Применение
уравнения состояния
1.7.2.2.1.1.
Уравнения состояния реальных газов
Модель совершенного газа неадекватно описы-
вает двухфазные состояния газа и ее применения
ограничены областью очень низких давлений (мак-
симум несколько бар).
В газовой промышленности в общем случае не-
обходимо использование уравнения состояния ре-
альных
газов.
Уравнение состояния имеет вид соотношения:
/(P,V,T,y)
= O
где:
Р - абсолютное давление,
V - мольный объем,
Т - абсолютная температура,
у- состав (мольные доли).
Коэффициент сжимаемости Z определяется со-
отношением:
Z =
PV
RT
107

1
ОБЩИЕ
СВЕДЕНИЯ
Для описания физического поведения
реальных
газов
было
предложено множество уравнений, ко-
торые можно сгруппировать в несколько классов:
— кубические уравнения,
— уравнения, использующие принципы соответст-
венных
состояний,
—
вириальные
уравнения и более сложные моди-
фикации, развитые на их основе.
1.7.2.2.1.1.1.
Кубические уравнения
Это двухпараметрические уравнения, вытекаю-
щие
из уравнения Ван-дер-Ваальса:
(P
+ ^)(V-b) = RT
а
- коэффициент притяжения, описывает
асимме-
тричное воздействие молекул из объема на мо-
лекулы, находящиеся в непосредственной бли-
зости
от стенки или соударяющиеся с ней, и та-
ким
образом определяющие давление в
рассматриваемом объеме;
b - коэффициент отталкивания (размерность объ-
ема),
учитывает
ненулевой объем, занятый ато-
мами.
Коэффициент сжимаемости теперь записывает-
ся в виде:
Z =
PV
RT
(V-Ъ) RTV
Его можно найти как решение кубического урав-
нения:
ЬР
В
приведенной
форме
(т.е. в
переменных
У^-коорди-
Р, = в-. V, = — и Т, = —, где
•с
V
o 'с
наты
критической точки рассматриваемого веще-
ства) уравнение имеет вид:
,+
AW,-1)
=8T,
Коэффициенты а\лЬнаходятся из условий:
ЗР
С
27R
2
T
2
>'
а =
64
Р
с
RT,
8Р,
Р
которые соответствуют точке перегиба критичес-
кой изотермы (Т = Т
с
на диаграмме (P,V) в точке
P
= P
C
,V = V
C
(см.
§1.7.2.2.1.2.)).
К
уравнению Ван-дер-Ваальса сохраняется пе-
дагогический интерес, но оно более никогда не
применяется к природному газу и его составляю-
щим.
В настоящее время наиболее распростране-
ны уравнения Редлиха-Квонга и Пенга-Робинсона.
Уравнение Редлиха-Квонга:
Р=
или в форме полинома:
Z - 7? + (А - В -
аР
где
А =
и
В =
: - АВ = о
ЬР
R'T R
2
T
В оригинальной статье а и b
являются
констан-
тами
для каждого компонента, которые легко на-
ходятся из координат критической точки:
2
а
=
0,427
48 R
2
RT
e
и Ь =
0,086
64 —-
но
было
предложено множество модификаций
(Soave, Graboski и
Daubert),
в которых параметр а
являлся
функцией температуры и ацентрического
фактора ш, за счет чего обеспечивалось улучшен-
ное совпадение с кривой давления насыщенных
паров углеводородов:
а(Т,
со) = аа
здесь:
сс=
[1 +
(0,485
08 + 1,551
71со-0,156
13со
2
)
х
Уравнение RK2-GDF, которое приводится далее
(см.
1.7.2.2.3),
является другой частной модифика-
цией
уравнения Р-К, в которой параметры а и Ь
были
выражены
как степенные функции темпера-
туры
для различных компонентов природного
газа.
Уравнение Пенга-Робинсона:
р=
V-b
аа
или в форме полинома:
Z - (1 - BJZ
2
+ (А - ЗВ
г
- 2B)Z - (АВ - В
г
- В) = 0
причем
А =
ааР
R?
В =
ЬР
RT
где
-г*
а = 0.457
24R
2
-?;
• е
b =
-^;
• е
а= [1 +
(0,374
64+1,542
26со-
-
О,269
92со
2
)
(1 - 7TV) ] •
Приложение к смесям.
При использовании этих уравнений для газовых
смесей
(подобных природному газу) параметры а и
b смеси определяются по правилам смешения:
где:
(аа)
ц
= (1 -к
ц
)
7(800,(80),
Ь =
1У,Ь,.
108
1 ОБЩИЕ СВЕДЕНИЯ
Фактически,
уравнение будет определено лишь
после того, как для каждого компонента будут ус-
тановлены параметры
(act),
и Ь„ а также введены
коэффициенты парного взаимодействия k
f
для
смесей.
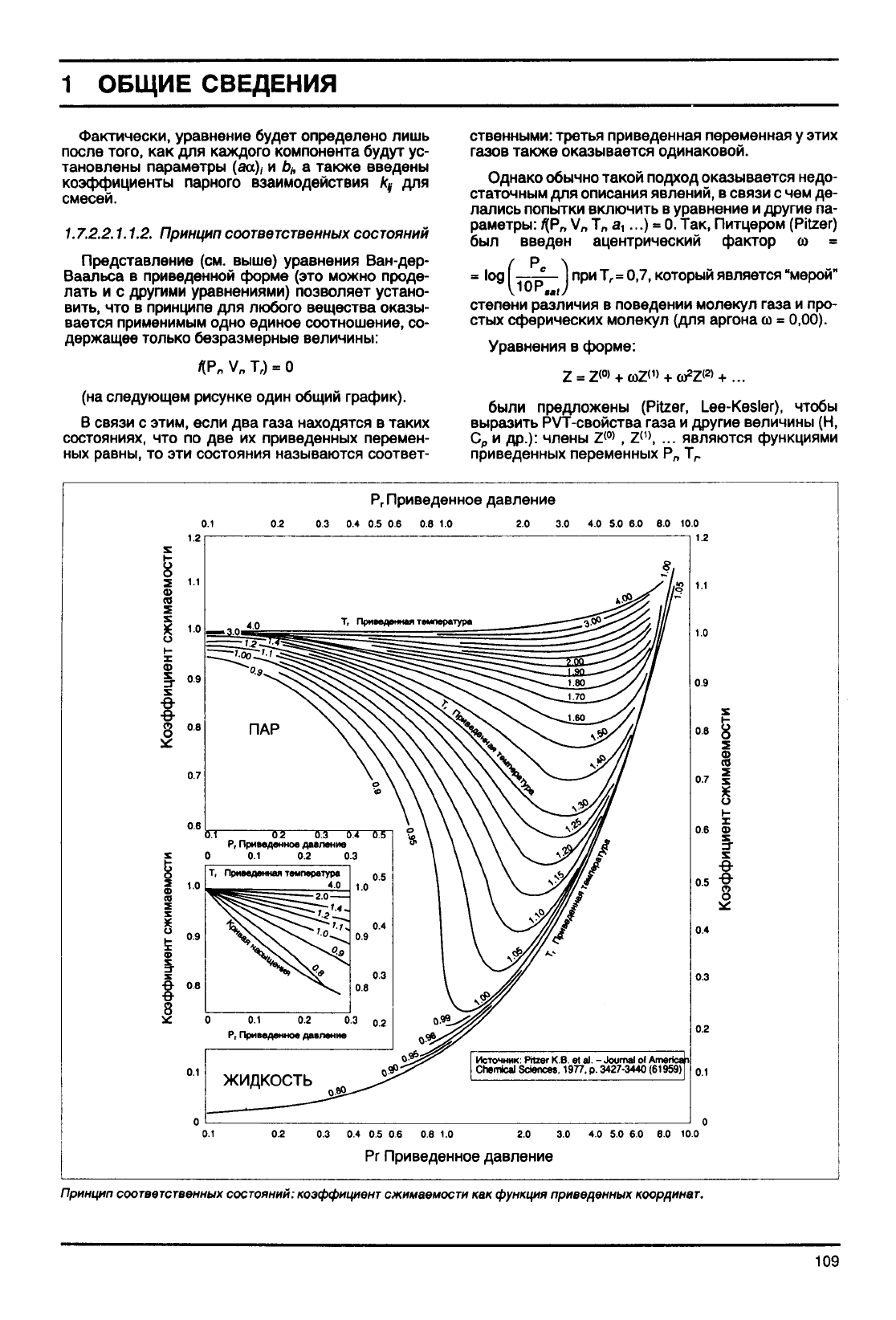
1.7.2.2.1.1.2.
Принцип
соответственных
состояний
Представление (см. выше) уравнения Ван-дер-
Ваальса в приведенной форме (это можно проде-
лать
и с другими уравнениями) позволяет устано-
вить,
что в принципе для любого вещества оказы-
вается применимым одно единое соотношение, со-
держащее
только
безразмерные величины:
*Р„
V
n
Т,) = О
(на
следующем рисунке один общий график).
В связи с
этим,
если два
газа
находятся в таких
состояниях, что по две их приведенных перемен-
ных равны, то эти состояния называются соответ-
ственными: третья приведенная переменная у этих
газов
также оказывается одинаковой.
Однако
обычно
такой подход оказывается недо-
статочным для описания явлений, в связи с чем де-
лались попытки
включить
в уравнение и другие па-
раметры:
f{P
n
V
n
Т„
а,...) = 0.Так, Питцером (Pitzer)
был введен ацентрический фактор со =
/ р \
=
log
c
при Т
г
=
0,7,
который является "мерой"
степени
различия в поведении молекул
газа
и про-
стых
сферических молекул (для аргона
со
=
0,00).
Уравнения в форме:
были
предложены (Pitzer, Lee-Kesler),
чтобы
выразить PVT-свойства
газа
и другие
величины
(Н,
С
р
и др.):
члены
Z
(0)
, Z
(1)
, ...
являются
функциями
приведенных переменных Р„ Т
г
Р
г
Приведенное давление
0.1 0.2
1.2
Р, Приведенное давление
0
0.1 0.2 0.3
0.1
0.2 0.3 0.2
Р, Приведенное давление
Источник: Pitzer K.B. et al. - Journal of America i
Chemical Sciences.
1977,
p.
3427-3440
(61959)
0.4
0.3
0.2
0.1
0.1
0
2 0.3 0.4 0.5 0 6 0.8 1.0
2.0 3.0 4.0 5.0 6.0 8 0 10.0
Pr Приведенное давление
Принцип
соответственных
состояний: коэффициент сжимаемости
как
функция приведенных координат.
109

1
ОБЩИЕ СВЕДЕНИЯ
Приложение
к
смесям.
Необходимо определить координаты критичес-
кой
точки
для
смеси.
Было
предложено несколько
правил,
наиболее распространенным
является
простое
суммирование критических параметров
компонентов
с
весом, равным мольной доле.
Та-
ким
образом определяются псевдокритические
параметры
смесей:
1.7.2.2.1.1.3.
Уравнения вириального
типа
Они имеют
вид:
_
PV . В С
2
1 + + +
=
1+Вр + Ср
г
+ ... = 1+В'Р + С'
где
(RT)
2
(RT)
Эта формулировка вытекает
из
статистической
механики,
которая дает интерпретацию вириаль-
ных коэффициентов: второй вириальный коэффи-
циент^)
учитывает
взаимодействие между двумя
молекулами (парное соударение), третий
-
взаимо-
действие трех молекул
и т.д.
На практике
для
проведения вычислений
ряд
обрывают
на
2-м, либо
3-м
члене. Коэффициенты,
являющиеся функциями температуры, определя-
ются
с
помощью экспериментальных корреляций
(Pitzer-Curl:
В =
В<
0)
+
соВ
(1
>),
либо могут
быть
оцене-
ны
с
помощью соотношений
для
потенциалов
меж-
молекулярного взаимодействия.
Другие,
часто используемые
для
газа уравнения,
родственны
к
вириальным,
но
содержат дополни-
тельно
последний член, описывающий поведение
отброшенного
остатка разложения.
Уравнение Бенедикта-Вебба-Рубина (Benedict-
Webb-Rubin):
Уравнение Стерлинга (Starling):
Z =
RT
b-a d
~RT~RT
RT
+
RT
RT
RT
+
RT
(1+ур
г
)р
2
ехр
(-
В публикациях авторов можно найти значения
коэффициентов
для
индивидуальных компонентов
природного
газа,
а
также правила смешения.
Приведенные выше соотношения являются
об-
щими
уравнениями, позволяющими оценить физи-
ческие
свойства
газа.
Существует множество
дру-
гих
уравнений, некоторые
из
которых, имеющие
специальное назначение, применяются
и в
газовой
промышленности,
например,
для
расчета плотнос-
ти жидкой
фазы
(сжиженного природного
газа).
1.7.2.2.1.2.
Расчет
свойств газов
Поскольку свойства газов
в
совершенном состо-
янии известны
или
легко вычисляются
(см.
§
1.7.2.1),
свойства
реальных
газов вычисляются
следующим образом:
М
= М° + (М - М°),
где
второй
член
представляет собой разницу
в
свойстве
М
между реальным газом
и
данным газом
в совершенном состоянии
при тех же
условиях
(Р,
Т): он
называется отклонением
и
рассчитыва-
ется
с
помощью уравнения состояния
по
соотноше-
ниям,
приведенным
в §
1.7.1.3.3.
1.7.2.2.1.2.1.
Энтальпия
Для энтальпии можно получить
в
итоге:
^
H-H° =
p
ЭТ
dP
P
или
же:
или,
если ввести
Z:
0
H-H
U
= U-U
U
+
RT(Z-1)
V
H_H°=
frv(^)
+
i(f.
J
L 3V
T
Э
V
н-н°=
RW^I) ^
+
PV-RT
либо, используя уравнение состояния:
Редлих-Квонг
=>
Н - Н° =
(bRT)
{
2
JT °Ч
Вириальное
=> Н - Н° =
=
-RT
2
cfT
и
т.д.
Аналогично можно получить выражения
для дру-
гих
свойств
с
помощью следующих соотношений.
1.7.2.2.1.2.2.
Внутренняя
энергия
U
- U
0
= RT(1 - Z) + Н - Н°
1.7.2.2.1.2.3.
Удельная
теплоемкость
о
р
•J
V)
=
- RT
110
1
ОБЩИЕ
СВЕДЕНИЯ
^- (Л/.
RT
mr
ZRI
_,2
яг
1.7.2.2.1.2.4.
Энтропия
dP
=
1.7.2.2.1.2.5.
Свободная энергия
F
- P - (U - U°) - T(S - S°)
1.7.2.2.1.2.6.
Потенциал
Гиббса
G
- G° - (H - H°) -
T(S
- S°)
7.7.2.2.1.2.7. Фугитивность
ДЛЯ
расчетов фазового равновесия использует-
ся фугитивность
/,
определенная
как:
dG
=
RTotln
г) при lim / = Р
р-»0
Далее будет использоваться коэффициент
фу-
гитивности
Ф = р,
вычисляемый
как:
1.7.2.2.1.2.8.
КоэффициентДжоуля-Томсона
Все
эти соотношения могут использоваться
сов-
местно
с
уравнениями состояния, приведенными
ранее.
В распоряжении управления исследований
и но-
вой техники общества Таз де Франс" имеются про-
граммы,
осуществляющие расчет этих свойств,
к
примеру,
в
форме программного обеспечения Таз-
пак*
(Gaspack), выполненного
в
диалоговом виде,
что делает его доступным для любого пользовате-
ля либо
на
терминале компьютера G.D.F., либо
на
дискетах
для микрокалькулятора.
1.7.2.2.1.3.
Фазовое равновесие
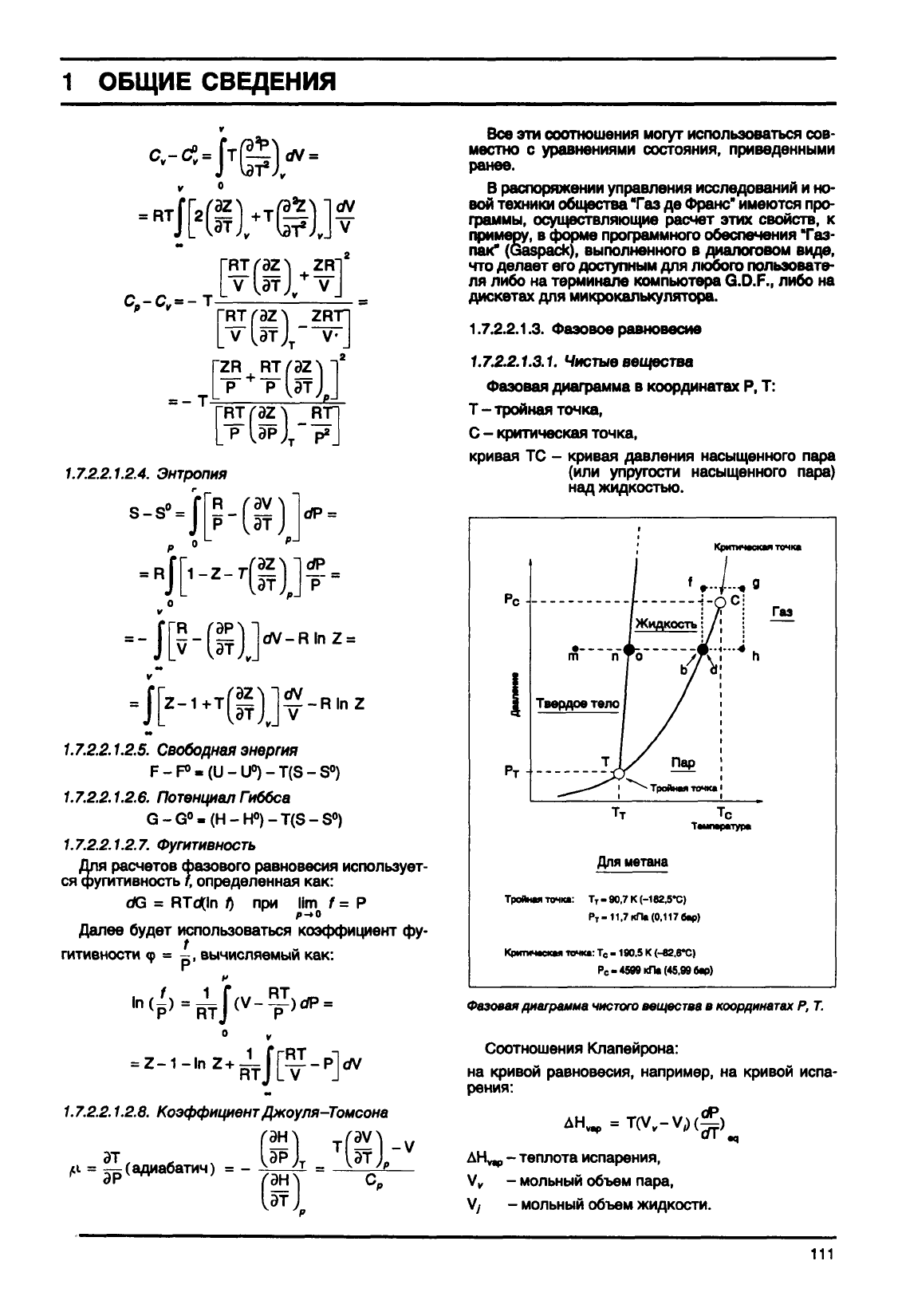
1.7.2.2.1.3.1.
Чистые
вещества
Фазовая
диаграмма
в
координатах
Р, Т:
Т
-
тройная точка,
С
-
критическая точка,
кривая
ТС -
кривая давления насыщенного пара
(или
упругости насыщенного пара)
над жидкостью.
г
с
-
Критическая
точка
Газ
Для метана
Тройная
точка: Т
т
-90,7К(-182.5*С)
Р
т
-11,7кПа(0.117бар>
Критическая точка: Т
с
-
190.5
К (-82,в*С)
Рс-«599 кЛа
(45.99
бар)
Фазовая
диаграмма
чистого
вещества
в
координатах
Р, Т.
Соотношения Клапейрона:
на кривой равновесия, например,
на
кривой испа-
рения:
~
теплота испарения,
W
v
-
мольный объем пара,
V; -
мольный объем жидкости.
111
1 ОБЩИЕ СВЕДЕНИЯ
Фазовая диаграмма в координатах Р, V:
С - критическая точка,
Т - тройная точка,
р
с V» Т„- координаты критической точки.
Для критической изотермы критическая точка
является точкой перегиба
Газ
Насыщенная
жидкость + пар
Фазовая диаграмма
чистого
вещества
в
координатах
Р, V.
1.7.2.2.1.3.2.
Смеси
Фазовая диаграмма (координаты Р, Т).
Даииниа
Тмрди
,'Тмрдо»
ТвЛО
I
TWIO
+
I
ЖИДКОСТЬ
Жидкость
Крипт некая точка
Тмрдоа тало + пар
П«Р
Фазовая
диаграмма
(общий
случай).
i
Ml
Кримя точек
рооы
—
ss// / ; j
/7
/во% у / /
100%
жидкоотм_ —
•^^__
-
^^"^%
жидкости
1
/
V
Кривая
росы
Тампаратура
t%^%<
Область
ратроградной конданоацин
,м
г«
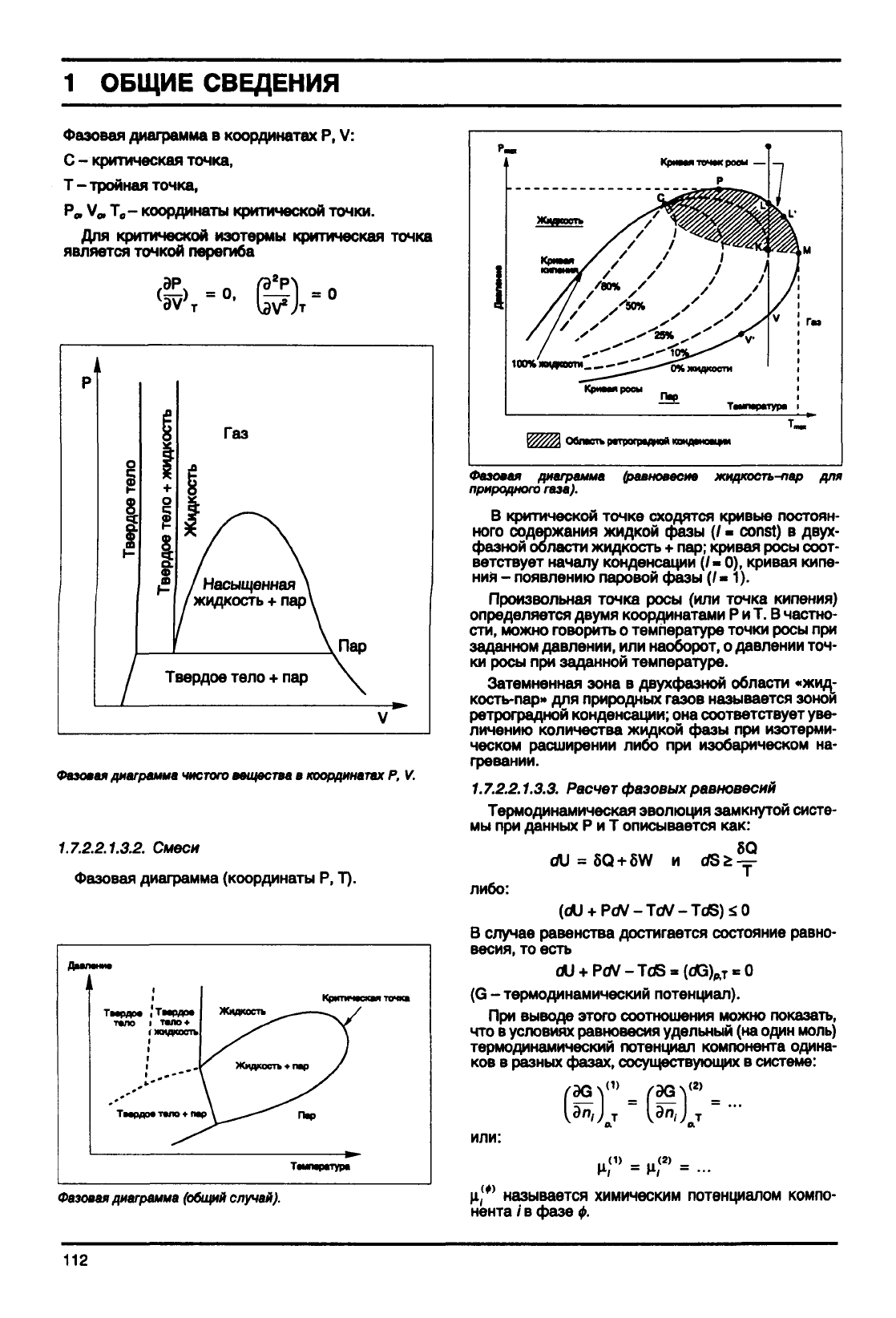
Фазовая диаграмма (равновесие
жидкость-пар
для
природного
газа).
В критической точке сходятся кривые постоян-
ного содержания жидкой фазы (/ - const) в
двух-
фазной области жидкость + пар; кривая
росы
соот-
ветствует началу конденсации (/•
0),
кривая кипе-
ния - появлению паровой фазы (/«1).
Произвольная точка
росы
(или точка кипения)
определяется двумя координатами Р и Т. В частно-
сти,
можно говорить о температуре точки
росы
при
заданном давлении, или наоборот, о давлении точ-
ки
росы
при заданной температуре.
Затемненная
зона в двухфазной области «жид-
кость-пар» для природных газов называется зоной
ретроградной конденсации; она соответствует уве-
личению количества жидкой фазы при изотерми-
ческом расширении либо при изобарическом на-
гревании.
1.7.2.2.1.3.3.
Расчет
фазовых
равновесий
Термодинамическая эволюция замкнутой систе-
мы при данных Р и Т описывается как:
t/U
= 8Q + 6W и dS^-=-
либо:
(dU
+ PdV-ToV-ToS)^0
В случае равенства достигается состояние равно-
весия, то есть
(G - термодинамический потенциал).
При
выводе
этого соотношения можно показать,
что в условиях равновесия
удельный
(на один моль)
термодинамический потенциал компонента одина-
ков в разных фазах, сосуществующих в системе:
У"
**
У"
=
(—
Эп,)
т
(д
или:
ц, называется химическим потенциалом компо-
нента / в фазе
ф.
112
1 ОБЩИЕ СВЕДЕНИЯ
Правило фаз.
Оно вытекает из вышеприведенных соотноше-
ний и формулируется следующим образом: вари-
антность (число независимых интенсивных пара-
метров) гетерогенной системы, содержащей ффаз,
N
компонентов и г химических реакций, равна:
vU + 2-ф-г
Примеры:
Равновесие жидкость-пар чистого вещества:
у-1+2-2-1=*
если зафиксировать Р, тоТ од-
нозначно определена (и на-
оборот).
Равновесие жидкость-пар бинарной
смеси:
v-2 + 2-2«2=> можно фиксировать две
пере-
менные, например, темпера-
туру и давление, и
получить
состав фаз.
Равновесие метана с гидратом метана:
СЬЦгаз)
+ лН2О(жидкость) =^ [СН
4
, лН
2
О} (тв. тело),
Вариантность трехфазной системы есть:
v=3
+ 2 —3
—
1
-1 => если зафиксировать Р, можно
получить
значение Т (кривая
гидратообразования).
Химический
потенциал вычисляется с помощью
соотношений:
— для компонента в состоянии совершенного
газа:
(g
f
- стандартный потенциал чистого компонента);
— для компонента идеального раствора:
(х,- мольная доля жидкой фазы,
д,-
потенциал чистого компонента);
— для компонента в реальном состоянии, в жид-
кой
или паровой фазе:
(1,-
фугитивность компонента).
Фугитивность компонента / в паровой фазе f,
вычисляется с помощью соотношения:
где:
ф," - коэффициент фугитивности,
выводится
с
помощью уравнения состояния (см. §
1.7.2.2.1.2.7.).
Фугитивность компонента / в жидкой фазе (
вычисляется по уравнению состояния или с по-
мощью эмпирических корреляций (Chao и Seader и
др.)
через активность а/=у**/:
где:
у,- коэффициент активности,
X/-
мольная доля,
f,- фугитивность чистого компонента.
Равновесие фаз описывается соотношениями
(для N компонентов):
1}
= f,"
Исходя их этих уравнений
вычисляются
кон-
станты равновесия или коэффициенты распреде-
ления:
*,=
*
х,
1.7.2.2.1.3.4.
Расчет
разделения фаз,
точки
кипения и
точки
росы
Расчет разделения фаз дает ответ на следую-
щий
вопрос: при заданной смеси N компонентов,
характеризуемой
составом (ц), рассматриваемой в
условиях Р, Т, каково ее состояние (однофазное
или многофазное), характеризуемое долей жидкой
фазы, и каковы соответствующие составы различ-
ных фаз.
В случае расчета точки кипения (/ -1) или точки
росы
(/ - 0) задаются суммарный состав и одна из
двух
переменных (Р или J), а искомыми
являются
оставшаяся переменная (Т или Р), а
также
состав
зарождающейся
фазы.
Можно
показать, что все расчеты сводятся к ре-
шению
уравнения:
=
0
где:
/- доля жидкой фазы, к,- константы равнове-
сия,
вычисляемые по уравнениям состояния.
Решение
строится итерациями, так как коэффи-
циенты к,
являются
функциями Р, Т, x
h
y
h
Все
расчеты
выполняются
с помощью программ-
ного обеспечения Газпак.
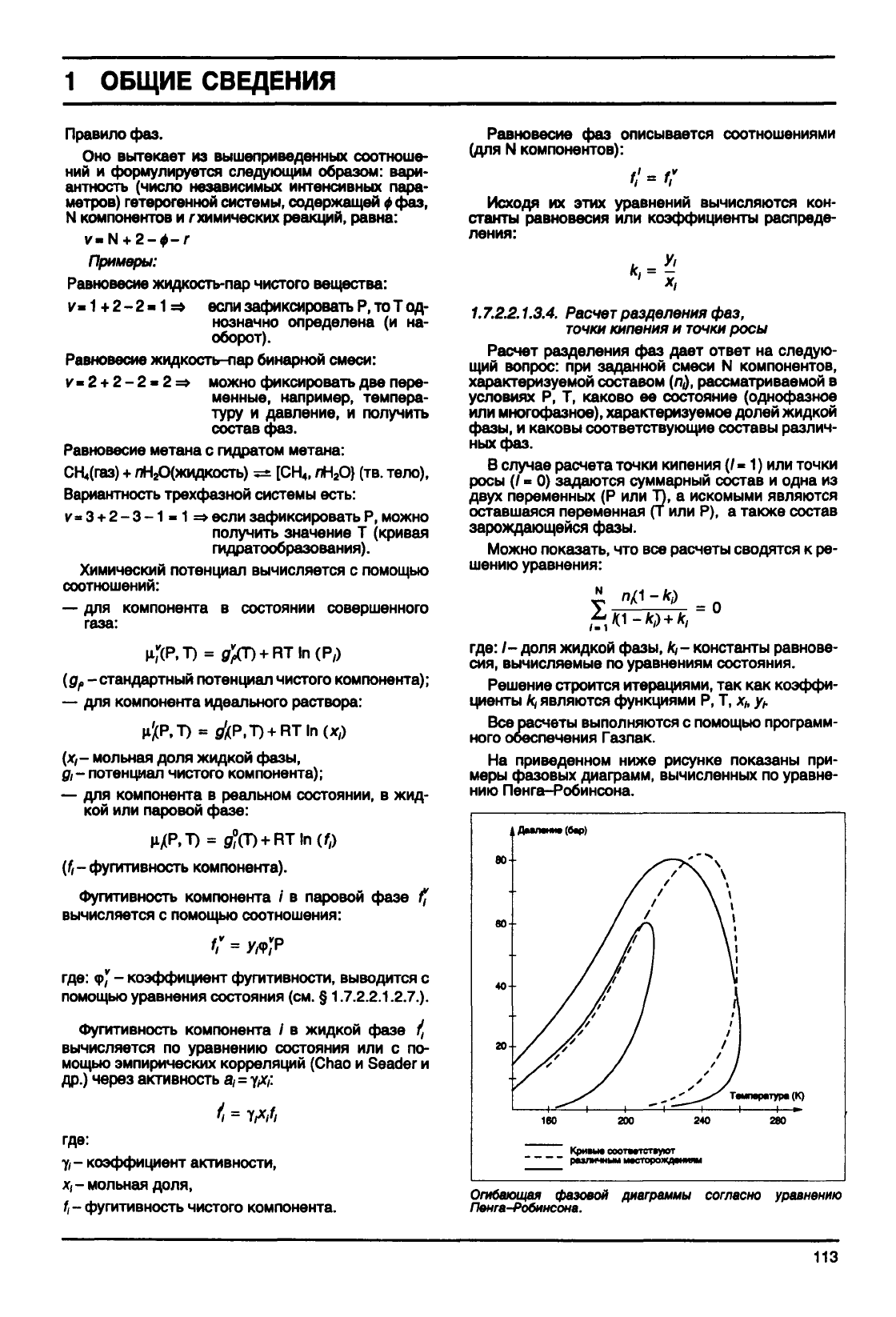
На приведенном ниже рисунке показаны при-
меры
фазовых
диаграмм,
вычисленных
по уравне-
нию Пенга-Робинсона.
Огибающая фазовой диаграммы согласно уравнению
Пенга-Робинсона.
113
