Савельев В.С. (ред) 80 лекций по хирургии
Подождите немного. Документ загружается.

Роль сосудистого хирурга в лечении онкологических больных
артерий служит одной из главных причин смерти онко-
логических больных. Особенно опасны в этом отношении
муцинпродуцирующие аденокарциномы легкого, подже-
лудочной и молочной железы, женских половых органов,
желудочно-кишечного тракта. Большинство лекарствен-
ных препаратов, используемых для лечения злокачествен-
ных опухолей, достоверно способствуют развитию тром-
бозов и тромбофлебитов. Это циклофосфамид, метотрек-
сат, преднизолон, тамоксифен, цисплатин, винбластин,
доксорубицин, 5-фторурацил, винкристин, блеомицин,
этопозит и другие более современные. Роль лучевой тера-
пии в отношении риска тромбоэмболических осложнений
изучена недостаточно. Учитывая сказанное, можно конс-
татировать, что в ходе комбинированного, комплексного и
паллиативного лечения следует проводить эффективные
антитромбоэмболические мероприятия.
Основной подход к профилактике венозных тромбо-
эмболических осложнений регламентируется приказом
№ 233 Министерства здравоохранения и социального
развития Российской Федерации. Большинство больных
с онкологическими заболеваниями относятся к группе
высокого риска венозного тромбоэмболизма. Мы по-
ступаем так. Для первичной профилактики использу-
ем фракционированные низкомолекулярные гепарины
(клексан, фраксипарин). Первая их инъекция с про-
филактической целью производится через б—8 часов
после операции, клексан в дозе 20—40 мг, фраксипарин
0,3—0,6 мм, а затем еще 7—10 дней с аналогичным дози-
рованием. Традиционный нефракционированный гепа-
рин рекомендуем начинать вводить внутривенно инфу-
зоматом через б—8 часов после завершения хирургичес-
кого вмешательства в суточной дозе 5000—15 000 ЕД
в зависимости от массы тела пациента на протяжении
5—7 дней. Самый дискуссионный вопрос— продолжи-
тельность профилактики антикоагулянтами. По мнению
авторов Консенсуса Всемирного союза ангиологов по
профилактике венозных и тромбоэмболических ослож-
нений (2006), все зависит от степени сохранения факто-
ров риска тромбозов. Понимать это можно по-разному,
но если пациент оперирован по поводу распространен-
ного рака и/или имеет метастазы, принимает химиотера-
пию, ограниченно подвижен, ранее уже имел венозные
тромбоэмболические эксцессы, то это основание для
длительной профилактики оральными антикоагулянта-
ми (варфарин) под контролем MH0.
Имплантацию кава-фильтра производили только при
наличии эмбологенного илиофеморального тромбоза,
а кавапликацию иногда и без него, но при высоком
риске и если больному предлагалась лапаротомия по
поводу опухоли. Лигирование поверхностной бедрен-
ной вены подходит к случаям ее тромбоза ниже места
слияния с глубокой бедренной веной, особенно если он
осложнен ТЭЛА. Кроссэктомия известна как средство
вторичной профилактики, но мы широко применяем ее
до развития флебита лицам с распространенным вэри-
козом большой подкожной вены на бедре и рецидивных
флебитах. Исповедуя описанный профилактический
подход с 1999 г., частота венозных тромбоэмболических
осложнений в Челябинском областном онкологическом
диспансере снизилась на 42%. Для сравнения эксперты
Всемирного союза ангиологов (2006) утверждают, что
широкая разноплановая профилактическая программа
способна нивелировать угрозу на 45%.
Сейчас 50,4% онкологических больных состо-
ят на учете более 5 лет (Чиссов В.И. и соавт., 2006).
Увеличение продолжительности жизни привело кучаще-
нию поздних лучевых повреждений, которые снижают
качество жизни наших пациентов. Постлучевая артерио-
патия (ПЛАП) — позднее осложнение лучевой терапии,
проведенной по стандартным схемам без превышения
общепринятых суммарных очагов доз (СОД) облучения.
В большинстве случаев она развивается в сроки 5 и
более лет после лучевой терапии опухолей различных
локализаций с СОД, превышающей 40 Грей. Все паци-
енты, выжившие 5 и более лет после лучевой терапии,
должны подвергаться скрининговым обследованиям
артерий (ультразвуковая допплерография и дуплексное
сканирование), соответствующим полям облучения для
выявления возможных постлучевых изменений. При
облучении полей с поверхностным расположением арте-
рий (паховые области и шея) сроки начала скрининго-
вых исследований целесообразно уменьшить до 3 лет.
Клиническая картина ПЛАП складывается из двух
групп симптомов — проявлений ишемии в бассейне
пораженной артерии и последствий постлучевых изме-
нений других органов и тканей, расположенных в пре-
делах полей облучения. Основным диагностическим
критерием ПЛАП, развивающейся у 4—5% пациентов
после лучевой терапии, служит развитие локальной
окклюзии (стеноза) в крупной артерии в пределах поля
облучения. ПЛАП может существовать как самостоя-
тельное заболевание, так и сопутствовать атеросклеро-
зу, модифицируя его течение. Несмотря на отсутствие
абсолютно специфичных признаков, морфологическая
картина постлучевого поражения имеет ряд харак-
терных особенностей. Определение тактики лечения
невозможно без оценки онкологического статуса паци-
ента, что определяет особенности обследования.
Консервативное лечение показано при наличии
любых симптомов ишемии в бассейне пораженной арте-
рии. Показаниями к оперативному лечению служит
выраженная ишемия при неэффективном консерватив-
681

Онкохирургия
ном лечении, необходимость профилактики осложне-
ний и осуществления одномоментного вмешательства
по онкологическим показаниям. Результаты лечения не
хуже таковых при лечении пациентов с атеросклеро-
тическим поражением артерий. Оперативное лечение
по поводу ПЛАП не показано, если риск ампутаций,
мозговых инсультов или других сравнимых по тяжести
осложнений меньше, чем риск смерти от осложнений
онкологического заболевания в течение года.
Выявлен ряд особенностей патогенеза ПЛАП, влияю-
щих на приемы оперативного лечения. ПЛАП возникает
в пределах поля облучения, часто в нетипичных для ате-
росклероза локализациях (рис. 3). Из этой особенности
сделаны два вывода. Во-первых, желательно примене-
ние ангиографии для уточнения локализации поражения
даже в тех ситуациях, когда при атеросклерозе можно
ограничиться ультразвуковым исследованием. Во-вто-
рых, операционный разрез может быть нетипичным —
например, при стремлении прооперировать постлучевой
стеноз общей сонной артерии из мини-доступа.
Облученные ткани обладают уменьшенной репара-
тивной способностью, пониженным местным иммуните-
том. Это приводит к повышению риска гнойных осложне-
ний, в том числе отсроченных. Риск увеличивается при
использовании синтетических протезов. У нас произо-
шли 2 отсроченных нагноения ран в паховых областях
после реконструкций аорто-подвздошного сегмента —
через неделю и 2 недели после выписки из стационара.
Последующее консервативное лечение, некрэктомии
были неэффективны, в обоих случаях в процессе лече-
ния произошел тромбоз протеза, и было выполнено
перекрестное аутовенозное бедренно-бедренное шун-
тирование, с хорошим результатом. Обе пациентки ранее
получали лучевую терапию гинекологического рака.
Фиброз тканей в зоне операции приводит к техничес-
ким трудностям при выделении сосудов. Он может быть
настолько выраженным, что приходится менять план
операции и прибегать к экстраанатомическому шунти-
рованию. Выраженность фиброза в ряде случаев можно
оценить до операции — при осмотре, а также на основе
данных ультразвукового исследования и компьютер-
ной томографии. В зоне выраженных изменений тканей
нежелательно наложение артериальных анастомозов,
т.к. репаративная способность тканей понижена.
Бляшка, закрывающая просвет артерий при ПЛАП,
имеет ряд морфологических отличий от атеросклероти-
ческой. Bee формировании значительную роль играют
процессы фиброзирования. Поэтому стенозирующий суб-
страт монолитен, плохо отделяется от адвентициальной
оболочки. Такие особенности делают эндартерэктомию
технически сложной и, скорее всего, нецелесообразной.
Любая операция при ПЛАП должна выполняться с
учетом онкологического статуса пациента. Если имеет-
ся местный рецидив опухоли в зоне стеноза или окклю-
зии артерий, это служит дополнительным показанием к
операции. При этом удаление рецидивной опухоли еди-
ным блоком с рядом расположенными сосудами будет
способствовать повышению радикальности вмешатель-
ства. Несмотря на ряд дополнительных трудностей, опе-
ративное лечение ПЛАП дает хорошие результаты.
Постлучевая венопатия реже служит показанием к
реконструктивным операциям, скорее речь идет о тра-
диционных принципах лечения посттромботического
синдрома с использованием как консервативных, так и
хирургических методов.
Подводя итог, нужно констатировать, что коорди-
нированное лечение сосудистых заболеваний и опу-
холей является объективной потребностью. Причины
просты — эти болезни поражают значительную часть
населения, сопровождаются высокой инвалидизацией
и смертностью, нередко ассоциировано присутствуют у
одного и того же пациента, требуют огромных матери-
альных затрат на диагностику и лечение.
'^feW?
^itmun
Рис. 3. Критический стеноз общей сонной артерии через
54 месяца после у-терапин по поводу рака гортани с СОД 64 Гр.
Поле деятельности ангиохирурга в онкологии будет
неуклонно расти, изменится методология, диагности-
682
сосудистого хирурга в лечении онкологических больных
ческие и лечебные средства, повысится их эффек-
тивность. Неизменной должна остаться потребность
в согласованных совместных действиях онколога и
сосудистого хирурга при оказании помощи конкретно-
му больному, страдающему одновременно от опухоли
и обусловленных ею или самостоятельных сосудистых
расстройств.
Литература
1. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирур-
гия — 2005. Болезни и врожденные аномалии системы
кровообращения. М., Издательство НЦССХ им. А.Н. Баку-
лева РАМН, 2006.
2. Балуда В.П., Балуда М.В., Тлепшуков И.К., Цыб А.Ф. Рак и
тромбоз. М., Обнинск, 2001.
3. Важенин А.В. Радиационная онкология.
Организация,
так-
тика, пути развития. М.: Издательство РАМН, 2003.
4.. Важенин А.В., Фокин А.А. Избранные вопросы онкоангиоло-
гии. М.: Издательство РАМН, 2006.
5. Клиническая ангиология. Руководство для врачей под ред.
А.В. Покровского. М.: Медицина, 2004.
6. Матякин Е.Г., Дан В.Н., Шубин А.А., Вельшер Л.З., Дудиц-
ская Т.К. Парагангиомы шеи (хемодектомы). М., Вердана,
2005.
7. Петровский Б.В. Кардиоонкология/ Грудная хирургия, 1988,
№
6,
с.
5— 10.
8. Практическая онкология: избранные лекции. Под ред. С. А. Тю-
ляндина, В.М. Моисеенко. СПб.: Издательство «Центр ТОММ»,
2004.
9. Проблемы патологии сосудов у онкологических больных.
Сб. научных трудов под ред. А.А. Фокина, А.В. Важенина.
Челябинск, «Иероглиф», 2002.
10.
Современное состояние сосудистой хирургии Урала, Сибири
и Дальнего Востока. Дифференциальная диагности-
ка опухолевых и сосудистых заболеваний. Материалы
VI межрегиональной конференции. Под ред. А.В. Пок-
ровского, В.П. Харченко. Челябинск, «Иероглиф», 2006.
11. Состояние онкологической помощи населению России
в 2005 году. Под ред. В.И. Чиссова, В.В. Старинского,
Г.В. Петровой. М., 2006.
12. Фокин А.А., Прык А.В. Реконструктивные операции на
сонных артериях без ангиографии. М., 2006.
13. Arterial surgery. Management of challenging problems. Ed.
J.S.T. Yao, W.H. Pearce. Stamford: Appleton and lange, 1996.
14. Davydov M.I., Akchurin R.S., Gerasimov S.S., Polotsky B.E.,
StilidiJ.S., Machaladze Z.A., Kononets P.V. Simultaneous oper-
ations in thoraco-abdominal oncology. Eur. J. Cardiothorac.
Surg., 2001, v. 20, «? 6, p. 1020— 1024.
15. Friedman S.G. A history of vascular surgery. Mount Kisko:
Futura Publishing Company, Inc, 1989.
16. Krupnick A.S., Kreisel D., Hope A., Bradley J., Govindan R., Mey-
ers B. Recent advances and future perspectives in the manage-
ment of lung cancer. Current Problems in Surgery, 2005, v. 42, № 8.
17. Leggon R.F., Huber T.S., Scarborough M.T. Limb salvage surgery
with vascular reconstruction. Clin. Orthop., 2001, v. 387, № 2,
p. 207—216.
18. Prevention and treatment of venous thromboembolism.
International Consensus Statement (Guidelines according to sci-
entific evidence). Int. AngioL, 2006, v. 25, № 2, p. 101—160.
19. Vascular access in the cancer patient. Ed. H.R. Alexander.
Philadelphia: 3.B. Lippincott Company, 1994.
20. Vascular surgery. Fifth Ed. R.B.Rutherford. Philadelphia,
London, Sydney, Toronto: W.B. Saunders Company, 2005.
21. Vascular trauma. Second Ed. N.M. Rich, K.L. Mattox, A. Hirsh-
berg. Philadephia: Elsevier Saunders, 2004.
683
ОСНОВНЫЕ ПРОБЛЕМЫ
ЭНТЕРАЛЬНОГО ПИТАНИЯ В ОНКОХИРУРГИИ
А.И. Салтанов
В цивилизованных странах, наряду с такими при-
оритетными проблемами онкологии, как хирургическое,
лекарственное и лучевое лечение злокачественных
опухолей, самое серьезное внимание уделяется вопро-
сам клинического питания у онкологических больных.
Примером может служить Национальная служба здо-
ровья Великобритании, которая реально контролиру-
ет вопросы питательной поддержки у онкологических
больных. Указанные проблемы широко изучаются и в
нашей стране.
В историческом аспекте нельзя не отметить значение
для развития парентерального питания в онкологии мос-
ковской школы онкоанестезиологов, так как именно при
лаборатории анестезиологии Института эксперименталь-
ной и клинической онкологии АМН СССР (ныне Российский
онкологический научный центр им. Н.Н. Блохина РАМН)
по инициативе профессора В.П. Смольникова была созда-
на первая отечественная лаборатория парентерального
питания, которую возглавил его ученик профессор А.В.
Суджян. Оба ученых поддерживали тесные контакты с
профессором Арвидом Вретлиндом, что позволило еще в
60-е годы XX века внедрить в практику и глубоко изучить
парентеральное питание с помощью жировых эмульсий и
аминокислотных смесей. Параллельно велись исследова-
ния в Ленинграде (профессор Фрид И.А. с соавт.), Обнинске
(профессора Хмелевский Я.М. и Словентантор В.Ю.)
и других городах бывшего СССР.
В наши дни можно выделить несколько школ по кли-
ническому питанию — московскую, северо-западную
(Санкт-Петербург), уральскую (Екатеринбург). Авторы —
представители этих школ — за последнее пятилетие
опубликовали немало интересных книг и содержатель-
ных монографий. Среди них работы Т.С. Поповой с соавт.
(1996), А.Л. Костюченко с соавт. (1996), Ю.Н. Лященко и
А.Б. Петухова (2001), В.М. Луфт, А.Л. Костюченко (2002).
Выпущено информативное и емкое руководство под
редакцией доктора мед. наук И.Е. Хорошилова (2000).
Опухоль и организм
Концепция «Особенности организма онкологического
больного» строилась на фундаментальных исследованиях
ученых биохимиков, среди которых наиболее близко к
проблемам питательного статуса подошли исследования
профессора B.C. Шапота. По его инициативе и при его
непосредственном участии разработаны две основные
концепции в отношении взаимодействия опухоли и орга-
низма. Он писал: «... злокачественная опухоль способна
функционировать как ловушка глюкозы в организме и
оказывать на него постоянное гипогликемическое дав-
ление вследствие огромного перепада между высокой
концентрацией глюкозы в артериальной крови и исче-
зающе малой ее концентрацией в ткани самой опухоли».
Гипогликемическое давление влечет за собой гипофунк-
цию инсулярного аппарата по механизму обратной отри-
цательной связи, включение и напряжение компенсатор-
ных механизмов организма для поддержания нормогли-
кемии — стимуляция эндогенного образования глюкозы
из аминокислот и глицерина. Другой не менее важной
концепцией, разрабатываемой школой B.C. Шапота, явля-
ется «опухоль — ловушка азота», хотя корни этой пробле-
мы, безусловно, связаны с исследованиями И.П. Мищенко
(1940), показавшего, что опухоль развивается благодаря
захвату азота из организма «опухоленосителя» за счет
катаболизма собственных белков организма.
Современные авторы подтверждают особенности, на-
иболее характерные для опухолевого организма (Cerra F.,
1992; Barton R., 1994; Takala 1, 1995; Bower J., 1997):
• пониженная толерантность к глюкозе (скрытый
диабет);
• тенденция к гипогликемии;
• истощение запасов гликогена в печени и мышцах;
• мобилизация липидов из жировых депо и мышц;
• дистрофия мышц (усиленный катаболизм и ослаб-
ленный синтез белков);
• повышенный глюконеогенез в печени и почках;
• активация системы «гипоталамус—гипофиз—над-
почечники» с гиперпродукцией глюкокортикои-
дов;
• инволюция тимуса, иммунодепрессия.
Питание и «раковая кахексия»
Кахексия с греческого переводится как «плохое
(kakos) состояние (hexis)», что не отражает в должной
мере смысла этого синдрома. По существу, кахексия —
684
Основные проблемы энтерального питания в ониохирургии
СМЕРТЬ
Поглощение
глюкозы и
аминокислот
Липолиз
Ингибирование
Липопротеинлипазы
Гипертриглицеридемия
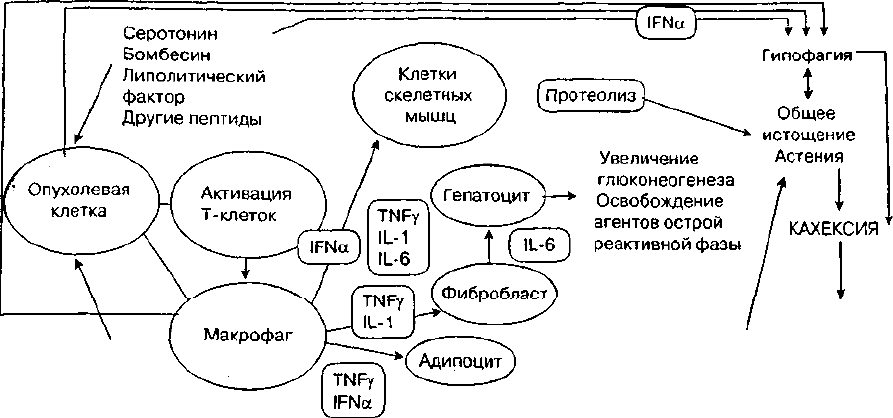
рис. 1. Возможные механизмы кахексии (по Norton J.A., Thorn А.К., 1996)
крайняя степень истощения, являющаяся результатом
ряда прогрессирующих процессов, среди которых ано-
рексия, дисфагия (гипофагия), чувство раннего насыще-
ния, потеря массы тела, астения, протекающих, как пра-
вило, на фоне нарастающей анемии и отечности тканей.
Патофизиологию кахексии (рис. 1) многие авторы
связывают с гиперметаболизмом как парадоксальной
реакцией на голодание по сравнению с физиологи-
ческой реакцией, при которой уровень метаболизма
снижается. Длительно протекающий процесс гиперме-
таболизма быстро истощает резервы, приводит к нега-
тивному энергетическому балансу и потере массы тела.
В патогенезе анорексии большую роль играют цито-
кины — фактор некроза опухолей (альфа), интерлейки-
ны 1 и 6, интерферон (гамма), которые опосредованно
влияют на центр питания в гипоталамусе, продуцируя
анорексигенные нейропептиды, в частности, корти-
котропинрилизинг-фактор, угнетающий нейропептид Y,
возбуждающий аппетит. Доказано, что многие лекарс-
твенные препараты, в том числе противоопухолевые,
а также боль и депрессия — все это поддерживает и
Усиливает анорексию.
В генезе кахексии играют роль также липолити-
ческие и протеолитические энзимы, вырабатываемые
самой опухолью. Нарушения обмена при кахексии опо-
средуются гормональными сдвигами, выражающимися
в гиперкортизолемии, гиперглюкагонемии и гипоинсу-
линемии.
Белково-энергетическая
недостаточность
у онкологических больных
Белково-энергетическая недостаточность (БЭН)
является фактором повышенного риска в период лече-
ния онкологических больных. Она может привести к
послеоперацонным осложнениям и другим нежелатель-
ным результатам, среди которых следует выделить:
• развитие ранних и поздних раневых осложнений
(недостаточность швов анастомоза, эвентрация);
• развитие инфекционных нозокомиальных ослож-
нений (пневмония, уроинфекция, синуситы и др.);
• увеличение длительности ИВЛ;
• раннее формирование синдрома полиорганной
недостаточности (ПОН);
• существенный рост медикаментозной нагрузки на
пациента;
• увеличение длительности пребывания больных в
ОРИТ и стационаре;
• увеличение затрат на лечение больного.
Схема танатогенеза при прогрессирующей БЭН
представлена на рис. 2. Недостаточность питания
(malnutrition) приводит к снижению уровня нуклеи-
новых кислот. Уменьшение цитоплазматической рибо-
нуклеиновой кислоты (РНК) ведет к снижению синтеза
белка. В результате последовательных патологических
685
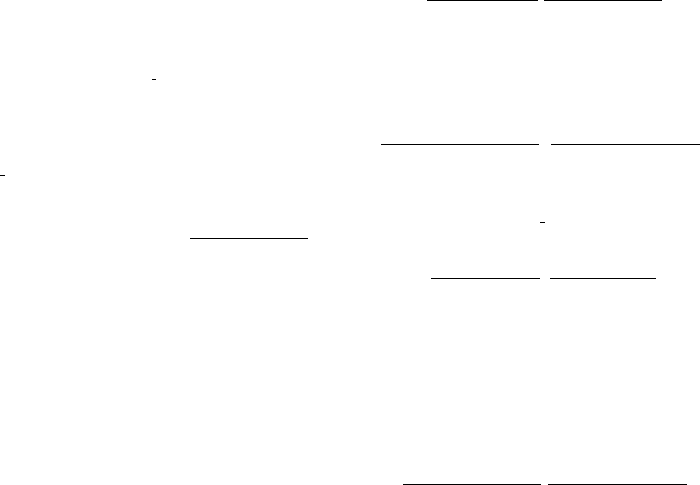
Онкохирургия
Недостаточность питания
(malnutrition)
G
С
Снижение цитоплазматической РНК
Снижение синтеза белка
I
Снижение концентрации
цитоплазматического
белка и энзимов
; i -
Жировая дегенерация печени
Атрофия поджелудочной железы
Снижение фагоцитоза
Атрофия гладких и скелетных мышц
Атрофия сердечной мышцы
Сердечная недостаточность——
Остеопорозы
Атрофия волосяных фолликул
Снижение легочного сурфактанта
) С
Снижение клеточной ДНК
j
J
Снижение общей клеточной массы,
особенно в органах с высокой
скоростью клеточной репликации
ф
С
с
Пневмония
Атрофия костного мозга
I
Анемия
Ф
D
С
Атрофия органов пищеварения
Мальабсорбция
Снижение продукции
иммунокомпетентных клеток
1
J
Увеличение восприимчивости
к инфекции
Органная недостаточность
У
с
Смерть
Рис. 2. Схема танатогенеза при прогрессирующей белково-энергетической недостаточности (Douglass H.O., 1997)
процессов снижается концентрация цитоплазматичес-
кого белка и энзимов. Нарушение синтеза и увеличение
катаболизма соматических белков приводят к атрофии
гладких и скелетных мышц, атрофии сердечной мышцы
с развитием сердечной недостаточности. Появляются
остеопорозы, атрофия волосяных фолликул. Нарушение
обмена висцеральных белков проявляется в нарастании
жировой инфильтрации печени, атрофии поджелудоч-
ной железы. Снижается синтез легочного сурфактанта,
возникают условия для развития пневмонии. Этому спо-
собствуют снижение активности фагоцитоза, атрофия
костного мозга, снижение продукции иммунокомпетен-
тных клеток. Развитие этих процессов связано со сни-
жением общей клеточной массы, особенно в органах с
высокой скоростью клеточной репликации, что опреде-
ляется уменьшением клеточной дезоксирибонуклеино-
вой кислоты (ДНК). Параллельно нарастающие процес-
сы клеточного катаболизма ведут к прогрессированию
органной, полиорганной недостаточности (ПОН) и как
следствие этого — к летальному исходу.
Одной из первых публикаций о связи послеопера-
ционной летальности с нарушениями питания больных
явилась статья Worren в 1932 г., где сообщалось, что из
500 аутопсий умерших от онкологических заболеваний
686
Основные проблемы энтерального питаний в оннохирургии
больных 22% были связаны с истощением больных.
Последующая и современная литература полностью
подтверждает эти сведения, свидетельствуя о причин-
ной связи «истощение —> иммунодефицит —> присоеди-
нение инфекции —> летальный исход».
По данным метаанализа, проведенного американс-
кими учеными в 80-х годах прошлого века, 50% онколо-
гических больных, направляемых на комплексное лече-
ние, имеют дефицит веса разной степени, а 15% — до
10% уровня до начала заболевания. При раке легкого
потеря веса также существенна (Chlebowsky et al., 1996,
Jebb et al., 1997).
Энтеральное питание в онкологии, как и в хирур-
гии, применяется издавна, однако лишь в последние
15—20 лет сформировалась современная концепция,
в соответствии с которой доказаны неоспоримые пре-
имущества энтерального пути приема пищи по сравне-
нию с парентеральным.
Энтеральное питание подразумевает введе-
ние питательных смесей через зонды, как пра-
вило — назогастральный и назоеюнальный, или
через стомы. Оно считается более физиологичным
и полезным по сравнению с парентеральным пита-
нием, так как способно не только обеспечивать пол-
ноценное питание организма, но и самой кишечной
трубки, которая в условиях длительного паренте-
рального питания подвергается ряду серьезных
патологических изменений — от функциональных
нарушений ферментативного аппарата и моторно-эва-
куаторной активности до тяжелых дистрофических
изменений слизистой оболочки. Рациональность энте-
рального питания определяется следующими эффекта-
ми (Луфт В.М. и Костюченко А.Л., 2001): 1) питательные
субстраты стимулируют рост и регенерацию клеточных
элементов слизистой оболочки за счет непосредствен-
ного поступления в нее, активируют ферментативную
активность пищеварительных соков, выработку интес-
тинальных гормонов и увеличивают мезентериальный
кровоток; 2) кишечный химус активизирует процесс
пищеварения и является профилактическим фактором
в возникновении острого гастродуоденального эрозив-
но-язвенного поражения; 3) энтеральное питание пре-
дупреждает контаминацию микрофлоры из дистальных
отделов кишечника в проксимальные и транслокацию
бактерий из кишечника в кровь.
Учитывая интегративную роль желудочно-кишечно-
го тракта (ЖКТ) в гомеостазе, становится ясной роль
энтерального питания в профилактике полиорганной
недостаточности.
Кишечная недостаточность имеет большое значение
в формировании П0Н. По данным А.Л. Костюченко с
соавт. (1996), при кишечной недостаточности разви-
вается истощение энтероцитов, меняется микрофло-
ра и возникает ишемия стенки кишки, что приводит
к чреспортальной абсорбции токсинов и микробов.
В результате этого происходит повреждение гепатоци-
тов и активируются макрофаги. Одновременно проис-
ходит лимфатическая транслокация токсинов и микро-
бов, что ведет к системным и органным нарушениям.
Причины нарушения питания
в послеоперационном периоде
Проблемы питания после операций
по поводу опухолей головы и шеи
После частичной ларингэктомии по поводу рака гор-
тани препятствием для нормального питания является
угроза аспирации. После обширных операций по поводу
удаления гипофаринкса с замещением свободным лос-
кутом из тонкого кишечника возможно ретроградное
поступление жидкости и пищи в глотку. Как ослож-
нение этих операций описывают развитие стриктуры
верхнего или нижнего анастомоза трансплантата.
После операций на ротоглотке (резекция мягкого
неба, корня языка, стенки глотки) возникают затрудне-
ния для формирования пищевого комка и его прохожде-
ния изо рта в глотку. Появляется риск аспирации, может
возникать назальная регургитация.
После вмешательств по поводу опухолей языка,
глотки, мягких тканей дна полости рта и нижней
челюсти у больных возникают серьезные ограничения
нормального питания через рот.
Резекции или экстирпация пищевода приводят
к нарушениям всасывания жиров, застою в желудке и
диарее.
Проблемы энтерального питания
при раке пищевода
При раке пищевода одним из ранних симптомов
заболевания является дисфагия. Уже на предопера-
ционном этапе рекомендуется оценить адекватность
диеты и в соответствии с результатами изменить ее
структуру. При необходимости и возможности сле-
дует перейти на энтерально-зондовое питание (ЭЗП).
В случаях непроходимости пищи показано наложение
гастростомы или полное парентеральное питание. При
стенозе пищевода и риске его окклюзии необходима
687
Оннохирургия
жидкая или полужидкая диета, регулярное промыва-
ние пищевода газированной водой. Следует избегать
употребления большого количества овощей и фруктов.
В случаях использования ЭЗП необходимо переводить
больного в положение сидя. Персонал или родственник
ки должны знать инструкцию по применению препара-
тов для зондового питания.
В послеоперационный период необходимы обогаще-
ние пищи добавками, снижение частоты приема пищи,
ограничение питьевой жидкости, стимуляция аппетита.
По показаниям назначают антациды и антирефлюксные
средства. При негерметичности анастомоза питание
следует проводить через еюностому либо переходят на
полное парентеральное питание.
Основные проблемы энтерального
питания при раке желудка
На дооперационном этапе часто наблюдаются
такие симптомы, как раннее насыщение, тошнота, рвота.
Следует оценить адекватность микро- и макронутри-
ентов, пересмотреть диету в отношении обогащения
и дополнения питания, использовать частые приемы
пищи маленькими порциями. По показаниям применяют
антиэметики.
Операции в объеме гастрэктомии выключают желу-
дочный этап пищеварения. В послеоперационный
период на первый план выступают проблемы, связан-
ные с парезом кишечника. С учетом этого во время
операции в тонком кишечнике размещают зонд для
проведения энтерально-зондового питания.
После вмешательств развивается «демпинг-син-
дром» с гипогликемией, стеаторея, нарушение вса-
сывания жирорастворимых витаминов железа, каль-
ция и витамина В
1г
. При нарушении функции тощей
кишки абсолютно показано парентеральное питание.
При развитии «демпинг-синдрома» следует избегать
гиперосмолярности применяемых питательных смесей.
Рекомендуются частые приемы пищи маленькими пор-
циями.
В случаях удаления сфинктера пищевода необхо-
дима профилактика регургитации и рефлюкса, оцен-
ка адекватности микро- и макронутриентов, положе-
ние сидя во время кормления, назначение антацидов.
Маленькая емкость оставшейся части желудка дает
симптомы раннего насыщения, что требует частых при-
емов пищи маленькими порциями.
Одной из важных проблем послеоперационного
периода после операций на желудке является так назы-
ваемый «быстрый кишечный транзит». Необходима
профилактика растяжения кишечника, препараты про-
тив диареи (Лоперамид), при стеаторее — исследо-
вание функции поджелудочной железы (ПЖ). Кроме
того, показаны углеводы, витамины, микроэлементы, а
после гастрэктомии — обязательно назначение вита-
мина В
]2
.
Стремление к раннему энтерально-зондовому
питанию (ЭЗП) можно проиллюстрировать данными,
доложенными (Гудков О.С. и Репин В.Н.) на 4-м меж-
дународном конгрессе Парентеральное и энтеральное
питание (2002). Отечественные исследователи прово-
дили ЭЗП после гастрэктомии, выполненных в плано-
вом и экстренном порядке (в связи с кровотечением)
у 156 больных раком желудка. При этом накладывали
оригинальный муфтообразный пищеводно-кишечный
анастомоз с формированием резервуара из начальных
петель тощей кишки. Во время операции устанав-
ливали ирригатор в отводящую петлю ниже межки-
шечного соустья. Введение в ирригатор начинали к
концу первых суток послеоперационного периода.
Первоначально вводили изотонические кристалло-
идные растворы, добавляя со 2—3-х суток смеси для
детского питания на молочной или соевой основе и
на основе натуральных продуктов (бульон, компот,
кисели). В последние годы применяли поликомло-
нентную смесь «Нутризон». Трансфузионную терапию
полностью отменяли с 3-х суток послеоперационного
периода. Энтеральное зондовое питание продолжали
до б—7 суток, постепенно переходя на естественное
кормление. У оперированных больных не отмечено
снижение уровня белка крови ниже минимального
уровня, не было зарегистрировано критической ане-
мии, требующей введения эритромассы. Потеря массы
тела составляла до 5—7 кг от дооперационного уров-
ня. ЭЗП способствовало восстановлению перисталь-
тики тонкой кишки и сохраняло ее всасывательную
функцию, позволяло более эффективно компенсиро-
вать энергетические затраты организма, сохраняло
иммунный статус больных.
Дуоденальная резекция ведет к дефициту панкре-
атических ферментов и желчи. Нарушается абсорбция
жира, снижается эффективность переваривания и вса-
сывания. В результате резекции тонкого кишечника
нередко возникает синдром «короткой кишки», при
котором отмечается нарушение абсорбции жирных кис-
лот и витамина В
12
.
После наложения тонко-толстокишечных ана-
стомозов развивается синдром «выключения слепой
кишки», проявляющийся в диарее, стеаторее и анеми-
зации.
Панкреатэктомия ведет к экскреторной и инкре-
торной недостаточности поджелудочной железы.
688

Основные проблемы знтерального питания в оннохирургии
Обструкция кишечника
По опубликованным данным, обструкция кишечника
опухолью происходит у 5—51% больных раком яичника
и 10—28% больных с гастроинтестинальным раком.
Возможные причины:
• адгезивные процессы;
• компрессия кишечника извне (опухолью);
• дисфункция моторики;
• тяжелые запоры.
Синдром «короткой тонкой кишки»
Его проявления зависят от локализации оператив-
ного вмешательства на тонком кишечнике. Так, после
проксимальных резекций двенадцатиперстной и/или
начальных отделов тощей кишки (Хорошилов И.Е., 2000)
происходит ускоренное опорожнение желудка без
нарушения транзита пищи по кишечнику. Диарейный
синдром не выражен. Постепенно снижается масса
тела, возникает дефицит железа, фолиевой к-ты, каль-
ция, магния, водорастворимых и жирорастворимых ви-
таминов.
После дистальных резекций (конечные отделы
тощей кишки, подвздошная кишка, илеоцекальный угол)
нарушается моторно-эвакуаторная функция кишечника,
ускоряется транзит кишечного химуса, что приводит к
выраженной диарее.
После ограниченной резекции подвздошной кишки
(до 100 см) происходит нарушение абсорбции желч-
ных кислот — «желчная диарея». Обширная резекция
(более 100 см) ведет к абсолютной недостаточности
желчных кислот, проявляющейся в виде стеатореи.
Побочное действие
химиотерапии
на питательный статус
Современная полихимиотерапия (ПХТ) в онкологии
проводится так называемыми «жесткими курсами».
Противоопухолевые препараты вызывают побочные
эффекты, оказывающие отрицательное воздействие на
состояние питания онкологических больных (табл. 1).
К ним относятся: тошнота, рвота, дисгезия вплоть до
отвращения к пище и анорексии. Нередко возника-
ют мальабсорбция, запоры, диарея. Ряд препаратов
вызывает мукозиты. Особенно упорно протекает стома-
тит. Нарушения развиваются на фоне цитотоксических
эффектов полихимиотерапии — лейко-, тромбоцитопе-
нии и анемии.
В период химио-лучевой терапии рака пищевода
частой угрозой являются мукозиты ротовой полости
или пищевода, в связи с чем необходим регулярный
уход за полостью рта. Показана гомогенная нераздра-
жающая структура пищи.
ЭЗП показано в тех случаях, когда естественное
питание становится неадекватным.
Таблица 1. Токсичность хнмиоирепаратон
Хнмиопрепарат
Преимущественная
токсичность *
Алриамицим
Карлио-11ито-Мук
Блеомицин
Пульмо-Мук-Диар
Винбластин
Цито-Мук-Диар
Винкристин
Нейро-Гепа-Цито-Нефро-Кардио
Дактиномнцин
Цито-Мук-Днар-Гепа
Ифосфамид
Цито-Нефро-Нейро-Мук-Диар-Гепа
Метотрсксат
Цито-Мук-Диар-Гепа-Кожа
Цисплатин
Нсфро-Цито-Мук'Гепа-Нейро
Сокращения: Карлио — кардиотоксичность; Цито — цито-
токсичность; Мук — мукозиты; Пульмо — острые повреж-
дения легких; Диар — диарея; Нейро — нейротоксичность;
Гепа — гепатотоксичность; Нефро — нефротокеичность;
Кожа — кожные проявления токсичности.
Побочные эффекты
лучевой терапии
Специфические побочные эффекты лучевой терапии
на питательный статус онкологических больных зави-
сят от области облучения, длительности экспозиции и
тотальной (суммарной) дозы.
Лучевая терапия при опухолях головы и шеи доста-
точно распространена. Следует знать локализацию
опухолей головы, при которых назначается лучевая
терапия: ротовая полость, губы, язык, верхняя и нижняя
челюсти, ротоглотка, мягкое небо, носоглотка, орбита.
Опухоли шеи, подвергающиеся лучевому лечению, лока-
лизуются в гортаноглотке, гортани и шейном отделе
пищевода.
При облучении области головы и шеи появляется
ксеростомия («сухой рот»), дисфагия, боль и нарушения
акта глотания, анорексия, мукозиты, кариес, гипогезия и
другие нарушения вкуса.
Лучевая терапия области груди может вызвать дис-
фагию, эзофагит, диспепсию, тошноту и рвоту.
Облучение области живота и газа также вызывает
тошноту и рвоту, диарею, анорексию. Часто описывают
лучевой энтерит, мальабсорбцию, обструкцию кишечни-
ка, колит, формирование свища.
функционально РТ может приводить к нарушению:
689
Онкохирургия
• моторики кишечника;
• снижению абсорбции желчи, электролитов и лак-
тозы;
• транслокации бактерий толстого кишечника в тон-
кий, что также вызывает мальабсорбцию.
Гастроинтестинальные побочные эффекты тазовой
радиотерапии (РТ) могут наблюдаться как при кратко-
временной, так и длительной лучевой терапии.
При кратковременной лучевой терапии наблюда-
ются тошнота и рвота, диарея, энтерит, проктит, спазм
тонкого кишечника, мальабсорбция, формирование
свища. При длительной лучевой терапии развивается
недостаточность тонкого кишечника, мальабсорбция,
энтерит, приступообразный стул, колит, недержание
кала, проктит, изъязвление и абсцедирование слизис-
той, стриктура и фиброз, обструкция и некроз, форми-
рование свища.
Особое место отводят острому лучевому (радиаци-
онному) энтериту, который может развиться в течение
облучения и через б—8 недель после него.
Хронический радиационный энтерит может проте-
кать годами после лучевой терапии. Симптомы: частые,
непредсказуемые позывы на стул, недержание кала
ставят под угрозу качество жизни. Пациенты могут не
связывать эти явления с перенесенной лучевой тера-
пией, однако врачу необходимо при сборе анамнеза
учесть этот немаловажный факт.
При энтеритах лучевого происхождения показана
без- или низкошлаковая диета, обезжиренная пища,
низкое содержание или отсутствие лактозы. Элементная
диета может стать достаточной профилактической
мерой в отношении дальнейших нарушений функции
кишечника. При хроническом энтерите следует исполь-
зовать пищу с малым содержанием волокон, жира,
лактозы. В наиболее серьезных случаях следует вести
пациента как при синдроме короткой кишки.
Помимо проблем нутритивной поддержки при луче-
вом энтерите показана симптоматическая терапия.
Так, при диарее эффективен лоперамид (Имодиум) и
Lactobacillus acidophilus. При тошноте и рвоте хоро-
ший эффект достигается при применении антиэметиков
(Ондансетрон, Трописетрон, Гранисетрон).
Факторы, предрасполагающие к возникновению
побочных эффектов РТ:
• предшествующая брюшная/тазовая хирургия;
• расстройства микроциркуляции, в том числе диа-
бет II типа и/или высокое АД;
• артериальная гипертония;
• гастроинтестинальные сопутствующие заболева-
ния, включая болезнь Крона, дивертикулы;
• воспалительные процессы области таза.
Оценка питательного статуса
и эффективности энтерального
питания
Рекомендации в отношении оценки питательного
(трофологического) статуса приводятся практически во
всех монографиях и руководствах, вышедших в послед-
ние годы в нашей стране и за рубежом. Мы представим
наиболее простые и эффективные методики, основан-
ные на антропометрическом и лабораторном исследо-
вании. Данные отражены в таблицах 2—4.
ш Анамнез:
— динамика массы тела, предшествующая ос-
мотру;
— типичный пищевой рацион;
— употребление алкоголя;
— социально-экономическое и семейное положе-
ние;
— анорексия, рвота, диарея;
— менструация, беременность, лактация;
— применение лекарств, отрицательно влияющих
на аппетит и пищеварение.
• Физикальные данные:
— кожа — бледность, чешуйчатый дерматит,
ксероз, гиперкератоз, пеллагрозный дерсатит,
петехии, экхимозы, перифолликулярные крово-
излияния;
— волосы — диспигментация, истончение, вы-
прямление, ослабление корней волос;
— голова — исхудание лица, увеличение около-
ушных желез;
— глаза — бляшки Бито, ангулярное воспаление
век, ксероз конъюнктивы и склеры, кератома-
ляция, васкуляризация роговицы;
— полость рта — хейлоз, ангулярный стоматит,
глоссит, атрофия сосочков языка, изъязвление
языка, разрыхление десен;
— сердце — кардиомегалия, признаки застойной
сердечной недостаточности;
— брюшная полость — гепатомегалия;
— конечности — снижение мышечной массы,
отеки, койлонихия;
— неврологический статус — слабость, раздра-
жительность, болезненность икр, утрата глубо-
ких сухожильных рефлексов.
• Функциональные показатели:
— работоспособность;
— адаптация зрения к темноте, острота вкуса;
— ломкость капилляров;
— либидо.
690
