Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.


17
вием в них сопряженной кислотно-основной пары. Величину буферного дей-
ствия характеризуют буферной емкостью β. Она оценивается как количество
сильного основания (щелочи), которое необходимо добавить к раствору для
изменения его рН на единицу:
Простейшие широко распространенные в лабораторной химической прак-
тике буферные растворы включают в себя, как правило, компоненты слабых
минеральных или органических кислот (кислота и соль этой кислоты, соли
многоосновых кислот различной степени замещения и т.д.).
Буферные смеси применяемые для биохимических исследований
должны удовлетворять следующим требованиям:
¾ обладать достаточной буферной емкостью;
¾ обладать достаточной степенью чистоты;
¾ хорошо растворятся в воде и не проникать через биологические мем-
браны;
¾ быть устойчивыми к действию ферментов;
¾ не оказывать токсического и ингибирующего действия;
¾ не поглощать свет в видимой и УФ-областях.
Механизм действия буферных смесей.
рН растворов кислот и оснований
Рассмотрим самый общий случай. Кислота (HA), отщепляя при диссо-
циации протон, переходит в сопряженное основание (А
-
):
HA
A
-
H
+
+
Пара НА ⇔ А
-
представляет собой таким образом сопряженную пару:
кислота - основание.
Для одноосновных сильных кислот (сильных электролитов) в разбав-
ленных растворах концентрацию ионов водорода можно принять равной ис

18
ходной аналитической концентрации кислоты (С
k
). Соответственно рН рас-
творов сильных кислот выражают как:
рН = -lgC
k
а рН растворов сильных оснований как:
рН = 14 - lgC
k
Слабая кислота в растворе диисоциирует не полностью (частично).
Константа равновесия процесса диссоциации в соответствии с законом дей-
ствия масс выразится в этом случае следующим образом:
Ka
AH
HA
=
•
−+
[][ ]
[]
Условие общей электронейтральности раствора можно записать так:
[A
-
] + [HO
-
] = [H
+
]
В водных растворах обычно выполняется неравенство:
[HO
-
]<<[A
-
]
т.е. условие общей электронейтральности можно выразить следующим обра-
зом:
[A
-
] ≅ [H
+
]
С учетом последнего, выражение для К
а
примет вид:

19
K
H
HA
a
=
+
[]
[]
2
Здесь [HA] есть, как и везде выше, не аналитическая концентрация ки-
слоты, а ее равновесная концентрация. Она естественно меньше исходной
концентрации С, поскольку кислота частично продиссоциировала на ионы.
Количество распавшейся на ионы кислоты определится как:
[HA] = C
k
- [H
+
]
Тогда, для К
а
получим:
][H
2
][H
+
−
+
=
k
C
K
a
Решив последнее уравнение относительно [H
+
], будем иметь:
+±−=
+
k
C
a
K
a
K
a
K 4
2
2
1
][H
Для слабых кислот справедливо неравенство:
C
k
>> [H
+
]
и для K
a
можно ограничиться приближенным и менее громоздким выражени-
ем:
K
a
= [H
+
]
2
/C
k
Откуда:
k
C
a
K=
+
][H
20
Или:
pH = (pK
a
- lgC
k
)/2
Cоответственно, для слабодиссоциирующих оснований:
pH = (14 + pK
a
+ lgC)/2
где рК
а
-константа диссоциации сопряженной к основанию кислоты.
рН растворов сильных кислот в присутствии
сильных оснований
Величина рН таких растворов рассчитывается по той же, примерно,
схеме, что и выше. Отличие только в том, что условие электронейтральности
раствора нужно дополнить концентрацией катиона сильного основания (М
+
):
[M
+
] + [H
+
] = [A
-
] + [OH
-
] ≅ [A
-
],
Поскольку в применяемых на практике водных растворах очень часто вы-
полняется неравенство:
[A
-
] >> [HO
-
],
Для сильного основания допустимо приближение:
[M
+
] ≅ [MOH] ≅ C
o
где С
о
- аналитическая (исходная) концентрация сильного основания.
С учетом принятых допущений, для К
а
будем иметь:

21
K
a
HA
HA
HH M
C
k
C
o
H
=
+
=
++
+
+
−−
+
−
[][]
[]
[][ ]
[]
В данном случае, для нахождения равновесной концентрации кислоты [HA],
из ее аналитической концентрации вычитаются концентрации ионов водоро-
да, образовавшихся в результате диссоциации кислоты, и аналитическая кон-
центрация щелочи. Она уменьшает количество кислоты за счет реакции ней-
трализации.
Приближения:
C
k
>> [H
+
] и C
o
>> [H
+
]
остаются в силе. Тогда
o
C
k
C
o
C
o
C
k
C
a
K
−
+
=
−
++
=
][H
]][M[H
После логарифмирования, получим:
)(lgplgppH еравновесны
кислоты
С
основания
C
a
K
o
C
k
C
o
C
a
K +=
−
+=
Это уравнение называется уравнением Гендерсона-Хассельбальха. Из него
следует, что рК
а
есть величина рН, при котором половина молекул кислоты в
растворе находится в диссоциированном состоянии.
Экспериментально, величину рК
а
можно легко определить методом по-
тенциометрического титрования, результат которого выражают в виде зави
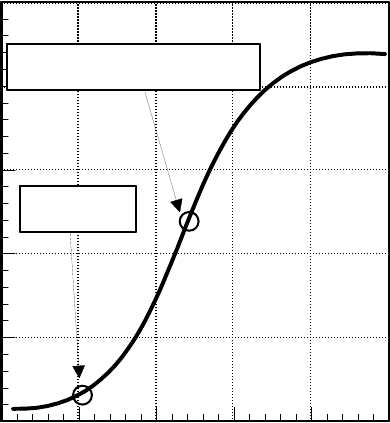
22
симости рН среды от количества введенных в раствор эквивалентов НО
-
-
ионов (см.рис. ниже)
Первая точка перегиба (в
нижней части кривой) и есть
точка, в которой рН = рКа. Из
рисунка видно, что в окрестно-
сти этой точки добавление ще-
лочи к раствору незначительно
изменяет величину рН, т.е. на-
блюдается буферный эффект.
Таким образом, буферная ем-
кость раствора максимальна при
значении рН = рКа.
Рассмотрим теперь на конкретном примере, как «работает» буферная
система. Пусть мы имеем в растворе сопряженную кислотно-основную пару:
Н
2
РО
4
-
/НРО
4
2-
. При добавлении к такому раствору ионов Н
+
они будут связы-
ваться акцептором протонов (сопряженным основанием) - НРО
4
2-
, что приве-
дет к уменьшению величины отношения: Н
2
РО
4
-
/НРО
4
2-
. И наоборот, при
введении ионов НО
-
это отношение будет увеличиваться, поскольку Н
2
РО
4
-
будет выступать донором протонов для связывания НО
-
в молекулы воды.
Если исходная буферная смесь содержит кислоту и сопряженное ей основа-
ние в эквимолярных количествах, то рН раствора = рК
а
для данной пары (см.
уравнение Гендерсона-Хассельбальха). И для того, чтобы рН изменилось на
1 необходимо, чтобы отношение Н
2
РО
4
-
/НРО
4
2-
изменилось (уменьшилось,
увеличилось) в 10 раз. Много это или мало?
Пусть мы имеем эквимолярную смесь Н
2
РО
4
-
/НРО
4
2-
с концентрацией
обоих компонентов по 0.1 М. Если ввести в нее 0.01 М ионов НО
-
, то
lg([HPO
4
2-
]/[H
2
PO
4
-
]) (а соответственно и рН раствора) увеличиться примерно
Количество эквивалентов ОН
pH
pH = pKa
Точка нейтрализации

23
на 0.05 единицы. В то же время, рН 0.01 М раствора щелочи = 12, т.е. при
растворении 0.01 М щелочи просто в воде рН полученного раствора возрас-
тет на 5 единиц (рН = 12 - 7).
Эффективность буферной системы, т.е. способность сохранять величи-
ну рН раствора максимальна при эквимолярных соотношениях кислота-
основание. Принято считать, что раствор может выполнять буферные функ-
ции в области: lg([A
-
]/[HA]) = ± 1.
В клетках, и организме в целом, физиологические значения рН под-
держиваются аминокислотами, нуклеотидами, белками, нуклеиновыми ки-
слотами, липидами и рядом других биомолекул, которые способны сущест-
вовать в сопряженных кислотно-основных формах.
1.1.5.2 Кислотно-основные свойства аминокислот
В соответствии с принципом кислотно-основного равновесия и в зави-
симости от рН среды α-карбоксильные и α-аминогруппы аминокислот нахо-
дятся в следующих взаимопревращаемых формах:
COOH
NH
3
+
COO
-
NH
3
+
COO
-
NH
2
Состояние с группами -СOOH и -NH
3
+
группами - полностью протони-
рованная форма аминокислоты, которая по Бренстеду является двухосновой,
т.е. способна отдать два протона. Диссоциация двухосновной кислоты идет в
две стадии если рК
а
протоногенных групп различны. Для большинства ами-
нокислот рК
а1
(СООН) находится в районе 2, а рК
а2
(NH
3
+
) около 9 -10. Для
глицина, например, процесс диссоциации выражается следующим равнове-
сием:

24
HOOC C
H
NH
3
+
H
H
+
H
+
-
OOC
C
H
NH
3
+
H
H
+
H
+
-
OOC
H
NH
2
H
катионная форма цвиттер-ионная аионная форма
суммарный заряд форма. Изоэлек- суммарный заряд
«+1» трическая точка «-1»
Состояние с зарядом «+1» (-СООН/-NH
3
+
) реализуется в сильнокислых
(рН ≤ 1) средах. В сильноосновных средах (рН ≥ 11) молекула аминокислоты
несет на себе отрицательный заряд «-1» (состояние -COO
-
/NH
2
). При рН, со-
ответствующем изоэлектрической точке положительный заряд на амино-
группе аминокислоты компенсируется отрицательным зарядом на карбок-
сильной группе и молекула в целом имеет суммарный нулевой заряд. Облас-
ти существования раз-
личных форм для кон-
кретных аминокислот
определяют по данным
потенциометрического
титрования. Типичная
кривая потенциометри-
ческого титрования
аминокислоты не со-
держащей кислых групп
в радикале R, приведена
на рис.1.1
Рис.1.1
Кривая потенциометрического титрования двухосновной кислоты (амино-
кислоты). pK(NH
3
), pK(COOH) - pK
a
диссоциации амино- и карбоксигрупп со-
ответственно; pI - изоэлектрическая точка. В скобках приведены значения
суммарного заряда (Z) на молекуле аминокислоты
Эквиваленты НО
-
→
pH
→
p
K(COOH)
(+1/2)
p
I
(0)
p
K(NH3)
(-1/2)
Z = +1
Z = -1

25
Аминокислоты, в которых остаток R не содержит кислотно-основных
ионогенных групп, называют нейтральными. В ряду 20-ти белковых их 13.
Величина рН, при которой молекула аминокислоты имеет суммарный ней-
тральный заряд называется изоэлектрической точкой (рН
I
или рI). Численно,
величина рI равна среднему арифметическому величин рК
а1
и рК
а2.
pI = 1/2(pK
a1
+ pK
a2
)
В любой другой точке кривой потенциометрического титрования (фак-
тически при любом другом значении рН кроме рН = рI) молекула аминокис-
лоты несет на себе заряд той или иной полярности. Величина и знак этого за-
ряда определяются относительными концентрациями частиц с зарядом «+1»
и «-1». Например при рН = рК
а1
в растворе будет находиться 50% СОО
-
/NH
3
+
(заряд «0») и 50% COOH/NH
3
+
(заряд «+1»). Суммарный заряд для этой точки
- +1/2. В т. рН = рК
а2
- -1/2. Суммарный заряд при любом другом значении
рН можно оценить по уравнению Гендерсона - Хассельбальха.
В общем случае, суммарный заряд молекулы аминокислоты определя-
ется не только α-амино- и α-карбоксильной группами, но и наличием ионо-
генных групп в остатке R. Аминокислоты с такими остатками приведены в
табл. 1.2.
Таблица 1.2
Аминокислоты с ионогенными группами в R-остатке
Аминокислота Диссоциирующая группа в R-остатке рК
а
Глутаминовая кисло-
та.
-СН
2
СН
2
СООН → -СН
2
СН
2
СОО
-
+ Н
+
3.9
Аспарагиновая кисо-
лота
-СН
2
СООН → -СН
2
СОО
-
+ Н
+
4.3
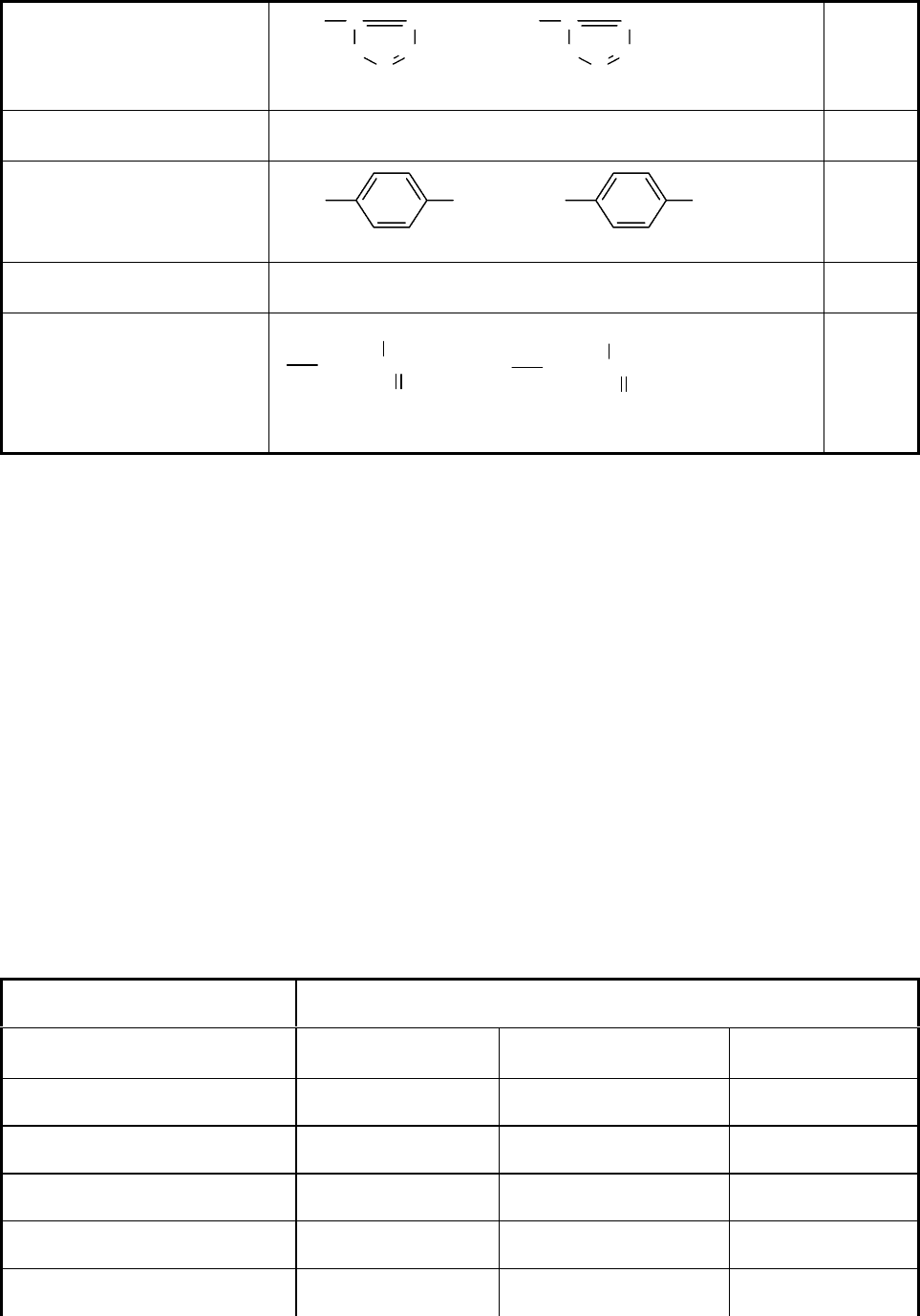
26
Гистидин
N
+
H
C C
NH
C
CH
2
→
N
+
C C
NH
C
CH
2
+ Н
+
6.0
Цистеин
-СН
2
SH → -CH
2
S
-
+ H
+
8.3
Терозин
CH
2
OH
→
CH
2
O
-
+ Н
+
9.1
Лизин
-(СH
2
)
4
N
+
H
3
→ -(СH
2
)
4
NH
2
+ H
+
10.5
Аргинин
(CH
2
)
3
NCNH
2
N
+
H
2
H
→
(CH
2
)
3
NCNH
2
NH
H
+ Н
+
12.5
Значения pK
a
для всех кислотно-основных ионогенных групп белковых
аминокислот приведены в табл. 1.3. Знание этих величин позволяет рассчи-
тывать значения изоэлектрических точек для отдельных аминокислот и уста-
навливать знак заряда, который несет молекула при заданном значении рН
среды. Это весьма полезная информации, которая позволяет оптимизировать
условия проведения некоторых экспериментов. Например, задание величины
рН среды для наилучшего разделения смесей аминокислот методом электро-
фореза или изоэлектрофокусировки, ионообменной хроматографии и т.д.
Таблица 1.3
Величины рК
а
ионогенных групп белковых аминокислот
Аминокислота рК
а
ионгенных групп
α-СООН α-NH
3
+
RH или RH
+
Глицин 2.34 9.60
Аланин 2.34 9.69
Валин 2.32 9.62
Лейцин 2.36 9.68
Изолейцин 2.36 9.68
