Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.


27
Продолжение таблицы 1.3
Серин 2.21 9.15
Треонин 2.63 10.43
Метионин 2.28 9.21
Фенилаланин 1.83 9.13
Триптофан 2.38 9.39
Аспарагин 2.02 8.80
Глутамин 2.17 9.13
Пролин 1.99 10.6
Аспарагиновая кислота 2.09 9.82 3.86
*
Глутаминовая кислота 2.19 9.67 4.25
*
Гистидин 1.82 9.17 6.0
*
Цистеин 1.71 10.78 8.33
*
Тирозин 2.20 10.07 9.11
*
Лизин 2.18 8.95 10.53
Аргинин 2.17 9.04 12.48
*-
В этих аминокислотах группа R ионизируется раньше, чем α-NH
3
+
.
Величины рК
а
для R-групп в глутаминовой и аспарагиновой аминокис-
лотах (4,25 и 3,86 соответственно, см. табл. 1.3.) свидетельствуют о том, что
эти группы являются кислотными. Эти две аминокислоты относят, поэтому,
к кислым. R-группы лизина и аргинина имеют основный характер. Их отно-
сят к основным. Между этими явно основными и кислыми аминокислотами
расположены гистидин, цистеин и тирозин, рК
а
которых близко к 7 и не дает
веских оснований для отнесения их к кислым или основным.
Для нахождения изоэлектрической точки три- и более основных ами-
нокислот вычисляют среднее арифметическое двух последовательных значе-
ний рК
а
.
, между которыми расположена точка pI. Полезно усвоить и помнить,
что pI численно равна значению рН среды, при котором количества положи

28
тельных и отрицательных зарядов на молекуле равны по абсолютной вели-
чине, т.е. молекула имеет суммарный нулевой заряд. Это позволяет, рассчи-
тав значение pI для конкретной аминокислоты, соотнести его с легко изме-
ряемой экспериментально величиной рН раствора и оценить каких зарядов
(положительных или отрицательных) на молекуле при этом значении рН
больше. При этом, можно без особых опасений пользоваться следующим
простым правилом: при рН > pI - молекула приобретает избыточный отрица-
тельный, а при рH < pI - избыточный положительный заряд. В силу этого,
при наложении внешнего электрического поля (при электрофорезе, напри-
мер), молекула в среде с рН > pI будет двигаться в направлении положитель-
но заряженного электрода (анода), а при рH < pI - отрицательно заряженного
электрода (катода). Этим правилом можно пользоваться для аминокислот и
сравнительно небольших пептидов. С увеличением числа аминокислотных
остатков в пептидах погрешность расчета pI через pK
a
отдельных ионоген-
ных групп быстро возрастает и делает описанный выше способ оценки знака
суммарного заряда малоэффективным или неприемлемым.
Ниже, в качестве примера, приведены расчеты величин pI для некото-
рых двух- и трехосновных белковых α-аминокислот, которые вычислены с
использованием приведенных в табл. 1.3 значений pK
a
ионогенных групп
этих аминокислот
Аланина - нейтральная аминокислота:
рI =
234 969
2
..+
= 6.02
Аспарагиновая кислота - кислая аминокислота:
98.2
2
86.309.2
p =
+
=I

29
Лизин - основная аминокислота:
pI =
+
=
895 1053
2
974
..
.
Чтобы не ошибиться в выборе пары величин pK
a
, которые необходимо
использовать для расчета значения pI для более чем двухосновной аминокис-
лоты или пептида, можно просто выписать последовательность постадийной
ионизации всех входящих в состав молекулы ионогенных групп. Выстраивая
последовательность стадий диссоциации аминокислоты или пептида нужно
пользоваться величинами pK
a
ионогенных групп, выстраивая различные
формы в ряд по возрастанию pK
a
, начиная с полностью протонированной (с
наибольшим по величине положительным зарядом). Цвиттер-ионная (изо-
электрическая) форма будет всегда находится между состояниями с зарядами
(+1) и (-1). Все сказанное выше наглядно иллюстрируют приведенные ниже
схемы для трехосновных (кислой и основной) аминокислот.
HOOCCH
2
CHCOOH
NH
3
+
HOOCCH
2
CHCOO
-
NH
3
+
-
OOCCH
2
CHCOO
-
NH
3
+
-
OOCCH
2
CHCOO
-
NH
2
+1
0
-1
-2
pKa1 = 2.1
pKa2 = 3.9
pKa3 = 9.8
H
3
N
+
(CH
2
)
4
CHCOOH
NH
3
+
H
3
N
+
(CH
2
)
4
CHCOO
-
NH
3
+
H
3
N
+
(CH
2
)
4
CHCOO
-
NH
2
H
2
N(CH
2
)
4
CHCOO
-
NH
2
+2
+1
0
-1
pKa1=2.2
pKa2=9.0
pKa3=10.5
Стадии ионизации
аспарагиновой к-ты
Стадии ионизации
лизина
p
I
p
I
pI = 1/2(2,1 + 3,9)=3 pI = 1/2(9,0 + 10,5)=9,75

30
1.1.5.3 Буферные системы крови
Уникальным свойством кровеносной системы является очень стабиль-
ная величина рН (7.37-7.44). Средняя величина - 7.40. Венозная кровь имеет
рН=7.38, артериальная 7.42. Поддержание постоянной величины рН крови
обеспечивают, в основном, четыре сопряженных кислотно-основных пары:
¾ H
2
CO
3
- HCO
3
-
, бикарбонатная
¾ H
2
PO
4
- - HPO
4
2-
, фосфатная
¾ гемоглобиновая,
¾ белковая
Бикарбонатная буферная система является наиболее управляемой
буферной системой внеклеточной жидкости и крови. На ее долю приходится
около 10% всей буферной емкости крови. Сопряженная кислотно-основная
пара:
H
2
CO
3
-
H
+
HCO
3
-
Кислота Основание
+
Фосфатная буферная система составляет только 1% буферной емко-
сти крови. Она является одной из основных в тканях. Поддерживается парой:
Н
2
PO
4
-
- донор протонов (кислота), HPO
4
2-
- акцептор протонов (основание).
Способна поддерживать рН в интервале 6,1 - 7,7.
Гемоглобиновая буферная система является основной. На ее долю
приходится 75% всей буферной емкости крови. Буферные свойства обуслов-
лены двумя формами гемоглобина: оксигемоглобина HHbO
2
c pKa = 6,62 и
дезоксигемоглобина HHb с рКа = 8,18. При физиологических значениях рН
для HHbO
2
преобладает основная форма HbO
2
-
, Для дезоксигемоглобина -
кислая HHb:
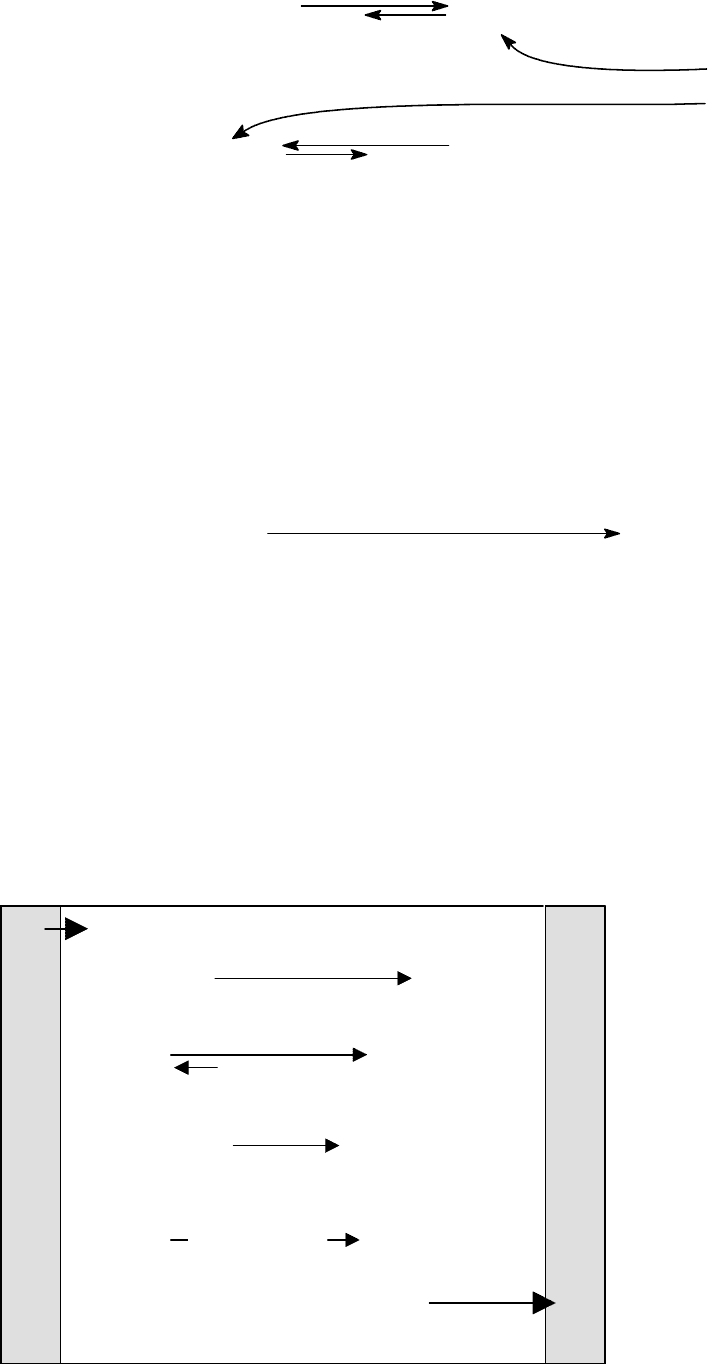
31
Механизм действия гемоглобиновой буферной системы состоит в сле-
дующем.
¾ При понижении рН эффективность связывания кислорода гемоглобином
существенно понижается (эффект Бора) и оксигемоглобин превращается в
дезоксигемоглобин:
HHbO
2
HHb
Повышение [H+]
Способствует распаду HHbO
2
+
O
2
¾ СО
2
в эритроцитах эффективно превращается в Н
2
СО
3
под действием
Zn
2+
-зависимого фермента карбонатдегидратазы (карбоангидразы). При
физиологической величине рН=7.4 Н
2
СО
3
, имея рКа = 6.35, диссоциирует
практически нацело (на 90% и более), что увеличивает [H
+
].
¾ Кислотно-основное равновесие для дезоксигемоглобина смещено в сто-
рону HbO
2
-
, что обеспе-
чивает связывание про-
тонов.
Одновременное протека-
ние всех этих процессов
приводит к устойчивому
состоянию равновесия и
поддерживает постоян-
ную квазистационарную
концентрацию ионов Н
+
.
HHbO
2
-
HbO
2
-
H
+
+
+
H
+
Hb
-
HHb
П
ри физиологических значениях рН = 7,4 преобладает:
CO
2
+H
2
O
H
2
CO
3
Карбоангидраза
H
2
CO
3
H+ + (HCO
3
)-
H+ + (HbO
2
)-
HHbO
2
HHbO
2
HHb + O
2
O
2
CO
2
Ткани, участвующие в процессе дыхания
Ткани, участвующие в процессе дыхания
Эффект Бора
32
Схематически, все сказанное иллюстрирует рисунок.
Связывание кислорода с гемоглобином изменяет определенным обра-
зом структуру белка, что вызывает, в свою очередь, изменение его активно-
сти. Этот, чрезвычайно важный, принцип регуляции активности белков весь-
ма распространен в клетках.
1.1.6 Физические и химические свойства аминокислот
Физические свойства аминокислот
Все белковые аминокислоты, которые входят в состав белков, находят-
ся при нормальных условиях (Т=298К, Р=1атм) в твердом состоянии. При
плавлении они ведут себя как аморфные вещества, т.е. не имеют четко обо-
значенных точек плавления.
Растворимость аминокислот в воде сильно варьирует. Наименее рас-
творимы цистеин и тирозин, наиболее -пролин и оксипролин. Все аминокис-
лоты хорошо растворяются в разбавленных растворах кислот и щелочей и
практически не растворимы в абсолютном спирте и эфире.
Реакции аминокислот
В целом, количество реакций, в которые могут вступать аминокислоты
как органические соединения весьма велико. Поэтому мы рассмотрим только
те из них, которые так или иначе связаны с биохимической направленностью
некоторых реакций или используются в лабораторных исследованиях амино-
кислот, т.е. только характерные реакции по их функциональным группам: α-
карбоксильной, α-аминогруппе, R-группе боковой цепи.
33
1.1.6.1 Реакции по
α
-карбоксильной группе
Наиболее характерной реакцией по α-карбоксильной группе является
реакция этерификации метиловым или этиловым спиртами. Реакция протека-
ет при нагревании в среде абсолютного спирта в присутствии сухого HCl
(лучше тионилхлорида - SOCl
2
) как катализаторов:
R-CHNH
2
-COOH + ROH → R-CHNH
3
+
-COOR • Cl
-
+ H
2
O
Эфиры аминокислот являются исходными веществами для синтеза пептидов.
Склонны к гидролизу, особенно в щелочной среде.
В реакции этерификации образуются, как правило, соль эфира амино-
кислоты. Сложные эфиры выделяются из солей обработкой при низких тем-
пературах щелочью:
[NH
3
+
CHR
O
OCH
3
]Cl
-
NH
2
OCH
3
O
CHR
+KOH
-KCl; H2O
Образовавшиеся сложные эфиры аминокислот экстрагируют этиловым эфи-
ром. Последний отгоняют и дважды перегоняют эфиры аминокислот при по-
ниженном давлении (пониженной т.кип.). Такой прием использовал впервые
Фишер для разделения аминокислот в белковых гидролизатах.
При обработке эфиров аминокислот безводным аммиаком образуются
амиды:
NH
2
RCH COOR NH
2
RCHCONH
2
NH
3
+
Для временной защиты α-карбоксильных групп в процессе пептидного
синтеза их превращают в трет-бутиловые эфиры по реакции с изобутиленом
в присутствии серной кислоты:

34
NH
2
RCH COOR CH
2
C
CH
3
CH
3
NH
2
RCH COO C(CH
3
)
3
H
2
SO
4
При анализе аминокислот и пептидов часто используется реакция вос-
становления карбоксильной группы боргидридом натрия до соответствую-
щего α-аминоспирта:
NH
2
(R)CH-COOH + NaBH
4
→ NH
2
(R)CH-CH
2
OH
Аминоспирт можно идентифицировать хроматографически.
Декарбоксилирование. При нагревании твердых аминокислот в высо-
кокипящих растворителях или с баритовой водой происходит декарбоксили-
рование и образуются соответствующие амины:
NH
2
(R)CH-COOH → CO
2
+ R-CH
2
NH
2
Эта же реакция осуществляется и ферментативно в процессе гнилостного
расщепления белков под действием ферментов, выделяемых микроорганиз-
мами кишечника. Известны декарбоксилазы для лизина, гистидина, аргини-
на, фенилаланина, тиро-
зина, глутаминовой ки-
слоты.
Во всех живых
клетках постоянно про-
текает реакция амино-
кислот с АТР, как пер-
вая стадия включения
HOOC CHR NH
2
+ ATP
фермент
O
OH
OH
N
H
H
OPOCH
2
CNH
2
(R) HC
(O)
O
O
-
N
N
N
NH
2
H
H
Аминоациладенилат
35
аминокислоты в пептидную цепь. Реакция с АТР превращает аминокислоту в
более реакционноспособное соединение - аминоациладенилат (см. выше).
1.1.6.2 Реакции по
α
-аминогруппе
N-алкилирование. Эта реакция протекает при взаимодействии амино-
кислот с алкилилгалоидами или диметилсульфатом ((СН
3
)
2
)SO
4
). В послед-
нем случае образуется N-монометил или N,N-диметилпроизводное соответ-
ствующей аминокислоты:
HOOC-CH(R)-NH
2
+ (CH
3
)
2
SO
4
→ HOOC-CH(R)-N(CH
3
)
2
+ H
2
SO
4
Вышеназванные реагенты могут замещать также водород в карбоксильной
группе или радикале R, но скорость этих реакций существенно меньше. Ре-
акция используется иногда в исследовательских целях для выяснения влия-
ния замещения водорода концевых аминогрупп белка на его биологическую
активность.
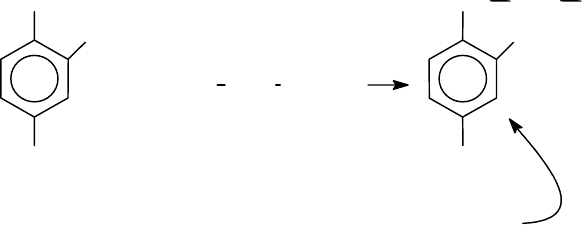
Арилирование. Представителями этого типа реакций являются: а) из-
вестная реакция Сенгера с 2,4-динитрофторбензолом (ДНФБ) и б) реакция
Эдмана с фенилизотиоцианатом (ФИТЦ).
Реакция Сенгера протекает в спиртово-щелочной среде при Т = 35-37
0
С
с образованием динитрофенильных производных аминокислот (2,4-
динитрофениламинокислота - ДНФ-производное аминокислоты):
F
NO
2
NO
2
+
H
2
NCHRCOOH
NH
NO
2
NO
2
CHR COOH
-HF
Д
НФ-аминокислота

36
Эту реакцию Ф. Сенгер впервые применил для количественного введе-
ния метки в аминогруппы аминокислот и пептидов.
Все аминокислоты присоединяют по α-NH
2
группе один радикал
ДНФБ. Лизин, гистидин, цистеин, тирозин, присоединяют и второй радикал
по ε-NH
2
-группе, имидазольной, SН-группе и гидроксильной соответственно.
Все ДНФ-производные, кроме О-моно-ДНФ-тирозина и S-моно-ДНФ-
цистеина окрашены в желтый цвет (λ
мах
= 360 нм). Все они, за исключением
ди-ДНФ-лизина, хорошо растворимы в эфире. Последний растворим в бути-
ловом спирте.
Значимость реакции динитрофенилирования состоит в том, что она яв-
ляется количественной и приводит к образованию желтых кристаллических
соединений. Они легко выделяются хроматографически и количественно
анализируются методами спектрофотометрии. Кроме того, связь ДНФ - ами-
нокислота не гидролизуется кислотой в продуктах реакции динитрофенили-
рования. Это позволяет использовать ее для определения N-концевых остат-
ков в белках.
Позже, наряду с
ДНФБ, стали применять
сходную реакцию меж-
ду аминогруппой и 1-
диметиламинонафтил-5-
сульфонилхлоридом
(дансилхлорид-ДНС).
Образующееся по этой
реакции ДНС-
производное аминокислоты (дансиламинокислота) обладает интенсивной
флуоресценцией. Последняя обусловлена дансильными группами. Это по-
зволяет анализировать следовые количества аминокислот методом флуори-
метрии.
N
S
CH
3
H
3
C
Cl
O
O
+
N
H
H
C
COOH
RH
N
S
CH
3
H
3
C
N
O
O
C
H
COOH
HR
Дансиламинокислота
