Анищик В.М., Борисенко В.Е., Жданок С.А., Толочко Н.К., Федосюк В.М. Наноматериалы и Нанотехнологии
Подождите немного. Документ загружается.


210
стоящими из ряда неодинаковых по строению мономеров – аминокислот.
Белки подразделяются на простые (протеины), молекулы которых состоят
только из аминокислотных остатков, и сложные (протеиды), представляющие
собой биологически активные комплексы белков с небелковыми веществами.
Аминокислоты, образующие структуру белков, связаны между собой
пептидными связями NH – CO. Таким образом, молекула белка является по-
липептидом. Существует множество разновидностей белков, большинство
которых построено из 20 основных аминокислот, различающихся своими ра-
дикалами. Радикалы одних аминокислот, например, глицина (R = H), аланина
(R = СH
3
) и т.п., нейтральны, гидрофобны. Радикалы других аминокислот
имеют активные полярные или заряженные группы OH, NH
3
, SH и другие,
например, в серине R = CH
2
OH, аспарагине R = CH
2
CONH
2
и т.п. Эти группы
способны образовывать водородные или ионные связи, к ним легко присое-
диняются молекулы воды.
Белки различаются по количеству и ха-
рактеру расположения аминокислот в поли-
пептидной цепочке. При этом различают че-
тыре уровня организации молекул белков:
первичный, вторичный, третичный и чет-
вертичный.
Первичная структура представляет со-
бой полипептидную цепь, конфигурация ко-
торой определяется последовательностью
образующих ее аминокислотных остатков.
Вторичная структура подразделяется на
два типа: α-конфигурацию и β-
конфигурацию. Структура α-конфигурации
представляет собой полипептидную цепоч-
ку, свернутую в спираль (рис. 6.16). Шаг
спирали составляет около 0, 5 нм, а диаметр
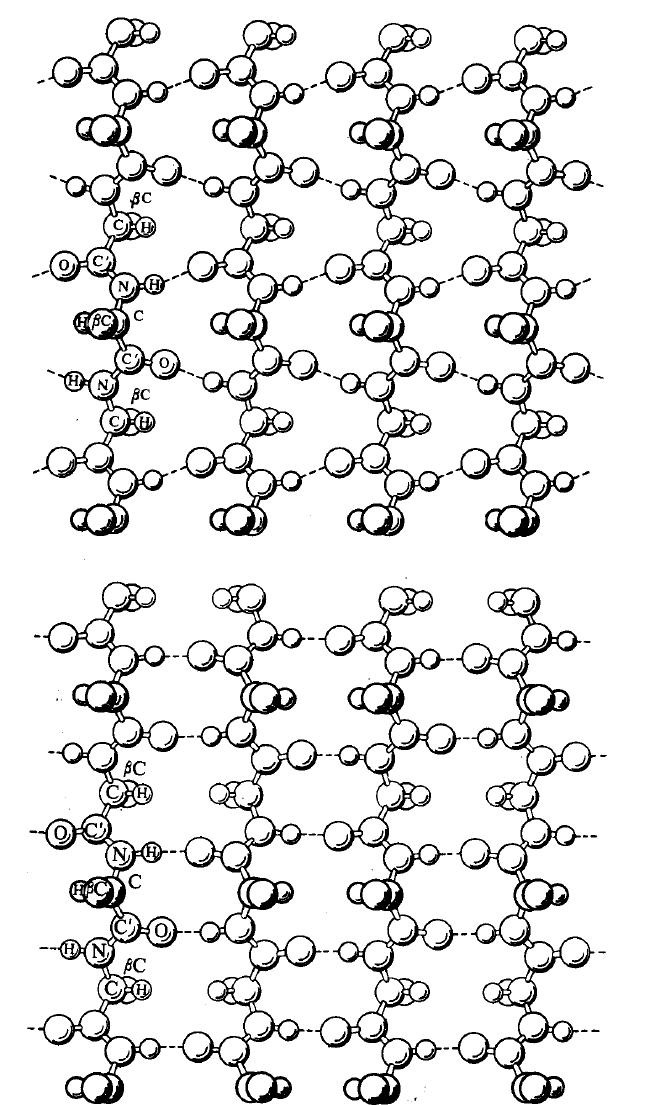
– около 1 нм. Структура β-конфигурации
образована набором полипептидных цепей,
расположенных параллельно друг другу в
виде слоя и сшитых водородными связями.
Полипептидная цепь является поляр-
ной: ей свойственна определенная последовательность чередования атомов
при следовании вдоль нее в заданном направлении. При этом β-структура на-
Рис. 6.16. Модель α-структуры
белка [8]
(синтетический полипептид-γ-
метилглюкомат)
211
зывается параллельной, если полипептидные цепи идут в одном направ-
лении, и антипараллельной, если они идут в противоположных направлениях
(рис. 6.17). Характерными параметрами β-структуры являются период поли-
пептидной цепи (около 0,7 нм для структур обоих типов) и рассто-яние меж-
ду цепями (около 0,5 нм и 1 нм соответственно для параллельной, и антипа-
раллельной структур).
Вторичная структура типична для так называемых волокнистых (фиб-
риллярных) белков. Примерами волокнистого белка с α-структурой являются
кератин (белок волос, шерсти, рогов, перьев), миозин (белок мышц), эпи-
дермин, фибриноген и др. Пример волокнистого белка с β-структурой – фиб-
роин шелка. Волокнистой структурой обладает целлюлоза и некоторые дру-
гие полисахариды, присущие растениям, а также животным, например, хитин
– вещество оболочек тела и суставов членистоногих (ракообразных, пауко-
образных, насекомых).
Другой, отличный от α и β, тип вторичной структуры реализуется в кол-
лагене – белке соединительной ткани кожи, хрящей (рис. 6.18). Молекула
коллагена состоит из трех слабо спирализованных полипептидных цепей,
сшитых друг с другом водородными связями. Каждая цепь скручена по ле-
вому винту, а их оси – по правому. Период молекулы составляет около 2,7
нм. Сложная первичная структура коллагена (последовательность образую-
щих цепь аминокислотных остатков, а также остатков глицина и некоторых
других соединений) приводит к тому, что в волокнах этого белка существуют
сверхпериоды – 8,5 и 10 нм.
Третичная структура образуется в результате пространственного свер-
тывания полипептидной цепи, обладающей той или иной вторичной структу-
рой. Третичная структура характерна для так называемых глобулярных бел-
ков, в которых полипептидная цепь свернута в компактную глобулу. Глобу-
лярные белки выполняют в организмах функции транспорта малых молекул
или электронов, рецепции (восприятия, например, света или других внешних
воздействий), защиты (иммунные белки) и некоторые другие функции. Раз-
новидностью глобулярных белков являются ферменты.
Глобулярные белки способны кристаллизоваться. Кристаллы белков
имеют своеобразное строение: они представляют собой упорядоченную ук-
ладку молекул, в промежутках между которыми находится жидкость (вода),
причем часть молекул воды прочно связана с поверхностью белковых моле-
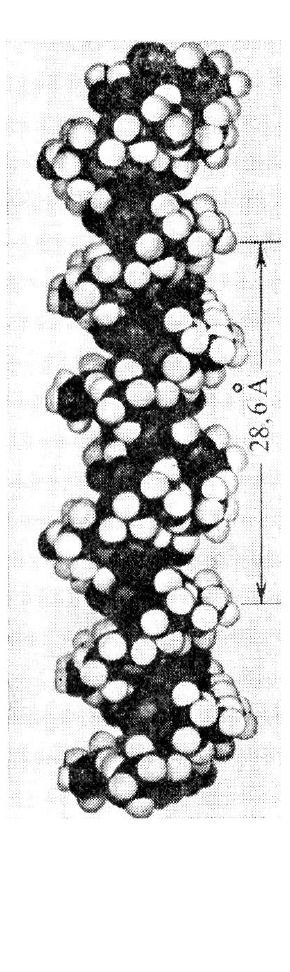
кул. Типичным примером глобулярного белка является миоглобин (рис.
6.19), который обеспечивает обратимое связывание молекул кислорода. В ча-
212
стности, он запасает кислород в мышцах. Молекулярный вес этого белка
18 000, он содержит 153 аминокислотных остатка, т.е. около 1200 атомов, не
считая водородных.
Рис. 6.17. Модели параллельной (а) и антипараллельной (б) β-структур белка [8]
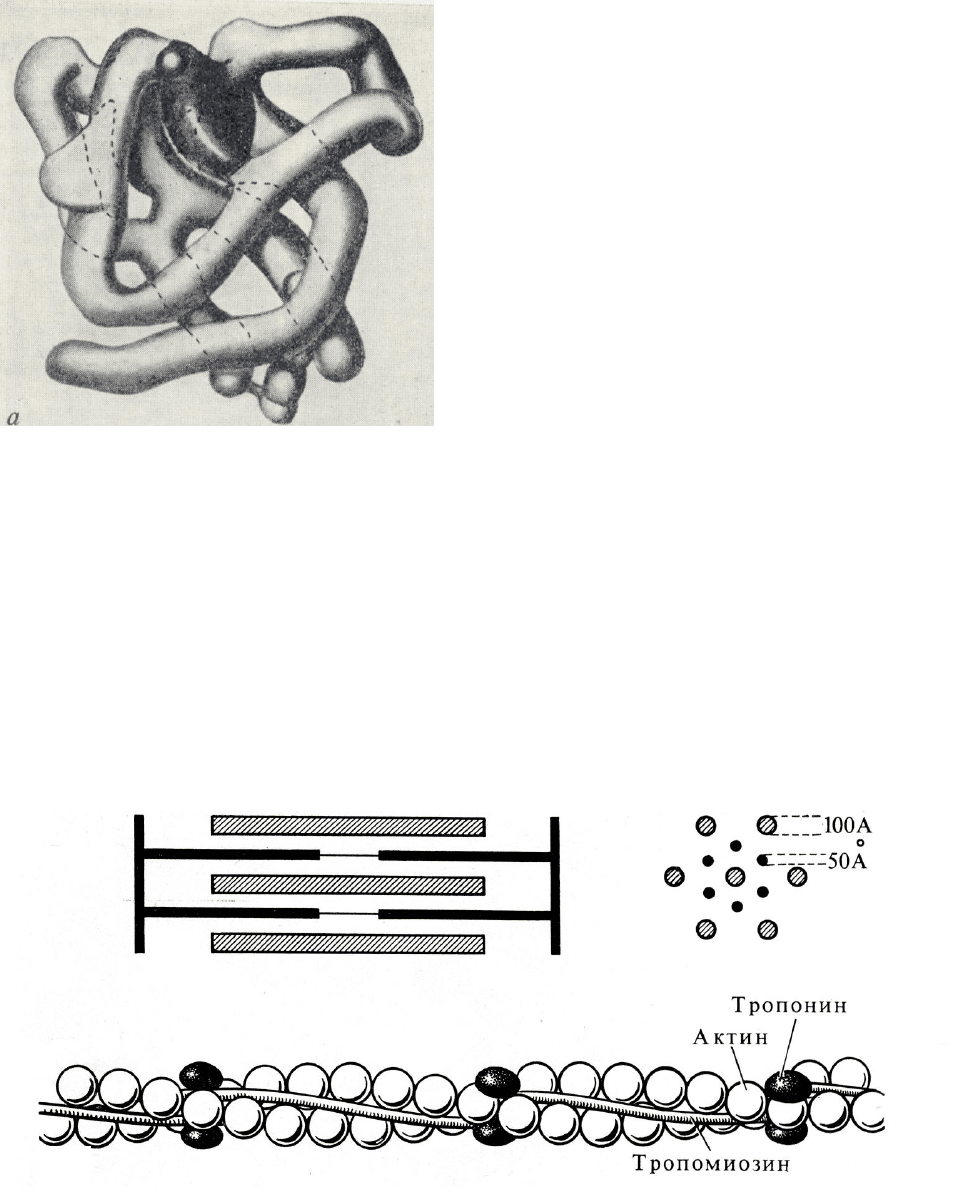
Четвертичная структура представляет собой объединение ряда макромо-
лекул, обладающих третичной структурой. Четвертичная структура харак-
терна для многих глобулярных белков, которые построены не из одной, а из
213
нескольких глобул (субъединиц), соединенных между собой. Примером тому
является гемоглобин, молекула которого состоит из четырех субъединиц.
Гемоглобин, подобно миоглобину, обеспечивает обратимое связывание мо-
лекул кислорода. Он находится в эритроцитах крови и переносит кислород в
ее токе.
Описание структуры биополимеров с разделени-
ем ее на первичную, вторичную, третичную и чет-
вертичную применяют не только к белкам, но также
к нуклеиновым кислотам, полисахаридам и некото-
рым другим классам соединений. Можно также рас-
сматривать структуру пятого порядка уровня органи-
зации – объединение ряда макромолекул, в том числе
обладающих четвертичной структурой, в ассоциации
типа вирусов, мембран и т.п.
Особый интерес представляет рассмотрение
строения белковых молекул или их ассоциаций, вы-
полняющих двигательные функции. Простейшие ор-
ганы такого типа – жгутики бактерий, построенные
из спиральных цепей белковых молекул. Более
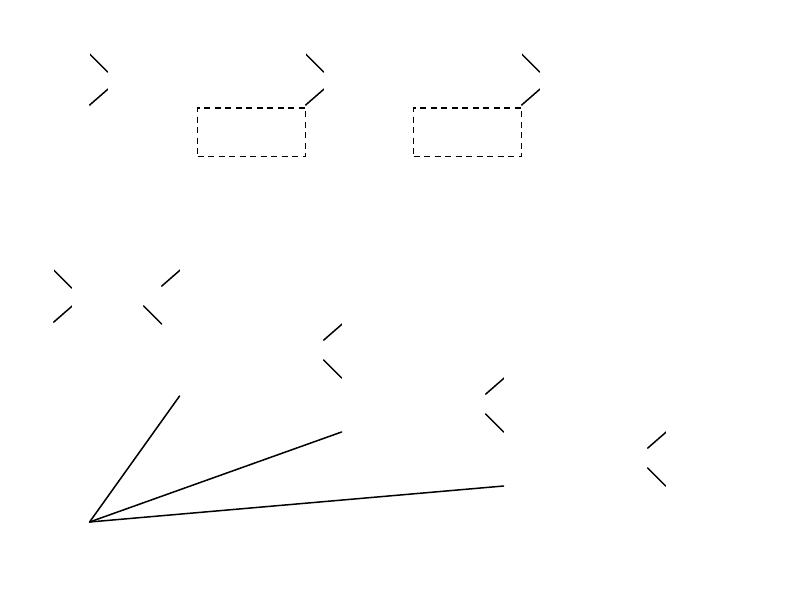
сложное строение имеет мышца – универсальный
молекулярный двигатель живых организмов. Струк-
турной единицей мышцы является саркомера, содер-
жащая волокнистые молекулы актина (толщиной
около 5 нм), между которыми находятся волокни-
стые молекулы миозина (толщиной около 10 нм)
(рис. 6.20). Молекулы обоих типов расположены в
строго гексагональном порядке. Процесс сокращения
мышцы состоит во взаимном втягивании волокон
обоих типов в промежутки между ними.
В процессе жизнедеятельности клетки происхо-
дит постоянный расход одних белков и синтез новых.
Клетки синтезируют строго определенные белки. Например, белок крови ге-
моглобин синтезируется клетками печени, белок миозин - мышечными клет-
ками, инсулин - клетками поджелудочной железы. Синтез белков происходит
в рибосомах.
Так как наследственные свойства клетки связаны с ДНК, то и наследст-
венная способность к синтезу белков также связана с ДНК. За синтез каждого
Рис. 6.18. Модель
структуры
коллагена [8]
214
конкретного вида белка отвечают отдельные участки ДНК – гены, которые
содержат полную информацию о природе белка и последовательности распо-
ложении определенных аминокислот в
белковых полипептидных цепях.
Поскольку для контролирования
последовательности расположения 20
аминокислот имеется всего лишь 4 нук-
леотида (аденино, гуанин, тимин и ци-
тозин), то каждой отдельной аминокис-
лоте должен соответствовать не от-
дельный нуклеотид, а их определенная
группа.
Аминокислоты кодируются три-
плетами, т.е. группами из трех последо-
вательно связанных нуклеотидов в
двойной спирали ДНК. При этом каж-
дый триплет управляет включением в
белок строго определенной аминокислоты. Такое соответствие определенных
участков ДНК – триплетов определенным аминокислотам составляет основу
системы кодирования, т.е. условной записи определенной информации. На-
пример, триплет Т-Т-Т контролирует присоединение лизина, триплет А-А-Ц
– лейцина и т. д. Триплеты отличаются не только составом нуклеотидов, но и
порядком их расположения.
Рис. 6.20. Строение саркомеры [8]
Важно отметить, что ДНК не принимает непосредственного участия в
а
б
в
Рис. 6.19. Модель молекулы
миоглобина [8]
215
синтезе белков. Перенос информации от ДНК к рибосомам, где происходит
синтез белков, осуществляется за счет и-РНК, которые формируются в яд-
рышках ядер клеток, причем синтез и-РНК идет под контролем ДНК. Как от-
мечалось выше, молекулы и-РНК образуются на одиночных спиралях рас-
плетенной молекулы ДНК в строгом соответствии с принципом ком-
плементарности. Вновь возникшая молекула и-РНК несет на себе такую же
информацию о структуре белка, как соответствующая ей молекула ДНК.
Другими словами, происходит переписывание (транскрипция) информации с
молекул ДНК на молекулы и-РНК.
В то время как информационная и-РНК переносит к рибосоме, т.е. к мес-
ту синтеза белка информацию о структуре, транспортная т-РНК доставляет
сюда же аминокислоты, которые присоединяются к одному из концов т-РНК.
При этом каждому виду аминокислоты соответствует своя т-РНК.
При образовании белков аминокислоты соединяются за счет пептидной
связи NH – CO. При этом у одной молекулы аминокислоты отщепляется атом
водорода от аминогруппы, а у другой – гидроксильная группа от карбоксиль-
ной. В результате образуется молекула воды, а две молекулы аминокислоты
соединяются пептидной связью:
Форми-
рующаяся
полипеп-
тидная
цепь
отделяется от рибосомы и претерпевает дальнейшие превращения, в частно-
сти, приобретает вторичную и третичную структуру. В результате образуется
белковая молекула со всеми присущими ей физиологическими и биохимиче-
H
H
R
|
N – C – H
|
C – OH
||
O
H
H
R
|
N – C – H
|
C – OH
||
O
H
H
R
|
N – C – H
|
C – OH
||
O
H
H
R
|
N – C
H
H R
1
| |
C – N – C
||
O
H
H R
2
| |
C – N – C
||
O
H
H R
3
| |
C – N – C
||
O
H
C – OH
||
O
Пептидные связи
216
скими свойствами.
Синтез белков сопровождается затратами энергии, которая поступает за
счет расщепления аденозинтрифосфорной кислоты (АТФ), состоящей из аде-
нина и рибозы, к которой прикреплены три остатка фосфорной кислоты. При
расщеплении молекулы АТФ образуется АДФ (аденозиндифосфорная кисло-
та), АМФ (аденозинфосфорная кислота) и выделяется большое количество
энергии (около 10 000 кал на грамм-молекулу освобождающейся фосфорной
кислоты):
АТФ + Н
2
О → АДФ + Н
3
РО
4
+ 10 000 кал,
АДФ + Н
2
О → АМФ + Н
3
РО
4
+ 10 000 кал.
Синтезированные белки поступают в эндоплазматическую сеть, а по ней
транспортируются к определенным участкам клетки.
6.2.3. Ферменты
Ферменты, иначе называемые энзимами, – это узкоспециализированные по
своему действию вещества, которые по своей природе являются белками.
Ферменты осуществляют превращения веществ в организме, направляя и ре-
гулируя тем самым его обмен веществ. Они обладают оптимальной активно-
стью при некоторых определенных условиях.
Ферменты обеспечивают процесс ускорения биохимических реакций. В
основе ферментативного катализа лежат те же закономерности, что и в осно-
ве небиологического катализа, используемого в химической промышленно-
сти. Обычно катализаторы взаимодействуют с реагентами, но в реакции не
расходуются и не входят в состав образуемых продуктов. Ферментативный
катализ отличается исключительно высокой эффективностью (увеличение
скорости реакций в 10
10
-10
13
раз), специфичностью и регулируемостью, т.е.
изменением активности ферментов в зависимости от потребностей организ-
ма.
Каждый вид ферментов катализирует превращение определенных ве-
ществ, иногда лишь единственного вещества в единственном направлении.
Поэтому многочисленные реакции в клетках осуществляет огромное число
различных ферментов. В частности, синтез ДНК осуществляется ферментом
ДНК-полимеразой. ДНК-полимераза не может начать процесс синтеза сама,
ей нужна ―затравка‖, в качестве которой обычно используется фрагмент
217
РНК. В свою очередь, синтез комплементарной нити РНК на молекуле ДНК
осуществляется ферментом РНК-полимеразой. РНК-полимераза не нуждают-
ся в затравке. Этот фермент синтезирует короткий фрагмент РНК – ту самую
―затравку‖, с которой начинается синтез ДНК
Каталитическими свойствами подобно ферментам, обладают также не-
которые виды РНК. Такие РНК-катализаторы называются рибозимами.
Ферменты играют важную роль в создании бсосенсоров. В общем случае
биосенсор состоит из трансдьюсера (преобразователя сигнала) и иммобили-
зованного биологического элемента [9]. Схема действия биосенсора включа-
ет несколько стадий (рис. 6.21):
1) распознавание биоэлементом специфического для него вещества (суб-
страта) из многокомпонентной смеси;
2) преобразование трансдьюсером информации о протекании биохими-
ческой реакции в форму электрического или другого (например, оптическо-
го) сигнала;
3) преобразование электрического (или другого) сигнала в нужную фор-
му для последующей обработки.
Существует два вида биомолекулярного распознавания: продуктивное и
непродуктивное, каждое их которых реализуется с помощью различных
биоэлементов. Продуктивное биораспознавание осуществляется ферментами,
которые связываются со специфическими субстратами, в результате чего
Преобразование информации
о биохимической реакции в
форму электрического сигнала
Преобразование
сигнала
Трансдьюсер
Иммобилизированный
биоэлемент
Распознавание
субстрата
Рис. 6.21. Схема действия биосенсора [9]
218
протекает химическая реакция, приводящая к образованию определенного
продукта. Непродуктивное биораспознавание, отличающееся высокоизбира-
тельным взаимодействием, осуществляется биологическими системами типа:
антиген-антитело, лиганд-рецептор и комплементарные одноцепочечные
олигонуклеотиды (ДНК).
Наибольшее распространение получили биосенсоры, действующие по
механизму продуктивного биораспознавания, т.е. биосенсоры на основе фер-
ментов. Среди ферментов чаще всего используются оксидазы, в частности,
глюкозооксидаза. Оксидазы окисляют свой специфический субстрат кисло-
родом воздуха. При этом кислород восстанавливается до пероксида водорода
H
2
O
2
, который подвергается амперометрическому детектированию.
Биосенсоры на основе ферментов легко подвергаются миниатюризации,
в частности, они могут быть изготовлены в наноисполнении и, как следствие,
эффективно имплантированы в живой организм для непрерывного анализа.
Особенно перспективно их использовать в одном из важнейших направлений
современной клинической диагностики – неинвазивной диагностике, т.е. в
анализе, не предусматривающем отбора крови.
Сложность создания бионаносенсоров, действующих по принципу био-
распознавания, связана с трудностью обеспечения их длительного и надежно-
го функционирования, так как биоэлементы обычно быстро теряют способ-
ность к биораспознаванию. В связи с этим необходимо, прежде всего, нау-
читься синтезировать молекулы, надолго сохраняющие заданные избиратель-
ность и химическое сродство.
6.2.4. Биомолекулярные комплексы
Тубулярные бионаноструктуры
В биологии довольно часто встречаются наноструктуры, имеющие тубуляр-
ную форму подобно углеродным нанотрубкам и выполняющие различные
функции в высших организмах. В частности, обнаружены некоторые вирусы
– неклеточные частицы размером 15-350 нм и более, содержащие нуклеино-
вые кислоты (ДНК или РНК), заключенные в белковую оболочку, по форме
весьма близкую к углеродным нанотрубкам. Вирусы являются внутрикле-
точными паразитами: они, размножаясь в живых клетках, используют их
ферментативный аппарат и переключают клетку на синтез зрелых вирусных
частиц – вирионов.

219
Структуру, схожую со структурой углеродных нанотрубок, имеют также
некоторые бактериофаги – вирусы бактерий, способные оказывать на них по-
ражающее действие (бактерии – микроорганизмы, преимущественно одно-
клеточные, различной формы с размерами от 100 нм до нескольких десятков
микрометров). В качестве примера на рис. 6.22 показана модель бактериофа-
га фСbК, который состоит из трубки с гексагональным упорядочением бел-
ковых элементов. Эта структура закрыта полусферическими фуллеренопо-
добными куполами.
Рис. 6.22. Модель каспида бактериофага фСbК [10]
Слоистые бионаноструктуры
В живых организмах довольно широко распространена биоминерализация, в
ходе которой путем самосборки формируются структурные элементы, пред-
ставляющие собой многослойные нанопленки. Биоминерализация состоит во
включении неорганических соединений, в частности, содержащих кальций в
мягкие живые ткани для их преобразования в более твердую форму. Так, ко-
стная ткань содержит множество палочкообразных неорганических крис-
таллов диаметром около 5 нм и длиной от 20 до 200 нм. Примером проявле-
ния многослойных нанопленок в биологических объектах являются струк-
турные цвета у насекомых, изменяющиеся при сжатии, высыхании или раз-
бухании пленки. В частности, клетки чешуек некоторых бабочек имеют ра-
дужный многоцветный вид благодаря оптической интерференции в тонких
многослойных пленках. Подобные пленки образуют структуру раковин мол-
люсков.
Самосборка слоистых бионаноструктур происходит следующим обра-
зом: сначала идет сравнительно медлннное объединение двух мономеров
(этап димеризации), затем образовавшийся димер начинает быстро расти пу-
тем последовательного добавления к нему других мономеров (этап полиме-
ризации).
а
б
