Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
60
1
01
3
21
k
ck
ce
kk
−
τ
=
−
. (2.135)
Разделив уравнение (2.135) на уравнение (2.110) получим соотношение
3
1
121
c
k
ckk
=
−
, (2.136)
выражающее постоянство отношения концентраций промежуточной частицы P
и реагента A в
стационарном состоянии. Иногда такое состояние называют
переходным равновесием.
Как уже было показано [см. уравнение (2.133)], к несколько иным резуль-
татам приходим в случае, когда
1
k не просто меньше
2
k , но и по абсолютной
величине очень мало, т. е.
12
kk . Уравнение (2.133), с учетом выражения
(2.41 а) и исходя из того, что
средняя продолжительность жизни формуль-
ной единицы при ее распаде
1/
l
kτ= , можно представить в виде
(
)
()
(
)
()
PP
31/2
1
AA
12
1/2
l
l
c
k
ck
τ
τ
τ
== =
τ
, (2.137)
где
()
P
l
τ ,
()
P
1/2
τ и
()
A
τ
l
,
()
A
1/2
τ – средняя продолжительность жизни и период полу-
превращения (полураспада) промежуточной частицы и реагента соответствен-
но.
Таким образом,
в стационарном состоянии концентрации промежу-
точной частицы и реагента будут относиться друг к другу как их средние
продолжительности жизни или периоды полупревращения
(полураспада).
Иногда в таких случаях говорят о
вековом равновесии.
2.2.1.6. Квазистационарное и квазиравновесное приближения
Из приведенных в 2.2.1.5 решений прямой и обратной кинетических задач
следует, что даже в случае двустадийной односторонней мономолекулярной
реакции, протекающей в закрытой системе, для кинетического описания при-
ходится составлять и решать систему дифференциальных уравнений. Для более
сложных реакций получить решение в аналитическом виде часто вообще не
удается. В то же время,
для определенных видов реакций и в определенных ус-

Х и м и ч е с к а я к и н е т и к а
61
ловиях процесс может протекать в стационарном или квазистационарном
режиме
, что существенно упрощает кинетические расчеты.
Стационарный режим протекания процесса может установиться в откры-
той системе. По смыслу стационарный режим напоминает ситуацию, которая
устанавливается в ванне, если в нее с постоянной скоростью льется вода из
крана и с той же скоростью вытекает вода через нижний слив. При протекании
реакции в стационарном
режиме концентрации всех промежуточных частиц в
данной точке пространства остаются постоянными, а следовательно, в течение
всего времени протекания процесса в стационарном режиме скорости образо-
вания и расходования всех промежуточных частиц одинаковы:
const; 0
i
i
dc
c
d
=
=
τ
, (2.138)
где
i
c – концентрация i-й промежуточной частицы в момент времени τ .
Для быстрого установления и последующего сохранения стационарного
режима протекания реакции промежуточные частицы должны быть достаточно
активными (продолжительность их жизни должна быть небольшой по сравне-
нию со временем протекания реакции) и их концентрация должна быть доста-
точна мала. Из уже рассмотренного нами
принципа независимости, справедли-
вого для реакций, протекающих как в закрытых, так и в открытых системах,
вытекает важное следствие.
Если в системе протекает несколько элементар-
ных реакций или стадий одной сложной реакции с участием одной и той
же формульной единицы, то изменение концентрации последней будет
равно алгебраической сумме скоростей каждой стадии, умноженных на
стехиометрический коэффициент, стоящий перед этой формульной едини-
цей в уравнении реакции, отвечающем данной стадии
. Именно указанная
алгебраическая сумма и приравнивается к нулю в уравнении (2.138). В резуль-
тате получается система алгебраических уравнений, позволяющая выразить
концентрации промежуточных частиц, а затем и скорость реакции, через кон-
центрации реагентов.
Метод расчета с использованием условия (2.138) при постоянстве кон-
центрации реагентов называется
методом стационарных концентраций Бо-
денштейна
.
Опуская выводы, отметим, например, что для протекающей в открытой
системе двустадийной реакции, состоящей из односторонних элементарных
стадий первого порядка, уравнение которой в общем виде (2.107), справедливо

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
62
()
2
P
P ст
1
k
c
e
с
−
τ
=− , (2.139)
где
()
P ст
c
– стационарная концентрация промежуточной частицы P. Следова-
тельно, формально стационарный режим, т. е. равенство
()
P
P ст
cc=
, достигается
только через бесконечно большой промежуток времени: при τ=∞
2
0
k
e
−τ
=
и
()
P
P ст
1
c
c
=
. В то же время, достаточно малые, но конечные отклонения
P
c
от
()
P ст
c достижимы за вполне приемлемое время. Так, если считать близкой к ста-
ционарной концентрацию
()
P
P ст
0,95с c=
, то из выражения (2.139) имеем
()
P
0,95
22
P ст
13
ln 1
c
kck
⎛⎞
⎜⎟
τ= − =
⎜⎟
⎝⎠
. (2.140)
Например, для
31
2
10 ck
−
= получаем малое время достижения стационарного
состояния –
3
0,95
310 c
τ
−
=⋅ .
В закрытых системах концентрации реагентов уменьшаются во времени,
а следовательно, при протекании многостадийных реакций, например реакции,
уравнение которой в общем виде (2.107), концентрации промежуточных частиц
не могут оставаться постоянными. Для закрытых систем полезно понятие
ква-
зистационарного режима
реакции. Это режим, при котором концентрации
промежуточных частиц в ходе процесса в каждый момент времени отве-
чают условиям стационарности по отношению к изменяющимся концен-
трациям реагентов, т. е. отношение концентраций промежуточных частиц
и реагентов остается постоянным
. Таким образом, для квазистационарного
режима реакции условие (2.138) остается в силе.
Подчеркнем два важных условия, при которых концентрации промежу-
точных частиц смогут «подстраиваться» к меняющейся концентрации реаген-
тов в каждый момент времени и принимать значения, требуемые при стацио-
нарном протекании процесса.
Во-первых, время достижения квазистационарного режима должно быть
коротким по
сравнению со временем развития процесса в целом. Это время оп-
ределяется константой скорости дальнейшего превращения промежуточной
частицы. Значит, эта частица должна быть очень активна в своем дальнейшем

Х и м и ч е с к а я к и н е т и к а
63
превращении (или дальнейших превращениях) Следовательно, условие квази-
стационарности может быть применено только к активным промежуточным
частицам. На примере рассматриваемой реакции, уравнение которой в общем
виде (2.107), ясно, что данное условие достижимо при больших значениях
(
)
21 2
kk k .
Во-вторых, предполагается, что максимальная концентрация промежу-
точных частиц достигается к моменту, когда концентрация реагентов практиче-
ски не изменилась. Однако промежуточные частицы образуются из реагентов,
малому изменению концентрации которых может соответствовать лишь очень
малая (меньшая, чем само изменение) квазистационарная концентрация проме-
жуточных частиц. Следовательно, условие квазистационарности применимо
только к частицам,
которые накапливаются в концентрациях, пренебрежимо
малых по сравнению с концентрациями реагентов. Значит, оно может быть ис-
пользовано только при малых значениях
[
11 2
kk k для рассматриваемой ре-
акции, уравнение которой в общем виде (2.107)].
Все вышеотмеченное согласуется с материалом, приведенным в 2.2.1.5
при рассмотрении последовательных реакций. Таким образом, можно еще раз
отметить, что для модельной реакции, уравнение которой в общем виде (2.107),
условие квазистационарности применимо лишь для случая, когда
12
kk .
Кинетика реакции, уравнение которой в общем виде (2.107), уже была
рассмотрена в 2.2.1.5. Понятно, что ни при каких соотношениях
1
k и
2
k процесс
не может быть квазистационарным в течение периода времени до максимума на
кинетической кривой для промежуточной частицы P. После достижения мак-
симума режим реакции для случая
12
kk приближается к квазистационарному
(рис. 2.12). Покажем это.
Зависимости концентраций реагента A и промежуточной частицы P от
времени для реакции, уравнение которой в общем виде (2.107), имеют соответ-
ственно вид
1
A0A
k
cce
−
τ
=
; (2.141)
(
)
12
1
P0A
21
kk
k
cc e e
kk
−
τ−τ
=−
−
. (2.142)
Условие квазистационарности в рассматриваемом случае запишется в ви-
де

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
64
() ()
P1
1A 2 A
P ст P ст
2
0;
dc k
kc kc c c
dk
=− = =
τ
, (2.143)
где
A
c – концентрация реагента A в данный конкретный момент времени
τ
.
Подставляя значение
A
c из уравнения (2.141) в выражение (2.143), нахо-
дим
()
1
1
0
P ст
2
A
k
k
cce
k
−
τ
= . (2.144)
Разделив почленно уравнение (2.142) на уравнение (2.144), имеем
()
[
()
21
P2
21
P ст
1
kk
ck
e
ckk
−
−τ
⎤
=−
⎦
−
. (2.145)
Анализ выражения (2.145) подтверждает тот факт, что квазистационар-
ный режим может быть реализован только при
12
kk , когда можно пренеб-
речь величиной
1
k в разности
21
kk
−
и выражение (2.145) переходит в уравне-
ние (2.139) для стационарного процесса. Метод расчета, основанный на исполь-
зовании условия (2.147) для промежуточных частиц при протекании реакции в
закрытой системе, называется
методом квазистационарных концентраций.
Если механизм протекания реакции по стадиям установлен, но неизвест-
ны константы скорости отдельных стадий при условии, что промежуточные
частицы достаточно активны, то часто для упрощения расчетов в качестве при-
ближенной модели данной реакции принимают, что реакция протекает в квази-
стационарном режиме. При этом метод квазистационарных концентраций рас-
сматривается как приближенный метод
расчета, т. е. говорят о квазистацио-
нарном приближении
.
Частным случаем квазистационарного приближения является
квазирав-
новесное приближение
. Оно наблюдается, если одна из стадий процесса обра-
тима, причем равновесие устанавливается чрезвычайно быстро. Тогда можно
считать, что на протяжении всей реакции между компонентами этой стадии со-
храняется равновесие, т. е. они присутствуют в равновесных концентрациях.
Во многих случаях использование квазистационарного и квазиравновес-
ного приближений приводит к кинетическим уравнениям, которые удовлетво
-
рительно описывают закономерности реального процесса.
При рассмотрении случаев несовпадения молекулярности и порядка ре-
акции (см. 2.2.1.2) мы останавливались на вопросах, связанных с мономолеку-

Х и м и ч е с к а я к и н е т и к а
65
лярным распадом на примере диссоциации ацетона, сделав при этом ряд выво-
дов, основываясь лишь на логических умозаключениях. Приведенный выше
материал позволяет детализировать ряд вопросов, связанных с мономолекуляр-
ным распадом, с использованием кинетических закономерностей процесса. При
этом, как и ранее, мы будем базироваться на считающейся общепринятой
схеме
Линдемана
1
, согласно которой активация молекул происходит путем двойного
соударения, т. е. бимолекулярно.
Рассмотрим реакцию, уравнение которой в общем виде ABC
→+, про-
текающую предположительно мономолекулярно. Согласно Линдеману меха-
низм этой реакции включает стадии, описываемые следующими уравнениями:
(
)
()
()
1
2
3
k
1AA A A активационный процесс;
2A BC распад;
3A A A A дезактивация.
k
k
∗
∗
∗
+⎯⎯→+
⎯⎯→+
+⎯⎯→+
В первом процессе появляется активированная молекула: возможно, относи-
тельная кинетическая энергия двух сталкивающихся молекул превращается в
колебательную энергию активированной молекулы A
∗
. Во втором процессе ак-
тивированная молекула распадается. Процесс (2), однако, осуществляется не
сразу после процесса (1), а по истечении некоторого конечного промежутка
времени (в чем и состоит основное отличие от бимолекулярной реакции). Дан-
ный промежуток времени необходим для перераспределения энергии внутри
молекулы и сосредоточения ее на связи, подлежащей разрыву. Так, например,
для
осуществления процесса (2) – распада этана на два метильных радикала:
3333
HC CH HC CH−→+
,
по-видимому, необходимо сосредоточение энергии (возбуждения колебания) на
связи CC
− . При соударении же двух молекул, в первую очередь, вероятно,
возбуждаются колебания по периферическим связям CH
−
. Для перехода в не-
обходимом количестве энергии с этих связей на связь CC
−
необходимо время.
Пока же данный переход не осуществился, может произойти третье превраще-
1
Рассмотрение вопросов неудовлетворительности схемы Линдемана в целом, а также осве-
щение других теорий мономолекулярных реакций выходят за рамки настоящего издания.
Эти вопросы достаточно подробно рассмотрены в [10]. Целью приведенного анализа являет-
ся лишь демонстрация использования принципа стационарности и более строгое, чем в
2.2.1.2, обоснование возможности протекания мономолекулярных реакций по различному
порядку.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
66
ние – дезактивация, т. е. процесс, обратный первому. При кинетическом расчете
активированная молекула A
∗
считается неустойчивой промежуточной части-
цей, к которой
можно применить принцип стационарности:
2
A
1A 2 3 A
AA
0
dc
kc kc kc c
d
∗
∗∗
=− − =
τ
. (2.146)
Отсюда концентрация активированных молекул
2
1A
A
23A
kc
c
kkc
∗
=
+
. (2.147)
Наблюдаемая скорость распада молекулы A равна, очевидно, скорости элемен-
тарной реакции, отвечающей второй стадии, т. е.
A
2
A
dc
kc
d
∗
−=
τ
. (2.148)
Подставляя в уравнение (2.148) выражение для концентрации A
∗
из формулы
(2.147), получим выражение для скорости распада молекулы A:
2
A12A 12A
A
23A 23A
dc k k c k k c
c
dkkc kkc
⎛⎞
−= =
⎜⎟
τ+ +
⎝⎠
, (2.149)
являющееся итогом рассуждений Линдемана. Согласно уравнению (2.149) по-
рядок реакции распада молекулы A промежуточный между первым и вторым.
Однако необходимо рассмотреть крайние случаи.
1. Концентрация (давление) молекул A
велика. В этом случае скорость
дезактивации
3A
A
kc c
∗
может оказаться много больше скорости распада
2
A
kc
∗
,
или
3A 2
kc k , и первым слагаемым в знаменателе уравнения (2.149) можно
пренебречь. В результате получится кинетическое уравнение реакции первого
порядка
1
:
()
A.
12
AA
I
3
dc
kk
ckc
dk
−= =
τ
. (2.150)
1
Здесь и далее правые нижние индексы у k в виде римской цифры в круглых скобках указы-
вают на молекулярность реакции (например, в уравнении (2.150)
()
I
k означает константу
скорости мономолекулярной реакции) и по отношению к ее порядку используются только
при его совпадении с молекулярностью.

Х и м и ч е с к а я к и н е т и к а
67
В этих условиях, очевидно, поддерживается статистически равновесная
концентрация активированных молекул и реакция происходит в соответствии с
законом спонтанного разложения
1
.
2. Концентрация (давление) молекул A
мала. В этом случае скорость рас-
пада
2
A
kc
∗
может оказаться много больше скорости дезактивации
3A
A
kc c
∗
, или
23
A
kkc . Пренебрегая в данном случае в знаменателе уравнения (2.149) вто-
рым слагаемым, получим кинетическое уравнение реакции второго порядка:
2
1A
A
dc
kc
d
−=
τ
, (2.151)
появляющееся, очевидно, в связи с относительно большими промежутками
времени между соударениями, в течение которых в пределе все активирован-
ные молекулы успевают прореагировать. В данном случае скорость наблюдае-
мой реакции равна скорости процесса активации.
Согласно схеме Линдемана
[уравнению (2.149)], константа скорости, вы-
числяемая по первому порядку, вообще говоря, имеет вид
()
12A
I
23A
kkc
k
kkc
=
+
. (2.152)
Следовательно, и «константа» первого порядка
2
, и время превращения опреде-
ленной доли реагента должны зависеть от концентрации или давления
A. Как
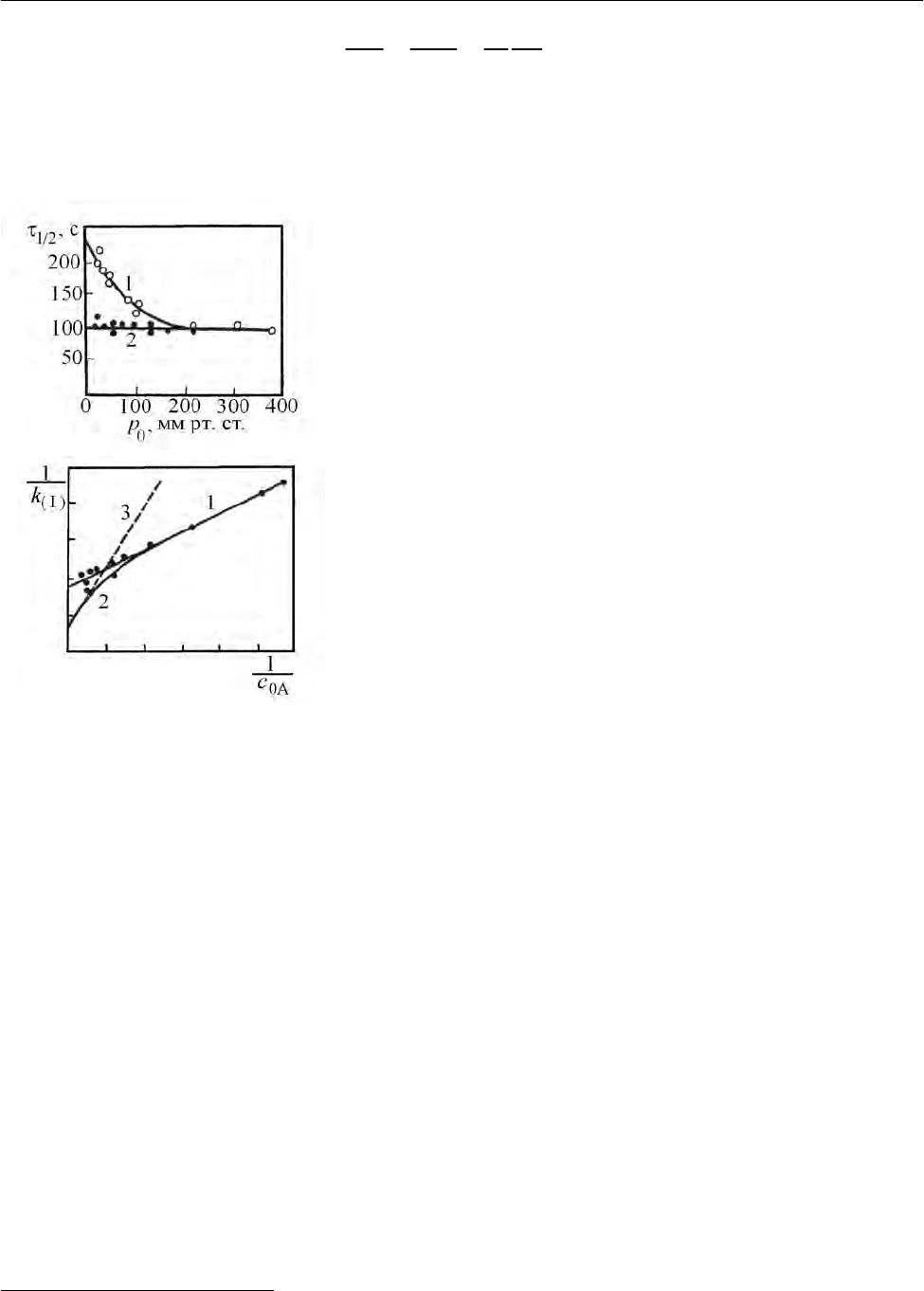
видно из рис. 2.14, при высоких давлениях период полураспада диэтилового
эфира сохраняет постоянство, что свидетельствует о первом порядке реакции
(см. 2.2.1.3), и увеличивается (реакция протекает уже не по первому порядку) с
понижением давления ниже 200 мм рт. ст.
3
Эту же зависимость можно предста-
вить и в более удобной для обсуждения форме. Величина, обратная константе
1
Чисто статистическое рассмотрение мономолекулярного распада, выходящее за рамки на-
шего изложения, ведет к уравнению реакции первого порядка, т. е. к экспоненциальному за-
кону. Единственным спорным допущением при этом является принятие распада молекулы
событием индивидуальным, т. е. независящим от распада других молекул [10].
2
В данном случае, как и при рассмотрении сложной реакции, состоящей из двух последова-
тельных двусторонних элементарных стадий первого порядка (см. 2.2.1.5), речь идет не о
константе скорости сложной реакции в целом, которой принципиально не существует, а об
эффективной величине, сложным образом зависящей от констант скорости всех стадий, а в
некоторых случаях
и от концентрации компонентов.
3
[
]
1 мм рт. ст. 133,3 Па 16= .
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
68
()
3
12 1 A
I
111
k
kkkkc
=+
, (2.153)
должна являться линейной функцией обратной концентрации. На рис. 2.15
представлены в спрямленном виде данные рис. 2.14
1
. Видно, что ближе к началу
координат наблюдается разброс точек, но все же можно провести прямую. Од-
нако в большинстве исследованных таким образом реакций прямая не получа-
ется. Примерный ход экспериментальной кривой показан на рис. 2.15 (кри-
вая 2). В целом, следует говорить о качественном подтверждении теории: при
повышении давления константа скорости
первого порядка стремится к посто-
янному значению
(
)
k
∞
. Таким образом, для каждой реакции существует мини-
мальное начальное давление, ниже которого константа первого порядка
уменьшается.
Ранее (см. 2.2.1.2) нами уже отмечался характер влияния примесей на по-
рядок мономолекулярной реакции. При анализе кинетики мономолекулярных
реакций всегда возникает вопрос о роли продуктов и добавок посторонних
инертных газов. Так, при разложении диэтилового эфира
добавление водорода
к исходному эфиру препятствует уменьшению константы, поддерживая ее на
уровне
k
∞
(рис. 2.14, кривая 2). Эти результаты могут быть объяснены участи-
1
Рис. 2.14 и 2.15 приведены по [10] без изменений.
Рис. 2.14. Зависимость периода полураспада
диэтилового эфира от начального давления
0
p
эфира:
1 – без водорода, 2 – с добавлением водорода
Рис. 2.15. Зависимость обратной величины
константы скорости мономолекулярной реак-
ции от обратной величины начальной концен-
трации реагента:
1 – диэтиловый эфир, 2 – обычное отклонение
от прямолинейной зависимости, 3 – прямая,
соответствующая уравнению (2.152)

Х и м и ч е с к а я к и н е т и к а
69
ем в активационном процессе механизма Линдемана и продуктов, и заранее до-
бавленного водорода. Подобное же компенсирующее свойство обнаруживают и
другие вещества.
Изучение способности того или иного газа поддерживать скорость моно-
молекулярной реакции используется как метод определения скорости передачи
энергии от одних молекул другим
[10].
Рассмотренный выше материал наглядно показывает возможности прин-
ципа стационарности при анализе кинетики сложных реакций. Завершая рас-
смотрение весьма важного, хотя и приближенного, метода кинетического рас-
смотрения сложных реакций – метода стационарных концентраций, часто свя-
зываемого с именем Боденштейна, сформулируем (без вывода) условия дости-
жения квазистационарного режима в реакциях, состоящих из нескольких
по-
следовательных стадий (односторонних и двусторонних) первого порядка.
1. Последовательность односторонних (необратимых) стадий будет ква-
зистационарной. Если константа скорости первой стадии значительно меньше
констант скорости всех остальных стадий.
2. Последовательность двусторонних (обратимых) стадий будет квазиста-
ционарной, если она включает одну стадию, обе константы скорости которой
много меньше констант скорости всех остальных стадий
в прямом и обратном
направлении.
3. Последовательность, включающая двусторонние и односторонние ста-
дии, будет квазистационарной, если константа скорости первой из односторон-
них стадий будет значительно меньше констант скоростей остальных односто-
ронних стадий.
2.2.1.7. Основные типы механизмов химических реакций
с участием промежуточных частиц
В предыдущем изложении мы уже сталкивались с тем, что многие про-
цессы, описываемые простым стехиометрическим уравнением, являются слож-
ными и протекают с помощью активных промежуточных частиц. Основная
причина этого в том, что обычно прямое превращение связано с преодолением
высокого энергетического барьера. Появление же новых химически активных
частиц приводит, в свою
очередь, к новым путям протекания реакций, причем
эти пути характеризуются более низким энергетическим барьером.
