Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
210
вн вн
kc
=
v , (2.423)
т. е. скорость внешней диффузии, а следовательно, и скорость всего каталити-
ческого процесса пропорциональна концентрации реагента. При уменьшении
размера гранул катализатора и толщины диффузионного слоя наблюдается уве-
личение константы внешнего массообмена. Увеличение скорости движения
жидкости или газа относительно твердых частиц катализатора приводит к
уменьшению толщины диффузионного слоя. Исходя из этого,
можно заклю-
чить, что скорость внешней диффузии будет тем больше, чем выше скорость
протекания газа или жидкости через слой катализатора (в проточных реакто-
рах) или интенсивность перемешивания суспензии катализатора в жидкой фазе
(в непроточных реакторах).
Диффузия реагирующих веществ в пористом катализаторе протекает за
счет разности концентраций на внешней поверхности
s
с и в объеме пористой
гранулы
V
c
(см. рис. 2.41). Примем, что диффузия в пористом катализаторе
подчиняется уравнению Фика (2.405) с тем различием, что вместо истинного
вводится
эффективный коэффициент диффузии D
∗
. Данный коэффициент,
исходя из того, что диффузия протекает не по всему объему гранулы катализа-
тора, а лишь в объеме пор, зависит от
пористости катализатора Π , равной
объему пор в единице объема пористой системы, и от степени извилистости
пор в грануле катализатора, называемой
коэффициентом извилистости или
фактором извилистости δ:
DD
∗
Π
=
δ
, (2.424)
где отношение
Π
δ
– проницаемость пористой гранулы катализатора, кото-
рая для большинства катализаторов лежит в пределах 0,1–0,3.
Одновременно с процессом диффузии реагентов в гранулу катализатора
на стенках пор протекает каталитическая реакция. Пусть ее скорость на равно-
доступной поверхности выражается кинетическим уравнением для реакций
первого порядка
к V
kc
=
v . (2.425)
Отнеся эту скорость к единице объема пористого катализатора
к
V

Х и м и ч е с к а я к и н е т и к а
211
к
кк
V
k
с
VV
=
v
(2.426)
и обозначив
кк
/Vv через
s
v , а /
к
kV через
s
k , получим
s
sV
kc
=
v . (2.427)
На рис. 2.41 наглядно видно уменьшение концентрации реагента от внеш-
ней поверхности к центру гранулы катализатора, вызывающее соответствую-
щее снижение скорости реакции в центральной части катализатора. Этот эф-
фект суммарно будет выражаться в том, что отнесенная к единице объема гра-
нулы катализатора скорость реакции, наблюдаемая на опыте
н
v , будет значи-
тельно ниже
s
v
. Лишь в случае, когда по всему объему гранулы катализатора
Vs
cc= ,
н
s
ss
kc
=
=vv .
Понятно, что при
Vs
cc
<
всегда
н
s
<
vv
. Величина
н
s
η=
v
v
(2.428)
характеризует степень использования внутренних слоев гранулы катализатора
и называется
фактором эффективности, или степенью использования по-
верхности
.
Уравнение макрокинетики (в случае гранул катализатора сферической
формы) имеет вид
н
г
3
s
s
kD c
r
∗
=v . (2.429)
Из уравнения (2.429) следует, что скорость процесса уменьшается с увеличени-
ем размера гранул катализатора и зависит как от
s
k , так и от D
∗
. Порядок реак-
ции при этом остается равным единице.
Наличие сильного диффузионного торможения оказывает влияние не
только на скорость реакции, но и на величину энергии активации каталитиче-
ского процесса. Наблюдаемая на опыте энергия активации каталитического
процесса в условиях сильного диффузионного торможения равна половине
энергии активации той же реакции, протекающей на равнодоступной
поверхно-
сти.
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
212
Следует отметить, что если реакция на равнодоступной поверхности под-
чиняется кинетическому уравнению для реакции
n-го порядка
n
s
sV
kc=v , то со-
гласно теоретическим положениям макрокинетики скорость процесса при на-
личии сильного диффузионного торможения может быть выражена уравнением
1
2
н
г
3
n
s
s
kD c
r
+
∗
=v . (2.430)
Из уравнения (2.430) следует, что при увеличении диффузионного торможения
порядок реакции изменяется от
n до
(
)
1/2n
+
. Так, для реакции второго поряд-
ка при наличии сильного диффузионного торможения порядок реакции, наблю-
даемый на опыте, будет равен 1,5.
С учетом всего вышесказанного сформулируем признаки протекания ге-
терогенно-каталитической реакции в той или иной области.
Признаками протекания реакции во
внешнедиффузионной области яв-
ляются:
- зависимость скорости процесса от интенсивности перемешивания жид-
кой фазы или от скорости протекания газа (жидкости) через слой катализатора
(поскольку
вн
k зависит от толщины диффузного слоя
δ
);
- увеличение скорости процесса с уменьшением размера гранул катализа-
тора;
- близость энергии активации реакции к энергии активации диффузии (4–
8 кДж/моль).
Признаками протекания реакции во
внутридиффузионной области яв-
ляются:
- увеличение скорости реакции с уменьшением размера гранул катализа-
тора при одновременном отсутствии ее зависимости от скорости потока реаген-
та или интенсивности перемешивания жидкой фазы;
- изменение порядка реакции при увеличении размера гранул катализато-
ра, если 1
n > ;
- зависимость скорости реакции от пористости, радиуса гранул и степени
извилистости пор катализатора.
При протекания реакции в
кинетической области (равнодоступная по-
верхность) ее скорость не зависит от интенсивности перемешивания реакцион-
ной смеси, скорости потока газа или жидкости через слой катализатора, размера
гранул катализатора и его пористости.

Х и м и ч е с к а я к и н е т и к а
213
При изменении условий проведения каталитического процесса может
происходить переход реакции из одной области в другую. Так, по мере пони-
жения температуры протекание реакции переходит из внешнедиффузионной
области через внутридиффузионную в кинетическую область. К переходу из
диффузионной области в кинетическую приводит и измельчение гранул катали-
затора. Процесс перехода реакции из диффузионной области
в кинетическую
приводит к увеличению скорости реакции и энергии ее активации.
2.3.6. Ферментативный катализ
Катализ под действием ферментов называют ферментативным. Фер-
менты
, или энзимы – это биокатализаторы, продукты жизнедеятельности
живых организмов
. Они имеют более сложное строение по сравнению с неор-
ганическими катализаторами. Ферменты бывают простые и сложные. Простые,
или однокомпонентные ферменты состоят только из белковых тел, в то время
как сложные ферменты включают белковую и небелковую составляющие. При
этом небелковая составляющая резко увеличивает каталитическую активность
фермента.
По сравнению с химическим катализом
ферментативный имеет ряд осо-
бенностей, к числу которых относятся высокая каталитическая активность, чет-
кая специфичность и селективность, повышенное влияние окружающей среды.
Каталитическая активность биологических катализаторов в миллионы раз
превосходит активность химических. При протекании одних и тех же реакций с
использованием обычного катализатора и фермента наблюдается колоссальное
увеличение скорости реакции в случае
ферментативного катализа (на 12 – 13
порядков!). Так, например, константа скорости реакции гидролиза мочевины
под действием обычного кислотного катализатора
(
)
3
HO
+
равна
7
7,4 10
−
⋅
(
)
л/ моль с
⋅
,
в то время как под действием фермента уреазы –
6
5,0 10
⋅
(
)
л/ моль с
⋅
. Данный факт обу-
словлен также снижением энергии активации за счет фермента (от 78,4 кДж/моль до
27,2 кДж/моль в приведенном примере). Скорость реакций, катализируемых фермен-
тами, зависит от концентрации реагирующих веществ и условий среды. Уско-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
214
рение ферментативной реакции
1
происходит, в частности, благодаря тому, что в
системе создаются условия для автокаталитической реакции.
Ферменты, в отличие от химических катализаторов, обладают большей
специфичностью: каждый из них способен ускорить только строго определен-
ную реакцию и даже образование определенных стереоизомеров. Реже фермен-
ты катализируют группы реакций: например, фермент пепсин способствует
расщеплению белков. Ферменты более чувствительны к изменению внешних
условий, в частности температуры, чем неорганические катализаторы. Для
большинства растительных ферментов рабочий температурный интервал со-
ставляет
o
40 60 C− , а для животных ферментов –
o
40 50 C− . Уже при темпера-
туре
o
70 80 C− происходит необратимое разрушение ферментов вследствие
денатурации – необратимого осаждения и свертывания белка, при кото-
рых нарушаются первоначальная специфическая конфигурация, укладка
цепей макромолекул и соответственно их конформация
2
.
Свою активность ферменты проявляют при строго определенном значе-
нии pH среды. Например, для уже упоминавшегося пепсина оптимальное зна-
чение pH составляет 1,5 – 2,0.
Ферментативный каталитический процесс обусловлен способностью
к взаимным синхронным изменениям структур
фермента и субстрата
(субстрат – вещество, на которое воздействует фермент). Эти изменения
связаны с конформацией взаимодействующих макромолекул.
Специфичность взаимодействия фермента и субстрата определяется
принципом ключ–замок [1]. Подобно ключу, отпирающему определенный за-
мок, фермент оказывает каталитическое действие на определенный субстрат.
Одна из причин такой специфичности фермента заключается в том, что в бел-
ковой молекуле фермента каталитические функции выполняют отдельные не-
большие
участки – активные центры, представляющие собой ориентирован-
ные в пространстве функциональные группы в основном белковых молекул.
Структура активного центра может возникнуть в процессе сближения молекул
фермента и субстрата.
Активные центры способны к избирательной адсорбции молекул суб-
страта, в результате чего образуется единый комплекс, внутри которого проис-
1
Вопросы теории ферментативного катализа весьма подробно рассмотрены в [2].
2
Конформациями называют энергетически неравноценные формы макромолекул, возни-
кающие при повороте мономерных звеньев без разрыва химических связей.

Х и м и ч е с к а я к и н е т и к а
215
ходит химическая реакция между ферментом и субстратом. Возникновение в
комплексе своеобразной микрофазы с параметрами (диэлектрическая прони-
цаемость, полярность и др.), отличными от параметров среды, способствует ус-
корению химической реакции. Процесс завершается десорбцией продуктов и
регенерацией активных центров для новых каталитических актов. Большое
число активных центров способствует протеканию каталитического процесса в
большой
массе субстрата.
Действие всех факторов обусловлено и геометрическим соответствием
структур активного центра фермента и самого субстрата (ключ–замок).
Простейшая схема ферментативной реакции может быть изображена сле-
дующим образом:
1
2
1
ES ES EP
k
k
k
−
⎯⎯→
+⎯⎯→+
←⎯⎯
, (2.431)
где
112
,,kk k
−
– константы скорости реакции. В соответствии со схемой (2.431)
фермент E обратимо реагирует с субстратом S с образованием комплекса ES ,
который распадается на продукты Р и реагент – фермент Е.
Применение квазиравновесного приближения (см. 2.2.1.6) к схеме (2.431)
(при условии
21
kk
−
) с учетом уравнения материального баланса
E0EES
cc c
=
− ,
где
0E E
,cc – начальная и текущая концентрации фермента соответственно;
ES
c – текущая концентрация комплекса, позволяет выразить скорость образова-
ния продукта (его текущая концентрация
P
c
) через начальную концентрацию
фермента и текущую концентрацию субстрата
S
c :
20ES
P
SS
kc c
dc
dKc
==
τ
+
v . (2.432)
Входящая в формулу (2.432) константа
S
K
, называемая субстратной кон-
стантой
, определяется выражением
ES
1
S
1ES
cc
k
K
kc
−
== . (2.433)
При увеличении концентрации субстрата скорость реакции стремится к пре-
дельному значению:

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
216
max 2 0E
kc
=
v . (2.434)
Подставляя уравнение (2.434) в выражение (2.432), получаем следующее соот-
ношение, связывающее скорость реакции с максимальной скоростью реакции:
max S
P
SS
c
dc
dKc
==
τ
+
v
v
. (2.435)
Определение параметров
Smax
и K v
обычно проводят на основании измерения
зависимости начальной скорости от начальной концентрации субстрата для ря-
да начальных концентраций.
Наиболее часто для анализа кинетических схем ферментативного катали-
за используют метод стационарных концентраций (см. 2.2.1.6) (
21
kk ). При-
менение этого метода к простейшей схеме катализа (2.431) дает
уравнение Ми-
хаэлиса-Ментен
:
max S
P
S
M
c
dc
dKc
==
τ
+
v
v
, (2.436)
где
max
v – максимальная скорость реакции (при бесконечно большой концен-
трации субстрата), отвечающая выражению (2.434);
M
K
– константа Миха-
элиса
, определяемая выражением
21
1
M
kk
K
k
−
+
= . (2.437)
Константа Михаэлиса соответствует концентрации субстрата, при которой ско-
рость реакции равна половине максимальной скорости. Типичные значения
M
K
лежат в пределах от
6-1
10 до 10 моль/л
−
. Константу скорости
2
k иногда назы-
вают
числом оборотов фермента. Она может изменяться в пределах от
161
1, 7 10 до 1,7 10 c
−−
⋅⋅
.
Уравнение (2.436) можно записать в координатах, более удобных для об-
работки экспериментальных данных:
max max S
11 1
M
K
c
=+
vv v
(2.438)
или
max
S
M
K
c
=−
v
vv
. (2.439)
Х и м и ч е с к а я к и н е т и к а
217
Для определения параметров
max
и
M
K v по уравнениям (2.438) и (2.439) прово-
дят серию измерений начальной скорости реакции
0
v
от начальной концентра-
ции субстрата
0S
c и представляют экспериментальные данные в координатах
(
)
00S
1/ 1/
f
c=v или
(
)
000S
/
f
c=vv .
2.3.7. Примеры и задачи
А. Примеры решения задач
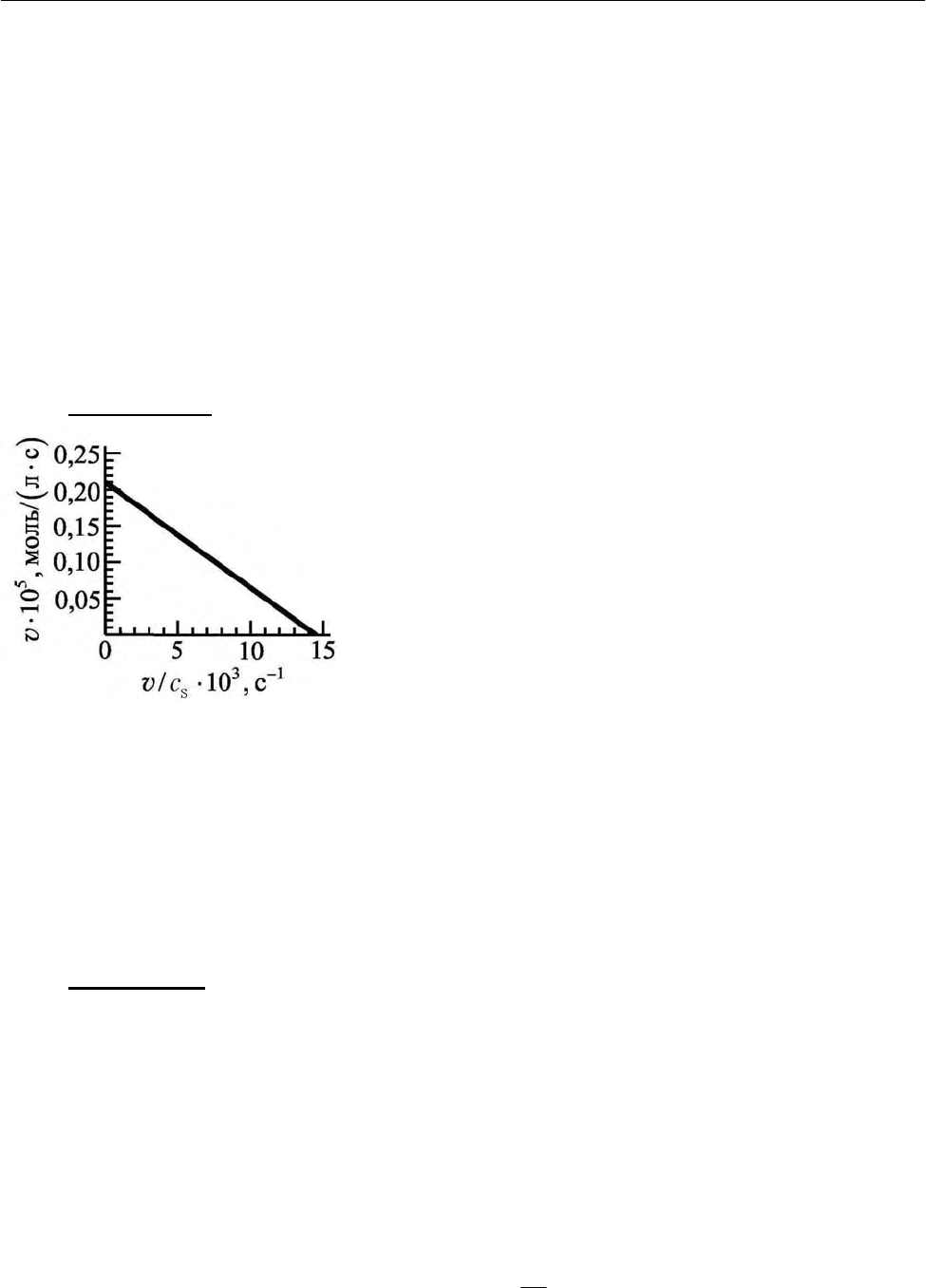
Пример 10.
Найдите константу Михаэлиса и максимальную скорость
гидролиза аденозинтрифосфата, катализируемо-
го минозином по кинетическим данным, приве-
денным на рис. 2.42.
Решение
Уравнение Михаэлиса-Ментен в коорди-
натах, приведенных на рис. 2.42, имеет вид
(2.439). Следовательно, точки пересечения с
осями имеют следующие координаты:
(
)
max
0; v
для оси ординат и
(
)
max
/;0
M
Kv для оси абсцисс.
Точка пересечения с осью ординат дает значения
6
max
2,1 10
−
=⋅v
()
моль/ лс⋅ . Точка
пересечения с осью абсцисс позволяет найти константу Михаэлиса:
max
/
M
K =v
31
14,6 10 c
−−
⋅ , откуда
M
K
= 2,1·
6
10
−
/14,6·
3
10
−
= 1,44·
4
10
−
моль/л.
Пример 11. Для некоторой ферментативной реакции константа Михаэли-
са равна 0,035 моль/л. Скорость реакции при концентрации субстрата 0,110
моль/л равна
3
1,15 10
−
⋅
(
)
моль/ лс
⋅
. Найдите максимальную скорость этой ре-
акции.
Решение
Исходя из уравнения (2.439), выражение для максимальной скорости
имеет следующий вид:
max
S
M
K
c
=+
v
vv
.
Рис. 2.42. Кинетические
данные
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
218
Подставляя в это выражение конкретные значения величин, получаем
()
3
33
max
1,15 10
1,15 10 0,035 1,52 10 моль/ лс
0,110
−
−−
⋅
=⋅ + =⋅ ⋅
v .
В. Задачи для самостоятельного решения
Задача 26.
Начальная скорость окисления сукцината натрия в фумарат
натрия под действием фермента сукциноксидазы была измерена для ряда кон-
центраций субстрата:
S
, моль/лс
0,01 0,002 0,001 0,0005 0,00033
6
10⋅v ,
(
)
моль/ лс⋅
1,17 0,99 0,79 0,62 0,50
Определите константу Михаэлиса данной реакции.
Ответ:
4
4,86 10 моль/л
−
⋅ .
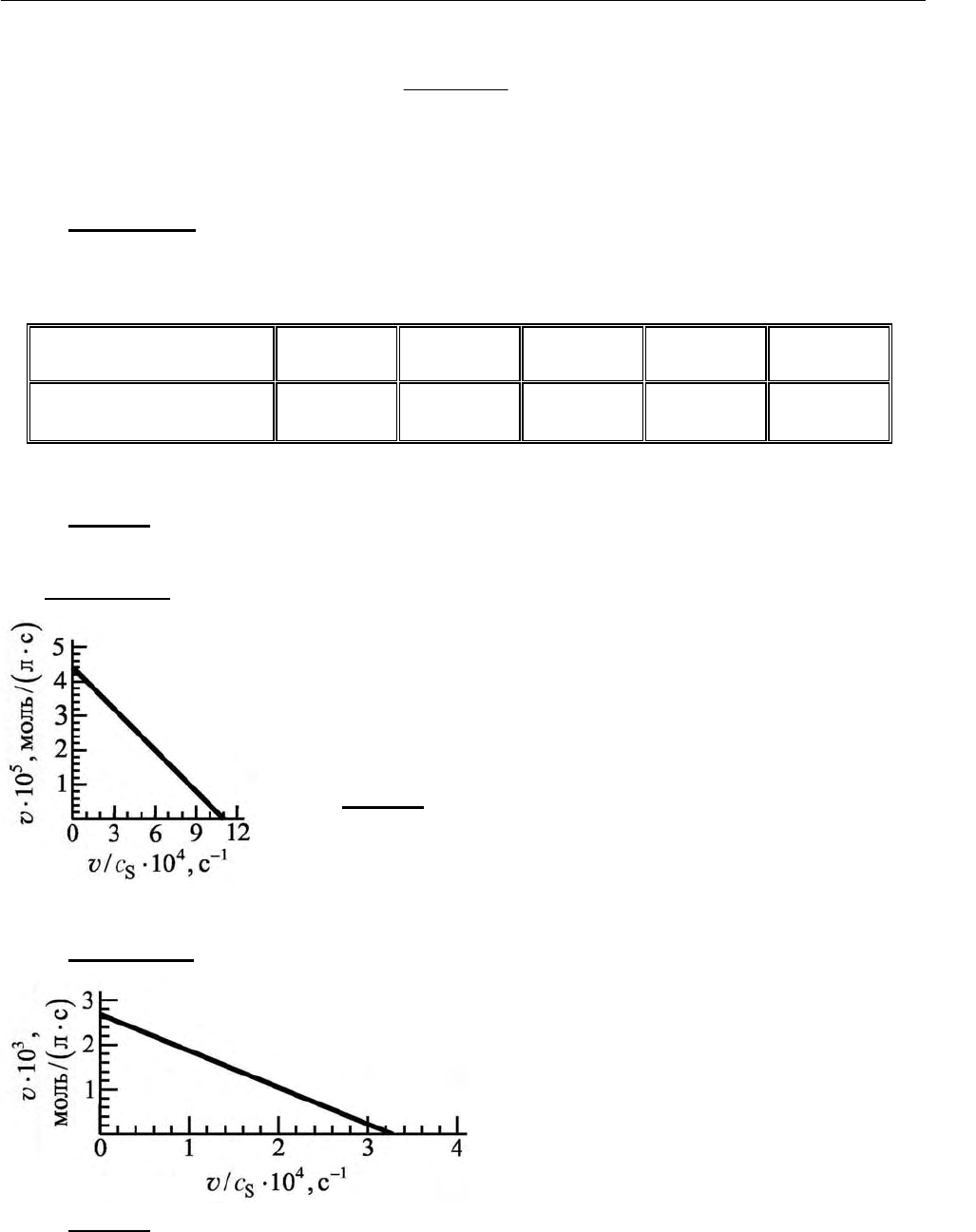
Задача 27.
Найдите константу Михаэлиса и максимальную скорость ката-
литического разложения гидроперекиси по кинетиче-
ским данным, приведенным на рис. 2.43.
Ответ:
0,040 моль/л;
M
K
=
.
max
=v
=
5
4,4 10
−
⋅
(
)
моль/ лс
⋅
Задача 28. Найдите константу Михаэлиса и максимальную скорость ка-
талитического окисления циклогек-
сена
трет-бутилпероксидом по ки-
нетическим данным, приведенным
на рис. 2.44.
Ответ:
0,083 моль/л;
M
K =
5
max
2,7 10
−
=⋅v
(
)
моль/ лс
⋅
.
Рис. 2.43. Кинетические данные
Рис. 2.44. Кинетические данные

Х и м и ч е с к а я к и н е т и к а
219
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Зимон А. Д., Лещенко Н. Ф. Физическая химия: Учебник для вузов. –
М.: Химия, 2000. – 320 с.
2. Денисов Е. Т., Саркисов О. М., Лихтенштейн Г. И. Химическая кинети-
ка: Учебник для вузов. – М.: Химия, 2000. – 568 с.
3. Зенин Г. С., Привалова Т. А., Пенкина Н. В. Физическая химия. Ч. 1.
Химическая термодинамика: Текст лекций. – СПб
.: СЗТУ, 2003. – 76 с.
4. Киреев В. А. Курс физической химии: Учебник для вузов. 3-е изд., пе-
рераб. и доп. – М.: Химия, 1975. – 776 с.
5. Стромберг А. Г., Семченко Д. П. Физическая химия: Учебник для хим.
спец. вузов / Под ред. А. Г. Стромберга. – 3-е изд., испр. и доп. – М.: Высш. шк.,
1999. – 527 с.
6. Физическая
химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика
и катализ: Учебник для вузов / К. С. Краснов, Н. К.Воробьев, И. Н. Годеев и др.;
Под ред. К.С. Краснова – 2-е изд., перераб. и доп. – М.: Высш. шк., 1995. –
319 с.
7. Эткинс П. В 2 т. Т. 2. Физическая химия / Пер. с англ. / Под ред.
К
. П. Бутина. – М.: Мир, 1980. – 584 с.
8. Даниэльс Ф., Ольберти Р. Физическая химия / Пер. с англ. / Под ред.
К. В. Топчиевой. – М.: Мир, 1978. – 645 с.
9. Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия:
Учебник для биол. ф-тов университетов и пед. вузов. 2-е изд., испр. и доп. – М.:
Высш.
шк., 1990. – 416 с.
10. Еремин Е. Н. Основы химической кинетики: Учеб. пособие для уни-
верситетов и химико-технологических вузов. 2-е изд., доп.. – М.: Высш. шк.,
1976. – 375 с.
11. Жуховицкий А. А., Шварцман Л. А. Физическая химия: Учебник для
вузов. 4-е изд., перераб. и доп. – М.: Металлургия, 1987. – 688 с.
12. Алексеев А. И. Кинетические расчеты технологических
процессов в
производстве минеральных удобрений и глинозема: Учеб. пособие. – Л.: СЗПИ,
1986. – 80 с.
13. Сена Л. А. Единицы физических величин и их размерности: Учеб.-
справ. руководство. 3-е изд., перераб. и доп. – М.: Гл. ред. физ.-мат. лит.,
1988. – 287 с.
