Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

181
хания, то содержание креатинфосфата уменьшается. Это, в свою очередь, ведет
к уменьшению концентрации АТФ и утрате, в конечном итоге, сократительной
способности мышцы.
Важная роль креатинфосфата, как резервуара АТФ, подтверждена также в
экспериментах с ингибиторами (Кейн с соавт., 1962г). Так, креатинфосфоки-
назную активность интактных мышц можно полностью подавить 2,4-
динитрофторбензолом (реактивом Сенгера). В мышцах, отравленных этим ин-
гибитором, наблюдается очень быстрое уменьшение концентрации АТФ при
сокращениях. Это следствие того, что канал образования АТФ из креатинфос-
фата заблокирован 2,4-динитрофторбензолом.
Имеются сведения о том, что креатинфосфат используется в мышце, осо-
бенно сердечной, не только как депо легкомобилизуемых макроэргических
фосфатных связей, но и транспортирует богатые макроэргичесикими фосфат-
ными связями продукты окислительного фосфорилирования. Предложена схе-
ма такого переноса из митохондрий в цитоплазму клеток миокарда. Согласно
этой схеме, АТФ из матрикса митохондрий переносится через их внутреннюю
мембрану с участием специфической АТФ-АДФ-транслоказы на активный
центр митохондриального изофермента креатинкиназы. Последний расположен
на внешней стороне внутренней мембраны митохондрий. В межмембранном
пространстве, в присутствии ионов магния, и при наличии в среде креатина об-
разуется тройной фермент-субстратный комплекс: креатин-креатинкиназа-
АТФ-Mg
2+
. Этот комплекс распадается затем с образованием креатинфосфата и
АДФ-Mg
2+
. Креатинфосфат диффундирует в цитоплазму, где используется в
миофибриллярной креатинкиназной реакции для рефосфорилирования. Пред-
полагается, что аналогичный путь транспорта энергии из митохондрий в мио-
фибриллы реализуется и в скелетной мускулатуре.
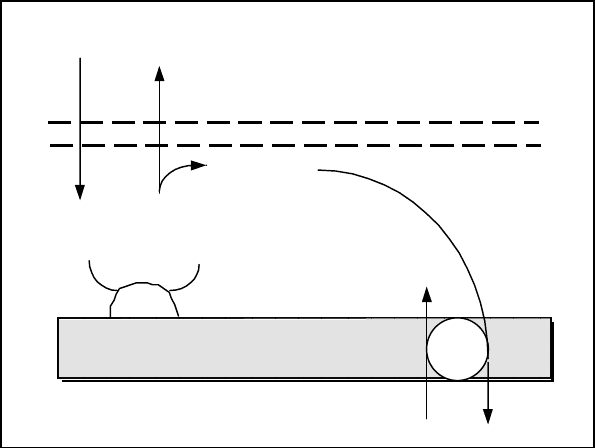
182
Процесс переноса энергии из митохондрий в цитоплазму клетки миокарда (по
Саксу и др.) схемати-
чески представлен на
рис.
Где а, b – наружная и
внутренняя мембраны
соответственно; Кр -
креатин; КрФ – креа-
тин фосфат; КК - креа-
тинкиназа; Т - Транс-
локаза
Процессы ре-
фосфорилирования АДФ до АТФ и образования креатинфосфата поддержива-
ются во всех мышцах гликолизом и дыхательной активностью. Однако, вклад
гликолиза и дыхания в разных мышцах различен. В высокоактивных, или крас-
ных мышцах (цвет обусловлен высоким содержанием миоглобина и цитохро-
мов) основным источником является окислительное фосфорилирование в мито-
хондриях. К этим мышцам относятся летательные мышцы птиц и мышцы ко-
нечностей млекопитающих. В малоактивных, или белых скелетных мышцах с
малым содержанием миоглобина и цитохромов основной источник энергии
гликолиз.
3.2.3.2 Особенности химического состава сердечной мышцы
По содержанию ряда химических веществ сердечная мышца зани-
мает промежуточное положение между скелетной и гладкой мышцами. В сер-
дечной мышце значительно меньше миофибриллярных белков, чем в скелетной
мышце. Миозин, тропомиозин и тропонин сердечной мышцы и гладкой муску-
латуры отличаются по своим физико-химическим свойствам от соответствую-
щих белков скелетной мускулатуры. В саркоплазме миокарда относительное
ADP-Mg
Kp<-->Kp-ATP-M
g
<------------> ATP----M
g
KK
T
a
b
ATP
ADP
ЦИТОПЛАЗМА
Kp
КрФ
183
содержание миоальбумина выше, чем в саркоплазме скелетной мускулатуры.
Содержание АТФ на 1 г мышцы выражается следующими цифрами: гладкая
мускулатура - 1.38 мкмоль; сердечная мышца - 2.60 мкмоль, скелетная муску-
латура - 4.43 мкмоль. Очень низкий процент содержания в сердечной мышце и
мышцах гладкой мускулатуры дипептидов ансерина и карнозина (не более 0.1г
на 1кг сырой массы). По сравнению с другими мышечными тканями миокард
богаче фосфоглицеридами. Окисление неуглеводных веществ обеспечивает
около 65-70% потребности миокарда в энергии. Из свободных жирных кислот в
сердечной мышце особенно легко окисляется олеиновая кислота.
185
ГЛАВА 4
МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ СТРУКТУРЫ БЕЛКОВ
4.1 Размер и форма белковых молекул
Существует много методов и приемов, позволяющих установить форму и
размеры белковых молекул. Однако получаемая с их помощью информация
различна как по степени надежности, так и по степени разрешения структуры
макромолекул.
Наиболее точные данные о величине, форме, конформации белковой мо-
лекулы можно получить только с помощью метода рентгеноструктурного ана-
лиза (РСА). Практические трудности использования этого метода для исследо-
вания биологических объектов и высокая стоимость необходимого оборудова-
ния, однако, таковы, что метод РСА доступен далеко не каждой научной лабо-
ратории и число исследованных с его помощью белков пока весьма ограничен-
но, хотя в последние годы и растет очень быстро. Основное ограничение - это
необходимость иметь белок в твердом кристаллическом состоянии. Для боль-
шинства же белков сведения об их структуре получены с помощью менее со-
вершенных и более простых физико-химических методов, позволяющих вы-
полнять анализ в растворах. Эти методы позволяют определить основные фи-
зико-химические параметры макромолекул, и уже на основании этих характе-
ристик делать определенные заключения о форме и размерах белковых моле-
кул. В число этих параметров входят:
¾ молекулярная гомогенность,
¾ молекулярная масса,
¾ коэффициент диффузии,
¾ вязкость растворов белков
Молекулярная гомогенность характеризует число и относительное со-
держание различных видов белковых молекул в исследуемом образце. Методы,
186
которые позволяют получить такую информацию основаны на законах движе-
ния частиц в растворах, помещенных в гравитационные (седиментация, ультра-
центрифугирование) или электрическое (электрофорез) поля с высокой напря-
женностью.
Молекулярная масса (ММ) белковой молекулы может быть определена с
различной точностью, разными методами. Основное, при определении ММ -
это получение чистого гомогенного образца белка. Кроме того, важными пара-
метрами при определении ММ являются: заряд молекулы, ее форма и степень
гидратации. Так например, при измерениях скорости движения частицы надеж-
ные результаты получаются только для тех молекул, форма которых близка к
сферической, т.е. для глобулярных белков. Отклонение от сферической формы
(фибриллярные белки) и гидратация приводит к различным погрешностям из-за
увеличения коэффициента трения при движении молекул в растворе или воз-
растания их эффективного размера. В тех случаях, когда белок не является мо-
нодисперсным, результаты измерений усредняются (см. среднечисленная и
средневесовая ММ.)
Коэффициент диффузии (D) является одним из тех параметров, которые
достаточно отчетливо «реагируют» на форму белковой молекулы. Однако,
только на основании величины D можно сделать лишь весьма приближенные
заключения о размерах и форме молекул. Чаще, если известна ММ, вычисляют
величину так называемого фрикционного отношения (f/f
0
). Здесь - f- экспери-
ментально измеренная величина коэффициента трения, f
0
- идеальный коэффи-
циент трения - величина коэффициента f для негидратированных молекул той
же массы, что и белок, с идеальной сферической формой. Чем больше величина
фрикционного отношения отклоняется от единицы, тем более «вытянутую»
форму имеет молекула белка. Никакой другой (более определенной) информа-
ции о форме белковой молекулы значение фрикционного отношения не несет,
хотя в ряду белков она и может быть довольно наглядной относительной харак-
теристикой отклонения формы от сферической (см.табл. 4.1)
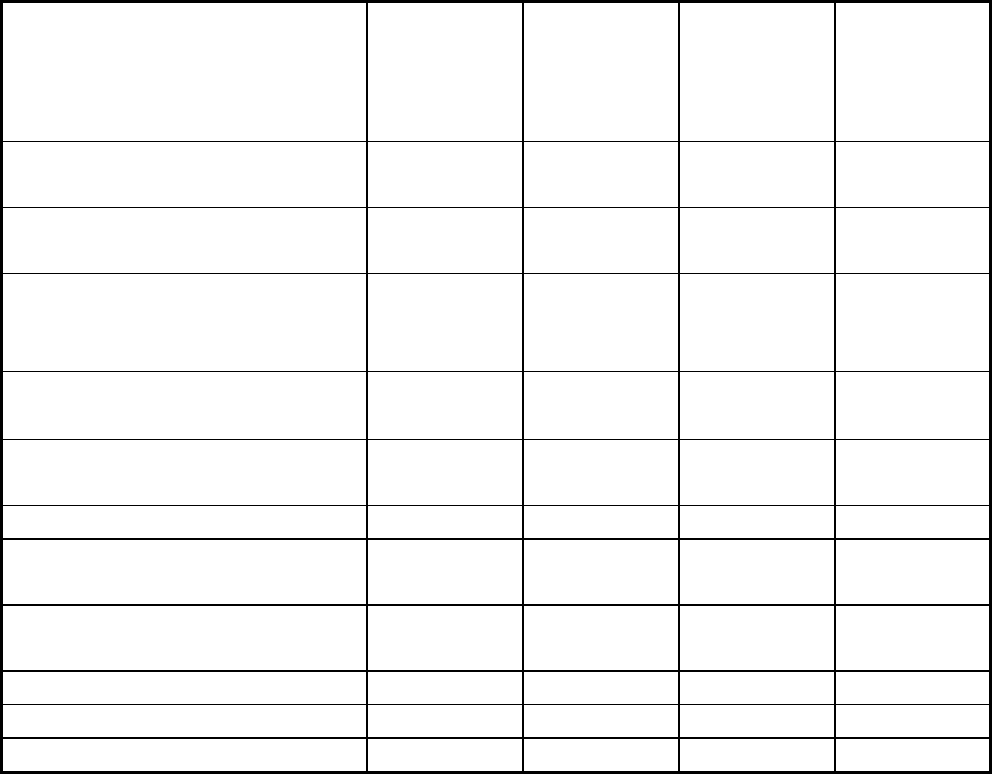
187
Таблица 4.1
Физические константы некоторых белков
Белок ММ D(20
0
) Константа
седимента-
ции
s (20
0
C)
Фрикцион-
ное отноше-
ние
f/f
0
Цитохром с (из сердечной
мышцы быка)
13 370 11.4 1.17 1.19
Миоглобин (из сердечной
мышцы лошади)
16 900 11.3 2.04 1.11
Химотрипсиноген (из
поджелудочной железы
быка)
23 240 9.5 2.54 1.19
β-Лактоглобулин (из
козьего молока)
37 100 7.48 2.85 1.26
Сывороточный альбумин
человека
68 500 6.1 4.6 1.29
Гемоглобин человека 64 500 6.9 4.5 1.16
Каталаза (из печени
лошади)
247 500 4.1 11.3 1.25
Уреаза (из семян
конвалии)
482 700 3.46 18.6 1.19
Фибриноген человека 339 700 1.98 7.63 2.34
Миозин трески 524 800 1.10 6.43 3.63
Вирус табачной мозаики 40590000 0.46 198 2.03
Вязкость раствора является, по-видимому, самой простой мерой асим-
метрии растворенных макромолекул. Вязкость белковых растворов определя-
ют, как правило, методом вискозиметрии. Его суть состоит в измерении скоро-
сти истечения раствора из капилляра под действием силы тяжести и сравнении
этой скорости со скоростью истечения чистого растворителя в тех же условиях.
По увеличению времени истечения белкового раствора судят о его характери-
стической вязкости. Характеристическая вязкость белкового раствора сравни-
тельно невелика, если его молекулы имеют сферическую форму. Она заметно
возрастает при переходе к элипсоидным и особенно палочковидным формам
188
при той же ММ белковых молекул их концентрации в растворе. Поэтому, изме-
рения вязкости широко используется для обнаружения изменений в форме мо-
лекул. Установлено, например, что при взаимодействии выделенного из мышц
белкового комплекса актомиозина с АТР вязкость раствора уменьшается. Обу-
словлено это тем, что в присутствии АТР молекулы актомиозина, имеющие
форму палочек, диссоциируют на актин и миозин. Молекулы последних имеют
элипсоидную форму с меньшей величиной отношения осей.
Таким образом, косвенно, методами физико-химического анализа, при
исследовании белковых растворов можно лишь с большей или меньшей степе-
нью вероятности установить какой из идеальных форм (сфера, цилиндр, элип-
соид вращения и т.д.) наиболее близка форма молекулы белка. В заключении о
форме белковой молекулы всегда должна содержаться информация о происхо-
ждении белка, его лабильности. Не исключено, что по ходу анализа форма мо-
лекулы может претерпевать большие или меньшие изменения. Белок может из-
меняться и в процессе его выделения, очистки. Учесть все это крайне сложно.
Поэтому всегда следует формулировать окончательные выводы о форме белко-
вой молекулы с некоторой осторожностью.
Не менее актуальным остается по сей день вопрос о том, насколько силь-
но отличаются между собой белки в растворе и в кристаллическом состоянии.
На то, что такие различия, вероятно, есть указывают результаты эксперимен-
тальных исследований некоторых белков.
4.2 Оптические свойства белков
Одним из важнейших оптических свойств пептидов и белков является
вращение плоскости поляризации света, или оптическая активность. Оптиче-
ская активность складывается из двух составляющих.
1.
Первая составляющая - это сумма инкрементов всех асимметричных α-С
атомов, которые входят в пептидную цепь. В пептидной цепи все α-С атомы
вращают плоскость поляризации, как правило, влево. Иными словами, амино

189
кислоты в свободном состоянии и аминокислоты в включенные пептидную
цепь могут вращать плоскость поляризации в разные стороны. Причина в том,
что направление и угол вращения молекулами свободных аминокислот сущест-
венно зависят от состояния амино-, карбокси- и других диссоциирующих групп
в боковом R-радикале, состава раствора, его рН и некоторых других факторов
среды. При образовании пептидной цепи вблизи асимметричного атома С все-
гда расположены незаряженные СО-NH- группы пептидной связи, что устраня-
ет сложное влияние зарядов на величину угла вращения. В результате, инкре-
менты для α-С- атомов различных аминокислот выравниваются (он оказывает-
ся практически одним и тем же). Для концевых аминокислот этого эффекта нет,
но вклад этих двух атомов в суммарную величину удельного вращения всей
пептидной цепи крайне мал.
При анализе этого вопроса на практике, вместо эмпирической величины
удельной оптической активности [α] пользуются так называемым эффективным
вращением звена цепи [m], выражая его в виде:
['] []m
n
M
λ
α
λ
=
+
⋅
3
2
2
0
100
где М
0
- ММ звена, n - показатель преломления среды.
Рассмотрим примеры для пептидов не имеющих хорошо организованной вто-
ричной структуры, т.е. находящихся в состоянии статистического клубка. Так,
полиглютаминовая кислота в щелочной среде (когда она полностью ионизиро-
вана и несет на себе максимальный отрицательный заряд, т.е. не имеет спи-
ральной конформации) имеет величину [α]
D
= -107
0
(удельная активность изме-
ренная при D-линии натрия, 589,3 mµ). Величина [m]
D
при М
0
=129, n=1.37 со-
ставляет:
[]
(. )
()m
D
=
+
⋅−=−
3
133 2
129
100
107 109
2
190
Для полилизина в 6 N соляной кислоте [α]
D
=-80
0
, M
0
=130, n=1.38. Откуда
[m]
D
= -82
0
. Как видно, структура боковой цепи аминокислот не очень сильно
влияет на величину эффективного угла вращения звена. Подобные колебания
наблюдаются и в белках. Для денатурированных белков [m] заключено в преде-
лах от -85 до -100
0
. Эти колебания отражают различия в аминокислотном со-
ставе белков.
2.
Вторая составляющая оптической активности белков определяется струк-
турой макромолекулы как целого. Если α-спираль является основным элемен-
том вторичной структуры пептидной цепи, то она должна давать большой
вклад в величину оптической активности. Обычно он колеблется в пределах от
80 до 100-105
0
. В самом общем случае цепь главных валентностей правой спи-
рали вращает плоскость поляризации вправо, а левой - влево. Поскольку при-
родные белки, состоящие из L-аминокислот, образуют правую спираль, то для
них наблюдается правое вращение. Из всего сказанного напрашивается вопрос:
можно ли опираться на параметры оптической активности для установления
самого факта наличия спиральной структуры в пептидной цепи и можно ли,
выполнив соответствующую калибровку, оценивать степень спирализации пеп-
тидной цепи? Абсолютно точный и абсолютно утвердительный ответ на эти
вопросы пока дать нельзя. Единственное, что можно утверждать с абсолютной
уверенностью - это то, что упорядочивание макромолекул глобулярных белков
проявляется большим положительным инкрементом в оптической активности.
Типичная кривая изменения оптической активности в процессе, напри-
мер, тепловой денатурации белка приведена на рис. 4.1.
Сам по себе факт распада упорядоченной структуры, который проявляет-
ся изменением оптической активности, не есть доказательством существования
обязательно α-спирали или какой-либо спирали вообще. Только по совокупно-
сти данных различных методов исследования может быть принят такой вывод.
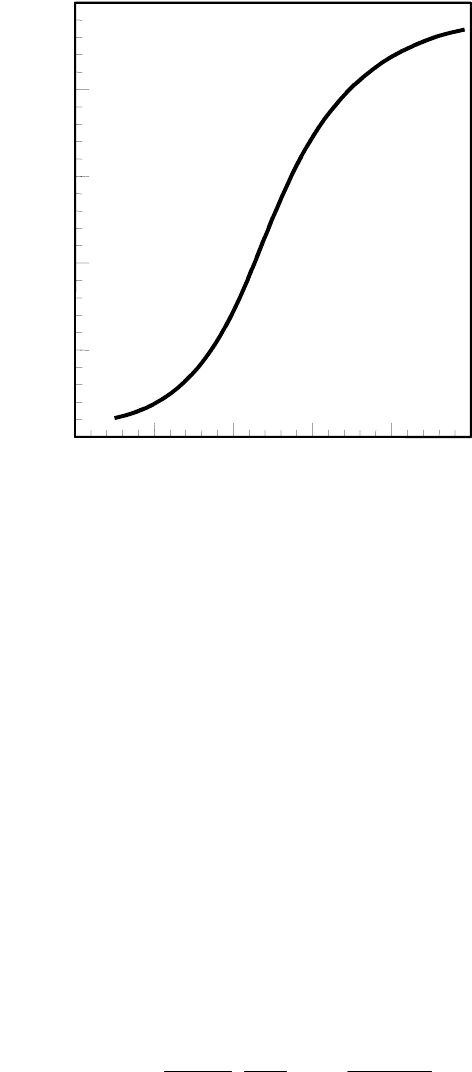
191
Температура
Типичная кривая плавления
вторичной структуры белков
Рис. 4.1
[
α
]
4.2.1 Дисперсия оптической активности
Под дисперсией оптической активности понимают зависимость величины
удельного вращения от длинны волны облучающего света. Теория этого явле-
ния в приложении к спиральным пептидным цепям (в том числе и в белках)
разрабатывалась Моффитом.
Дисперсия оптического вращения в простых случаях соединений с от-
дельными хиральными атомами углерода описывается уравнением Друде:
[] []
m
n
Ma
λ
α
λ
λλ
=
+
⋅=
−
3
2
2
0
100
00
2
2
0
2
Оно хорошо согласуется с опытом при длинах волн не слишком близких к по-
лосе поглощения атомов или групп, соседних с асимметричным атомом угле-
рода (λ
0
). Системы, которые описываются одночленным уравнением Друде
имеют простые кривые оптической дисперсии. В то же время, для многих сис
