Рубин А.Б. Современные методы биофизических исследований (Практикум по биофизике)
Подождите немного. Документ загружается.


Так
как обычно / > ft, то Р
х
"р Р
г
- Следовательно, при исследо-
вании
слабоокрашенных или прозрачных образцов оптимальной
является схема освещения под
углом
90°.
В
другом
предельном
случае
интенсивно окрашенных образ-
цов для мощности рассеянного излучения получаются выражения
Я,
-
АР
0
Цг
(v
0
)e (v) cb];
P
t
~APj[z
(v
0
)
+e(v)],
из
которых
следует,
что Р
г
< Р
2
.
Таким
образом, из проведенного анализа видно, что
схему
с уг-
лом 90°
между
возбуждением и регистрацией целесообразно исполь-
зовать для снятия нерезонансного КР. Для схемы с
углом
180°
сигнал КР растет с увеличением концентрации резонансно рассе-
ивающих молекул при малых концентрациях и почти не зависит от
нее для значений [е (v
0
) + e (v)] cb > 3. Эта схема наиболее оп-
тимальна для снятия спектров резонансного КР. Плотность мощ-
ности возбуждающего света, используемая для снятия КР-спектров
в
схеме
с
углом
180°, меньше, чем в
схеме
с
углом
90°. Основные па-
раметры лазерного спектрометра КР: 1. Я, возбуждающего излуче-
ния
—
441,6;
488; 514,5; 633 нм. 2. Полуширина аппаратной функ-
ции
монохроматора на длине волны 500 нм ^ 1 см
-1
. 3. Обратная
линейная
дисперсия монохроматора — 0,45 нм/мм. 4. Коэффициент
подавления остаточного рассеянного излучения при возбуждении
излучением К = 441,6 нм и отстройке 40 см"
1
от возбуждаю-
щей линии и ширине щелей, соответствующих разрешению 4,4;
6, 6 и 8, 8 см"
1
, составляет соответственно 10
7
'
7
; 10
7
и 10*
>в
. 5. Ско-
рости сканирования спектра —
0,012;
0,04; 0,35 и 1,1 нм/мм.
6. Спектры хлорофилла и его производных (коэффициент экстинк-
ции
10
5
л-моль"
1
см"
1
) записываются при концентрации пигментов
10~
4
и выше. 7. Регистрация сигналов КР осуществляется в диапа-
зоне изменения скорости счета фотонов от 60 до 5-10* имп/мин.
Использование автоматизированной системы регистрации спект-
ров КР позволяет существенно упростить их обработку и получить
значительно больше информации по сравнению с регистрацией в сис-
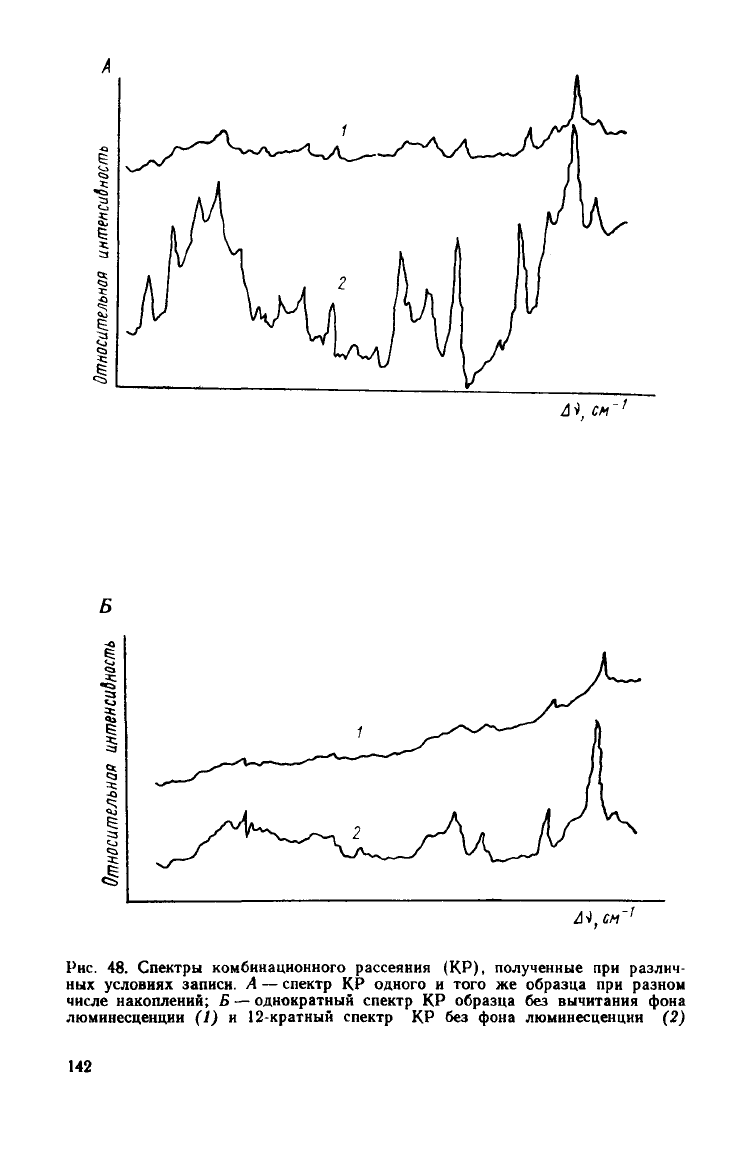
теме ФЭУ — усилитель — самописец. В качестве демонстрации воз-
можностей разработанной системы регистрации на рис. 48, А приве-
дены спектры одного и того же образца с разным числом накопле-
ний.
При числе накоплений N в 16 существенно улучшается от-
ношение
сигнал/шум (в Y~N — 4 раза), что позволяет увеличить
интенсивность регистрируемого спектра.
Биологические объекты представляют собой многокомпонентные
системы, содержащие большое число люминесцирующих пигмен-
тов. Поэтому при многократной записи спектров происходит накоп-
ление люминесцентного фона, полностью маскирующего спектр
КР.
Разработанная система регистрации позволяет осуществить
вычитание фона люминесценции и, таким образом, реализовать
запись спектров КР люминесцирующих объектов. Из сопоставления
141
Д-).
см'
Д1.СН
-1
Рис.
48. Спектры комбинационного рассеяния (КР), полученные при различ-
ных условиях записи. А — спектр КР одного и того же образца при разном
числе накоплений; Б — однократный спектр КР образца без
вычитания
фона
люминесценции (/) и 12-кратный спектр КР без фона люминесценции (2)
142

спектров (рис. 4.8. Б) видно, что описанная система регистрации дей-
ствительно позволяет исследовать спектры КР окрашенных и лю-
минесцирующих образцов.
Использование многоканального анализатора в системе регист-
рации
спектрометра позволяет осуществлять целый ряд операций,
облегчающих снятие и интерпретацию спектров. Особенно важно
отметить возможность нормирования различных спектров и их срав-
нения
(вычитания) и сочетания анализатора с ЭВМ, что позволяет
автоматизировать процедуру обсчета спектров.
В свою очередь, ЭВМ снабжена необходимым набором программ
для анализа как спектра в целом, так и его отдельных линий. В част-
ности,
отдельная широкая полоса может быть разложена на ком-
поненты,
что важно для извлечения отдельных линий из уширен-
ной
полосы, являющейся суперпозицией вклада элементарных ко-
лебаний атомов или групп атомов молекул — компонентов иссле-
дуемого
соединения.

Глава
IV
Методы
изучения
ионной
проницаемости
биологических
мембран
§
1.
Микроэлектродные
методы
Микроэлектроды широко используют при изучении таких мембран-
ных процессов, как возбуждение нервных и мышечных клеток, хемо-
и
фоторецепция, преобразование световой энергии в хлоропластах,
движения в растениях и простейших. Изучение электрических свойств
мембран отдельных клеток
дает
важную информацию о механиз-
мах действия фармакологических агентов и природных физиологи-
чески активных веществ, позволяет проследить за изменениями
электрических свойств клеток в процессе эмбриогенеза, при росте
растений, запуске фотосинтеза.
Одна из
основных
функций
клеточный
мембраны
состой! в под-
держании трансмембранных ионных градиентов и селективного
транспорта веществ
между
цитоплазмой и средой.
Ионный
баланс
поддерживается благодаря наличию в мембране пассивных прово-
дящих путей — селективных ионных каналов, а также систем ак-
тивного транспорта и обменного транспорта ионов. В специализи-
рованных клетках различных видов выявлены системы активного
транспорта Н
+
, Са
2+
, Na
+
, Cl~ и
других
ионов. Для идентификации
активных и пассивных ионных потоков в различных типах клеток не-
обходимо иметь сведения о стационарной величине мембранного по-
тенциала и внутриклеточных концентрациях ионов. Основой для
гакого анализа
служит
электродиффузионная теория, согласно ко-
торой поток J независимо движущихся ионов в однородной
среде
144

пропорционален действующей силе — градиенту электрохимиче-
ского потенциала (d
/=
—
cud\i,'dx
— — uRTdc'dx
—zFcudy/dx,
(IV. 1.1)
где ^Г = |л
0
—(— RTlnc 4-
zFq>;
\x
0
— стандартный химический
потенциал; с, и, г — концентрация, подвижность и валентность
иона
соответственно; ф — электрический потенциал.
Суммарный поток J
t
представляет собой разность встречно на-
правленных односторонних потоков (У,- = / — /). Можно показать
что односторонние пассивные потоки связаны
между
собой соотно-
шением Уссинга:
///"в
cJCi
ехрр>
= ехр[р(ф
0
—ф)],
(IV. 1.2)
где $ =
zF/RT;
ф
0
— равновесный потенциал для данного иона, оп-
ределяемый по формуле Нернста:
Ф
0
= [/?Г/(г^)]1п(с
о
/с
г
). (IV. 1.3)
Выполнение соотношения (IV. 1.2) при подстановке
всех
входя-
щих в него величин — односторонних потоков, внутриклеточных
концентраций
и мембранного потенциала —
служит
критерием
того, что перемещение ионов в обоих направлениях через мембрану
происходит пассивно и независимо, без участия специфических пере-
носчиков
и активных транспортных систем.
Предварительное заключение о механизмах поддержания нерав-
номерного распределения ионов
между
клеткой и средой может
быть сделано без измерения ионных потоков, на основании сравне-
ния
измеряемого мембранного потенциала ф с равновесными потен-
циалами ф
0
для различных ионов. Близость значений ф и ф
0
ука-
зывает на преимущественно пассивное распределение данного иона
между
водными фазами мембранной системы, а значительное рас-
хождение значений — на существование в мембране специфиче-
ских транспортных систем, препятствующих выравниванию элект-
рохимического градиента данного иона.
Можно получить выражение для мембранного потенциала, созда-
ваемого пассивной диффузией:
RT
1п
Я
к
[Ко]
+
Р,
а
[Ма
о
]
+
Р
с1
[С1
г
]
F ^lKl^
[№]
+
Р[С1]
Принято
считать, что мембранный потенциал нервных и мышечных
волокон,
а также некоторых
других
животных клеток обусловлен
в
основном диффузией ионов К, Na и С1 по концентрационным
градиентам.
Однако в некоторых объектах (харовые водоросли, клетки выс-
ших растений) мембранный потенциал намного превышает по аб-
солютной величине значения равновесных потенциалов для любого
145

из
перечисленных ионов, что указывает на существование в мемб-
ране дополнительных генераторов потенциала —
электрогенных
ионных
насосов.
Эти мембранные ферменты транслоцируют заряд
через мембрану и способны преобразовывать энергию АТФ или оки-
слительно-восстановительных реакций в электрическую форму.
Нативную клеточную мембрану можно уподобить насосу с
утеч-
кой
и представить ее в виде эквивалентной электрической схе-
мы,
содержащей два параллельных участка с собственными ЭДС
и
проводимостями.
Микроэлектроды позволяют регистрировать не только стационар-
ные параметры клеточных мембран, но и переходные электрические
процессы, вызываемые различными воздействиями. Наиболее под-
робно изучены явления электрической возбудимости нервных и мы-
шечных волокон.
Мембранные электрические процессы играют
ключевую
роль
в
механизме синаптической передачи возбуждения, а также в хе-
мо-,
фото- и механорецепции.
Одна из основных проблем биофизики мембран
—проблема
био-
энергетики.
Центральная роль в преобразовании энергии света и
редокс-процессов в энергию АТФ и
другие
виды работы в мембран-
ных системах хлоропластов и митохондрий принадлежит трансмем-
бранному электрохимическому градиенту протонов, который вклю-
чает
два компонента: мембранный электрический потенциал и транс-
мембранный градиент рН.
Прямые
измерения
электрического
потенциала
на энергосопря-
гающих мембранах крупных хлоропластов в ряде отношений ока-
зываются предпочтительными по сравнению с оптическими метода-
ми
регистрации. Эти преимущества связаны с проведением экспери-
ментов на отдельных пластидах, высоким отношением сигнала к шу-
му и возможностью использовать световые импульсы произвольной
длительности.
Индукционные
изменения
мембранного
потенциала
регулируют
перемещение ионов
между
тилакоидами и стромой хлоропласта,
влияя
косвенно на активность катионзависимых ферментов цикла
Кальвина.
Микроэлектроды используют не только для регистрации мембран-
ных потенциалов, но и в
других
целях: для электрической стиму-
ляции
возбудимых клеток, измерения проводимости мембран, элект-
рофоретической инъекции заряженных веществ.
Методом
инъек-
ции под давлением в клетки вводят не проникающие через мембра-
ну красители, по распространению которых в примыкающие клетки
можно
судить
о наличии межклеточных контактов. Таким же спо-
собом в клетки вводят фотобелок
экворин,
используемый в качестве
флуоресцентного зонда для регистрации внутриклеточной концент-
рации
Са
2+
при различных воздействиях. Пропускание тока через
микроэлектрод
дает
возможность смещать мембранный потенциал
и
наблюдать за изменениями функциональной активности клетки
146

или
субклеточных
структур.
Например, приложение внешнего
электрического поля изменяет
выход
флуоресценции хлоропластов,
что
свидетельствует
о модификации переноса электронов в реакци-
онных центрах фотосистемы II. Контролируемое пропускание тока
через внутриклеточный электрод в целях смещения мембранного по-
тенциала составляет основу
метода
фиксации
напряжения
—одного
из
важнейших методов исследования возбудимых мембран.
Усовершенствование микроэлектродных методов привело в пос-
ледние годы к созданию
ион-селективных
электродов,
позволяю-
щих измерять активность К.'
1
", Н
+
, Са
2+
, С1~ и
других
ионов
в
живой клетке. Ион-селективные электроды готовят из обычных
микропипеток,
заполняя гидрофобизированный кончик пипетки
жидким ионообменником или раствором нейтрального переносчика.
При
измерениях внутриклеточной активности ионов помимо ион-
селективного датчика в клетку вводят второй микроэлектрод, кото-
рый
служит
электродом сравнения.
Широкое
распространение получили микропипетки, сочетаю-
щие в себе
микроэлектрод
с
микроприсоской.
Такие электроды не
вводят внутрь клетки, а подводят вплотную к клеточной мембране
и
слегка втягивают мембрану в присоску. С помощью таких электро-
дов регистрируют токи одиночных ионных каналов в нативнои мем-
бране. Микроэлектроды, совмещенные с микроприсоской, обеспечи-
вают
высококачественную электрическую изоляцию в области кон-
такта мембраны со стеклом, благодаря
чему
они оказались
удоб-
ным
инструментом и при регистрации мембранных потенциалов
в
клетках малых размеров (диаметром до 10 мкм). Для проведения
таких измерений после подсасывания клетки к микропипетке мемб-
рану прорывают импульсом давления или электрическим током,
в
результате
чего
устанавливается контакт с внутриклеточным со-
держимым. При этом клетка не
получает
значительных поврежде-
ний.
В последующем изложении перечисленные методы начиная
с микроэлектродной регистрации биопотенциалов рассмотрены бо-
лее подробно.
Микроэлектродные методы
дают
возможность регистрировать из-
менения
мембранного потенциала с временным разрешением 10—
100 мкс в функционирующей клетке, не нанося ей существенного
повреждения. В отличие от прямых электрических измерений ре-
гистрация мембранных потенциалов с использованием потенциал-
чувствительных красителей
зачастую
оказывается более инерцион-
ной
и сопряжена с побочным токсическим действием красителей.
Попытки
измерять мембранный потенциал растительных клеток по
распределению проникающих ионов (типа тетрафенилфосфония)
осложнены связыванием этих ионов с мембраной, что приводит
к
ошибочным значениям (расхождение с реально измеряемыми зна-
чениями
достигает нескольких десятков милливольт).
Для микроэлектродных измерений пригодны клетки диаметром
не
менее 10 мкм. Хотя таким способом
удавалось
измерять мембран-
147

ный
потенциал эритроцитов человека,
в
ходе
измерений наблюда-
лось быстрое разрушение клеток.
При
работе
с
мелкими клетками
сказывается
и
утечка
электролита
из
кончика микроэлектрода,
приводящая
к
изменению ионного состава цитоплазмы.
При
измерении мембранного потенциала
в
клетку вводят микро-
электрод, который устанавливает контакт
между
внутриклеточной
средой
и
неполяризующимся хлорсеребряным
или
каломельным
электродом сравнения. Второй идентичный электрод сравнения
по-
мещают
в
наружный раствор. Разность потенциалов
между
элек-
тродами измеряют электрометрическим усилителем.
В
рассматри-
ваемой электрической цепи скачки потенциала
на
двух
электродах
сравнения
взаимно компенсируются; диффузионный потенциал
на
кончике
микропипетки сравнительно
мал, так как
подвижность
диффундирующих
из
кончика
К
+
и
С1~
в
водных растворах одина-
кова. Поэтому измеряемая разность потенциалов обусловлена прак-
тически полностью скачком потенциала
на
клеточной мембране.
Внутреннее сопротивление вольтметра должно намного (более
чем
в
100 раз)
превышать сопротивление внешней цепи. Несмотря
на
заполнение микроэлектродов концентрированным раствором
КС1,
их сопротивление остается достаточно высоким
и
составляет
10—
100
МОм. Для
измерения потенциала
в
такой цепи необходим
электрометр
с
входным сопротивлением
не
ниже
10 ГОм.
§
2. Свойства микроэлектродов
Микроэлектродами
принято называть капилляры
из
химически
стойкого стекла
с
оттянутым тонким кончиком, заполненные раст-
вором электролита,
хотя
в
действительности настоящий электрод
образуется
при
контакте металла
с
электролитом. Микроэлектрод
—
это только солевой микромостик, позволяющий установить элек-
рический контакт
с
внутриклеточной средой. Диаметр кончика
стандартных микроэлектродов лежит
за
пределами разрешающей
способности светового микроскопа,
т. е.
составляет менее
0,5 мкм.
Минимальные размеры кончика,
судя
по
электронным микрофото-
графиям,
не
превышают
0,05 мкм.
Потенциал
кончика. Для
заполнения микроэлектродов обычно
используют концентрированный раствор
КС1.
Благодаря одинако-
вой подвижности
К
+
и С1~ в
воде
(и
+
= ы_)
диффузионный
потенциал, определяемый формулой
примерно равен нулю. Однако полностью избежать появления скач-
ка
потенциала
между
микроэлектродом
и
средой
не
удается. Вели-
чина потенциала кончика зависит
от
физических свойств стекла
и
возрастает
с
уменьшением толщины кончика.
При
обламывании
мик-
ропипетки
потенциал кончика исчезает. Возникновение потенциала
148

Рис.
49. Схема кончика микроэлек-
трода. А — упрощенная эквивалент-
ная
электрическая
схема;
Б — геоме-
трия кончика микропипетки:
Д
о
— сопротивление отверстия микропипет-
ки.
Re — сопротивление стенок капилля-
ра, Як — сопротивление электролита в
канале микропипетки, Е — разность скач-
ков
потенциала на наружной и внутрен-
ней
поверхностях стекла, С — емкость кон-
чика;
остальные объяснения см. в тексте
кончика
связано с ионообменными свойствами стекла и низким со-
противлением стенок капилляра в оттянутом носике микропипетки.
На
рис. 49, А показано, что электрическая цепь
между
средой
и
пипеткой замыкается не только через отверстие микропипетки,
но
частично и в
обход
его через тонкие стенки в области кончика.
Показанная
на
схеме
ЭДС отражает разность скачков потенциала
на
границах стекла с раствором. При погружении микроэлектрода
в
разбавленные солевые растворы потенциал кончика имеет отрица-
тельную
величину, точно так же как приобретает отрицательный
потенциал стеклянный калиевый электрод в
среде
с низкой кон-
центрацией К
+
•
Влияние ЭДС, включенной параллельно основному
пути тока, становится тем заметнее, чем меньше сопротивление
стенок капилляра.
Появлению
потенциала кончика также способствуют электро-
отрицательные атомы кислорода, входящие в
структуру
стекла.
Внутри капилляра вблизи отрицательно заряженной поверхности
создается избыток подвижных катионов, но понижена концентра-
ция
анионов. Основными носителями заряда в области двойного
слоя становятся катионы, в
результате
чего
на кончике микро-
электрода возникает диффузионная разность потенциалов со зна-
ком
«—» внутри кончика.
Потенциалу кончика свойственна зависимость от ионного состава
среды. Для того чтобы избежать ошибок в определении потенциала
покоя,
микроэлектроды сортируют и отбирают только те, у которых
потенциал кончика не превышает 5 мВ.
Диффузия
электролита.
При работе с мелкими клетками
следует
учитывать возможную диффузию электролита из кончика микро-
электрода в цитоплазму. Если
радиус
отверстия микропипетки ра-
вен а, а
угол
схождения кончика в радианах — 26 (рис. 49, Б),
то скорость диффузии КС1 из микроэлектрода в изотонический
раствор электролита рассчитывают по формуле
а = —
DnaQc,
149

где
D —
коэффициент диффузии,
с —
концентрация заполняюще-
го электролита. Расчетная скорость диффузии
КС1 из
микроэлект-
родов
с
диаметром кончика
0,2 мкм
составляет
5-10~
14
моль/с.
Такая
утечка
КС1
не
должна влиять
на
ионный состав сравнительно
крупных клеток,
но
может приводить
к
набуханию таких мелких
клеток,
как
эритроциты. Экспериментально измеряемая скорость
диффузии
КС1 из
кончика микроэлектродов варьирует
от 10~
15
до
10~
14
моль/с. Диффузия
КС1 из
микроэлектрода
не
всегда
приво-
дит
к
набуханию
даже
мелких клеток, объемом порядка
1 пл.
Клетки
некоторых эпителиальных тканей
обладают
высокой
К
+
-
проницаемостью,
в
результате
чего
устанавливается стационар-
ный
поток
К
+
в
клетку
и из нее в
окружающий объем.
Сопротивление микроэлектродов.
Микроэлектроды
с
диаметром
кончика
0,2 мкм,
заполненные
3 М
раствором КС1,
обладают
сопро-
тивлением
от 25 до 50
МОм. Микроэлектроды
со
слишком высоким
сопротивлением имеют большой
и
нестабильный собственный потен-
циал,
плохо пропускают токи,
ухудшают
временное резрешение
системы.
Сопротивление микроэлектрода
R
зависит
от
геометрии кончика:
где
а —
проводимость заполняющего электролита
(26
См/м
для 3 М
раствора
КС1).
Проводимость идеальных растворов определяют
из
уравнения Нернста
—
Эйнштейна:
В уравнении
(IV.2.1)
не
учитывают,
что
проводимость раствора
в
кончике микропипетки неоднородна
по
длине вследствие диффузии.
Градиент концентрации электролита проявляется
в том, что
сопро-
тивление микроэлектрода зависит
не
только
от
проводимости запол-
няющего раствора,
но и от
концентрации солей
во
внешней среде.
Например,
10-кратное снижение наружной концентрации электро-
лита приводит
к
увеличению сопротивления примерно
в
пять
раз.
Вольт-амперные
характеристики.
Пропускание через микро-
электрод тока более
3 — 5 нА
часто приводит
к
изменению
его со-
противления.
Это
проявляется
в
нелинейной зависимости тока через
микроэлектрод
от
приложенной разности потенциалов. Форма
вольт-амперной характеристики зависит
от
диаметра кончика.
Микроэлектроды
с
низким сопротивлением
и
относительно широким
кончиком
сохраняют квазилинейные электрические характеристики
при
пропускании тока
до
десятков наноампер,
тогда
как для вы-
сокоомных электродов нелинейность проявляется
при
гораздо мень-
ших токах.
При
подаче
на
микроэлектрод напряжений
в
несколько
десятков вольт часто можно наблюдать хаотичные колебания тока,
объясняемые закипанием электролита
в
кончике вследствие очень
высокой плотности тока. Предельные значения тока, пропускаемо-
го через микроэлектрод, составляют около
1 мкА.
150
