Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


9чейки
очень
часто гермети3ируют
для
того'
чтобы иметь
во3мо)к-
:тость
со3давать
в
них
>!(елаемую'
например'
инертную атмосфру, осо_
фнно
над
расплавами'
содер)кащими
ионы' способные окисляться
или
восстанавливаться.
Фбычно еще
до
нагревания
во3дух
из ячейки.эвакуи-
руют'
расплавленньтй
электролит
выдерх(ивают
под
умень1ше!|нь1м
давле'
1пйем,
йтобы
удалить
и3 него
растворенные
га3ь|.
3атем га3овое
простран-
ство
ячейки заполняют
чисть1м
аргоном
или
гелием.
йногда
для
этого
исполь3уют
так)ке
азот.
Фднако
при высоких
температурах он
проявляет
3начительную
реакционную
способность
по
отно1шению
ко
многим
мате_
риалам
электродов.
3лектролиты,
содер)кащие
соли'
которые
легко гидроли3уются
'и
поэтому с
больтцим
трудом
получаются
в чистом
фзводном
состоянии'
например
хлоридь1
бериллия,
титана'
циркония'
гафния,.-тория'
урана
и т.
п.,_:{елесообразно
готовить
непосредственно
в
ячейках анодным
растворением
соответствующих
металлов. 3тот способ
особенно
}Аофн
для
получения
растворов
солей
в
расплавах
хлоридов
щелочных
или
щелочно3емельньтх
металлов.
Фн
дает
во3мо}кность
тонко
регулировать
концентрацию
потенциалопределяющих
ионов в электролите
и сра3у
х{е
,получать
равновеснь1е
с
металлическими
электродами
смеск
катионов
ни31пих
и вь1с1пих
валентностей.
|1ри анодном
растворении
металла
в качестве катода
мо}кно исполь_
.зовать
хлорный
электрод'
находящийся
3а
диафрагмой'
причем
лучтпе
на силитовой,
а
не
угольной
подкладке'
которая
во
время электроли3а
ра3рушается.
|_[елонньте
или
щелоч!|о3емельньте
металль|
на нем
не
вы-
деляются'
а
происходит
иони3ация хлора:
€\"+2е_--12€1!'"',).
йзотерминность
солевь|х
расплавов'
погрух(енных в
них электродов
и
ра3деляющих
их
диафрагм
офспечивается
тем' что
ячейки
помещают
в
массивнь|е
металлические
блоки
с
больтпой тепловой
инерт{ией,
которые
нагреваются
в электрических
печах
сопротивления
с
автоматическиш
Ргулированием
температурь|.,[!аттиками
для
терморегуляторов
слу)!(ат
термопарьт
или термометры
сопротивления'
находящиеся
в
блоках.
1ем'
пература
в ячейках
и3мер_яется т€рмопарами'
погру}кеннь|ми
в электро-
.литы
'во3ле
электродов.
йеталлы
термопар 3ащищаются
от
непосред_
ственного
контакта с
электролитом
чехлами' сделанными
из
материалов'
которь1е
не взаимодейству:от с
солевыми
расплавами
в
ячейке.
Ёух<но стремиться
к
тому'
чтобы отвод
тепла от
ячейки
бьтл возмох<но
мень[шим.
с этой
целью
токоподводь|
к
электродам
делают
тонкими
,и
длинными'
пропуская их чере3 зону
обогрева. |'аз,
например
хлор'
подаваемый в
янейку на газовый электрод'
предварительно
нагревают
до
рабоней
температурьт.
14наче
электродный
потенциал
начи_
нает
(чувствовать)
скорость
подачи
газа
в
ре3ультате
и3менения
темпе'
ратуры.
-
[]рактинески
трудно со3дать
янейки,
в
которых
электродитами
-бьтли
'бы
нё
растворы'
а
чистые
летучие
хлориды таких
металлов'
как Фрил_
лий,
ширконий.
и т. п.
в них
ра3виваются
высокие
давления
паров'
поэтому стенки
таких ячеек
дол)кнь1
обладать
боль:пой
механической
прочностью при высоких
температурах.,|!1ногие
металль[' обладающие
цу}кными
механическими свойствами,
ока3ь1ваются непригоднь1ми
для
их
и3готовления'
так
как
взаимодействуют с
парами
хлоридов.
Ёеобходимо
'офспечить
и3отермичность
всей ячейки.
Ёсли
>ке
температура
какой-либо
части ее будет
ни}ке' то
весь электролит соберется
там. 1ребование
и3о'
'термичности
привносит
массу осло>кнений
в конструкции,
например'
проблему
уплотнения
и
электрической изоляции
токоподводов к
электродам.
||одробное
описание
ячеек
ра3нь|х
типов мо)кно
найти
в многочис'
.лен[{ь1х
работах,
посвященных
термодинамике
высокотемпературнь[х
про'
цессов'
а так'(е
и3учению металлических
сплавов и
расплавленных
солевых
систем. Ёаиболее
тйпичные
и3 них показаны
на
рис.
1.
4,

$
2. йеталлические э^ектродь| сравненпя
в
расп^ав^еннь[х
хлориднь[х
а^ектро^итах
3лектрод сравнения
долх{ен
отвечать
ряду
требований. Фсновньтми
и3 них являются
устойтивость
и воспрои3водимость его
потенциала при
работе
в ячейках в
сочетании с
другими
электродами
разнообразньтх
типов. А это
практически вьтполнимо ли11]ь в том случае' когда материал
электрода и окру}кающий его электролит
устойнивьл
в
работе
и
легко.
воспрои3водимьт
в
отдельнь!х опь1тах.
€ушественную
роль
играет
кон*
струкция электрода. Фна
допкна
бьтть во3мох(но более
простой
в
испол_
нении
и
наде>кной в
работе.
3лектрод с окрух(ающим его электролитом
обь:чно
капсулируют' т. е.
помеща1от в
отдельнь!й сосул.
3лектринеский
контакт
с
электролитом в полуэлементе с
исполь3уемым
электродом
осу]]дествляется чере3
диафрагму,
которой
могут слу}кить пористые
стен-
ки
тиглей или
3акрь|ть1е
асфстом
отверстия в
стеклянных,
фарфоровьтх
или
кварцевьтх пробирках.
111ирокое
применение получили металлические электроды сравнения..
Фни представляют
собой
чистьте
металль]'
погрух(еннь1е
в
солевь|е
рас_
плавь1
определеннь]х
составов
со
строго
фиксированной
коншентра[ией
(активностью)
потеншиалопределяющих
ионов.
}1еталл
не
дол}кен
взаимо-
действовать
с материалом стенок
сосуда'
в
котором находится электролит.
14наче
происходит
бестоковь:й
перенос
его
с электрода на сте|{ки
3а
счет
дисг{ропорционирования
катионов низгпей валентности. 9то нару1цает
равновесие
ме)кду электродом и
электролитом' что приводит
к
неустой-
чивости электродного
потенциала.
Ё{ух<но
следить 3а тем' чтобьт концент_
рация
ионов металла в течение
всего
опь]та
не менялась в
ре3ультате'
улетучивания
его хлорида
и3 электроли?а или
в3аимодействия
с газовой
фазой,
например' кислородом
во3духа.
Более
устойнивы
в
работе
элект_
родь|
сравнения и3 относительно электрополох{ительнь!х
металлов'
не'
взаимодействующих с
материалами' и3
которь]х
обычно
делаются
вь|со_
котемпературньте
ячейки
(фарфором'
тугоплавкими стеклами, кваршем)-
Фбзор литературь|
по
электродам сравнения
дается
в
книгах
Аели-
марского и &1аркова
|2],
[\ейти
[65]'
Алабь!шева' ./|антратова
и йора-
чевского
[66].
Авторьт
последней по,:1робно
рассматривают
конструкции'
теорию
работьт
уа области применения
всех и3вестнь1х
до
1965
г.
элект;
родов
сравнения
с
расплавленнь|ми
солевыми электролитами. |[оэтому
мь! остановимся кратко только
на тех металлических электродах' которь1е
наиболее
часто исполь3уют
в
ячейках с
расплавленнь1ми
хлоридами.
€вшнцовьсе элекгпрФьс.
€винец
плавится
при
327' с, так
что в кон-
такте
с
электролитами и3 более
тугоплавких
солей'
в том
числе Рьс1!
(т.пл.
498'с),
он
находится в
х(идком
состоянии.
]окоподвод
к
х(ид_
кому металлу'
помещаемому в
стеклянной,
фарфоровой
или
кваршевой'
пробирке, обычно
делают
и3 >келе3ной,
плолибденовой
или вольфрамовой'
проволоки'
3ащищаемой
от соприкосновения
с электролитом
фарфровой.
илр1
кваршевой
трубкой.
[елезо
не
растворяется
в
расплавленном
свин_
ше,
а молибден
и
вольфрам
электрополо}(итель!!ее
его и
поэтому
не влия_
ют на потенциал свинцового электрода.
Б
качестве электролита берут'
чистьтй х<идкий
хлорид
свинца
ил\4
его
растворь|
в
расплавленных
хлоридах
щелочнь]х
металлов.
3.д.
с.
гальванического элемента
Рб1*1
|
Рб€121*1
|€1'с":,
€
измерялась.
в
3ависимости
от т€мпературы
многими
исследователями
в янейках
ра5-
нь1х конструкший.
||о
данньтм
.[{оренша
и Фельде
[67],
а так}ке
6олстро--
ма
[63],
она
равна
в:\,78!7
-6,5.10-47+0,0015
с.
]4ньте
3ависимости'
бьтли
-
установле|{ь|
Бахтером и [ильдебрандом
[69]:
е:\,7561
_
._
6,25.!0_4| в,
а
так;(е
Артамоновьтм
|70|:
в:1,728
-
5,вв.\0-ц7
в.
йзмерения с помощью :плейфного
осциллографа, который
фиксировал
потенциал свинцового анода
в
расплаве
Рб€1, по
отно[цению
к хлорному'
электроду в моменты
вь1ключения
поляри3ующего тока'
дали
величину'
42

о:|,75
_
6,2.70_4т
в
|7|].
Ёапря:кение
разло)кения
)кидкого
_ Р!-€1''
рпределенное
с электронйьтй
коммутатором'
получилось
равнь1м
е: 1,685
_
_'5,41 .10_4т
в
[72,73].
Раснет
из
и3вестнь]х
термодинамических даннь|х
для
Рьс12
(см.
гй. у,
$
2)
дает
€:1,697-
5,3'\0_'7
в.
исследователями'
и
отклонения
их
от
величинь1'
найденной
термодинами--
ческимрасчетом,являютсяследствиемнеконтролируемь1хнару1пении
равновесия
мех{ду
солевь1м
расплавом
и электродами'
особенно
хлор_
'нйй
1т+1.
Б
какой-то
мере
это*свя3ано
с
тем'
что металлический
свинец
растворяется
в
распла,'Б""'*
РБ€1, с обра3ованием
субхлорищ
|75_77|'
Ёъсг;';
Рь?с1;
|78,79|.
Ра_створийость
металла
невелика.
Фна
состав_
;;;6;б',
о/ь6ь{й
0,'т23'мол.,/,
соот"етст"енно
при
600, 700
и
300'с
[в0|.
,€толь
не3начительнь|е
концентрации
субхлорида
не ока3ь!вают
практи-
чески
никакого
влиян|4я
Ёа
вя3кость
и электропроводность
расплавов
Рьс12
[81],
но
могут
вь13вать
деполяри3ацию
хлорного
электрода.
Б
Ёределах
отшйбок
измерений
экспериментальнь1е
з[|ачения
э.
д.с.
при
ттт_э6о'(
вполне
удовлетворительно
согласуются
друг
с
другом'
3 этом
интервалетемпературпотенциалсвинцовогоэлектродаврасплавленном
Рб€1,
на |,255:1,]05
в отрицательнее
потенциала
хлорного
электрода.
_
в"
расплавлен""*
с*ес"х
с
х_л-оридами
щелочнь|х
металлов
Рб€1,
об_
ра3ует
комплексньте
ионы
[в2'
83].
14х
прон-ность^^во3растает
с
увеличе_
нием
радиуса
катионов
щелочнь]х
металлов
[84-в9].
|{оэтому
в сме1пан_
ных
х"торидньтх
электролитах
потенциал
свинцового
электрода
опреде-
ляется
йе
только
кон:{ентра:{иФ
ионов
свинца,
но
зависит
так>ке
от
природь{
соли-растворителя.
||ри одинаковьтх
концентра-ц-ия:'_:-::'ч
пературах
он
смещается
в сторону
более
электроотрицательнь|х
3начении
по мере
увеличения
радиуса
катиона
соли
средь]
в
ряду
!1€1-\а€1_
-кс1_&ьс1_€з€1.
йо
о6стоятельство
3атрудняет
сопоставление
ре3уль_
татов
измерений,
вь]полненнь|х
со
свинцовьтми
электродами
в
ра3ньтх
"электролитах.
Аля
этого
ну)кно
3нать
не
только
температурную'
но
и концентрационную
3ависимость
их потенциалов.
Б качестве
электролита
для
свинцовь1х
электродов
сравнения
обьтчно
берут
растворь1
Рб61,
в
расплавах
эвтектической
сптеси
хлоридов
л|4т\4я
и калия
или
эквимойьно?:
смеси
хлоридов
натрия
и калия.
Б литературе
имеются
работьт,
в которь|х
бьтли
измерень1
ра3ности
потенциалов
ме)кду
ёвинцовьтй
и хлорнь1м
электродами
в этих
расплавах
в 3ависимости
от
концентрации
хлорида
свцнц4
и
температурь]'
..
Аля
",ёек
.
р'Б.Ё'йй
ЁБс:,
в
рас,йав1ённой
эвтектике
||с1_кс1'
по
данным
?акахаси
[90],
РБ€1"'
мол.
о/'
е,
в
50,0
1
,781-6,1
.10-'4
4о
'2
|
,787-6
,0.70_4т
30;0
1,795-5,9.10-4г
20,|
1,804-5,8.10-4г
9нг
и {,удсон
[91]
лают
несколько
инь!е
3ависимости:
РБ61', мол.
о/'
е'
в
10.0
1
,826-5,6.10-4г
5;0
1,837-5'4'1о-4|
1
,0
1
,846-4,8.10-4г
8,
6
РБ€19'
мол.
о/,
о'
8
1
'
763-6
,00
.
10_4
г
2
,23
\
'7^5-'-+
'?1'|9_:|
|''}эб-ц',в1
.то-,т
1',64
1
,
673-3,08'
10_4
г
1
'73|-4,28.10_4т
РБ€1,
'
мол.
0/'
55
,50
13,90
4,77
.
,[1ля
янеек
с
растворами
Рб€1,
в
расплавленной
эквимольной
смеси
'шаб-кс:
бьтли
|олувеньт
с,педующие
значения
э'
д'
с'
[92]:
РБ€1',
мол'
о/'
е,
в
19,3
1,745-4,8.7о_4т
в
;
35
\
,7
4о_4
,2
.
|о_цт
4:99
1
,74|-4 ,о.1о-4т
2"56
1,768-3,9.10-4г
2',0\
1
,768-3
,8
.
10_4г
РБ€!',
мол.
0/9
е'
в
0.76
1
,737-3 ,1
.7о_4т
о''2\
|,741_2,6.1о_4т
0.071
1,778-2,5.|0-4т
0;031
1,729-|,7.|0_4т
43

3
расплавах'
содер}кащих
менее
10
мол.% Рьс!2,
коэфициент актив_
ности ионов
свинца остается
практически (в
пределах
точности и3мере_
ний э.
д.
с.)
постоянным.
йеталлический
свинет1
растворяется
в
расплавлен|{ь'х
смесях Рьс12
с хлоридами
щелочных
металлов
[93],
но в
мень1пей степени' так как
вь|сшая
валентная
форма
(Рба+;
стабилизируется в
ре3ультате
образования
комплексньтх
ионов
(рю:?-).
&1еталл не переносится
на
стекляннь1е,
фар-
форовь:е
или кварцевь:е ячейки' так
как он не взаимодействует
с этими
материалами.
Фднако ионь| низтпей валентности'
попадая на
другие
электроды
в отсутствие
диафрагмь|'
могут
оказьтвать влияние на их по_
теншиалы.
€винцовьте
электродь[ сравнения исполь3овались
при
.
измере!!иях
равновеснь|х
потенциалов титана
!94]
и
ванадутя
[95],
при и3учении
катодной поляризации
свинца
|78|
и
висмута
[96],
анодной
поляри3ации'
цинка
[97],
ниобия
[98]'
тантала
[99].
€еребряньсе элекгпрйьс. €еребро
относится
к
электрополох<ите}тьным
металлам'
не
взаимодействующим
с
материалами'
и3
которь|х
обычцо
делаются
ячейки
для
потенциометрических
и3мерений
при высоких тем_
пературах. Фно плавится
при
961'€,
поэтому
для
работьт
при более
ни3ких
температурах электрод мо}1(но
изготовдять из
серебряной прово-,
локи или пластинки.
€еребряньтй электрод необходимо
помещать в отдельном
сосуде
с плотной
диафрагмой,
осоФнно в тех
случаях'
когда
он сочетается
в элементах
с
электродами и3
более электроотрицательных
металлов
(Фриллия,
титана'
циркония'
тория'
урана
и
др.).
[:1оньт
серебра окис-
ляют их и часто образуют при этом
сплавь!.
Б
результате
концентра-
ционных
изменений
в
электролите
и
сплавообразования на
исследуемь|х
электродах могут происходить
3начительные
и притом
трудно контро-
лируемые
и3менения их потенциалов.
€еребрянь:й
электрод
!1]ироко исполь3уется
при исследованиях
хло-.
риднь|х расплавоР'
поэтому
описа1{ие
его' и3готовления
и
устройства
мохшо найти
во
многих
работах
[100_109].
Б
качестве
диафрагмьл
часто
исполь3уют не
пористь1е'
а спло1ш!!ь!е
стенки
стекляннь|х
или
фарфровь:х
пробирок,
чере3 которые ток
переносится
в
основном
катионами
щелоч_
ных
металлов.
!,ифузия
:,лонов
А9+ чере3
них очень не3начите.,|ьна.
(ак
у}ке
говорилось в
предыдущем
параграф, поведение
подобных.
диафрагм
в
расплавленных
хлоридах
выяснено
еще
далеко
неполностью'
ософнно
в
тех случаях'
когда
электролиты
по обе
стороны
ее
сильнФ
ра3личаются
по
составу и
не
имеют
с нею
общих
ионов. Ёеизвестнш
величинь1 скачков
электрического потенциала
на
мех<фазнь|х границах
диафрагма/солевой
расплав.
Ёеясно,
как они меняются в 3ависимости
от
температуры и состава контактирующих
фаз,
а такх(е
во времени
по
мере
проникновения
ио!|ов'
дифундирующих
и3
солевого
расплава
в материал
диафрагмь:.
14змерения по{енциалов
капсулированньтх
подобнь:м
образом
ме-
таллических
электродов
по отно1пению
к какому_то
одному'
например
хлор-
ному'
немогут исключить
отпибок' свя3аннь|х
с неоднородностью
материалов'
кФтФ!о1€
ра3ные
авторы
исполь3уют
для
и3готовления
своих
электродов
сравнения.
Р{ными
словами'
ках<дртй
такой
электрод
сравнения
нухс{о,
калибровать.
!!1еталлическое серебро восстанавливает
ионы
А8+
до
субионо",
А8*.
Растворимость
металла в
его чистом
х{|]дком
хлориде почти
такая
]|<е'
как
свинца.
Фна
составляет 0,03 и
0,06
мол.%
соответственно
при
49Ф
и
700"с
[80]
ил|\
да)ке
них(е:
0,0123 мол.0/о при 520"с
[110|'
тем
не
менее
возмо}кен
перенос
металл!1ческого
серебра субионами
в те
места
янейки,
где они
могут
диспропорцио!|ировать.
3.
д.
с. гальванического
элемента
А91'1
|
А9€1
с*л
[
€1а
(г),
€,
и3меренная
€олстромом
[111]
в
3ависимости
от
температуры в интервале470_600'6'
ц

вырах(ается
уравнением1
е-]1,1259_2,92.|0_|
!в,
а вычисленная
и3
тер-
модинамичес*'*
д'"й,!*
для'А9€1
при
455_627'
(см.
гл.9,
$
2)
равна
е-
1,095_2,6'\0-ц
?
в.
-
Ёййй'"й'Ав+
имеют
меньтпий
ионный
момент'
чем
Рб2+,
поэтому
1!е
проявляют
вырах(енной
склонцости
к
комплексообразованию
в среде
оасплавленных
хлоридов щелочнь1х
металлов'
Расплавленньте
смеси
[вб|_ь;с:
обнаруйивают
дах(е
3аметные
полох(итедьнь1е
отклонения
от
идеального
поведения
[112].
€меси
А9€1*
['{а€1
показывают
очень
не3начит€льное
полох<ительйое
отклонение
от
идеальности
и
представ-
ляют
собой
ре.у']р,йе
растворь1
!1^1-3'
114]'
||о
даннь!м
Фленгаса
"^й".р","*^'й,
]!1'ы;'_|'о],
й""'$ы
А9€1
"
щ!1*:1::}'й
эквимольной
смеси
хлоридов
натрия
|1
калия
в
инте!вале
к6ншентраций
0'1-6,0
мол.
%
йй";;.'б|ришате_льнь|е
отклонения
от
идеальности
появляются
у рас_
плавленнь|х
смесеи
А9€1_(€1'
что'
.по-видимо_пду,,
обусловлено
не
ком_
плексообра3ованием'
а
мех(ионнь||}{и
эФфектами
[!
]/|'
Б качестве
,'**|рБ'йй]
!л[
серео$йного
элёктрола
сравнения
обычно
о"рй'й^й"",,й'
р'ёйй!Б'""*!ь:и
А|:€1,
а
растворъг
в
расплавах
!
эвтекти-
ческой смеси
хлоридов
литу|я
|1,
калу|я
или
эквимольной
смеси
хлоридов
;;;й
;';;;;;.
п"скольку
последние
по своему
поведению
очень
близки
к
идеальнь|м'
ве'1ичину
электродного
потенциа,а
в
расплаве
]ч{а€1_(€1
мох(но
рассчитать
по-
уравнению
Ёернста'
подстав_'1яя
в
него
непосред-
ственно
мольнодолевые
концентрации
ионов
сербра..
Ёо
так
делать
нель3я
в
случае
расплавов
!|с1_кс1,
растворы
*99|
в
которых
уже
.ййе'й,,"
образом'
отклоняются
от
идеальности.
Ёепосредственные
и3_
меоения
прои3веден";^т;;;;;;й'1::в:
й^й.'"
и )(улсоной
[119].
||о
лан_
ны1м
первой
работьт,
э.
д.
с.
ячейки
А8с.:/А8+
(эвтектика
[!с1_кс1у€121"1,
6
в
интервале
400_600'с
меняется
в 3ависимости
от
температуры
и
кон_
центрации
согласно
уравнениям:
|.л7:':45.10_1г
''"'!Ё]Ё'
,
:,:й]*:.зя-:т
|'!|о_)]зв. |о_4т
5:0
1,115_1'05'10_14
|'.||;-2''ь.!б-'г
1;0
|,352_0'25'!о_4т
1:117_2,00.10_4
г
дают
несколько
иные
3ависимости для
767_825'€"
о'
в
А8€|'
шол.
о/
е' о
1.116-2'33.10_4г
4,52
!'щг0'33'1г:1
;]1о,_т:ББ.'б_.}
3',67
1;107_0'30'10_'г
Ёекоторьте
исследователи
в качестве
электрода
сра]нения
использу|от
серебряную
проволоку'
погрух(енну}о
в
рас'плавы'
фз
добавок
А9€1'
Ёъъ;а;;;
._Ёй--*
на
электроде
устанаБливается
стационаРный
потен-
циал
3а
счет
коррозии
серебра
по
реак||,ии
Ае*!!1еЁ*,')
:
А8|и"','1
*
йё1распл1:
гдейе_щелочнойметалл[120_\22|.Ётовеличина3ависитотконцен-
Б;*;;
"йББ-
А!;
в
приэлёктродном
слое
электролита-'^
определяемой,
в свою
очередь'
*{
!йфу.ие?'
в объеме
расплава
[123].
йзменение
условий
кон!ективно* диффузии.в
ячейках
приводит
к
трудно
контроли_
!уемьтм
и3менениям
толщийьг
дифузионного
слоя
и' с'1едовательно'
величи_
йы
стационарного
потенциала
электрода.
-_--€еребрян!:й
электРод
сравнения
исполь3овался
при.изучении
равно-
весных
потенциалов
кадмия
в
эквимольной
смеси
['{а€1-(€1
|\24|'
урана [125],
равновеснь]х
электродных
и окислительно_восстановите]1ьных
потенциалов
уРана'
нептуния
1|
плутония
[126]- оавновесного
потенциала
тория
в
среде
р^.й,|",е!'ной
эквийол!ной'смеёи'
!ч1а€|_(€|
[\27|.
Ав€1'
мол.
%
50,0
40,1
30,1
20,0
9нг
и
)(улсон
А9€|'
мол.
о/9
50,95
19,66

|7лагпцновь!е
элекп!ро0ьс.
1латина обменивается
с
хлориднь|ми
распла-
вами одно- и
двухвалентными
ионами. йоно-
и
дихлорйд
платины
тер_
щцу9с]и^
-
н_еустойнивы: первый
ра3лагается
при
583,
а второй
_
пЁи
5в1'с
[128[.
3то
о3начает'
что платиновьтй
электрод
функ(ионирует
как металлинеский,
обратимый к своим ионам
(Р*+
и Р12+)
тойько
при высоких
окислительно_восстановительных потенциалах
срець|'
когда
в
газовой'!фазе над хлоридными
_
р_асплавами
давление
хлора
достаточно
велико. 1ак,
например'
при 581'с
над
расплавом
с йольнодолевой
концентрацией ионов
$двухвалентной-платины,
равной
10_',
равновесное
давление
хлора составляет
6'9.10-6
а7пм. Бсли
га3овое
пространство
над электролитом
эвакуируется ни)ке этого
давленця
илп
непрерь|вно
промь[вается
током
чистого аргона'
|4лп
в
него помещается
металл
(титан,
ширконий
и т.
п.),
который
энергично
поглощает
хлор'
то потен_
циал
платинового
электрода смещается
в
сторону
более
электроотрица_
тельных
значений в
ре3ультате
уменьтцения
концентрации
ионов
платины
3а
счет
реакции:
Р||$",1
*26|$'с,')
:
Р.{т)
*
61'1"1.
|1ри
потенциалах
отрицательнее
-0,5
в
по
отношению
к
хлорному
электроду
платина
ведет
себя
у)ке
как индифферентный электродный
материал'
в
равновесии
с которьтм
в электролите концентрация
ее ионов
пренеброкимо
мала.
|1латиновый
электрод
принимает
при этом величину
редокс_потенциала
окрух{ающей
солевой среды.
Рго коррозия в
расплавах
хлоридов
щелоч_
ньтх
металлов очень мала.
1ак,
например'
при
800_900'с
давление
паров
калия
над
рас-
пдавленным
хлоридом кал\4я'
в который погрух(ена
платина'
состав_
ляет
величину
порядка !0_|8 агпм
[129].
(алий
выделяется
в
ре3уль.
тате
реакции
Р!+(2
_
х) къ""',л
:
{РЁ6'.,,
1
*
( 1
_
&
Р1а1""'
+
(2
-.{,)
(
6'с,'1,
где
доля
ионов платины низтпей валентности
определяется константой
равновесия
реакции
РЁ
+
Р{а1"""1
*
2Р11|,",,1
в
дан}!ых
условиях.
"Бполне
очевидно'
,что
при
работе
с
платиновь|м
электродом
срав!|ения
необходимо
тщат€льно и3олировать
диафрагмой
не
только
окру>кающий
его электролит'
но так}ке га3овое пространство
над
ним.
Б
результате
термической
неустойчивости
ионов платинь| в хлориднь|х
расплавах
!|;12?{1!Ф3Б1€
эдектродь[
мо)кно
исполь3овать ли1пь
при температурах
них(е
-600'€,
т.
е.
в
относительно легкоплавких
солевых
эвтектййах.
1ак,
например'
платиновый электрод
сравнения применяется
для
и3мерения
?,19ктР94ны_х_
потенц_иалов
_ 1
р49ц4авл_енных
эвтектиках
[1с1
_кс1
[
1 30-
]р2:
193|
й9€1'_},|ас1-кс1
[134_137]
и
других
легкоплавких
хлоридах
[138-140].
1{онцентрацию
ионов платины в электролите
возле
электрода
задают
обычно анодным
растворением
металла'
измеряя
при
этом коли-
чество
электричества'
которое проходит чере3 ятейку
3а время
электро-
ли3а.
||ри
термодинамических исследованиях металлических
сплавов методом
э.д.с.
в
качестве электродов сравне}|ия берут
наиболее
электроотрица_
тель}!ь1е
и3 металлов' входящих в их состав. Фчень
часто
во3никают
3а_
труднения
в подборе
материалов
для
и3готовления
ячеек
с такими элек_
тродами.
Ёсли стенки
и
диафрагма
в3аимодействуют
с металлом'
то
нару1цается
равновесие
ме}кду
ним и его иог|ами
высшей
валештности
в
электролите.
}то
пРиводит
к
неустойтивости
потен|{иала,
особенно в тех
случаях'
когда велик перенос
металла
на стенки
3а
счет
диспропорцио_
нирова1|ия
ионов
низщей валентности'
а концентрация
ио!|ов
выс:пей
валентности
уменьтцается
в
ре3ультате
улетучиван|1я
|т3
расплава
выс1шего
хлорида.
46

.!!1еталлические
электродь!
сравнения
применяются
в
исследованиях
поляризации
при
кат0дном
_осах(дении
или
анодном
растворении
метал_
лов
в тех
)ке электролитах.
14змеряемые
разност1
!^']"]^,3'лов
дают
при
этом
непосредственно
величины
катодной
или
анодной
поляри3ации'
$
3.
&орвьпй
электрод
сравшецпя
в
расплавленнь[х
хлоридпь[х
адектродптах
}1етод
э.д.с.
!пироко
исполь3уется
при
и3учении
термодинамики''со-
левых
расплавов'
оёобенно
для
определения
активностей
их компонен-
тов.
й?змерения
с
металлическими
электродами
сравнения
позволяют
непосредственно
наблюдать
ли1ць
0тносительнь!е
и3менения
активностей
потен1циалопределяющих
катионов.
в
электролите'
свя3аннь1е
с
и3мене_
нием
либо
их
концентрации,
либо
компо3иции
расплава.
3.д.с.
ячеек'
вкоторь|хисследуемь1еметаллическиеэлектродь1сочетаются'например'
с
сере6рянь|м
электродом
сравнения'
равна
е:Ё!;9+7а9
_
Ё%*+
у
м.+
*Б
#
.[1ля
того
чтобь:
вь]числить
активность
ионов
/у1е,*-
в
расплаве
зада|1-
ного
состава'
ну)кно
3нать
активность
катионов
серебра
в
полуэлементе
с
серебрянь:м
электродом,
а
такх(е
ра3ность
стандартных
электРоднь|х
потенциалов'
определяемую
и3 соотно[шения
Б|,9+1я9_
Ё%е'+ум:
^с0
где
^с0
_
и3менение
стандартной
энергии
[|иббса
при
реакции
лА9€1
<*:
*
.]!1е
:
.]!1е€1'
1,'1
*
пА9.
3начйтельно
проще
эта
3адача
ре|]]ается
с
элементами'
в
которь|х
металлические
электродь!
комбинируются
с
хлорнь!м
электродом
9гав*
ния.
Разность
потенц14алов
мех(ду
ними
является
непосредственнои
мерои
и3менения
энергии
[иббса
при
реакции
обра3ования
хлоридов
соответ_
ствующих
металлов
в
расплавах
данного
состава:
!тБ
+!
|
'п€12
1"1
:
йе€1,
1распл),
Б6:_пРв.
пР
Фна
равна
п
е: Б|1;ст_
-
Ё%а"+:м"у
{=т'__р&'-
'
пР
амв'*.о(,у_
8о всех
хлориднь]х
расплавах
не3ависимо
от
их
катионного
состава'
которьтй
мо>кет'
бьтть
веььма
ца3нообра3ным'
мольнодолевая
концентраци
я
ионоь
хлора
равна
единице.
8сли
полохсить
условно
их
активность
то'(е
равной
едйнице,
а потенциал
хлорного
электрода
равным
нулч
при
всех
температурах
и
давлении
хлора
Рс1,:\
апм'
то
мы
получаем
единую
ш]кал'
для
численного
вь|рах(ения
активностей
отдельных
катионов
"
'й6,'*
хлориднь}х
расплавах.
Фни связаны
с
потенциалами
Ё соответ-
ствующих
металлических
электродов'
и3мереннь1ми
по отно!шению
к хлор-
ному
электроду
сравнения'
равенством
Ё
:
-
в
:
Ё%.,+
м.*$1п
а[пр,
где
Ё!1"п-рдце
_
потенциал
металла
по отно[шению
к
хлорному
электр9{ц
в чистом
х(идком хлориде
йе€1',
иными
словами'
разность
потенциалов
,,
йей!у
эле;тродам#
ячейки
мё
1
ме€1'
с*:
!
€1э
("),
€, в3ятая
с
обратнь1м
47

Рпс.
2.
}/стройство
хлорного
электрода
'-кварцёвая
капсула:
2-графптовая
трубка;
3
-накокечник
в3
уг]1я
спектраль-
вой
чистотц;
4
-
расп.гивленйшй хлорвд;'}
_?'й"й"'
диаФрагма
3наком'
поскольку
все
металлические
электроды
имеют
флее
отр!1_цат€.,1ьные
потенциалы'
чем
хлорнь[й.
(огда
электролит
хлорного
элекърода
отличается
соста_
вом
своих
катионов
от
расплава'
в
котором
находится
ис-
следуемьгй металл'
на
ра3деляющей
их
пъристой
дйафрагме
во3никает
скачок
электрического
потенциала.
(ак
п61сазы-
вают
расчеты
(см.
гл.
|[), которьте
подтверх(даются
экспери_
ментальными
данными'
диффузионнь]е
потенциалы
имеютъе_
личины
порядка
10-4
_
10_9
с,
если
удельная
электропро_
водность.
Расплавленных
солевь|х
электролитов
'раЁна
-|
ом-|.
см-\
и вьтше.
3
подобньтх
случаях'
когда
;.д.с.
и3меряются
с точностью
4о
10-з
в,
диффузионнь|е
потенциа-
лы
мох(но
не
принимать
в
расчет.
Б
.:|итературе
встречаются
утвер}кдения
о
якобы
ограни_
ченной применимости
хлорного
электрода
по
сравнению
с
металлическими. Бекоторые
авторь|
считают'
что
его нель_
3я
исполь3овать'
например'
в
и3мерениях
окислительно_
восстановите.,|ьных потенциалов
и3-3а
окислительного
дей-
ствия
хлора. Фднако
подобньте
выска3ь|вания
соверш:ённо
несостоятельны'
так
как хлорный
электрод
помещается
3а
диафрагт*|ой'
препятствующей
проникновению
хлора
на ис-
следуемый
элек:ро4
как
чере3
расплав'
так
и
чере3
га3овое
пространство.
.{'иафрагма
не
мо)кет
рассматриЁаться
как
недостаток'
присущий
только
хлорному
электроду.
Фна
ну}кна
|! в случае
-металлических
электродов'
о
чем
гово_
ридось
в
предыдущем
параграф.
8
качестве
подкладки
д]1я
хлорного
электрода
обычно
исполь3уют
графит или
уголь
в
виде стер>кней. 14х
глась:щают
хлором'
который-по_
лучают
отдФ|ьно
цл|4
выделяют
непосредственно
на
электроде
при
электроли3е.
|[оказано
[141]'
что наиболее
подходят
для
и3готовления
хлорных электродоч
сравнения
угольнь!е
стер}!ши'
исполь3уемь|е
в
спек-
трайьном
анали3е.
8^них
просверливают
скво3ные
отверстия'
чере3
кото-
рые
подается хлор.
Фн
поступает
и3 специального
электролизера'
где вы-
де.,|яется
на
ук)льном
или
графитно-м
аноде электроли3ом
чистого
рас-
плавленного
хлорида
свинца
при
520_550'с.
€
повышлением
темпера_
туРы
выход хлора
заметным образом
пони}кается
из-3а
окисления
на
а1{оде
ионов
одновалентного
свинца,
образуемых
во
все
б6льш:их
коли_
чествах
на катоде.
||отенциал
хлорного
электрода
устанавливается
довольно
медленно'
осфе}|но
в
тех случаях'
когда
в
качестве подкладки
берутся
угольные
стер)кни со
3начительной
3ольностью. |[редварительная
да>ке
кратковре_
менная анодная
поляри3ация электродов
в
хлоридных
расплавах
|!л\4
обработка их в атмосферо хлора при вьтсокой
температуре
[141,
1421
3начительно сокращает
время
достих(ения
рав}|овесных
значений потен_
цт4ала.
[рафит_более пористый
.
материал'
чем
уголь.
3то
способствует
больц:ей
адсорбции хлора
и
устойнивости
потенциала
электрода.
[рафи_
товые
трубки 3начительно
трудне€ и3готовить
из-3а хрупкости
материа-
ла.
Ёо
эт0 3атруднение
мо}к}|о
обойти:
из графита
делаются
лишь
нако_
нечники электродов'
погру)каемые
в электролит.
Фгли
наса}киваются
на
плотные
уголь}|ые
трубки, слух(ащие одновременно
токо-
и хлоро_
подводами
к электроду.
||ористые
графитовые
наконечники
могут
не
48

иметь
скво3ных
отверстий.
)(лор
пролавливается
в электролит
чере3
поРь]
" "Ё#;#'.Ё!;''",''ующее
действие
|!а
хлорнь|й
электрод
ока3ывают
проникающие
в электролит
катионь1
ни31пих
валентностей'
а
такх(е ооРа_
зуюшиеся
под
воздеййвием
влаги
и кислорода
атмосфры
оксисоединения.
бднако,
в отличие
от
металлических
электродов'
потенциал
хлорного
электрода
во3вращается
к
равновесной
величине'
как
только
прекращает'
ся
и;
доступ.
-||равда,
при
загря3нении
электролита
оксисоединениями
подкладкаэлектродачастичнора3ру|цаетсявре3ультатетого'чтоугле.
1аблица
1
'
[1оправка
к
потенциалаш'
и3мереннь|м
по отнощению
к
хлорношу
эдектрду
сРвнения
при
ра3лич1|ом
давлении
хлора
;|
тпо[
тэо|
тзо|
т+о|тьо
^
в
(!'св'
пр'|
давлениях
хлора, |!ся
ово
|
690 -!------_-]-
7601 770 !
780
!!
,100
5ш
600
700
800
900
1ш0
3,225
3,704
4,183
4,662
б,\4\
5,620
6,099
2,801
3,217
3,634
4,050
4,466
4,882
5,299
2,384
2,738
3,092
3'ц7
3,800
4,155
4,509
!,973
2,266
2,559
2,852
3,145
3,438
3,732
1
,568
1,800
2,033
2,266
2,499
2,732
2,965
1,168
1,341
1,515
1,688
!,862
2,035
2,209
0,773
0,888
1,ш3
1,118
1,233
1,347
1,462
0,
о,44|
-0,379
-0,436
-0,492
_0'и8
-0,605
-0,661
-0,717
-0,753
-0,865
-о,977
-1
,089
-1
,201
-1
,313
-\
,424
0,61
0,
0,
0,
0,
0,
0,
0,
0,
0,
0,
0,
род
свя3ь1вается
с
кислородом
тонкой
в3веси
окисла
металла:
при
реакции
хлорирования'
например'
йеР'с':
+
п€ \
214
*
|
| 2п(к':
:
2йе€1,,
1 рс,'1
*
1/2п€Фэ1"1'
|-азовое
пространство
полуэлемента'
в
котором
находится
хлорный
электрод'
и3олируется,
чтобь|
над электродом
и окру}кающим
его
элек_
6;;;'*"'
й;й"й'о
поддер}кивать
опЁеделенное
давление
]"9Р1'_л9:
тёнциал
хлорного
электрода
в хлоридных
расплавах
лц1тищается
равным
нулю
при всех
температурах
и
давлеЁии
хлор-а
в га3овой
ф-азе
над
ним,
Б1'*о*'|
апом.,[1овольно
сло}кно
со3дать
я'лейку,
в которой
это
условие
ёоблюдалось
бы
строго.
3начительно
проще
рафтать,
когда
давление
хлора
равно
внетшнёму
атмосферному,
хотя оно
подвер)кено
3начительным
колёбайиям
и
в и3меряемь|е
значения
э.д.с.
необхоцимо
вносить
поправки
(табл.
1).
|1ри
дав;ениях
ни)|€
1 агпм
онц
прибавляются'
а
вы|це
|
агпм
_
вычитаются.
(онструкция
хлорнь1х
электродов
мох(ет
бьтть
весьма
ра3нообра3._
'ои
]1ц1:]"Фчень удо6ен
в
работё
электрод
(рис.2),
3аключенный
в
узкой
квар|тевой
проби'ке
с
отверстием
на
АЁ€,
которое
3акрь1то
пористои
;;й;ьъьй
!йафр1гмо*.
)йо}
цодается
чере.3
плотную
угольную
трубку
с
наконечником
и3
чистого
г|афита,
котор|тй
погруйен
в
расплав.
3 ка_
честве
электролита
исполь3уетс_я-^_р!сплавленная
эвтектическая
смесь
хлоридов
л\4тия
\4 калпя
(т. пл..
-352'с)
или эквимольная
смесь
хлоридов
Ё'{6"?
п
кал\4я
(т.
пл.'
660'с).
3в'!ектика
!!с1_кс[
гигроскопична'
поэБму
ее
берут
тольк9
Р
те_х случаях'
когда
и3мерения
проводят
при
темпер!турах
'их(е
660_"
с.
3лектролит
хлорного
электрода
!'е
мо}кет
содер1кат{
в неи3менной
концентрации
катионы
тех
металлов'
выстшие
хлорР|ды
которь1х
легко
во3го!{яются
и3
расплавов.
$
4.
[ершо.а.!.с.
ме'кду
токоподводамв
к ал€ктродаш
вь[сокотемпературвь(х
ячеек
Разности
температур
между
внутренними
и
в!|е1пними
концами
токо_
подводов
к электродай
высокотемпературных
ячеек
достигают
многих
соЁн
градусов.
|1оэтому
ме}кду
токоподводами
и3
ра3ных
ма1€риалов
4
м. в.
смирнов
49
во3никает
термо_ э'д'с',
которая
входит
наряду
с
ра3ностью
электрохи_
мических
электроднь1х
потенциалов
в
измеряемую
на опь|те
велйнину
э.д.
с.
ячейки.
]ермоэлектродвих(ущая
сила,
Ё,,
во3никает
в
3амкнутой
электрипе-
ской
цепи, состоящей
и3
разнородньтх
проводников'
когда
места
их
контактов
имеют
Р]1ную
температу.ру..
Фна
-определяется
ра3ностью
тем-
ператур
горячих
(7')
п
холодных
(7')
контактов
и
3ависит
от природы
материалов
пр9водников
[1{5].
в
относительно
у3ких
температурньтх
интервалах
наблюдается
лйнеййое
отно1!]ение
мех(ду
термо-э.
д.
с.
и гра_
диентом
температурь1:
в'-с
(72
_
!
,).
'
Р::*:*::-
"^^]9^
равенство
сомнох{итель
с на3ь1вается
термосилой,
коэф-
Фициентом
термо-э.
д.с.
ил|\
уАельной
термо-э.д.с.
Бели.|ина
ц
мен"етЁя
в
|пироких
преде.цах'
от
десять]х
долей
до
десятков
микровольт
на
градус'
;#"ж*:",'#,;"ё,;жё;ъ#:#'};#3##ь"*::ьЁ*ъ,"",н#:з:;|::
одной
-"
тй
х{е
парь1 проводников
мох(ет
даже
менять
.й'а
,*''[
;;ъ:
ратньти.
Б
подобнь:х
случаях
температурная
3ависимость
термо-э.д.с.
имеет
не
линейньлй,
а
пара6олитеский_вид.
3нак
термо_э.
д.
с. определяется
направлением
тока.
|]олох<ительный
5::99'тэ.ч^.1^:Р'.'.'Ёается
те[1
металлам'
от
которь|х
течет
ток
чере3
холодньтй
контакт.
?ак,
например'
в
цепи'
составленной
из
*"'езЁой
и_молибденовой
проволокг1'
в
йесте
холодно|.о
контакта
ток течет
от
х(е-
{91,
"
молибдену,
а в
месте
горячего_от
молибдена
к }келе3у.-
всйи
ч1-з19сть
температур
мех<ду
нимй
составляет
100',
причем
одни
концьг
::1]111'рующих
проволок
находятся
при
0,
а
другие'при 100.€,
,
це]й
ра3вивается
термо-э.
д.
с.'
равная
примерно
0,6
й;.
-!ермо-э.д.с.
не
и3меняется
при
последовательном
включении
в
цепь
любого
количества
проводников
из
разнороднь|х
материалов'
если их
контакть|
имеют
одну
и
ту }!е
темпера1уру.'Бьтсокотемпературные
ячейки
представляют
собой
последовательнь|е
цепи
проводников:
т'*','*,''
т
|
,*^"''|
1
|
3лектРолит
[1
|
,'*',',,',
,
!
|
3лектрол
2
т|
т2
3
зоне
и3о?ермическот.о
нагрева
ятеек
(7':сопз1)
термо_э.д.с.
мех(ду
токоподводом
1
и электродой
1,
электрёд?лм
2
/ элёктродитом'
элек-
0ф
1,6
тролитом
и
электро_
дом
2,
электродом
2'
и токоподводом
2
рав_,
ны
нулю.
?аким
об-
ра3ом'
п{ех(ду
холод_
ньтми
нарух(нь[ми
кон.
цами
токоподводов
1
и 2,
сделаннь1х
и3
раз}1ь1х
материалов'
действует
такая
тер-
мо-э.д.
с., е+2,
как
если
бы оЁ1{
}!а[Ф.||}1:
лись
в
непосредствен_
ном
контакте
друг
с
другом
в
горяней
зо-
не
ячейки.
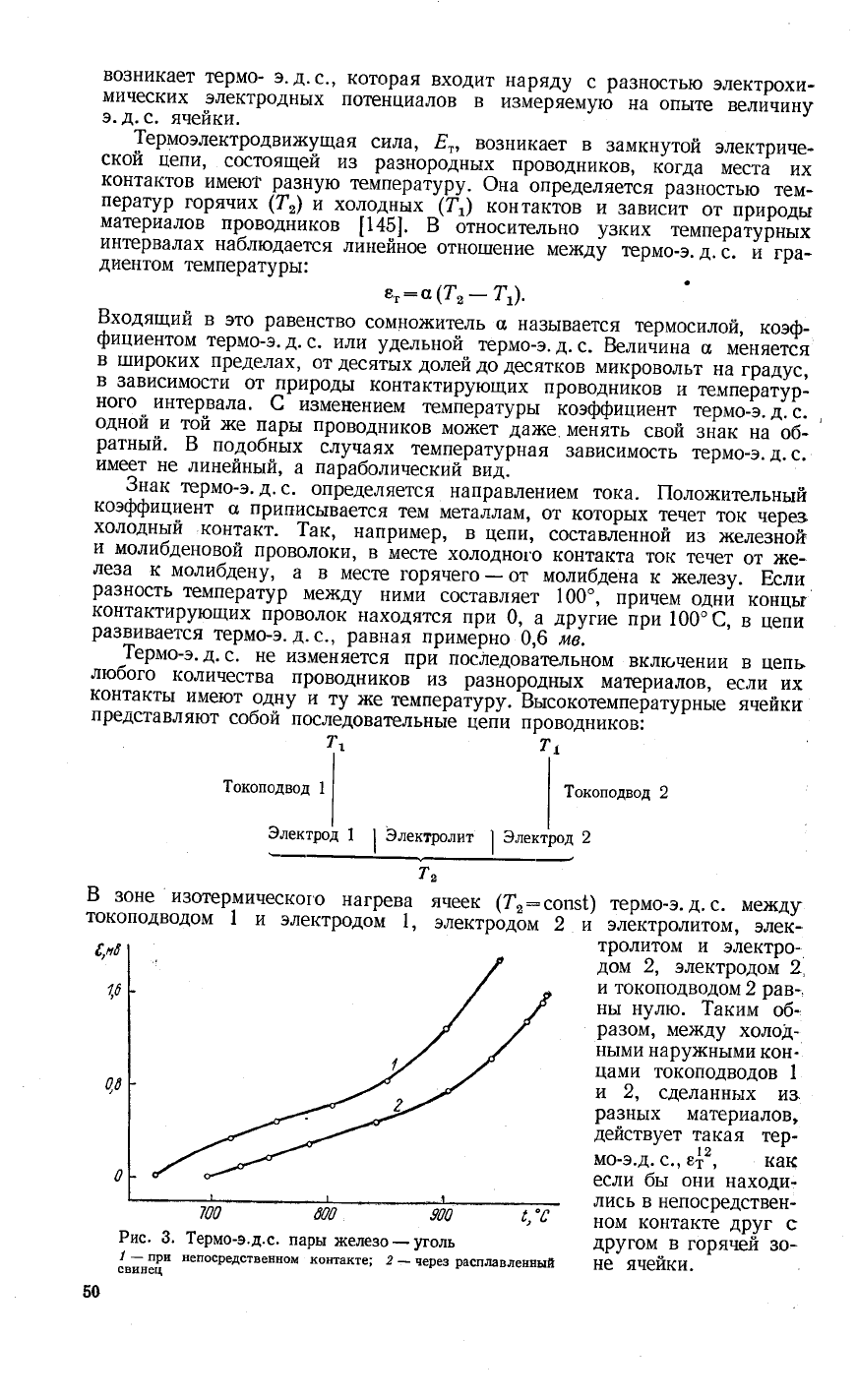
700
000
900
!,"€
Рис.
3.
1ермо-э.д.с.
пары
х(елезо_уголь
]-:_19"
непосредственном
контакте;
2
_
через
расплавленвый
свинец
50
