Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


влиянием
прохо}кдения тоца' т.
е.
что
потенциал электрода
определяется
концентрацией
ионов в6л|1з14
электрода точно
таким }ке
обра3ом''
какон
опреде.,1ялся
бьт в
равновеснь1х условиях.
Рдинственная
поправка' которая
вносится,
согласно этому
предполо)кенито'
в
фрмульт
для
равновесного
потенциала'
состоит
в
том' что
исходное значение концентрации
того
веще-
ства'
которое
определяет
потенциал
электрода' 3аменяется новь]м' изме-
ненным
3начением
концентрации' а
именно-тем
значением' которое
уста-
навливается
в6лпзи поверхности электрода при прохох{дении тока.
€деланное
предполо>*{ение
является известньтм
прибли)кением'
кото-
рое
не
всегда
одинаково оправдь1вается. }1о>кно
указать
случаи
(например,
образование
амальгам многих металлов), когда оно
соблюдается
и
когда
6латодаря
этому легче
разобраться
в явлениях' свя3аннь1х
с
дви)кением
ионов
в
растворе.
Б
других
случаях на эт|1 явления накладь|ваются
дополнительнь1е
и3менения' что
усло)княет рассмотрение
общей
кине-
тики электрохимических
процессов.
||редставление о
значении концентрации
потенциал-определяющих
ионов в6лизи
поверх ности
электрода'
которьтм мь1 пол ьзов алу!сь' н
уждаетс
я
в
уточнении.
|1редставим себе металлический электрод'
например, сереб-
рянь:й,
погру>кенньтй в
раствор
своей соли. )/
поверхности электрода, как
это бьтло
разобрано
в
введении,
имеется
двойной
электринеский
слой,
в котором нару1цается
равномерное распределение
зарядов
(ионов),
суще-
ствующее
в
объеме
раствора.
(онцентрашия
ионов
серебра в
пределах
двойного
слоя
дах<е
в
равновеснь|х
условиях
отличается
от объемной
концентрации
этих ионов;
при поло)кительном
3аряде
поверхности
электрода эта концентРация мень1пе' чем в
толще
раствора'
при
отрица-
тельном
заряде-боль1пе.
Бозникает вопрос' о т0м'
какое значение
концентрации
подставлять
в
выра}кение
для
равновесного
потенциала
9,:90+
$м'''-
(46)
Фневидно,
было бьт неправильно
внести
в
эту
фрмулу
3начение концен_
трации'
которое
имеется в точке' лех<ащей в
пределах
двойного
слоя.
3
этом
случае
Ёеобходимо
бьтло бьт
учесть
электростатическое
поле
двой_
ного слоя
и
изменение
химического потенциала в
кахсдой точке
двойного
слоя'
вызванное
действием
этого
поля. Бсли пользоваться
фрмулой
({6)
в обычном ее виде'
то в нее необходимо подставлять
значение
концентра-
ции
потенциал-определя1ощих
ионов
серебра
на таком
расстоянии
от
по-
верхности электрода'
на
котором
мо>кно
пренебрень
действием
сил
двой-
ного электрического
слоя.
Б слуяае )ке поляризованной
системь1' т.
е.
системь|,
через
которую
проходит
электрический
ток, как
бьтло
отмечено вы1пе, концентрац|1я ио-
нов
в
приэлектродном
слое
раствора
мецяется с
расстоянием
от электрода'
и в вьтражение
для
потенциала поляри3ованного
электрода
необходимо
подставлять концентраци|о
потенциал_определяющих
ионов вблизи элек-
трода.
||олунается некоторое противоре!ие, которое
вь|звано тем' что
термину <вблизи поверхности
электрода> в
обоих
случаях придается
ра3-
ный смысл
Ёарухпение
распределения
3арядов на
поверхности
электрода' вь|зван-
ное
9лектрическим
полем
двойного
слоя'
простирается
в глубь
раствора
ли|||ь на небольтпое
расстояние'
рав|-!ое
толщине
дифузного двойного
слоя. ББличина
этого
расстояния'
как
это
у>ке
было
разобрано,
3ависит
от общей концентрации
электрол|1та ъ
растворё
и
для
не очень Ёизких
концентРаций
электролита
имеет
порядок
10-7-10*6 см.
Б придегающей
6'

кдвойному слою
зоне
раствора
концентрация
ионов в
равновеснь|х
усло*
виях
везде одинакова; в
неравновеснь|х
х{е
условиях
она и3меняется
по
некоторому
закону. Б
обьтчньтх
условиях
переме1пивания
это
изменение
концентрации
простирается
на
расстояние
не
мень1ше
10-3-10_2
см; слой,
в
котором происходит
такое
изменение концентрации'
вь|3ванное
электро_
химической
реакцией
на поверхности
электрода'
назь]вается'
по причи-
нам' которь:е
буАут
яснь1
и3
дальнейтпего,
дифузионньтм
пограничнь]м
слоем
(не
сметливать
с
дифузнь]м
двойньтм
слоем).
|1о
сравнению
с
тол-
щиной
дифузионного
слоя
толщина
двойного
слоя
мала.
Аругими
сло-
вами'' мо}кно
вьтбрать
точки'
которь1е
одновременно
удовлетворяли
бы
следующим
двум
условиям:
во_первь]х'
чтобьт
они ле)кали
вне пределов
двойного
слоя'
т. е. чтобьт
в них
не наблюдалось
действие
электрического
поля
двойного
слоя'
и' во_вторь]х, чтобьт
они все
>ке
находились так
Рис,
37
'
Распределение
концентрации
электролита
с$,
анионов (сд)
и
катионов
(с6)
в
диффузн6й
части
двойного
слоя
и в
диффузионном
слое
отрицательно
заря}кенного
электрода. л..-траница
диффузной
пасти
двойного
слоя; с2-грани\\а
диффузйойного
слоя;
с'_
и сходн
а я
кон
центр
аци яэлектР
ол йт
а вда||14
от
элек-
близко к поверхности
электрода,
нтобьт
с точки зрелия
изменения
концен-
трации
в
диффузионном
слое.мо)кно
бь:ло бьт
говорить
о концентрации
ионов
у
самой
поверхности
электрода (топка
А
на
рис.
37).
€овокупность
этих
требований'
однако' не
всегда
мо>ке| бьтть
вьтпол_
нена. Б
крайнем
случае
при
очень низкой
общей ко}|центрации
раствора
у
поверх-ности
электрода
толщина
лиффузной
насти
двойного
слоя
возрастает
и
прибли>хается
к
толщине
Аиффузионного
слоя; при
этих
условиях
те
элементарнь|е
соотно|шения'
которьте
будут приведень|
ни>ке'
неприменимь].
!,отя
такие
явления
иногда
могут
иметь
место'
все )ке практически
они
не
имеют
существенного
3начения
д]|я
обьтчньтх
условий
электролиза'
и сдела
нное вы!ше
допущение
в боль:пинстве
сл
учаев
явл
яется впол
не за кон_
ным. ?аким
образом,
если в
дальнейтпем
будетисполь3овано
пРедставление
о
ко}1центрации
в6лизи
поверхности
электрода'
то это
представление
надо
понимать
в макроскопическом'
а не в микроскопическом
смь]сле.
Бо
избе_
х(ание
неясности
мь:
буАем при
этом
говорить
о концентрации
(вбли3и
поверхн0сти
электрода>>
|тли
(в
околоэлектродном
простра
нстве>'
оставляя
термин <поверхностная
концентрация)
для
обозначения
концентрации
частцц
на.
молекулярнь1х
.
расстояниях
от
границьт
ра3де.'|а.
(ак
бь:ло пока3ано
А.
г. €амаршевым
1';,
изме}1ение
концентрации
ионов
в6лизут поверхности
электродов во
время
прохох<дения
тока
мох{ет
в2

бьтть
непосредственно
обнарух<ено
оптическим путем
по
изменению
пока-
зателя преломления
раствора.
|!рименение
чувствительного
интерферо_
метра
в сочетании
с поляри3ационнь|м
микроскопом
позволяет
определить,
величину
градиента
концентрации
в
разнь|х
участках
дифузионного
слоя,
а так)ке
общуто величину
разности
концентраций
мех<ду
точками
в
объеме-.раствора
и
вблизи
поверхности
электрода.
||ерейдем
к
рассмотрению
условий
изменения
концентрации
при про-
хох{дении
электрического
тока
в
самом простом
случае.
|1усть
имеется
металлический
электрод,
например,
серебрянь:й,
находящийся
в капил-
лярной
трубонке
и
занимающий
все ее
сёчение.
1(апиллярная
трубонка
наполнена
разбавленнь]м
раствором
азотнокислого
серебра
и
со
второго'
открытого конца
соединяется
с больгпим
сосудом'
содер)кащим
тот
х{е
Рис.
38
раствор
(рис.38).
|1оскольку
объем
раствора
в больтпом
сосуде
велик
по
сравнению
с
объемом
раствора
в капиллярной
трубке'
то при
прохох<де-
нии
тока
изменения
кон1].ентра1|ии
электролита
в
этом сосуде
незначитель-
нь1'
и ими
мох{но
пренебрень.
Аругими
словами,
мо}кно принять'
что кон_
центрация
ионо.в
у
открь1того
конца
капилляра
не
меняется
и
всегда
остается
равной
исходной
концентрации
ионов
в
растворе.
Рассмотрим
сначала
слунай,-
который,
как
будЁт видйо
из
дальней_
1пего,
является
более
прость]м.
А
именно:
предполо}ким'
что в
растворе
кроме
тех
ионов'
которь]е
определяют
потенциал
электрода
и которь!е
м0гут
разря>каться
на поверхности
металла
(т.
е.
в
приведенном
примере'
кроме
ионов
соли
серебра),
присутствует
еще
в избьттке
посторонни?
электро'ит,
не
участвующий
в процессе
электролиза'
например,
из6ьтток
азотнокисло-
го калия.
Рассмотрим
условия
подачи
ионов
серебра
к поверхности
электрода
во
время
электролиза.
Б
первь:й
момент
после
включения
тока
ионь1 сфеб-
ра
начнут
ра3рях{аться
и концентрация
их около
поверхности
электрода
будет
падать.
Б
растворе,
находящёмся
в капилляре'
возник'ет
"е'о'ор"й
градиент
концентраций,
приводящий
к
дифузии
разря>каемь|х
ионов
из более
отдаленнь]х
участков
к
поверхности
электрода.
6корость
диф_
фузи]:
ионов
!т.лет
пропорциональна
градиенту
концентрации.
'
(роме
дифузии
происходит
дви}цение
заря)кеннь]х
ионов лод
влия-
ниом
эле'ктростатического
поля
в
растворе.
1акое
движение
в электрохи,
мической
литературе
часто
назь|вают
миг!ацией
ионов.
9лектростатическое
поле
в
растворе
приводит
к
миграции
всех
ионов,
как
разря}кающихся
+
63

на
поверхности
эл.ектрода' так
и
не
ра3рях{ающихся'
т.е.
в
ука3анном
случае как
ионов
А9*,
так
и ионов
(-
и
!'{Ф3.
€огласно
сделанному
допу-
щению'
концентрация
ионов серебра мала
по
сравнению
с
концентрацией
остальнь1х
ионов;
поэтому
ли1пь
незначительная
часть
тока в
растворе
обусловлена
миграцией
ионов
серебра. €деланное
допущение
позволяет'
таким образом,
пренебрень
миграцией
ионов
серебра в общем
процессе
подвода этих ионов к поверхности
электрода.
1ретьим, нрезвьтнайно
вах{нь1м
фактором,
от
которого зависит подвод
вещества к электроду' является
дви:*<ение
самой
)кидкости'
возник8ющее
\
самопроизвольно
или благодаря
ра3мешиванию
раствора.
({тобьт
исклю-
чить
его
влияние' в
разбираемом
примере
рассматривается
дви}кение
ио-
нов в капиллярной трубке,
т. е. в
условиях'
которь!е
искл}очатот
конвек-
тивное
движение
и
ра3ме1шивание
х{идкости
(рис.
38).
Блияние
миграции
ионов
и
конвекции
}кидкости
на
процесс
подачи
реагирующих
веществ к поверхности
электрода
будет
рассмотрено
в
после-
дующих
разделах.
|1о
мере прохо}кдения
тока
раствор у
поверхности
электрода все
боль:пе
обедняется
ионами серебра,
что
в
свою
очередь
приводит
к
увели-
чению
градиента концентрации
и
вместе
с
тем к
усилени}о
подачи
этих
ионов
путем
диффузии.
9ерез
некоторое
время
достигаются
такие
усло-
вия'
при
которь]х
количество
ионов' исчезающих
благодаря
реакции
разряда'
становится
равнь]м
тому количеству'
которое подводится
к по-
верхности
электрода
дифузией.
}станавливается
некоторое стационар-
ное' т. е.
не
изменятощееся
во времени состояние;
это
состояние' конечно'
не
буАет
равновеснь]м,
так
как
оно
поддер)кивается
прохо)кдением
тока
чере3
раствор
и сра3у
нару1пается
после прекращения
тока.
$
2.
уРАвнвния
диФФу3ии
!,ля
того
чтобьт
определить закономерности'
свя3аннь1е
с прохо)кде-
нием тока через
раствор
в стационарнь1х
условиях,
необходимо
ре1шить
простей:путо задачу
дифузионной
кинетики.
€огласно 3аконам
дифузии,
количество
вещества
гп,
дифундирую_
щее
3а время
АЁ
нерез некоторое
плоское
сечение, перпендикулярное
к оси
,'
направленной
в
сторону возрастаю[]!их концентраций,
пропорционально
градиенту
концентрации
$,
""'^,"не
сечения
5,
а такх<е
отрезку
вре-
мени
А|:
гп:
|3
*Ф
ь1.
!(оэфициент
пропорциональности
!
_
коэфициент
дифузии
_
имеет
ра3мерность
квадрата
длинь|'
деленного
на время;
обьтчно он вь!ра-
)кается в единицах
см2|сек
или см2|суптки.
||оло>кительнь1м
направлением
дифузии
мьт
будем
считать
дифузито
в
сторону
убь:вающих
значений
концентрации.
Рсли концентрация
диффундирующего
вещества
в
ках<дой
точке
рас_
твора не является
постоянной велининой,
а
меняется
во времени'
то мо}{(но
найти связь мех{ду
скоростью
ее и3менения
и величиной, характеризую-
щей
распределение
концентрации
вдоль
пути
дифузии.
!,ля
этой
цели
проведем
два
одинат{овь|х
параллельнь1х
сечения
5::3я
на
расстоянпут
ёх
друг
от
друга
(рис.
39). Бсли градиент
концентРации
у
первого сечения
-
/ 0с\
обозначить
нерез
(Ё
)
',
"'
в6лизп
второго сечения
он
булет отличаться
64
(47)

":
:;:"""чно
малую
величину'
т.
е.
будет
равняться
(#),-
(#),
*
*
-
116.
'
ох"
(оличество
вещества'
диффундирующее
чере3
первое
сечение'
равно
п:'_
|3
(#)'
.
.',
а
количество
вещества'
дифундир',*"!
Б;
второе
сечение
*,.:
,2{
(#),
+
#
ах}
ьс
€корость
изменения
кон_
центрации
в
объеме
ёо:3
4х,-заклБч"й"'м
ме)кду
двумя
сечениями'
равна
отно|пению
разности
количеств
втекающего
и вь1текающего
в единицу
вре-
мени
вещества
к величине
объема
4о, т.
е.
0с
&о-1т
о!
3ёх
.А!
|1одставляя
значения
для
!7!1
11
12,
получаем
следутощее
диференшиальное
уравнение:
0с
^
62с
ы:0
а*"'
(49)
в
рассматриваемом
-
случае
диффу-
3и|1 в
капиллярной
трубке
через
нёко_-
торое
время
после
начала
прохо)|{де-
н|4я
тока
устанавливается
стационар-
ное
состояние,
т' е'
концентРация
в
]тюбой
точке
капилляра
во
вре-
мени
делается
постоянной
и
$:о'
йз
уравнения
(49)
вытекает'
что
в этом
случае
#
:
"',.1,
т.
е.
гради.,"
*Б"ц""трации
во
всех
точках
-']}]::,,
имеет
одинаковое
3начение'
которое'
очевидно,
р',,,
$:
'
где
/
-.дл14на
калилляра'
св_концентРация
ионов'
которая
уста1{авливается
вбли3и
поверхности
электрода
при
прохо)кден
ии
тока,
и с0
_
концентрацня
у
открь1того
конца
капилляра,
которая
совпадает
с
исходной
концентрацией
йонов
в
растворе
до
пропускания
тока.
(оличество
иойов,
дифундируьщ""
в
единицу
времени
к
одному
квадратному
сантиметру
поверхности
электрода'
равно
(50)
/!апра0ленае
0шффузиш
(48)
(эту
велини.ну
прч
олисани|!
диффузионнь:х
пРоцессов
часто
на3ь!вают
потоком
лиффузии). Аз этой
форйульт
легко
подсчитать
|]лотность
элек-
трического
тока
(т.
е.
силу
тока,
отйесен1у'о
к
единице
поверхности
элек-
трода),
проходящего
через
систему.
д"а".""Ё?;;;;
";'
стационарнь1х
условиях
вел
ичина
тока
определяется
количеством
продиффу"д"Б'"'Ёй1"
ионов
и, чтобьт
вь|числить
плотность
тока,
необх'д'*'
й,Б*".,
величину
потока
диффузии
ионов
на
заряд
ион'.
в.';-;;"цЁЁ{р"'.',
вь]ра}кена
в
грамммо'1ях
на
кубинеский
сантиметр'
то
величину
йБ''',
диффузии
необходимо
умно)кить
на
пР,
где
п-валентность
ионов*,
Р-число
Фарадея:
!:пР|
/ 0с\
| _!
\
3.т
,7
*:о
'
(51)
*
Б
общем
случае'
когда
электрохимический.
процесс
не
сводится
к
ра3ряду
ионов
металла,
величина
а
обозначает
,'.''_:-{:*''о!:ов
на
одну
молекулу
реагиру_
ющего
вещества'
исчезающих
(или
освобох<дающих6я)
"й
йЁ[]Ё"Ё"'"
,р'ц"."".
5
кпнетика
алентродн.
процеооов
65

Формула
(52)
вьтра>кает
зависимость
йе>кду
плотностью
тока'
прохо-
дящего
через
систейу,
и
стационарной
концентрацией
ионов металла
у
поверхности
э'"''р'да
с$.Рассмотрим
более
подробно
характер
полу_
ченного
вь!рах(ения.
|1ри
увеличении
плотности
тока
концентрация
ионов
у
поверхности
электрода
дол)кна
умень1шаться.
Беличина
с3
мо}кет
меняться'
начиная
от
исходного
значения
кон1(ентрац11||
со
при плот-
й""!й
тойа,
близкой
к нулю'
и
при
увеличении
! мох<ет
умень1питься
до
нуля.
Б
последнемслучае
плотность
тока
достигнет
некоторого
предельного
3наче!{ия'
которое
мь!
обозначим
через
!6'-
3ту
предельную
плотность
тока
часто
назь!вают
(предельнь1м
током
дифузии>'
Фна
равна
Б слунае
стационарной диффузии
величина
плотности
тока
равна
^0-л9
!:пР
о"_;
(52)
. пРРсо
|а:__1-
о
(53)
0!а
.
пРсо 09
-
от-
! о!
(54)
сз:с|(:_-)
\
|а./
(56)
3ная
связь
ме}кду
плотностью
тока
и
концентрацией
ионов
у
поверх-
ности
электрода'
мох(но
ре1пить
поставленную
3адачу
о3ависимости
потен_
ц||ала
электрода
от
величинь| тока
дифузии,
если
только
предполо)клть'
как
это
бьтло
сделано
вь111]е' что
потенциал
электрода
определяется
по ооь|ч-
ной
термодинамической
формуле
т.
е.
предельная
плотность
тока
пропорциональна
исходной
концентрации
ио}{ов'серебра
в
растворе
и
обратно
пропорциональна длине
капилляра.
Ао
тех
п6р
.-тока
ёохраняется
правильность
сделанного
нами
допущения'
согласно
которому
на
катоде
разря}каются
только
ионь:
серебра'
чере3
рассматриваемуюсистемунель3япропуститьток'плотностькоторого
превь11шала
бьт
указанное
п])едельное
значение'
1ак
как величина
*о"фиш"е"та
дифузии растет
с температурой,
то
для
данной
системь1
величина
предельного
тока
диффузии
такх{е
дол)кна
возрастать
с
температурой,
согласно
.соотно1пению
1а
ао
о
'-о!
9:чо*$_
|'..
,
в
которой
с5-концентрация
потенциал-определяющих
ионов
вблизи
поверхности
электрода.
[[одс"''ля"
в
6ту
формулу
вь1ра)кение
для
с' из
(56), получаем:
({6а)
,36
ч:'ч0*
#'"''+#,"
('_*)
(57)
({асто
нас
интересует
не
самое
значение
потенциала'
а
изменение
его
по
сравнению
с тем
значением'
которое
потенциал
имел в
равновесных
условиях'
т.
е.
до
прохох{дения
тока. Беличина
этого
сдвига'
которую
мы обознаним
терез
А9,
обь:чно
назь]вается
поляри3ацией
элект$ода
Ар:
(:--)
\
аа./
(5в)
9равнение
(53),
связь:вающее
величину
и3менения
потенциала
с плот-
ность}о
тока при
предполох{ении'
что прохо)кде1{ие
тока
влияет на потен_
циад
электрода
|олько
и3-3а
и3менения
концентрации
ионов, на3ь|вается
уравнением
концентрационной
поляри3ации.
йз
уравнения
(53)
видно'
.'то
при
плотности
тока, 6лизкой
к нулю,
величика
поляризации
так)ке
близка
к нулю'
т
. е.' в
соответствии
с
вы|пе-
изло'(еннь!м'
при
отсутствии
тока не
наблюдается
поляризации
электро-
-
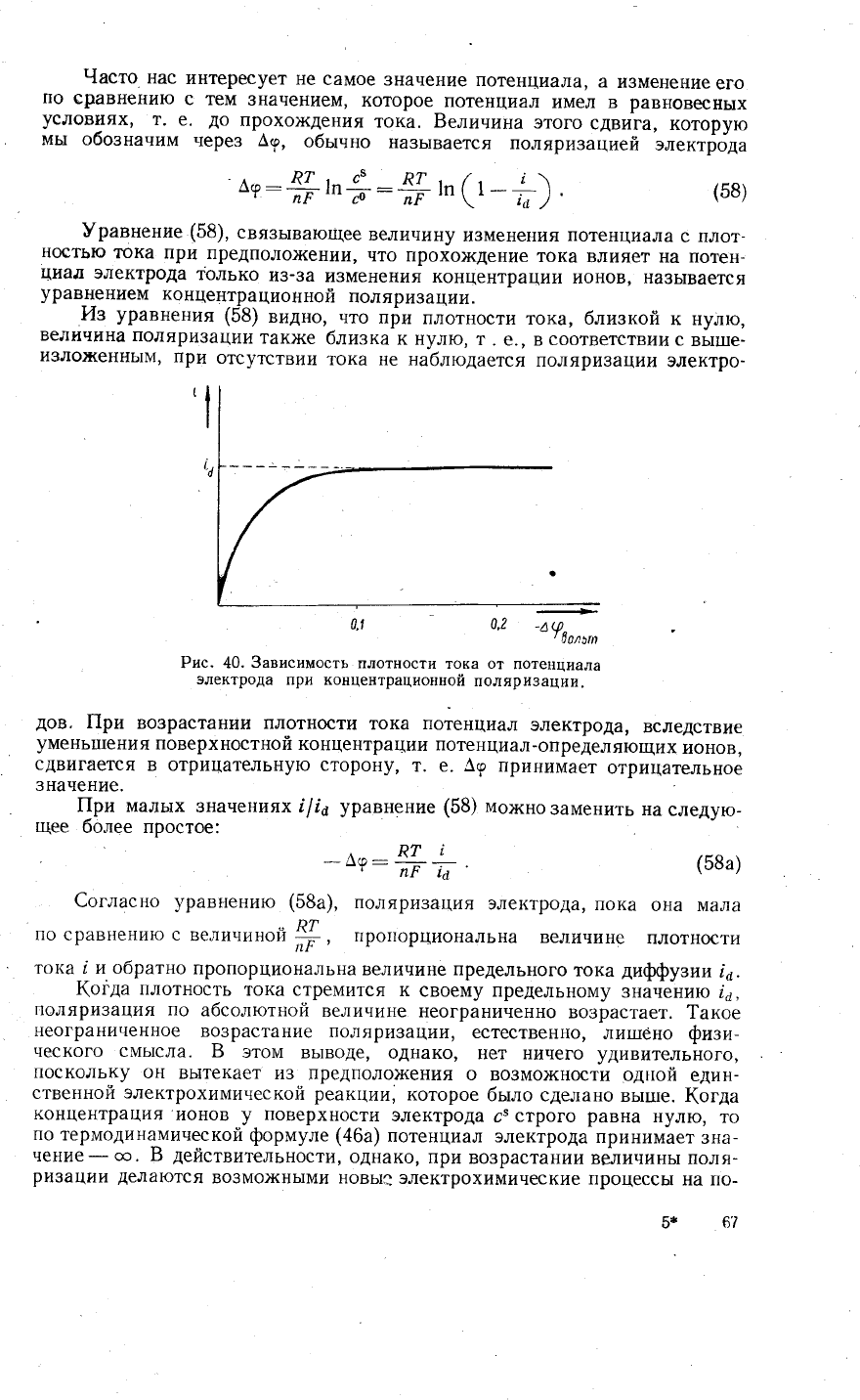
0'2
-А(0
|
0олотп
Рис.
40.
3ависимость
плотности
тока от
потенциала
электрода
при
концентрациопной
поляри3ации.
дов.
|1ри
во3растании плотности
тока
,'{-,ц"',
электрода'
вследствие
умень1пения
поверхностной
концентрации
потенциал_определяющих
ионов,
сдвигается
в отрицательную сторону'
т. е.
А9
принимает
отрицательное
значение.
|{ри мальтх
3начениях |/|6
уравнение
(56) мох(но
3аменить
на
следую-
щее
более простое:
#,"*:#,"
0,1
. &?!
'
п!'
|а
€огласно
уравнению
(53а),
поляри3ация
электрода'
пока
она мала
по
сравнени}о с
велич
иной
\
'
пропорциональна
величине
плотности
тока_| и. обратно
пропорциональна
величине предельного
тока
диффузии
|6.
(огда
плотность
тока стремится
к
своему предельному
знанйию
;4'
поляри3ация по
абсолютной
величине
неограниченно
во3растает.
1акое
неограниченное
во3растание поляри3ации'
естественно,
ли1пёно
физи_
ческого смь1сла.
в
этом
вь]воде'
однако'
нет ничего
удивительного,
поскольку
он
вь!текает
и3 предполо}(ения
о
во3мо)кности
одгтой
един-
ственной
электрохимической
реакции,
которое
бьтло сделано
вь||'ше.
(огда
концентрация
-ионов
у
поверхности
электрода
с5
строго
равна
нул}о'
то
по
термодинамической
формуле
(46а)
потенциал
электрода
принимает
3на_
чение-
оо. Б
действительности'
однако'
при
во3растании
величинь1 поля_
ризации
делаются
возмо)кными новь1.
электрохимические
процессь]
на по-
(53а)
б*
в1
верхности€электрода
(разряд
других
ионов
или
молекул),
потребляющие
часть тока, благодаря
чему задер>кивается
дальнейтпее
изменение
потен_
циала.
Ёа
рис.
40
изобра>кена
кривая зависимости
плотности тока от
потен-
циала
электрода
при концентрационной
поляри3ации, соответствутощая
уравнению
(53).
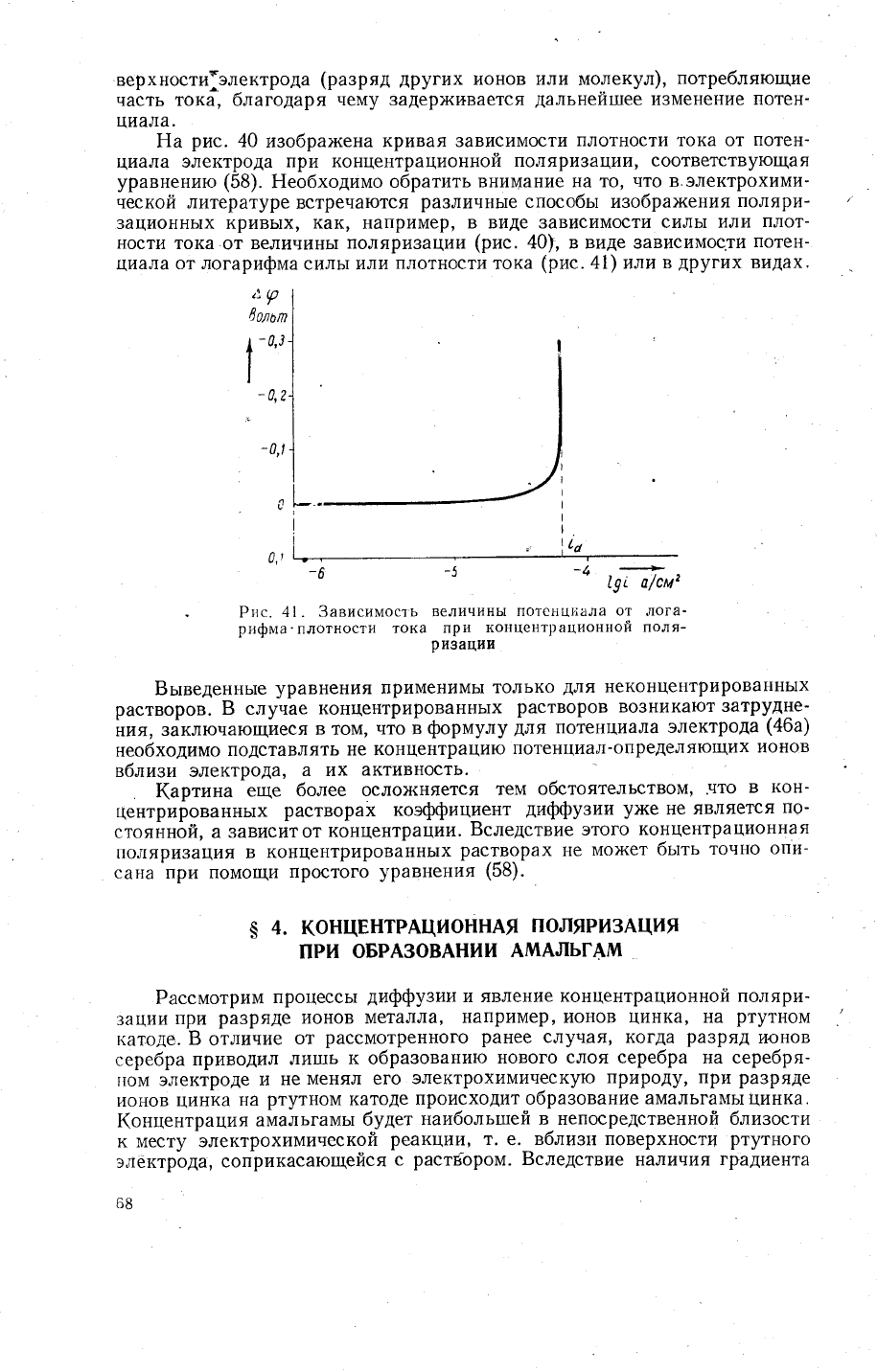
Ёео6ходимо
обратить
внимание на то'
что в.электрохими-
ческой литературе
встречаются
различнь1е
способьт изобра>кения
поляри-
зационнь|х кривь1х'
как'
например'
в виде зависимости
силь1 или
плот-
ности
тока
от
величиньт
поляризации
(рис.
40), в виде 3ависимос.ти
потен-
циала
от логарифма
силь1 или
плотности
тока
(рис.41)
или
в
других
видах'
,\Р
8олоп
!,
-
о'3
!
-л
'
-
0'1
р,,!.,
,
'
',|,,
-6
-5
-4
с97?/см'
Рис.
41. 3ависимос'1ь
величинь1
потснц!.ала
от
лога'
рифма'плотнос1'и
тока
пр].
концентрационной
поля-
ри3ац1'\1
Бьтведенньте
уравнения
применимь|
только
для
неконцентрированных
растворов.
3 слунае
концентрированнь1х
растворов
во3никают
3атрудне-
ния,
заключающиеся
в том'
нто й
формул},4;-1я
потенциала
электрода
(46а)
нео6ходимо
подставлять
не концентрацито
потенциал_определяющих
ионов
в6лизи электрода,
а их
акту|вность.
1(артина
еще
более осло>княется
тем
обстоятельством' .что
в кон-
центрированнь1х
растворах
коэффишиент
дифузии
у)ке
не
является
по-
стоянной' а
зависит от
концентрации.
Бследствие этого
концентрационная
поляри3ация в
концентрированнь|х
растворах
не
мо}кет
бь:ть
точно
опи_
саг{а при помощи
простого
уравнения
(53).
$
4.
концвнтРАционнАя
поляРи3Ация
пРи
оБРА3овАнии
АмАльгАм
Рассмотрим
процессь|
диффузии
и явление концентрационной поляри-
за1\ии
при
разряде
ионов
металла'
например' ионов
цинка'
на
ртутном
катоде.
Б
отличие
от
рассмотренного
ранее
случая' когда
ра3ряд
ионов
серебра
приводил
ли1пь
к образованию
нового слоя серебра на серебря-
!|ом электроде
и
не
менял его
электрохимическую
природу' при
разряде
ионов
цинка
на
ртутном
катоде
происходит обра3ование
амальгап{ь1
цинка.
(онцентрация
амальгамьт
будет
наи6ольгпей в непосредственной близости
к месту электрохимической
реакции,
т.
е.-вблиз11
поверхности
ртутного
электрода'
соприкасающейся
с
раствъром.
3следствие
наличия
градиента
68

концентрации
цинка
в
ртути
начинается
процесс
диффу3ии
атомов
цинка
с
поверхности
амальгамьт
в
глубь
ртутной
фазь:,
стрейящийся
уравнять
концентрацию
цинка
в
амальгаме.
|[ри
определеннь1х
условиях
мо'{ет
'
установиться
стационарное
состояние'
при
котором
количество
ра3ря)каю-
щегося
в единицу
времени
цинка
равно
количеству
цинка,
уходящего
с поверхности
амальгамь1
вследствие
дифузии.
€тационарное
состояние
дифузии
в
растворе
и амальгаме
мо)кно
осуществ-ить
при
д9у9тт1[
прибора,
схематически
изобра>кенного
на
рис.
42.
(апиллярнаятру6ка
сообщается
с
двумя
больтпими
резервуарами'
и3
которых-один
содер)кит
чистую
ртуть,
второй-раствор
электролита,
например'
7п(1,
и из6ьтток
посторонйей
солй.
Б
йапил.лляре
находится
Рис.
42
ртутньтй
мениск'
на котором
при
прохо)кдении
тока
происходит
электро-
химическая
реакция
!!3ряда
ионов
цинка.
Бнутри
калилляра
происходит'
с
одной
сто_роньт'
дифузия
ионов
цинка
к поверхности
ртутного
мениска
и' с
другой
стороньт,
дифузия
атомов
цинка
от
мениска
к
ре3ервуару
со
ртутью.
|1отенциал
амальгамного
электрода
олределяется
не только
величи_
ной
концентРации
ионов
цинка
в точке
раствора,
6лизкой
к поверхности
электрода,
но
и конце}ттрацией
атомов
цинка
в амальгаме
в точке'
6лизкой
к
поверхности
ра3дела
амальгамь1
с
раствором.
Рсли
обозначить
концен_
трацию
ионов
в
растворе
нерез
с|.,
концентрацию
амальгамь!
цинка
чере3
сй'
а соответствующие
значения
концентрациут
в6лиз.и поверхности
электроданерезс!,ис!,д,тодляамальгамногоэлектрода
р:р0*
#"*
9тобы
вывести
уравнение
концентрационной
поляризации
при
обра-
зовании
амальгамь1,
необходимо'
как
и
рань1]]е'
свя3ать
3начения
концен_
трацци
в6лизи
поверхности
с
плотностью
поляри3утощего
?Ф|{2;
А,иффузия
ио|.1ов
цинка
в
растворе
происходит
по
тем
же 3аконам'
как
и
в первом
рассмотренном
нами примере;
согласно
(53)
и
(56)
статшонар-
(5$)
69

!{ая
концентрация
ионов
вбли3и
поверхности
связана
с плотностью
тока
соотво!пением
0
,;:
+
0а_
|):#$а_
|).
|1оток
дффузии
цинка
в амальгаме
зависит от
градиента
концентра-
11ии
цинка
в амальгаме.
1(онцентрация
амальгамьт
в6лизн
границь]
ра3-
дела
с
раствором
равна
с|д;
концентрация
амальгамь|
на
конце
капил_
ляра
с}
равна
нулю'
так
как
конец
капилляра соприкасается
с
ре3ер-
вуаром
с чистой
ртутью.
|[оток
дифузии
поэтому
просто
пр-опорционален
концентрации
амальгамьт
вблизи
поверхности электрода.
1(ак
уже
гово-
рилось,
в
стационарнь1х
условиях
поток
диффузии,
вь]рах{еннь]й
в элек_
трических единицах;
равен
плотноститока
|эазряда;
таким
о6разом,
мех{ду
плотностью
тока
и
стационарной
концентрацией
амальгамь]
в6лпзут,
поверх_
ности сутшествует
простая
3ависимость
.
пРР' 5
|:_-у €м
или
"!'€у:---;;т
,
|
т
где
о'-
коэфициент
дифузии
цинка
в амальгаме,
|'
-
А]7ина
участка
кап|1лляра'
наполненного
амальгамои:
|!одётавляя
эти
вь1ра>ке[1||я
Аля
цоверхностнь1х
концентраций
в тер-
модинамическу1о
формулу
(59),
полунаем
уравнение
для'потенциала
.пол
я_
ризован!1ого
электрода'
вь]рах{енного
через
плотность
тока и
величину
предельного
тока
?: чо
+
$:"$
1''';':
соп51
+#ь''7'
.
(61)
)/равнение
(61)
является
уравнением
концентрационной
поляри_
зации
при наличии
концентрационнь1х
и3менений
как
в
растворе'
так
и
внутри
металлической
фа3ь1.
Раёсмотрим
физинеский
смь1сл
константь]'.
входящей в
уравнение
(61).
.[{егко
видеть'
что
эта константа
равна
тому
тотенциалу'
при котором
поляризующий
ток
достигает
половинь1
своего
предельного
3начения'
т. е.
.1
при
котором
|:
}1а.
}тот
потенциал'
по причинам,
которь]е буАут
ясньт
и3
дальнейш!его'
на3ь|вается
часто
потенциалом
полуволнь| и обо3начается
|т
1
21
таки!::/!
образом,
-.
&7
!пР
(60)
(61а)
1(ак
видно' 3начение
потенциала
полуволнь[
не
3ависит
от исходной
концентрации
раствора.
ф{
того ч|обы
п|:овести графивеский
анализ
уравнения
(61),
удобно
его переписать
в несколько
другом
виде'
ре|шая
его относительно
плот-
|а-
1
-
1
ности тока
;_
|а
пР(9-9т!я|
\+.7
Ёа
рис.
43
изобран<ена
кривая зависимости
плотности
по_ляр11-3ующего
тока
от
потенциала электрода,
соответствуюп\ая
уравнению
(62).
1(ак выте-
кает
из этого
уравнений,
в области
потенциалов,
в
которой
разность
7о
(62)
