Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


тогда
мольнодолевь1е
концентрации
ионов
равньт
[&1е.*]:х
[ме]
и
[:!1е'+]:(1
_
х)
[ме].
Р1змеряемьтй
равновеснь:й
потенциал
металлического
электрода
по
отнФ
1пению
к
его
ионам
низтпей
и
высп:ей
валентности
вь1ра)кается
ра-
венством
Р:
в;.*+|*"*#1п
{
[А4е]
:
Ё1"т"'|:м"+\хп(1
_
х)
[ме].
Бсли
при
данной
температуре
7
и3мереньт
3начения
электроднь|х
потенциалов
Ё1,
Ёа, ...,
Ё; соответственно,
при
9уууарчых
мольнодоле-
вьтх
концентрАшиях
его
ионов
в электролите
[&1е]',
[й"]',
.
. .,
[/!1е],
(Аостатонно
ни3ких'
чтобьт
их
коэффициентьт
активности
оставались
не-
йз*е"*,'*"),
то
полунаем
систему
уравнений:
Ё
1
:
Б]'"^'у,
*"
*
#1
п .{,
[А4е]'
:
Ём",*/м"
+
\
тп( 1
-
.{')
[ме]'
Ё
2
:
Б]^"*1,'.*
#1
п {,
[&1е],
:
Ё}т",*/м"
+
{
:п
1
:
_,{')
[}1е],
Ё1:
Ё|'"*у,^.*#1п.{,,
[&1е],:Ё}*,*/м"
+\тп(1
_
-{,,)
[&1е],,
в
которь!х
неи3вестнь1
величинь1
Ё*^"*+/^",
Ё!в.'*!м'
и
\.,.!словнь1естан-
дартньте
электроднь!е
потенциаль|
в
данной
солевой
среде
3ависят
только
от
те}{пературьт,
а
\у_Фт
температурь1
и
концентрации
ионов
в соот'
ветствии
с
константой
равновесия
реакции
$е[$""';
+
у-!
ме=#1ше]}"+"',1
|'#*
[!+г|цеп*]п1п
!#:
*"'*
[м'1,п_1п)/п^
|*"'*
[/т/[еп+1
|]'",*
'
-'
'
'
или'
вводя
условную
константу
равновесия
||ри
7:сопз1
вида:
.к*:
|**,",*
к,
[.#3+
уп|п
к-:#[^,1"]("
-
п)/(п.
мо)кно
исключить
Ё-м"^*|м"
и
получить
вь1рах(ения
Ё.
-
Ё,_
дг
(и
х,
+|,
]ме],
\
-7
_|
тпР
\---
|т
[&1е]'/
Ё,-
Ё,:#(:'{+:"]#*)
|[о
этим
уравнениям
и3
экспериментальнь1х
величин электроднь1х
потенциало,
Ё',
и3мереннь|х
при
одной
температуре
в
расплавах
с
ра3-
91

нь1ми
концентрациями
[ме]''
мо)кно
рассчитать
отно11]ение
долей
содерх(ащихся
в них
ионов
ни31цей
валентности
.[4е.*:
1р
{,
_
5040тп
(
Ё,
-
Б.\
-
1'
[&1е];
"
*, г
.
'
\/
'[м"]'-
1с
х|
(1)
(2)
||ри
7:сопз1 в
расплавах
с
достаточно
низкими
концентрациями
потенциалопределяющих
ионов'
где их
коэфишиентьт
активности
не-
и3менньт'
к'
:#;[ме]1'
_тп)/п
:#[ме]!'
-
пт)/п
:
:#[}1е]!'
_
пъ)/гп.
Фтсюда непосредственно
следует вьтра}кение
для
*,
чере3
экспери_
ментально
определяемое
отно1пение
х1'
х|
(*)"-(+#;:)"-*"*
-,
х|:
[
){'\"|^
|
|!'гуе1с1{"_*>/^
/;
\х'7
\гм"ь/
_т
Бь:числяя
отно1пения
*
""
экспериментальнь|х
данньтх
по
уравне_
нию
(1)
и
находя
_з-атем
#}'"""",{,
по
равенству
(2)
и
*.,
пои3вест_
нь1м
отнош",^^*
&,
легко
р''-,"1,'"
искомь]е
величинь]
условньтх
^7
стандартньтх
электроднь|х
потенциалов
в исследуемом
расплаве
при
дан-
нои
температуре:
Ё]6.*1
1
у":
е
!
_ 1'9у.
10_4 т 13 )(;
[}1е],
;
Б],,,.п4
1
ц":
Ё,
_
#
10-4 7 1в
(1
-
.{,)
[йе],.
_
Фневидно,
любые
комбинации
конт{ентраций,
не превь1шающих
2_
3 мол.
о/о,
дол)кны
давать
совпадающие
в
пределах
отпибок
измерений
значения- Ё'м"**/м'
и Ё},1",+17д.
для
3аданной йемпературь'.
||одобные
и3мерения
равновес}!ых
электроднь1х
потенциалов
и
расчетьт
по
ним
условных
стандартньтх
электродньтх
поте!|циалов
прои3водятся
при нескольких
температурах.
||ри
атом
получаются
линейньте
3ависи-
мости
стандартных потенциалов
от температурь1.
1аблица 5
Разности
ме1'(ду
электрднь[ми
потенциалами
металлов
в
расплавах
с 3аданнь|ми
от_
ношениями
суммарнь!х
конце['траций
потенциалопределяющих
ионов при 1000"
|( и
ука3аннь|х
долях
одновалентнь|х
ионов
в более
разФвленных
раств0р:|х
х|
(ЁгЁ')'
6 в
расплавах
с
величинами
отношений
[ме]'/[ме]'
о|7
0,99
0,90
0,80
0
'7о
0,60
0,50
0,40
0,30
0,2о
0,10
0,01
0,001
0,060
0,053
0,048
0,044
0,041
0,038
0,036
0,034
0,032
0,031
0,030
0,030
0,093
0,082
о'о74
0,068
0,064
0,060
0,057
0,054
0,051
0,049
0
'о47
о
'047
о
'117
0"102
0,092
0,085
0,979
о
'о74
0,071
0,06в
0,065
0,062
0,059
0,059
0,135
0,117
0,105
0,097
0,091
0,086
0,081
0,078
0,075
о
'072
0,069
0,069
0,150
0,129
0,116
0,107
0,100
0,095
0,090
0,086
0,083
0,080
о
'077
о
'о77
0, 163
0,139
0,125
0,115
0, 10в
0,102
0,096
0'ш3
0,090
0,087
0,084
0,084
0,174
0,147
о
'132
0,122
0,115
0,109
0,104
0,100
0,096
0,093
0,090
0,090
0,183
0,154
0,139
0,128
0,121
0,114
0,109
0,105
0,101
0,098
0,095
0,095
0,191
0,161
0,145
0,133
0,126
0,
119
0,114
0,
110
0'1ш
0,102
0,099
0,099
92

.[,остоверность
величин
условнь1х
стандартнь!х
электроднь|х
поте1{11иа-
лов'
находимь1х
этим
методом'
3авис}1т
от
точности
и3}'ерений
э_.
д.
с.
'соответствующих
гальванических
элементов'
определения
суммарнои-
ко^н
-
.центрац1{и
пот€нциалопредел
яющих
ионов
в
расплаве
и
температуры
|242|.
Б
тЁбл.
5
приведень:
ра3ности
потенциалов
в!_Ёь
и3мереннь|х
при
1000.
к
в
расплавах
с
ука3аннь1ми
отнотт!ениями
суммарнь1х
концентра-
ций
и
доля'ми
одновалентньтх
ионов
(гп:|) в более
разбавленньтх
раство-
рах.
в
тех случаях'
когда
ни3шая
валентность
ионов
равна
/12'
а
темпе-
р''ур,
т('к);
табличнь1е
даннь1е
нух{но
умнох(и1ь
на
величину
|0_3т|гп,
йто6Ёт
получйть
соответствуюш{ие
значения
Ё'_ Ё''
||риводимьте
в табл.
5
даннь:е
пока3ь|вают'
что при
одном
и том
}*{е
ра3б,осе
экспериментальнь1х
значений
потенциалов
Ё' и 8'-относитель-
!тьте
отпибки
в
ьпределении
доли
ионов
ни3шей
валентности х
во3растают
,с
умень1пением
х;
и отно1пения
[|т1е,]/[}1е]',
с
пони}кением температурь[
и
увеличением
7п.
-
9тобьт
умень1пить
случайнь1е
ошибки,
расче_тьт
не следует
прои3водить
'на
основе
однократных
замеров
потенциалов. в тех случаях'
когда
мох(но
.наде}кно
стабилизировать
концентрацию
потенциалопределяющих
ио}{ов
в электролите'
равновеснь!й
потенциал
и3меряют
при
ра3нь|х
темпфату-
рах,
получая
во3мох{но
бо,тьшее
число
эксп-ериментальнь!х
точек.
|1оли'
'|ермьг
э.
д.
с.
в
пределах
точности
и3мерений *|
мв,
как-правило:-пР|{9_
ли1нейньт
в
дово,ьно
11]ироких
интерв'лах
температур
(см.
гл. у'
$
2).
|!оэтому
экспериментальнь1е
точки лох{атся
на прямь|х' аналитические
уравнения
которь|х'
находимь1е
способом
наимень1ших
квадратов с оцен-
йой срелнеквадратичнь|х
отклонений'
по3воляют
вполне
наде)кно интер-
лолирьвать
3начения
потенциалов-
для
люб'й
температурь1
в исследован-
ном
интервале.
1аким
методом
бь:ли оп
ном
интервале.
-1'аким
методом
оь|ли оп!еделеньт
условные
стандар:ц^ь]е
электродные
потен!щалы_-в^9+/ф
ч. 9:'_*^{в"_Р.999де
распл€вленнь1х
!!с|,
электродные
потенциалы
Бе+/ф
ч. 9е1*|ве- Р
сРеде
распл-авленнь1х
!!с|
эв!€к;ики
3!|с1_2кс1,
кс1
и
сБс1
{1во]'_т1']/ц_
и
т13+/т! в среде-рас'
плавленной
эквимольной
смеси
1ч]а€1
_
кс1
[187]'
расплавленньтх
|!с!'
электроднь1е
потенциалы
ве+/щ
ч_ ч9:*{ве- Р
сРеде
распл-авленнь1х
!101
'
эв1€к;ики
3!|с1
_
2кс1,
кс1
и
сБс1
[186];
11а+/т'
и
т13+/т! в среде
рас'
п/авленной
эквимольной
смеси
}х]а€1
--(€1
[187]' расплавленньтх
кс1
и
€з€1
[56]
и
в
среде
расплавленнцх-$_в-!!''_9ч9|а-ц^Р,91:
7'а+|7г
и 7гц)|2т
в сре[е
расплавленньтх
!!61
[55|'
\1а€1
[1в2]'
кс
€з€1'
[54'[,
.|[я€1,
и 5€1,
[200];
}1о2+
|!т|о
и
ц'в+7!!1о
в
среде
расп/
,
и Ба61,
[198|;
[1в2]'
кс1
[209]'
€з€1'[54'|,
.|[я€1,
и 5€|,
[200];
.][о2+/1[о
и
мо8+/мо
в
среде
расплавлен-
",*
!;ё:
[5ъ1,_
кс|
1[э4],
1зс1
[5:]
и эвтектики
3[!с1- 2\\с|
|2+!|;
6"а+/(,е
и се6+/се
в ёреде
расплавленной
эвтектики
3[1€1
-
2кс1
[197].
3лектроотрицательные
металль|'
равновеснь[е
поте!!циаль[ которь|х
по
,отно|пению
к
хлорному
электРоду
сравнения
в хлоридньтх
расплавах
имеют величинь1
ни>ке
_
2,3 в,
сильно
корродируют
в
ре3ультате
окисле-
ния
катионами
щелочньтх
металлов в неи3отермических
ячейках
[244|.
€
такими
металлическими
электродами
нево3мо}кно получить
наде)кнь|е
политермь'1
и3-3а 3начительного
во3растания концентрации
потенциалопре-
деляющих
ионов.
|1оэтому
в ках(до]!1
опь!те приходится
ограничиваться
только
одним 3амером
потенциала.
Боспроизводить температуру
от
опь!та
к
ог1ыту
проще,
чем концентрацию.
Ф:едовательно'
равновеснь]е
потен-
циаль1
луч1пе
и3мерять
в
3ависимости
от
концентраци\4
т1р|4 неи3менной
температуре'
т. е. снимать
не политермь1'
а изотермы.9-.
А-с. для
усред_
нения'и
оценки
разброса
экспериментальнь!х
тонек
[242].
1аким методом
бьтли
определень{
условньте
стандартнь|е
потенциальт электродо" 11'а+/11:
и
11'с+7?}л
[192|,-цр+7}11
и н|4+|н1
[2|2|,
ге+/ге
и Ре2+/Ре
[146],
р,з+/Рш
[2+5|
в
среде
расплавленнь]х
хлоридов
щелочных
металлов.
1(огда
потенциалопределяющие
ионь1
вводятся в электролит
аноднь!м
растворением
металла'
их
мольнодолевую концентрацию
мох(но опреде-
лить, не
делая
химического
анализа
расплава'
по
формуле
пР
7+-
-
п|'
'ом
[ме]:
93

3десь
Р
_
навеска;
й
-
молекулярньтй
вес
соли-растворителя;
/*
-
тисло переноса
ее
катиона
чере3
пористую
диафрагму'
отде_
,пяющую
электролит ячейки
от
расплава'
в
котором находится
вспомогательнь:й
электрод
(обьттно
хлорньтй),
работающий
в ка-
честве
катода при
электроли3е;
п-валентность
металла'
переходящего
в
солевой
расплав;
@
-
колинество
электричества'
кцл.
Бстественно' что кулонометрический
способ
определения
концентрации
отвечает
действительности
ли1пь
в
тех
случаях'
когда все
ионьт металла
оста}отся
в электролите' т.
е.
нет взаимодействия
их со
стенками янейки,
во3гонов
солей
и т. п.
3начительно слох(нее кулонометрическое
определение
концентраций
металла'
если
в
равновесии
с
ним
участвуют
в сои3меримь!х
количест_
вах
ионь1
ра3нь!х
валентностей,
}1егп+
и-.&1е'*, как
например
в
случае
гафния
или тория.
3десь приходится прибегать
к
методу
последователь-
нь1х приблих<ений. |]олагая в первом
прибли>кении,
что
металл
при
анодном
растворении
переходит
в
электролит
только
в виде
ионов
}1егп*
|\ли
[у|е'*,
вь]числяют по приведенной
вь:тше
формуле
его
концентрации'
[}1е].
и
[}1е]',
получающиеся
в
ре3ультате
прохо}кдения
чере3 ятейку
@,
и
Фя
кулонов электричества. 1,]з
соответствующих
экспериментальнь1х
величин
равновесного
потенциала
рассчить1вают
значения
долей
ионов
низгшей
валентности. Бо
втором приблих<ении
концентрации
металла
нахо-
дят-
у}ке
по его
-средним
валентностям'
определяемь]м
из
знанений
.{'
и .{,,
первого прибли>кения'
в третьем приблих<ении
_
по
средним
валент-
ностям' отвечающим'
величинам
х| и .{, второго
приблих{ения'
и
так
далее'
пока они не
становятся
постояннь1ми
в
пределах
требуемой
тон_
ности.
Фбьтчно
для
этого
достаточно
четь|рех
пересчетов.
9с|еднение
и
[аблица
6
Результатьп
расчета
1.ур1
п
]?Б|
метолом
последовательньпх
прибли>кений
оценка
разброса
экспе_
риментальнь1х
величин
электродного
потенцйа-
ла
прои3водится
по
за-
висимости
Ё от
19
0,
ко-
торая
практически
(в
пределах
отпибок
изме_
рений)
линейна
в
отно-
сительно
у3ких
интерва-
лах
концентраций,
т.
е.
и количества
электриче_
ства.
3
качестве примера
в табл.
6 показаньт
ре_
3ультать1
расчета
мето-
дом
последовательнь1х
прибли>кений
доли
ио_
нов |\т2+ и
концентра_
ции
тория в
расплавах
(€1
при 800,
866,
911
и
962"6
[242|.
9исло
переноса катионов
ка_
лия,
1ц..:0,6
[2|4|.
|(огда в
равновесии
с
металлом находятся
иФЁБ| н€
А8}х;
а
трех
ра3нь]х
валентностей'
как например'
у
цир_
кония
(7г'*,
7г3+
п
!
этап
расчета |
п'р,""'р
!
.''..1,,,".
!,''".
|4сходнь:е
даннь]е
||ервое
прибли_
х<ение
8торое прибли-
'{ение
1ретье
прибли_
х(ение
9етвертое
при_
блих<ение
|{ятое прибли-
)кение
с1.
103Ё
€у8
09.103Ё
ёя, 0
х|
[ть]1.103
х2
[ть]?.10,
х|
[ть]1.103
х2
[ти]я.10,
х|
[ть]1.103
12
[ти]2.10,
х1
[ть]1'10з
х2
[ть]2.10,
х1
[ти]1.103
х2
[ть]9.10,
э'вцт|
у,твт| э,ттв|
э'ввв
2,5921
2,5651 2,5371
2,517
1,1321 1,0921
1,0751
1,056
2,5581
2,5271 2,4971
2,474
о.ээь1 о'эть!
0,3091
0.350
5,ооо!
5,ооо! 5,ооо!
5,ооо
0,0641
0,1491
0,1701
0,195
2,ооо!
2,ооо! 2,ооо! 2,ооо
о.ио[
о,звь!
о,в2|
0'4в2
5,1501
5,1811 5,2061 5,234
0,1391
0'2]8!
0,249|
о'2в3
1,0561
1,9331
1,9251
1,016
о.звэ!
о.цзо!
0,4771
0'515
5,4в1!
5,5361
5,6111
5,611
0,17\1
0,2471 0,2801
0,307
2.003!
2,0061
2,010!
2.013
о,цоо! о'+ав!
0,493|
0,52в
5,6531
5,6021
5,7731
5,811
о,1в1! 0,2591
0,2911
0,318
2.о40'
2'сф!
2'о45!
2'о4|
о'цуэ|
о'цьц| 0,500| 0,544
5,7611
5,7551 5,8861 5,865
0,1851
0,2641 0,2961 0,330
2'о42|
2,о54| 2'059| 2'053
!!!
94

]аблица
7
Беличиньт
средней
валентности
\21э
!
ионов
циркония'
рассчитаннь!е
ра3нь!ми
спосФами
\71э'|
[-'*|хт',+|п.р
и3
аподного
вь!хода
по
току
из конста}1т
равновесия
реакции
7г
+7гц*
=
27г2*
2т1-27тв+
=
37г2|
668
688
718
756
7,2
'о
7,2
19
0,830
0,840
0, в90
0,860
2,34
2,32
99,
2,28
0,840
0,860
0,
865
0,870
2,32
2,28
2,27
2,26
0,
810
0,815
0,820
0,
830
2,19
2,18
2,18
2,17
7т'+),
теоретически
немь1слимо,
чтобьт
все
они
присутствовали
в
сои3мери'
мь|х
кодичествах
в широком
температурном
интервале'
в
действительности
;;;;;;
;р6б''д'""
йакая-то
пара
и3
них.
|1оэтому
в
расчетах
мо}кно
Бгранинит!ся
именно
€0,
на
долю
которой
приходится
подавляющая
часть
потенциалопРеделяющих
ионов
мета;ла
в
электролите,
полагая
ф3
оБй"йоа
о1пибки,
нто
суммарная
концентрация
этих
ионов
равна
анал|4'
тически
ог!ределяемой.
бстается
ре1пить'.какая
пага
ио_нов
и3 во3мо)кнь1х
действительно
преобладает
в
с-олевой
фа3е'
находящейся
в
равновесии
Ё1Б1^''й""ской.,0,ля
этого
необходимо
определить
не3ависимь1м
методом
среднюювалентностьихвравновеснойсмесиисопоставитьсполучае.
мой
и3
расчетов
по
равно;еснь1м
потенциалам.
&1ох<но,
в частности'
исполь3овать
метод
вь1хода
по
току
при
анодном
растворении
металла
в
условиях,
близких
к
равновесным'
7 *_..^^'^''т' о!тотта0
"
в
качестве
иллюстрации
в табл.
7
приведеньт
значения
среднеи
ва'
лентности
ионов
ширкьния
в
расплаве
хло^рида
лития'
находящемся
в
равновесии
с
мет,ллическим
цирконием.
Фни
вь:численьт
и3
анодного
вь|хода
по
току
и
условнь|х.констант
равновесия
двух
мь1слимь|х
в каче_
стве
преобладающих
реакции:
7'+7''*
?27г2+
^ 7г*27г3+?37т2+'
определенньтхи3равновеснь|хэлектроднь1хпотенциаловрассматриваемь1м
й 5''*
параграфе
методом
[55]'
ЁайдеЁнай
йз
анодного
вьйода
^по
току
средняя
валентность
циркония
всолевомрасплавебыланих<е3.3тоисключалоизрассмотре[|иявка.
честве
основной
реакцию
7г!37тц+
?
47г3+,
поскольку
в
данном
сл^учае.
ср€дняя
валентность
циркония
долх{на
бь[
иметь
3начения
*й;;
ы й
4.
б'""'д*о,
в
преоблад6ющей
электродной
БЁ{*ц""
больш-:ое
учаътие
принимают
ионь|
двухвалентного
циркония'
А таких
реакший
мо)кет
бьтть
две:
7г|7та+
?27т2+
у|
7т
+27т3+
?37т2+"
|1олагаякакдьтйра3однуизнихосновнойвэлектродномпрощссе'
вь1числили
и3
равновесньтх
электродньтх
потенциалов
доли
|4онов
7|2+'
а
следовательно'
и среднюю
валентность
_т1иркония
в
равновеснь1х
с
ме_
;.;;ыъ;;ях
2г'+
']
7'^*
или
7т2+
ут
7г3+.
€опоставление
ее
с
величи_
;;';ь";йй
валентности'
получаемой
и3
анодного
вь1хода
по
току'
пока-
зь!вает'
что
п!€.4,пФ;'1Ф)к€ние
о
преобладающей
рол.и
первой
реакции
в
электРод"'"
,р'ш"-се
блих<е
соо1ветствует
истине.
Аналогичньте
ре3уль-
тать1
получень1
для
равно_весной
с
метйллом
смеси
ионов
7|2+
п
7|4+
в
расплаве
хлорида
цфия
[54]'
9б

Бь:вод
о том' что в хлориднь|х
расплавах
в
равновесии
с
металличе-
ским
цирконием
преобладают
ионьт
7т2+
и 7гц+
над ионами
7г3+, хоройо
с9|.ца!уется
с
данными
.[|арсена и
,/[ецди
[246],
согласно
которым
вь|1пе
450" с трихлорид
циркония
неустойнив |[
распадается
на
д|4-
й тетра-
хлорид
по
реакции:
27т(|':7г(\"{7г(1ц.
,
Бстественно,
что при более вь1соких
температурах
равновесие
этой
реакции
очень
сильно
смещается
в сторону
образования тетрахлорида'
чему способствует
такх(е
свя3ь]вание его
в
среде
расплавленнь|х
хлори-
дов
щелочньтх
металлов
в
довольно
прочные комплекснь1е анионь|
7г(|3-.
Б
ряде
случаев
нево3мох{но
определить
условнь1е
стандартнь]е
элек_
троднь;е
потенциалы
путем
непосредственг{ого и3мерения
равновесных
потенциалов.
}то мо}кет быть обусловлено
различнь|ми
прининами.
1ак,
металлический
титан
восстанавливает
тетрахлорид'
растворенньтй
в
рас_
плавленнь|х
хлоридах
щелочнь!х
металлов' практически
полностьто
до
ди-
и трихлорида'
вследствие
чего становится недоступнь1м непосредст_
венному
и3мерению
условньтй
стандартнь!й
потенциал
Ё\;ц*/т;. Фднако
к определению
этой
величинь! мох(но
подойти
косвеннь|ми путями:
чере3
и3мерение окислительно-восста}1овительнь1х
потенциалов
т|4+/т!3+
(при
и3вестцом
Б1лз*/тл
|56!
легко
рассчитать
искомую величину
Ё)р+11;
|247'
248|)
или
>ке
чере3 определение
термодинамики
растворения
1!€1,
в исследуемь!х
солевь1х
расплавах
[249-255,
230|. Б литературе
[256|
имеются
даннь1е
по
и3менению энергии
[иббса при образовании и3
эле-
ментов га3ообра3ного тетрахлорида титана. 9тобьл определить эту вели-
чину
для
его
растворов
в
каких-либо
расплавленнь1х
солях'
ну)кно
3нать
ее
и3менение при
растворении.
Бсли и3мерить температурную
3ависимость
константь1
равновесия
для
распределения
т1с14 мех(ду газовой и
рас_
плавле!|нь|ми
солевь|ми
фазами
при
достаточно
ни3ких
давлениях
и
кон_
центрациях'
когда коффициенть] активности титана в
этих
фазах
остаются
практически
(в
пределах
отшибок
измерений) неи3менньтми' то получается
А61:с:а
(р,"'')
:
А6$;с:ц
1"1
*
А6[г'"').
9сл6вньтй
стандартный
потенциал
электрода
т|/т;4+ по
отношению
к
хлорному электроду сравнения
равен
напря>кению
ра3лох(ения
солевых
растворов
т|с[4, в3ятому
с обратньтм 3наком:
Ё}лц*/тл:-
8разл:
А6{;сгз]р,"":
.
$
3. 3ависимость
ус^овнь[х
стандартнь[х
алектРоднь[х
потенцпа^ов
металлов
в х^ориднь[х
расплавах
от
радиуса
катиона
соли.растворите^я
Рядом исследователей
[40,
84,
85,
в7, 226,
25т_2661
установлено'
что
на
равновеснь|е
потенциаль|
металлов ока3ь1вает
влияние природа
катионов
солевь1х
расплавов.
Фни
связьтвают
этот
ффкт
с образованием
комплекснь1х
ионов' вследствие
чего меняются
коэфициенть| активности
потенциалопределяющих
катионов
в
солевой
среде. Фднако основной
целью
больтпинства
этих
работ
бьтло
изунение
термодинамики
в3аимо-
действия
компонентов
!8€п.г13во1еннь{х
солевь1х
растворов
методом э.
д.
с.
}олько
в
одной
и3 них
[226]
показано' как
меняется
равновеснь1й
потен-
1{иал х(еле3а в хлориднь1х
расплавах
с
номинальной величиной
так
назы-
96

ваемого
катионного
потенциала среды
9+,
которь|й
авторьт
определяют'
из отно||]ения
р.:5
'!
',,
'
4г!
где
/й',
-
мольная
доля;
а}
-
номинальньтй 3аряд.;
г!-рад|1ус
катиона
сорта
!.
Б таких
координатах бьтли
получены
плавнь1е
кривь|е'
для
которь1х
трудно
дать
аналитические
вь1рах{ения.
Ёоминальнь1е
величинь| 3арядов
(эе)
катионов
могут
значительно
отли-
чаться
от
фактинески
проявляемь|х ими
в хлоридах
в
результате
частич_
ного
перекрь|тия электроннь1х
оболочек
и наложения ковалентной
свя-
зи
|267].
!:[х
радиусь]
в
ионнь|х
расплавах-,_
н-а-оборот'
остаются прип/]ерно
такими
8€,
как
в ионнь|х кристаллах
[215]'
следовательно'
ра3умнее
искать
количественнь|е
соотно|пения
именно
с ними' а не с ионнь]ми
моментами
{эе|г).
Ёа
практике
чаще
всего
приходится
иметь
дело
с
ра3-
бавленньтми
растворами
хлоридов получаемь]х или
рафинируе}}1ых
метал-
лов
в
расплавах
хлоридов
щелочнь|х
и
щелочно3емельнь1х
металлов'
а
такх{е
их смесей,
поэтому
целесообразно
получать эти
отно1пения
для
условнь|х
стандартнь1х
электроднь|х потенциалов
в хлориднь|х
расплавах.
9словные
стандартнь]е
потенциаль1
одних
и тех
х{е.электродов
в хло_
риднь|х
расплавах
с
ра3ньтми
катионнь1ми компо3ициями отличаются
друг
от
друга
на
величину'
3ависящую
от
отнотшения
предельньтх
значений
коэфишиентов
активности,
|}*'1'
потенциалопределяющих ионов, йе,*,
в
разбавленнь1х
растворах.
Рсли
для
одного
расплава
Ё
^"у+
1
*.:
Ё*т-'*/м-*
#'",}"?*,
,}"?г/*"
:
Ё&-'*/м-*
#'"|*"[*,
,'
г*
п.
_
лг
1,
,*{*
'м"|*|
м'_
Ём"![|м"'
пг
,.
'ме?г
€ледовательно' когда
при
переходе от одной солевой
средь|
*
.ру.*
коэфициент активности
умень|1]ается'
условньтй
стандартный
электрод-
нь:й потенциал
металла
дол}кен
смещаться
в
сторону
более электроотри-
цательных
значений
по
отно11]ению
к хлорному электроду
сравнения.
Аействительно'
как
пока3ь]вают
и3мерения
э.
д.
с.
ячеек с металлическим
и хлорнь|мэлектродами,
коэффипиенты
активности
потенциалопределяю-
щих
катионов
умень1паются
по мере
увеличения
радиуса
ионов
щелочнь1х
металлов в
ряду
14х
расплавленнь1х
хлоридов от
!1(1
к €з€1,
а
равно-
веснь1е потенциаль| соответствующих
металлов при
одинаковь1х
темпера-
турах и
концентрациях становятся
более электроотрицательнь|ми.
[1одобная
3акономерность
проявляется'
причем
более
четко'
когда
сопоставляются 3начения
условнь1х
стандартнь|х
электродных
потенциа-
лов. Бсли
отло'(ить
их на графике
по
отнотшению
к обратнь1м
величинам
ионньтх
радиусов
катионов
щелочнь|х
металлов солей-растворителей
для
какой-либо
постоянной температурь]'
то
получаются
практически
(в
пре_
делах
точности. определений)
линейные
зависимости
Ё'м.,+/м-
от
1/г*+.
}го мо>кно видеть на
рис.
9, где
приведень1 экспериментальнь1е
даннь1е
для
1100'1( из
работ_по
равновесйым
п0тенциалам
'{еле3а
[146'
268],
а
для другого
то
7
м.
в. €мирнов
97

400
*-
*
*Р
\-
'
2,оо
|1ц
ъ-
.
у7'ё
0{
!
!/г*,,А
Рис.
9. 3ависимость
условнь|х
стандартнь|х потенциалов
электродов
/!1еп*/А4е
от обратной
величинь1
радиусов
катионов
в
расплавленных
хлоридах
щелочнь[х
металлов
при 11Ф'
1(
'.
'
-р'о*!Ре:
2
_
2т2*|7т;
,
-
1;в*7т1;
'
_3.я*1ве;
б:
1,
-д'3*7мо;
,'
_1;з*1т|
''
_7'+*17г;
4'
-03+!т)
циркония
[54,
55,
194] и
урана [269]
209],
титана
[56]'
по отно1шению
к
(А)
*^."'"''
на графиках
3начения
радиусов
!пмидту
[270].
||рямьте
скими
уравнениями:
бериллия
[136],
молибдена
[52,
53,
х/|орному
электроду
сравнения.
щелочнь|х
металлов
в3ять1 по
гольд_
описьтваются следующими
эмпириче_
€}''*/м':
_1
,43+0,51 /г\+в,
Ё}1
з*,,т;
-
-2,25
+0,42/
гц-у
в,
Ё),'
+
р':
_2,ю+0,44
/
г\+ в,
Ё},
*:ш
:
-2'56+0,
30
/
гр1- в,
8Ё"'*/р":
-1
,69{0,45|гц
1в,
Ё2,'
+
рг:
_2'\9
+0'
4\
/
г
р4
в'
'
Ё|:'*ттл:_2'20'10'347г^1-в'
ЁЁ",
-/'":
_2,47
|0
,41/г*1-в'
|1ервьте члень1
этих
вьтра}кений 3ависят от
температурь|
и природь[
электродньтх
реакций
(металлов и валентности
их ионов' которыми
они
обмениваются
с
солевыми
расплавами),
а вторьте
_
от
температурь1 и
в3аимодействия
потенциалопредрляющих
ионов
с солями-растворителями.
8есьма характерно,
что коэффициенты
перед ионнь1ми
моментами
катио_
нов
щелочнь1х
металлов
довольно
близки
по
своей
величине несмотря
на
то' что
участвующие
в
электроднь]х
процессах
ионь|
3начительно
отли-
чаются
;{руг
ой
друга
своими
ра3мерами
и валентностью: ге2+_(2:0,8_3^7
-2,4|),
-
77а+
(2:_0,78:2,56),
т|,*(3:
0,69:4;35),
7г,+
(4:
0,82:4,90),
{-]'*(3:1,04:2,88).
}го наводит на
мысль'
что
структура
и энергия
свя3и
комплексов
типа
Рес1?_,
}1о€1!-,
7т(\!-,
которь1е
они
образуют
в
среде
расплавленнь1х
хлоридов
щелоч!|ь1х
металлов'
по-видимому' не претер-
певают сушественнйх
и3менений
при 3амене
катионов в
ряду
|1+
-
_
]т{а+
-
к+
_
(б+
_ (з+.
3нтропии
при
этом
долх(нь|
меняться
мало'
а
измепения
энергии [и66са
и
обусловленнь1е
ими смещения
электрод_
ных
потенциалов
определяться'
в
основном'
энтальпиями
реакций
ком-
плексообра3ования
в
расплавах:
*"э+1(€1?_
:
мес:?_
+
&+,
4,|!1е3+
+
5&с11_
:
цмест
3_ +
ь&+,
ме{*+
2&с11_-
ме€13_
+
2&+,
а
ре3ультате
которых
катионы
щелочнь!х
металлов
вь1тесня}отся
и3 авто-
комплексов,
&с1:-,
во вторые
координационные
сфрьт,
где их свя3ь
с анионами
ослабдяется
|27\],
98

.[|инейньте
3ависимости
условнь|х
стандартнь1х
электроднь|х потенциа-
лов от обратньтх
величин
радиусов
катионов
щелочнь|х
металлов
пред-
ставляют
не
только
теоретический
интерес.
Фни по3воляют интерполиро-
вать
или
экстраполировать,
чтобьт оценить с
достаточно
удовлетворитель-
ньтм
прибли}кением
(Ао
с-оть:х
долей
994-ьта)
вел_ичиньт^Ёй",*/м'
для
тех
солевых
сред
в
рялу
[1€1
-
\а€1
-
кс1
--
&ьс1
-
€з€1,
где
они
еще
не
определеньт
экспериментально.
Б
качестве
растворителей
очень
часто исполь3уют
не индивидуальные
расплавленные
хлоридь!
щелочнь1х
металлов'
а
их более легкоплавкие
сме-
си.
в
промь1|пленности
это
_
эквимольная смесь хлоридов натрия 14
калия'
в лабораторной
практике
-
эвтектическая смесь хлоридов лития
и
кал|4я'
состав
которой близок к
3[1€1_ 2кс1. |!оэтому
большлое
прак-
тическое
3начение
прибретает тот
факт,
что линейная
3ависимость
€й"'+,.м"
от
1/г*+ сохраняется
и в случае
расплавленных
смесей хлоридов1|1елоч-
нь1х
металлов''
если
в качестве эффективного
радиуса
их
катионов брать
величину
,11:
Ё
ш,',,.&-г
а?,
где
.с!'
-
мольная
доля
катионов сорта
|;
г|_рад\4ус
катиона
сорта
| в
солевой смеси' состоящей
из хлори-
дов
п
ра3личнь]х
щелочнь!х
металлов.
1ак,
например'
эфективнь:й
ралиус
катионов
в
эквимольной:смеси
]х1а61_
1((1
равен
г3Ф' :
/ш,*
*'к+
-
0'9в+1'33:
1.155д.
п+:
,
:
:
2
а в эвтектической
смеси
3!!с1
-
кс1
3'г;+12'к+
_
3.0'6в12.
1,33
-
0,94д.
55
Б качестве
п'римера
приведен
график
(рис.
19)'^}1кот9р9у_величины
условнь1х
стандартнь[х
потенциалов
электродов
3е2+/3е'
д{о8+/мо
в
рас-
плавах
[!с1,
кс1,
€з€1
и эвтектической
смеси !!с1
-
1(€1,
а
так}ке
Ре2+/Ре,
{-]'+/ш,
ц;++7Ё!
в
расплавах
}х[а€1,
(€1'
€з€1 и эквимольной
смеси
\а€1
-
(€1
отло)кень1
по отно1пению
к обратным величинам
ра-
диусов
катионов
солей-растворителей.
1очки вполне
удовлетворителБно
укладь|ваются
на одних
прямь1х
как в-случае_индивидуал!ч!1х
хлоридов
щелочнь1х
металлов'
так и смесей
3[!с1
_
2(€1 и \а€1_
(€1.
Р1змененр:е
состава
смесей
одних
и тех х<е солей влияет на
величину
электродного
потенциала'
так как
меняется эффективный
радиус.их
ка-
тионов.
1(огда
он
возрастает
при повьт|пении содерх(ания соли' катион
которой
больтше
по
ра3меру'
потенциал становится
электроотрицательнее'
и наоборот.
Бесьма
пока3ательнь1
в этом отно1|]ении
ре3ультать1
и3мере-
ний
равновеснь1х
потенциалов циркония
в
расплавленнь|х
смесях
хлори-
дов
лития
и
це3ия
разного
состава:
3!1с1_сзс1(г].ф+:0,95;),
[1с1-
_
€з€1 (';**:
1,21 А)
и !!€1
_
3€з€1 ('ач
:
1,43д)
[272|.
-Ёайденнье
,зна-
чения
условнь]х
стандартнь]х
потенциалов
электродов
7т2+|7г
и 7тц+|7т
при
1000'к отложень1
на графике
(рис.
11) по
отно|пению^к^обратнь:м
вёличинам
эффктивньтх
радиусов
катионов
в смесях
!1с1
_,€о€'|,'д'1д*,
"
эф
гп1
радиусов
г:+
(о,тв{)
и €з+
(:,оь.'|;
в
расплавах
их
хоро111о
ло)катся на
одни
и те
>ке
прямь]е как
для
и|1
д||ви
ду
а льньтх солей.
йзмерения
равновеснь]х
потенциалов
цчрко_нц1
в
и 5г61,
[2001,
титана
в
расплавленньтх
}19€1',
€а€1' и
7*
хлоридоЁ. 1очки
смесей,
так.и''для
расплав{)х
:1{9€1,
Ба[1,
'[1'.9€]
лшэка-
99
!Ф
,'
;\
\=,7':
.,
,|
'2р
4а
*
:&
|
2,0
'/'эр,
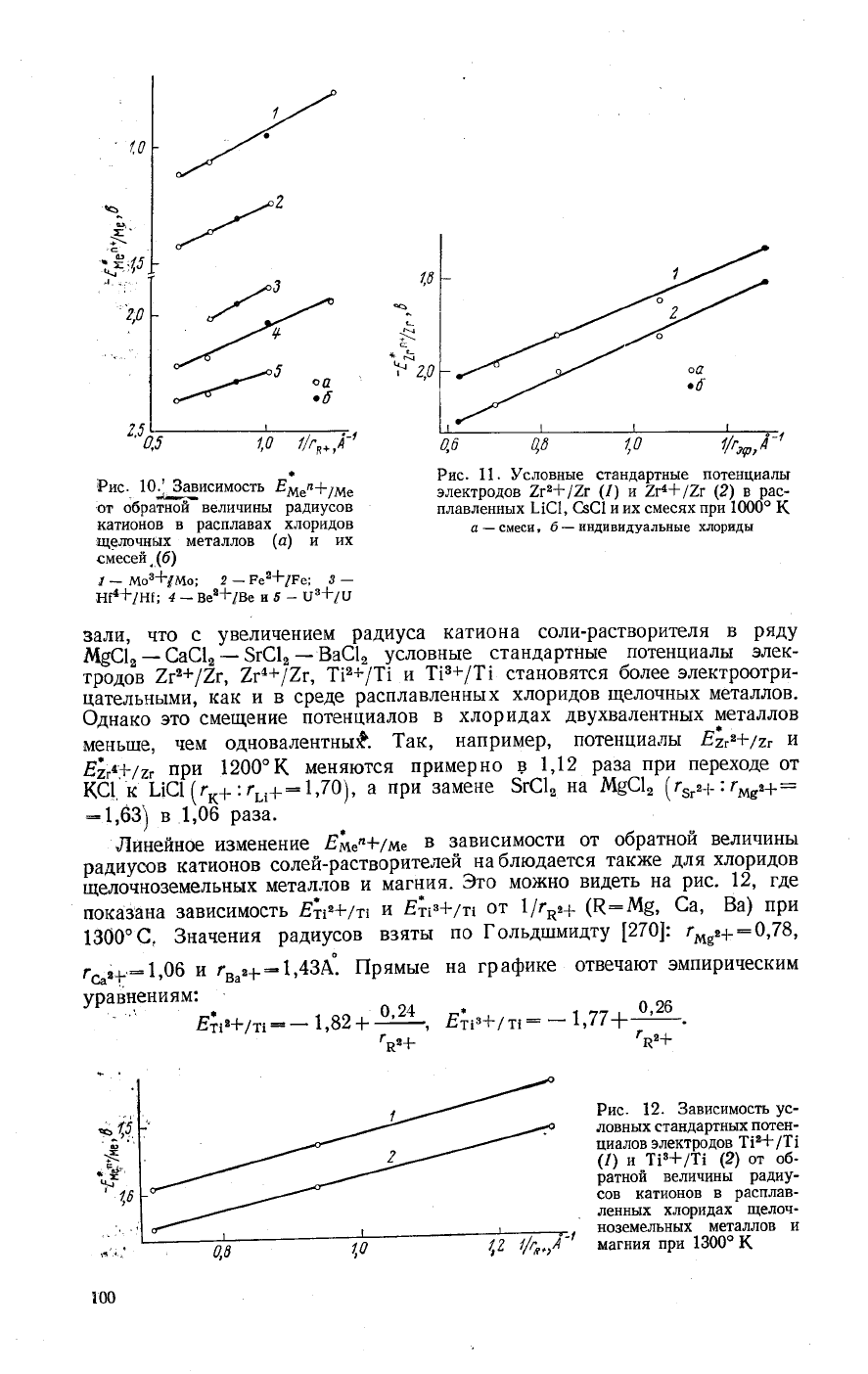
Рис.
10;!!!исимость
Ё'ц.'*1м.
|#"';"Ё1;#"':+"Ё,\',3"#^уЁ1;']?;;чт#
от обратной
величины
радиусов
плавленных
!!с1, &с1 и их смесях
при 1Ф0'
(
катионов
в
расплавах
хлоридов
4_смеси'
б_!4ндпв11дуальнь1е
хлориды
ще.'юч1|ых
металлов
(а)
||
их
смесей,
(б)
'_
моз*/мо;
2
-
Ре2+!Ре: 3
_
нг4
ь/нг;
1
_
3'**18е
н,5
-
03+/\]
3али'чтосувеличениемрадиусакатионасоли-растворителявряду
,][я€1"
_
6а€1,
_
5г61,
_
3а€1,
услов[!ь!е
стандартные
потенциалы элек-
трБдо1
7'ъ+12г'
7'о+|7т'
т12{|т\
"
11в+/1! становятся
более
электроотри-
цательнь|ми'
как и
в среде
расплавленных
хлоридов
щелочнь!х
металлов.
Фднако это
смеще1{ие
потенциалов
в хлоридах
двухвалентнь1х
металлов
мень1це'
чем
одновалентны*.
1ак,
например'
поте}1циаль]
Ё)''+17,
и
Ё?2.в'+17,
при
1200'к
меняются
примерно
^9 ^\,12
р3-за^.пру
переходе от
(ё:
й-!-:с:
(г*1:
г",+:
\,701, а
при-3амене
5г€1,
на }19€1,
(г..э4:
/*8'+:
:1,63)
в 1,06
раза.
йинейное
и3менение
Ё'м-'|/м.
в 3ависимости
от
обратной
величинь1
радиусюв
катионов
солей-растворителей
наблюдается
так)ке
для
хлоридов
щелочно3емельных
металлов
и магния.
3то
мо>кно
видеть
на
рис.
12, где
пока3ана
3ависимость
Ё\р11,'
и
Ё|7"11',
от
1/г*4
(&:][8,
€а, Ба) при
1300.с,
3начения
радиусов
взять|
по
гольдп!мидту
[270]:
г^'о-у:0,78,
гс-)|':1,06
и
/в'"+-1,43А:
||рямые
на графике
отвечают
эмпирическим
уравнениям:
"_-];-
Ё\р+1'':_|'82+
о'24
,
Ё1;'*/т:
:
_1,77+:ц_
гР2+
г&'+
?\[_
''"
0,5
*15
*
*$"
'
116
100
Рис.
|2,
3ависимость
ус-
ловнь|х
стандартных
потен_
циалов
электродов
т|'9+/т|
(1)
и 113*/1|
(2) от об-
ратной
величины
Рад\4у-
сов
катионов
в
расплав-
.
ленных
хлоридах
щелоч'
. ноземельных
металлов
и
'
маг*'"
при
1300' |(
