Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


Аз
приводимь|х
следующие
уравнения
электрду
сравнения:
Ё{€|",
мол.
о/'
0,34
0,57
о
'7|
2,\\
авторами
экспериментальнь1х
даннь'х
получаются
полйтерм
потен|1иалов
по
отно1дению
к
хлорному
Ён1''
_2
'500+3'64.10_4г
_2
'498+3,74.7о_1т
_2
'589+4
'92'|0-,т
_2
'790+7
,77
.|о_4т
||озднее
равновесные
электроднь]е
потенциаль1
гафния
в этой
х{е
соле-
вой__;Ё;-
6{'',
'з*"ре[|ь|
в
3ависи-мости
от
концентрации
при
флее
высоких
температурах'(687_850"
с)
[191].
|{олучень!
следующие
вь|ра}(е-
ниядляи3отермпотенциаловпоотно|11ениюкхлорномуэлектродусрав-
нения:
!'
'с
534-572
520-575
55,1-588
531-556
т'
.к
н!,
мод.
%
0,79-2,30
0,81-2,36
о,82-2'4о
0,85-2,50
Ё|11'
"
_1.979+7
'57
.1о-2
1в
[Ё1]+0'ф4
_1
.929+8.
19.
10_'! 1я
|Ё|!
+0'Ф2
_1
:в90+в ;79.
10_, |ё
[н|]
*0'005
-1
:
в50+9,58.
10_2 1Ё
[н|]
+ 0'0и
960
1016
\Ф2
\\23
Фбтлирнь:е
исследования
электроднь1х
поте-нциало_в
|9фния-
б-ь_тли
про-
ведены
в
расплава*
,*"'"о'"*ой
смеси_
1ч{а61
_
(€1
|208,^2\.2|,
в
рас-
плавленньтх
хлоРидах
лит||я'
це3ия
[291],
натрия
и калия
[212!,
кальшия
и барпя
[326].
_
[афний
вводили
в электролит
аноднь1м
растворением
металла.
Рго
концентрацию
определяли
кулонометрически'
Б
расплавленной
Бквимольйой
смеси
1ч]а€1
_
1(€1 снимали
как
поли_
'"рй"[эов},
так
и и3отермь1
[212]
электродного
потенциала.
Аля
соот_
ветствуБшйх
расплавов
получень1
следующие
вь|рах{ения
потенциала
по
отно1пению
к
хлорному
электроду
сравнения:
|{а€1_
((1
}.,]а€|
кс1
€в€1
€а€1э
8а612
Ё{1,
мол.
%
0,06
0,26
0,57
0,78-2,2
0,79-2,27
0,81-2,38
0,84-2,53
0,60-1,96
0,60-1
,96
0,60-1,96
0
,
86-2,
29
0,61-2,07
0,62-2,10
0
'7о-2,\2
о,87-2,29
0,47-0,90
0,50-1
,17
0,46-1,12
1
,92-5,
39
|
,04-2,82
1
,12-2,95
0,83-2,44
0,84-2,51
0,85-2,61
1,36-3,61
1,39-3,69
1,39-3,70
т'
ок
983-1185
969-1223
968-1203
1010
1093
1153
1225
963
1023
1093
1093
1 140
1 183
7213
1073
11ю
1203
1235
993
1065
1129
1097
1176
1239
1269
1333
1383
[1с|
.
Бн1'
"
-2.
565+3'
58. 10_4
г
+
0,
003
-2.
590+4.
30.
10-4
?
+ 0,006
_2
:
609+4:66.
10_4
г
+
0,006
-1'9в6+в,53
.10_'я
19
[н|]10'00!
_1
,921+9,53
.10_2
1в
!н{]+9'99?
-1
:
вв7+10.07.|о-2
1в
[н{]
+0'ф3
-1
:в09+11,от.
то_'
19
[Ё3]
+0'Ф3
-1
.825+9.32
.10_2
1в
!Ё{]+0,003
_1
.7в7+10'
1
.10_2
1е
[Ё{]
+0'Ф2
-|
'744+1о,87.10_'
18
[н']+
0'003
-1.851+9'9
.10_'д
1е
!Ё[]+0'ш{
-1
:
816+10'60.
10-'д
|в
[Ё{]
+0,005
-1
:790+1
1'08.
10_2
1в
[Ё{]
+0'005
-1:763+11
'42-1о_2
|в
[н|]+0'005
_2,о|7+7
'36
.10_'?
1в
]н!]+9'999
_1.952+в.46
.10_'
19
[Ё|]+0,Ф5
-1.89в+9.37
'1о_2
|в
[Б1]+0'002
_1
:
в46+10,
72. |0_2 |в
[Ё|]
*0'003
_2.168+5.80
.10_'
]е
[Ё|]+0'ф2
-2.093+6'72
.7о_2
1е
[Ё{]+0'003
_2'о44+7
,51
.10_'
!9
1н|!+0,003
_1
,8с6+10,06.10_д
1в
[Ё|]+0'003
_1'752+10,эц.
то_я 1Ё
.н!]
*
9' 991
_1
;70в+
11,74'7о_2
1в
[Ё{]
+0'003
_1.749+9'89
.10-'Р
1в
[Ё|]+0'003
_1
.
701
+10,85.
10_'? 1в
[Ё1]+0'Ф7
-1
'661+11
,47
.|0_2
|в
[Ё!]+
0'004
111

?оршй.
3первые
равновесные
электроднь1е
поте|{циаль]
тория
6ылп
ч1цер9цц_
в
3ависимости
от
температурь!'
которая
менялась
в
и1{тервале
6в0_825'€,
и
концентрации
в
расплавленной
эквимольной
смеси
шйс1-
_кс1
по отношению
к хлорному
э^лектроду.
сравненпя
[292].
э'ек'ройит
в
исходном
состоянии
содер>кал
0,14' 4,|\;
24,7
и
78,0
_вес.о/о
|!-д|\'.
Бь:ли
получет{ы
следующие
выра}{(ения
для
политерм:
|Ё, мол.
о/1
Ётъ''
1!, мол.
о/,
8ть'
'
0,25
_3,08045,98.10_4г
0,76
_3'146+8.08.10_4г
5
'52
_3
'
116+
в.6
4.\о_4т
38,6
-3,156+9,50.10_4г
||9злн9е
и3мерения
бь:ли
повторены
с
целью
уточнить
данньте
предьь
дущей
работьт.
€нимались
не
политермь!'
а изотермь1
электрод1{ого
потен-
циала
по
отно1||ению
к хлорному
электроду
сравнения.
Больтшое
внима-
ние
уделялось
чистоте
металлического
тория'
исходньтх
солей
и
удалению
следов
кислорода
и влаги
атмосферьт.
?орий
вводили
в электролит
анодным
растворением
металла.
8го концен-траццю
контролировали
куло_
нометрически'
и3меняя
от 0,6
до
2,1
мол.о/о
ть
[192].
3йспериментальньте
точки
далп
лтанейные
изотермь1'
которь1м
с поправйой
на термо-э.
д.
с.
отвечают
следующие
эмпирические
уравнения:
Ёть.
'
-2,473+5,47
.
10-2
!9
|1!!
+ 0. 002
-2,425+6
'о1
'
10-3
|в
[1[]
+
0
'
002
_2,31о+7
,48'10_2
|в
[ть1+0,002
Ёи>ке
приводятся
ре3ультать|
аналогичнь1х
нь1х
хлоридах натрия
[192]
и калпя
[244|:
т'
"к
953
1023
1173
измерений
в
расплавлен_
|{а€1
(0'6_2'1
мол,
%
|\'л)
кс1
(0'5_2'0
мол.
% 1!)
Ёть'
"
-?'3-?5+9'70.
10_,
|9
[1!л]
+0,003
-2'29\+7
'20.10_2
|9
[ть]+0,ш3
_2'227
+8,27
.
70_2
:Ё
[ть]
+
о,ооз
_?'456
+6'19.
10_я
19
|1|п]
+0,Ф2
_?
'998+6,88.
10_2
:Ё
[ть!*
о,оо:
_?'
?9|
+т'з2'
1о-2
|ё
]ть !
т
0
;
Ф2
-2,328+7
,85.10*2
1в
[ть]
Ё0;001
г'"к
1087
1 133
1239
1073
1 139
1 184
1235
!ран.3лектродные
потенциалы
урана
в хлоридньтх
расплавах
опреце_
ляли
неоднократно'
причем в
качестве
электролита
исполь3овали
обьтчно
ни3коплавкие
эвтектические
смеси !1с1
-
кс1
[126,
|32, 235-239,
293,
294|
и }'{а61
_.1(€1
-
м8с1,
-[1з7,
24!].
-Больгпинство
работ
,ро".де*'
с
расплавленной
эвтектикой
!|с1
_
(€1.
Равновесньте
потенциальт
уоана
1:]9й
солевой
ср-еде
и3меряли многие
исследователи:
1-руен
и
Фстё}янг
\?1!!
при
-450,
|4ццан
и
Бокрис
[238]
при
453,
9нг,'{,удсон
и
9иена
[295]
при-
500 и_^550,
1рх<ебь!ттовский'и
_(ип,а
[236|
'прй
400,
(наке,
(ра13
}1юллер
[293]
в
^йнте-р-ва^ле
450-650,
(али!ара',
йарт""о'
и
Аюп-
чер
[:-э+]-
в^интервалё
400-550'€.
3лектродом
сравнения
слу,л{ил
сере-
бряный
||26,
\37,
234-239,
293,
294|,
с
разньтми
концентрациями
а9€:
в
электролите'
а иногда
платиновый
|132,
137, 2401.
3то
затруднйет
сопоставление
экспериментальных
даннь|х
и
осло}княет
их термодинами_
ческую
интерпретацию.
Ёепосре2{ственно
по отно1цению
к
хлорному
электроду
сравнения
равновеснь1е
потенциалц_уран-а
были
определень1
в
расплавленной
экви_
мольной
смеси
\а€1
_
(€1.
Фни
и3мерялись
в
3ависимости
от темпера-
турьт
(700^_930'с)
и концентрятции
(0,35_19,6
мол.%
0)
урана
в
элёк_
тролите.
(_)н
вводился
в
солевой
расплав
в
ячейке
аноднь|м
растворением
112

металла.
14з
экспериментальнь|х
даннь1х
получень1
следующие
вь|ра>кения
для
политерм
[211]:
0'
мол.
о/'
0,098
0,337
0,601
1,03
2,\\
7
,1о
8
расплавленной
эвтектической
смеси
!1с1
_
(€1
равновеснь1е
элек-
троднь1е
потенциаль]
урана
по отно1|]ению
к хлорному
^электр^од{.
сравне_
н]ая'бьтли
и3мерень1
в
зависимости
от
темперщ}Ры
(400_51о'-9)^у
уу"_
центрации
(0,0606-0,476
мол.%т3)
|{иш:а
и-
1рйебьятовским
[296].
14ми
получень1
следутощие
уравнен1'1я
политерм:
|), мол.
|9
0,0506
0,0842
0,131
о'255
0,401
о,446
0,461
о,476
||озднее
в
этой
1л(е солевой
смеси
бьтли снятьт
и3отермь|
электродно-го
потенциала
урана
по
отно1пени1о
к хлорно_м_у^^электроду
сравнения
в бо_
лее
1пироком
интервале
температур
(402-608"с)
при
концентрациях
от
0,4
до
_2,0
мол.%ш
[269].
}.ран
вводился
в электролит
тох(е анодным
растворением
металла,
но только
в атмосфере
не сухого
хлористого
водо-
рода,
как
в
предь1дущей
работе'
а чистого
аргона.
3кспериментальнь|е
фчки
хорошо
лох(атся
на
прямь1е'
которьтм
отвечают
с
поправкой
на
термо-э.
д.
с.
ме)кду молибденовьтм
и
угольнь1м
токоподводами
соответ-
стьенно
к
урановому
и хлорному
электродам
ячейки
следующие
эмпири-
ческие
уравнения:
|), мол.
|.
Б0,
в
т'
'
к
0'4-2,0
_2,477+!,4'19-]
]в !ч]*9'99?
675
о''4_2"о
_?'4\7
+1'\.19_1
]9 !ч]*9'99?
777
о'.ц-э'.о
_2:406+5;3.10_'!
|в
[ш]+0'002
810
о''4_2"0
_2,364+5;в.10-'9
!Ё[ш]+0,002
881
Результаты тех
и
други-х^
и3мерений
расходятся
не
более
чем
на
0,03 в
в интервале
400-550"
с.
Равновеснйе электродные
потенциаль1
урана
-опр-ед|лялись
так)ке
в
расплавленнь1х
хлор'дах
л|4ту!я,
натрия
и
це3ия
[269].
во всех
опь1тах
и3мерения
проводил[1сь
непосредственно
по отно1шению
к
хлорному
элек_
троду сравнения.
Бьтли
получень1
следующие
вь|ра)кения
для
и3отерм
с
учетом
термо-э.
д.
с.:
|], мол.
уо
Ёц'"
1-|с|
о,25-1,\4
_2'2в2+5'9'19_:
!в ц!]]*9'99?
9о2
о',24-|',1
-2
.254+6
,3'
10-'я 18
тч]
Ё
9
'
99?
950
о,!эз-:,:з
_2,218+6,6'10-218[{_']:0'Ф2 1008
1.{а€1
0,18_1,4
-2,249+7
'+'19_]
|е |у_]Ё9'991
1100
о',\7_|''97
-2',2о2+7
,6'19_]
1в !ч]Ё9'999
1176
о,тз-т,о
_2;157+8'1'10_21в[ш]+о'оо+ |236
кс1
0,16_1,2
_2,34о+7,?'19_?!в!ч]*9'щ1
]103
о,
т о-т
,
т ь
-2
,299+7
,9
'
19_: |в !9!
*
9' {9
1|73
о,|35-1',77
_2',24в+в,1.10-'18[ш]+0'005
1233
€з€1
0,395-1,9
-2,46в+9,3'19_]
|в |ч]Ё9'99Р
97о
-
о"265-1''75
-2;413+6,8.19_'?!в1ч!*9'щ?
|044
о,тц-т"т
_2'375+7
'2.10-'!
1Ё
[т-]]*0'о02
1096
8
м.
в. смирнов
|13
Ё0' в
-3,о15+4,75.
10_4г +
0,
002
_3,
014+5, 05. 10_4г
+0,
002
_3,
ф5+5'
15. 10_4г
+
0,ш3
_3'
010+5, 35. 10_4г
+
0, 003
-3,009+5,60.
10_4г
+
0,003
_3,
006+5,
85.
10_4г
+ 0,003
Ё,' в
_2
'
853+
3,05. 10-4
т
+ 0,002
-2,87
4
у3,40.
10-4
1 + 0, 002
-2,871+3,50.10-4
7 +
0,002
-2
,
869+ 3,66. 10_4
г
+
0,002
_2
,
869
+3,
81
.
10_д 7
+ 0,
002
-2,
867+3,
83. 10_4
г +0,
00?
-2,869+3,
87
.\0-ц|
+0
,002
_2,
87
2
+
3'94. \Ф_
а
7 +
0,002

!|1олшб0ен. Бго
равновеснь1е
электроднь1е
потенциаль' и3мерялись
по,
отно1!]ению
к
хлорному
электроду в'
3ависимости от температурь1 и кон_
центрации
в
расплавленнь-1х
хлоридах л|4ту[я
[53],
калия
[197]'
::езия
[52]
и
эвтектической смеси [|с1
_
кс1
[243].
йолибден вводился
в электро-
лит
аноднь|м
растворением
металла непосредственно
в ячейке под
атмо*
сферой чистого
аргона. €
унетом
термо_э.
д.
с.
получень1
следующие.
уравнения
для
политерм
электродного потенциала:
Ём', ,
|'
"с
-1'296+2'91.10_4г*0,004
620-905
-1,
298+3, 28. 10-47
*
0,003
_1
'
299+3,63.10_4г
+0,004
_1'576+3'02.10_4г+0,ф3
780_940
_1'
581
+3'
55. 10_4г
+0,(ю3
_1'585+3'99.
10_4г
*
0,Ф4
_1
,639+3'
12.10_4г+0,004
650-930
-1'
м2+3'
68. 10_4г +0, 003
-1,644+4,16.
10_4г +0,ш3
-1,470+2'89.10-д7+0,004
500-860
_|'477
+3'75.
10_д7
+0' Ф4
)|{елезо.
Равновеснь:е электроднь!е
поте}1циаль1
х(елеза
впервьте бь:ли
и3мерень1
Фленгасом и }1нграхамом
[116'
232|
в
зависимости от темпе--
ратурь!
и
концентрации Ре€1'
в
расплавленной
эквимольной
смеси
}ч{а€1
_
(€1
по
отно1цению к серебряному
электроду
сравнения.
|1озднее.
[аур
и Бэл
[134_136|
произв€й}1 2Ё8а1Ф|ичнь]е и3мерения
в
расплавлен_
ной тройной
эвтектике
\а€1
_
кс1
-
!!19€1,
при 475" с
-по
отно1пению
к
платиновому
электроду
сравнения.
(юнль
и ь3енбрух
[266]
исследо--
вали влияние катионов
растворителя
на
термодинамическую
активность
Ре€1,
в
расплавленнь1х
хлоридах
щелочнь|х
и
щелочно3емельнь1х
метал_
лов. € этой
целью
они
измерили
при
820 и 920'с э.
д.
с.
ячеек
с
>л{е-
ле3}{ь1м
и хлорнь1м
электродами.
3лектролитом
слух(или
расплавь|
кс1
_
-
€з€1,
кс1,
0,768кс1
-
0,232}ц{а€1, 0,232кс1
_
0,768|',]а€1,
\а€1,,
\а€1-!|€1, !х1а€1-5г€1, и
[.{а€1-.с}19€1',
содер)кащие
от
0,1
до
15мол.%
Ре€1'.
йз приводимь!х
в
работе
эдспериментальньтх
даннь|х
получаются:
уравнения
для
изотерм
электродного
потенциала
}1(елеза:
Ре, мол.
$
Ё-'в
Ёе
т'
ос
|-!с1
кс1
€з€1
!!с1_кс1
мо'
мол.
оА
0,119
о,37
1,09
0,395
1,98
7,30
0,316
1,96
9,42
о,172
2,34
((1-€в€1
0'4_9,0
-1,376+15,55.10_,
|9[Ре]+0,Ф5 1093
0,4-9,0
_1,357+15'65.10_2
1в
[Бе]+0,0й
1193
кс1
о'7-7,9
_1,316+15,13.10_'
18[ге]+0'002
1093:
о,7__:7,9
*1,320+13'37.70_21в[Ре]+0'Ф3
1193
0'768 кс1
-
0,&_5,2
_|,295+13'26.10_,
1в
[Ре]+0,001
1093
0'232
!х|а€1 0,3-5,2
-1'275+\3,43.10-219[Ре]+0,Ф4
1193:
0'232
кс1-
о'2_4'9
-1,219+13,65.10_21в[Ре]+0,004
1093
0'768
},|а€1 о,2-4,9
_1,187+14,59.10_2
|9
[Ре]+0,005
1193
\а€1
о'5-4,7
_1,190+13,30.10_2|8[Ре]+0,007
1093
0
'5-4'7
-1
,160+14,10.10_а
1в
[Ре]*0'005
1193;
}\!а€1-!1(1
0,1-5,2
_1,205+10,80.10_21в[Ре]+0,ф7
1093
о
,1-5,2
-1
,
170+11
,80.
10_д
18
[ге]
+
0, ш9 1193
\а€1_5г€1,
0,3-5,8
_1,173+|2'22.|о_2
|в
[Ре]+0,004
1093
0,3-5,8
_|
'137
+|3,20.10_'9
18
[ге]
*0'005
1193]
}{а€1-й9€|2
0,3-9,0
_1,160+10,20.10_318[ге]+0,005
1093,
0,3-9,0
-|'124+11,04.10-21в]Ре]*0'006
1193;
|1озднее
равновеснь1е
электродные
потенциаль1 х(еле3а
в
расплавлен-
нь1х хлоридах натрия'
калия и их эквимольной
смеси
[146]'
а также
хлориде
1езия
[268]
были и3мереньт по отно|'шению к хлорному
электроду
сравнения в
более
11]ироких
интервалах т€мператур. 3кспер.иментальнь1е
!14

Ре'
мол.
|о
Ё^,в
ге
т'
'с
п*ас1
0,35_1,1
-|,232+\\,6'10_':9
{ге]1!'$2
1093
о]зо_:]:
-1'.217+12'.1.10_'1Ё[ге]*0'Ф!
1133
0:55_]
''
_1',197+12'7
'19_:
!ё [г'!*9'99?
1173
0:з6_]
:]
_т
,:ть*:з,ь'
10_' |Ё
[ге1+о,оо:
1223
кс1
о,44-\
'6
_1
,969+11
,2'|9-ь:9
ц[е]+!'!!!
1083
о'.+Б-1'.1
_1
:ш9+
1 1
,
в' :о_' :9
[ге1
+
о, ш:
1133
о'.цэ-1'.ц
-:.з:ь+:э,+'16-я19]ре]*0,Ф3
1173
о].{б-1
,з
-т
,зоо+:з,о'
10_' 1Ё
[ге]+о,шэ
1223
1.{а€|
_ (€1
0,38-1
,4
-1
,348+9,90'10-в
18
[ге]{_0.ф1
973
о]цБ-:]5
_т'зз:1т0,ь0'10_'1Ё{гь]+0,ш1
1023
о'.51_1'.1
_:'зов{т:,ть':о_'1ё]ге]10'002
1073
о"4у-1"1
-т':вь4тт'во':о_':Ё[ге]*о'оо:
1123
о.+]-]
.!
-|',263+12',40'10-2
:9
[ге1*о,ш:
1173
о,5:-1
']
_т',уцу+тз',э0'10_'
:Ё
{ре!1о'ш:
1223
€в€1
о'73-2'3
-1,486+9,7в
'19_118[Ре|*0,002
973
о]о0-:]5
-|'.457
+|б
'47'
10_2
:Ё
[ге]+о.ш:
1033
о''1ц-у,''з
-1:416+11''29'7о-2:9[це]19'9от
1103
о''73-2''4
_|',379+|2'1,3'10-2в[г'е]+0,002
1173
,[1,анньте,
приводимь1е
в
ука3аннь1х
вьттпе
работах,^хоро1по
согласуются
,
с,у''е
шаё:
и значите}ьно
расходятся
для
|(€1.
-Ёаклон
и3отерм'
полуйаемьтх
и3
ре3ультатов
и3мерений
(юнля
и Безенбруха,
при
повь1-
шении
температурь|
умень1пается'
а
не
во3растает
в соответствии
с
урав-
нением
Ёерйста.
}то
ставит
под
сомнение
достоверность
их
данных
для
(€1.
$
2.
Равновесшв
мех(ду
некоторь[ми
металлами
п их
понами
разнь|х
валентностец
в х^ориднь[х
расп^авах
Равновесше
реокцшц
&1'1
*Бе2+=2ве+
в
сре0е
расплавленных
хлорш0ов
щелоц[|ь!х
,!2!т!аллов.
Фп-ределение
вь1хода
по то{}
при анодном
рас-
творении
металлическогб'бериллия
в
расплавленной
эвтектической
смеси
1;ё1:(с:-йрй
ьоо"
|297|'у
и3-у19нч9
его
в3аимодействия
с
Бе€!',
рас_
твореннь1м
в
расг:лаЁе
!|с1
_
кс1
[298]'
пока3али'
что в
равновесии
сметалломнарядусдвухвалентнь1миионамиучаству1оттак)кеоднова-
лентнь1е.
(3лектрохимические
методь1
не по3воляют
одно3начно
ска3ать'
являются
ли
они
прость1ми'
Бё+,
или
димерньтми'
[*|};+.
[ля
ре1пения
этого
вопроса
ну)кно\
привлечь
другие
методь|
исследования'
ттобьт
раз_
.личать состояния
валентньтх
электронов
у
во3мо}кнь!х
ионнь1х
форд
с{:
ществования
одновале}{тного
берпйлия
в
хлориднь:х
расплавах).
1акой
,вьтвод
подтвер'(дается
ре3ультатами
измерений
э.
д'
с'
гальванических
элементов
с
бериллиевь1м
и хлорнь!м
электродами
в хлориднь|х
распла_
'вах.
Р{аклоньт
экспериментальнь1х
изотерм
электродного
потенциала
соот'
ветствуют
средней
валентностп
6ериллпя
мень1це
двух'
причем
она
уве-
'личивается
с
повь11пением
кон1{,ентра1|'ии
и
пони}кением
$емпературь|'
Ёа основании
ре3ультатов
и3мерения
равновеснь]х
электроднь|х
{1отен-
'*''',
Фриллия
}
!азбавленнь|1'растворах
е_го.
хлоридов'
где
коэффи-
циенть1
активности
и6нов
Бе2+
и
ве*
(
|}.,+
и
[**)
остаются
практически
(в
пределах т0чности
их
определения
на.опьтте)
постояннь1мп,
бьтла
най'
.!ена
температурная
3ависимость
условной
константь1
равновесия:
**:
й!д'_[Бе*]'9-
'3"*
гв"!.
д\
г3?*
[8е'*]
1
-
{3"+'
'
,Фна
вь|ра>кается
следующими
уравнениями
в
ука3анных
€Флёвь!х
€!€'
дах
[186].
,8*
115

1аблица
11
}словная
константа
равновесия
реакции
ве(т)+ве2+
=2ве+,
доля
ионов
ве+
и
сред-
няя
валентность
бериллия
]186'
213] в
расплавленнь|х
хлоридах
щелочнь|х
металлов
,,.-!
,"",1
,!
](ве_Ё
'"р
{ве*
'.р
,"р
к*
*.
[!
.'
'-
|
'""*
Б
расплавленной
эвтектике
!|€1-|{€1
8
расплавленном
(€1
! [8е]:
!:4,73'10-3
5,45.10-б
!
о'оэ
!:,эт
9,38'10-б
!
0'13
!
1,в7
1,48.10-4
!
0,16
11,34
2,15.10_4
|
0,1э
11,в1
800
900
1000
1 100
1200
900
10ш
1100
1200
1300
|Бе]:
:7
'15.1о_,
0,03
|
1,97
0,11
|
1
,80
0,17
!
1,83
0,2211
,78
0,28!1
,77
! [ве]:
!:1.0+.10-'
6,42.10_4
|
0,08
11,92
1,37.10_з
|
о'26
\1'74
2,51.10-3
!
0,39
!1,61
4,11.10_а
|
0,48
|1,52
6,23.10-3
|
0,54
11,46
1
100
1200
1300
1400
!
[ве]:
! [ве]:
|
:6,
06. 10-3,:9,55.
10-2
4,44.7о_4
|
0'20
|
1'80
]
0'06| 1'94
9,93.10_4
!
о'зо
1
1'70
}0'09 !
1'91
1,2в.10_з
|
0'37
|
1,63
|
0'11
|
1,в9
1'94.10_з
|
0'43
|
1'57
|
0' 13
:
1,87
8
расплавленном
€в€1
Б
расплавленном
[1€1
! [ве]: ! [Бе1:
|
:4'63.
10_з
|:2.4о.
1о_2
3,34.10-3
|
0,56
11,4410,31 11,69
3,55.10_з
|
0'57
|1'43!0'32|1'68
3,72.\о_в
|
0'58
|1,42|0,32|1'68
3,в8.10-3
|
0,59
|
1,41
|
0,33
|
1,67
4,02.70-3
|
0,50
|
1,41
|
0,33
|
1,67
1000
1 100
1200
1300
! [ве]:
|:1'01
.1о-:
!
0,02
!
1,98
!
о,о3
|
1,$7
!
о,о4
|
1,06
!
о,о5
|
1,95
Б
расплавленной
эвтектике
!!с1
_
кс1
18(*:
-0,232-2369|т.
Бе
значения при
ука3аннь]х'температурах
дань|
в
табл. 11, где
приво_
дятся
так}ке
доли
катионов Бе+
и
средняя валентность
бериллия
в
рас-
плавах [1с1
_
1(€1,
содер'{ащих
7,04 и
7,15 мол.
%
Бе.
Б
расплавленном
[|€1
19.(*:
-2)\в
-232|т.
Фбраштает на
себя
внимание
относительно
небольтпое
температурное
смещение
равновесия.
Фневгтдно'
смешение >кидких
хлоридов
6ер!}:лия
|| л|\т||я
сопровохцается
ли1шь
не3начительнь1м
изменением
энергии
свя3и
частиц
расплавов
с
температурой.
3
расплавленном
(€1
18'(*:
-0,375 -3276|т.
4оля
ионов
одновалентного
6ериллия
в
равновесной
с
металлом
сме_
си
ве+ и
Бе2+ в среде
расплавленньтх
хлоридов
щелочнь1х
металлов
во3растает
с
уменьшением
радиуса
их катионов'
повь11пением
температуры
и
поних(е11ием
кон]]ентрации._Фна
с^оставляет
около
0,1
при
1000"к
в
!}с_
плаве €з€1,
содерх(ащем 0,!7
мол.о/о
3е,
и
достигает
прй
той
>ке тейпе-
ратуре
0,57 в
расплаве
[1€1,
содер}кащем 0,46
мол.
%
м'.
Б
расплавленном
€з€1
18
1(*:
-
1,663
_
2601
|т.
-
Равновесце
реакцшш
[а1*1
*2!а3+=3[а'+
в
расплаве
хлорш0ов
лан!т!ана-
Бь1ход
|1о
току при
анодном
растворе\1ии
и
наклонь1
изотерм
равновес-
ного
электродного
потенциала пока3ь1вают'
что в
среде
расплавленной
эвтектики
[1с1
_
1(€1- в^-равновесии
с
металлом
прео6ладают
ионь|
трех-
валентного
лантана
[196],
олнако наряду
с
ними
при
отсутствии
кати-
онов
щелочньтх
металлов в
ощутимь]х
количествах
появляются
ионь[
двухвалентного
лантана
[216].
Ё.аклоньт
и3отерм
э.
д.
с. концентрацион_
нь1х
эле1\1ентов
[ас*:
[
[а€1,,
[а€121,,",,1
| |[а61',
/\а(|26^",,1
|&1о
при
разнь|х
концентрациях
лантана
в
электролите полуэлемента
с инди-
каторнь1м
молибденовь1м
электродом
совпадают по величине
с
2,3Р||Р
116

при
соответствуюш1их
температурах.
3то
свидетельствует
о
том'
что
в
равновесии
с
металлом
участвуют
ионь1
двух_
и
трехвалентного
,1анта_
на;
а
расплавьт
[а€1,
_
!а€1,
близки
к
идеальньтм
во всем
_инте-рвале
составов
от
чистого
ьйс:,
|'
$',*о"ес"ой
с
металлом
смеси
!а61,
-
!а612,
,-
{"{"р'а
преобладает
!ихл6рид.
14з
результатов
измерений
э.
д.
с.
в3ависимостиоттемпературь11,1составаполученовь1ра,(ениедлякон.
станть1
равновесия:
1вк:тв{$$:1,866
-+
Равновесие
меняется
с
температурой
незначительно.
Рассчитаннь:й
по
этому
равенству
состав
равнове6ной
-с
металлом
смеси
\а€|,
и
[а€1, при
вьб]тбьо'€
оЁвечает
эйпиринеской
формуле
[а€1э,'4
и
цах9дится
в
пол'
эй.'ри'еской
формуле
[а€1э,'4
и
ч1}9+ится
в
пол'
ном
согласии
с
прямь1ми
аналитическийи
определениями
[216].
Равновесше
реакцшш
€е{2€3з+
=
3се2+ в
-
хлорш0ньсх
расплавах.
Бь:ход
по
току
при
анодном
растворении
и
наклоньт
и3отерм
равновеснь1х
элек-
троднь!х
потенциалов
пока3ь1вают'
что в
равновесии
с
мета.т|лом
наряду
с
ионами
трехвалентного
церия
3аметную.
роль
игр.ают
т9'уе
двухвалент_
;";;тто'1.
-
Б_
р'с,''"ленной
эвтектичесйой
смеси
|!с1
-
к91:]9А"Р*3'1!3
850-1
с
ионами
трехвалентного
церия
3аметную.
роль
иг
;;ъ';;;:у.
ёБ,
у.''вная
констаг1та
равновесия
меняется
с
температурой
согласно
эмпирическому
уравнению
18/(*
:
:в
-!$}}:
4,ш9
-
#.
||ри повьтгшении
температурь1
от
400
до
700"^€_доля^ионов
двухва-
лентного
церия
"
ра"но"еёной'с
металлом
смеси
€е3+ и
€е2+
возрастает
примерно
от
0,05
ло
0,4.
'
Б
отсутствие
катионов
щелочнь|х
металлов
в
расплаве
равновесие
реакции
ёще
более
сдвигается
в сторону
образования
дихлорида
церия'
солео}кание
которого
в
равновеснои
с
металлом
смеси
€е€1,
и- €е€1,
;;й;;;;
ъ9
мо].
%.
€м<!си
€е€1,
-
€е€1,
по
своему
поведению
близки
7-й1",'"".,'.
(онстагтта
равновесия
меняется
с
температурой
незначи_
тельно
согласно
эмпирическому
уравнению
|р !(:1о
[€е€1я13
_2,362
-
ч.
'ё
_
\
_-
[с'с1';'
т
Равновесше
реакцшш
1!1.1*21!3+=3т12+
в
ще0е
расплавленнь!х
хлорш'
0ов
щелоинь|х
'ш
щелоцно3емельнь!х
мепшллов.
Равновесие
ме}кду
металли-
ческим
титаном
и его
иог1ами
ра3нь1х
валентностей
в хлоридн!1:'распла-
вах
и3учалось
многими
исследователями.^-,г\4еллщен
и
Фпие
[299]
иссле-
довали
его
в
расплавленнь]х
смесях
\а€1
-
5г€1,
в
3ав-исимости
от
их
состава'
темпеРатурьт
и общей
концентрации
ти1ана'
(рей
*и
^$''']9д:
[300]
провели
аналитические
исследования
в
расплаве
|\а0|
-
]\\'|
й
натпли,
что
при 700
-
800'с
титан
находится
преимущественно
в
двух_
валентном
состоянии.
Фни
вьтчис,пили
константу
равновесия
реакции
1!+:т;0:'=
3т!с12,
величина
которой
ока3алась
зависимой
от
концент_
рац|1и
титана
"
.''."о*
расплаве.'(омарек
и
[ерасименко
[301]
и3учили
оавновесиеме)кдуметаллическимтитаномирастворамиегодихлорида
Б
р'с,''"'енном
-1.,1а€1.
Фни
построили
фазовую
диаграмму
системь1
во
всём
интервале
состава'
которая
пока3ь|вает'
что
существуют
два.'.?ж-
нения:
ша}|с1',
образующееся
по
перитектической
реак11ии^
при
б26"
0'
|-ь!''пс;.,
р"'з''.''феся
в
^твердом
состоянии
йри
543'€,^
2-так)ке
эвтектика'
.'д"р*'ц'150
""..ж
-1у9т"
и
плавящая!3
,ри
605"с'
Авторьт
предполагают'
что
в
расплавах
}х1а€1
двухвалентньтй
титан
образует
хло_
риднь|е
комплекснь1е
ионь[
т1с1;_.
€читая,
что
подобньте
комплексь1
.'.''"'
т1с1г
дает
не
Ав}х-,
а
трехвалентнь:й
титан'
[рец9йу-
и 1огури
!302] рассматривают равновесие
реакции
в
расплавах
кт1с|4+\|2т|=
Ёйт;"ёй+кё[
щ-й''','й
мёталл)
и о6ъясняют,
каким
образом
\\т,

общая концентрация-т\4тана
и природа
солевого
расплава
могут
влиять
на него.
Бузенни
[303]
изунал
равновесие
ме)кду
металлическим
титаном'
его
ди-
и
трихлоридом
и натрием'
раствореннь1ми
в
расплавленном
\а€1,
и3мер-яя.ра3цо9ть
потен-циалов
мех(ду
титановь|ми
электродам||
в
расг]ла-
вах
\а€1-т|с13
и ]:{а€1_\а.
Фн
!становил'
что при'800'€
в
разбай-
леннь]х
Растворах
произведение
мольнодолевь|х
концентраций
натрия
и
дихлорида
равно
1,6.10_15,
а
отно1пение
мольнодолевьтх
конт{ентраций
три-
и
дихлорида
титана
составляет
0,02.
-.
{'".-цчцкий--|304]
считает'
что
в
расплавах
эквимольной
смеси
\а€1_
(€1
и
|(61 мех<лу.
хлоридами
титана
ра3нь|х
в4лентностей
проис-
ходит
несколько
реакций.
Равновесие
реакйии
2т|с13
=
1|€1,
+
1|ё1+с":
смещено
влево
в интервале
-темц9р4тур
700
__
800,
а
реакшии
2т|с13т
+т!=3т1с12
вправо
при
675-90о"ё.
!,ихлорид,
всвоБ
очередь'
мо}кет
вступать
в
следующие
реакции:
т1с19+т!с13=2т|с\
и
31!€1,
=
т!+т|с14,
4т!с13
=
т1+3т|с14.
Баймаков
и
(аменецкий
[305]
вь1дерх{ивали
мета,плический
титан
длитель_
ное время
цр_и
825^".€
в^
расплавленной
эквимольной
смеси !х{а€1-(€1,
содерх(ащей
8 вес.
%
т1с|з,
и
на|лли'
_что
равновесие
реакции
|1|2!1(|"1
=3т!с12
устанавливается
3а 4 цас.
(онстанта
равновесия
в их
опь|тах
зависела
от исходной
коншентрации
тр|1хлорида.
Б
расплавленном
1(€1
образуется
на
имень1пее
количество
дихл6р
ида.
Фно
увел
ичиваетс
я
с повь}1пе-
нием
концентрации
!'{а€1 в
смесях
\а€1
-
(€1
и
достигает
наибольтпей
велгт-
чинь| в
расплавленном
1',1а€1.
(онстанта
равновесия
во3растает
от
8,6.10_{
до
6,14.10_2
при
переходе
от чистого
(€1
к |,,1а€1.
Ёе
3ависимость
от
9Р^с1ав!^99левой
средьт бьтла
показана
так}ке
йарковьтм
с сотрудниками
[306,
307],
которь.!е
исследовали
равновесие
реак|лии
21;€1"+}{=3т!с|,
в
расплавах
\а€1-
кс1,
\а€1-. €а€1,
_
Ба€)',
й9€1,
и €зё1. Б
расплав1
ленной
эквимольной
смеси 1х]а€1
-
(€1
при
достийенйи
равновесия
с
ме-
таллом
80_90%
титана
^находится
в
двухвалентном
состоянии. Б
й9€1,
его_доля
падает
до
50%.
(онстанта
равновесия
реакции
равна
:'о
Ё
}.,1а€1^при
860;
0,12 в
кс1
при 300;
0,032
в эвтек1ике
[]с!
-
(€1
при
3в0'с.
Авторьт
на1']ли' что
она сильно
меняется
в
3ависимости
от общего
содер)кания
тита!|а
в
расплавах.
€кляренко
и Белов
[308],
наоборот'
счи_
тают'
что
равновесие
этой
реак!]ии
не
3ависит ни
от
температурь1'
ни
от
катионов
щелочнь]х
металлов'
входящих
в
состав хлорид}1ь!х
расплавов.
*.^}}лневский
и
др.
[309]
и3учили
особенности по'вфния
растворов
1!€1,
в
хлориднь1х
расплавах
и
установили'
что
его концентрашия
с"а'би-
лизируется
только
в присутствии
металла.
1'опиенко
[310_313]
исследо_
вал
восстановление
1|€1'
металлическим
титаном
в
среде
расплавленньтх
хлоридов
в
условиях,
близких
к
промьтшленнь1м.
8еличинь:
константы
равновесиг,
мФкду
металлическим
титаном
и
его
двух-
и
трехвалентнь1ми
ионами
в хлориднь1х
расплавах
3начительно
расходятся
по
даннь!м
ра3нь1х
авторов.
|1ри этом
устанавливаемь]е
3ако-
номерности
ее и3менения
с температурой,
природой
солевой
средь1 и
кон_
ллентрацией
часто противоречивьт.
в
частности' вь13ь!вает
недоумение
сильная
заРисимость
константь|
равновесия
от
концентрации
титана
в
рас-
плавах
в
тех
случаях'
когда
она
невелика'
потому
нто
коффи11иенть1
активности
ди-
и трихлорида
в таких
растворах'
меняются
очень мало.
1|ричина
всех
этих
расхо>кдений
и
противоречий
связана в какой-то
мере
с
бо_льш.тими
огшибками
в определении
равноРеснь1х
с металлом
кон-
центраший
двух-
и трехвалентного
титана
в хлориднь1х
расплавах'
так
как пока
нет наде}кнь1х
методов
ра3дельного
определения
ра3нь1х
валент-
ных
состояний
одного
и
того
}{(е
элемента
в
расцлавах
при
вь]соких
тем_
пературах.
|1оэтому
приходится
прибегать
к
анали3у
3асть1в1.пих
солевьтх
смесей,
охла)кденнь|х
до
комнатной
температуры.
йменно
3десь таятся
1|8

! аблица
12
/словная
константа
равновесия
реакции
[|111}2[!3*
=3т|'?+'
.
доля
ионов
]|2*
и средняя
валентность
титана
в
расплавленнои
1квимольной
смеси
[ч{а€!-кс!
[|87|
х11,+
|
|т\'+
.{1;:.!1
п",
|.:{11:+
к*
п'ц:.'';
;:4г'ц:',
-;,|г':]:
:,э
з' : о_'1!';]:о,
оо' : о_'
2,о5
2'о5
2,08
2,09
2,11
2,13
1000
1050
1 100
1 150
1200
12ьо
54,45
25,88
13,
18
0,852
0,607
0,381
0,99
0,98
0,98
0,97
0,97
0,96
2,02
2,02
2,02
2,03
2,03
2,04
0,98
0,9в
0,97
0,96
0,95
0,94
2,02
2,02
2,о3
2,04
2'о5
2,06
0,98
0,98
о
'97
0,96
0,94
0,92
2,02
2'о2
2,03
2'о4
2,06
2,08
0,95
0,95
0,92
0,91
0,89
0,87
источники
3начительнь1х
о1пибок
3а
счет
сдвига
равновесия
при охла)кде-
нии
на многие
сотни
градусов
и
переходе
от
х(идкой
фазьт
к твердь1м'
а
так)ке
3а счет
вто}ин1тьтх
реакций
окисления
соединений
ни31пих
валентностей'
особенно
когда
операции
подготовки
и самого
анали3а
исследуемого
материала
прои3водятся
не
в инертной
атмосфре.
|1оэтому
больтп6го
внимания
3аслу}кивают
ре3ультать1'
получаемь|е
при
и3учении
равновесия
методом
3.А.€.,
так
как 3десь
необходимо
3нать
лип]ь
общуто
йонцентрацию
титана
в исследуе-мь1х
расплавах'
-
Б_';ъ;'авленной
эквимоль}1ьй
смеёи
\а€1
-
1(€1
изотермь|
равновес-
нь|х
электроднь]х
потенциалов
имеют
наклоньт'
по
величине
очень
б'1и3-
;;'; з*'{е"й"'
2,3Рт12Р
г]ри
соответству]ощих
температурах.
это сви_
детельствует'
что
в
расплаве
},[а€1
-
кс1
подавляющая
доля
ионов
титана'
находя1цихся
в
равновесии
с
йё12.г|./1Фм;
приходится
на
1{2+.
.[|ля
температурной
3ависимости--условной
константьт
равновесия
получено
эмпирическое
урав}!ение
[187]
',3
181{*::9-!1"1!'
::в
^
4\[т!]:-
5,03в++.
'
[1:з+1а
'.
(1
-.{.1'+)2'
',
т
в та6л.
|2
приведень|
ее
3начения'
а
такх(е
доли
двухвалентного
титанаиегосредцяявалент}1остьдляука3аннь!хтемпературимольно.
долевь1х
концентраций.
^"-'1Б;
иБн]в
ф1э+
умень1пается
при
повь|1пении
температурь|
и
общей
концентрации
титана
в
расплаве.
в исследованнь1х
условиях
она
меняет-
;;;!'6;__|з/й,
'''
согласуется
с
даннь1ми
других
авторов
[299,
300'
5|+],
"..!Ёдова"й"х
это
равновесие
прямь1ми
методами.
Р1меется
такх(е
хор6тлее
согласие
с
ре3ультатами
и3мерений
вьтход'
",'
191-у^,]Р1
'']#;
ной
растворении
титана
в
расплавленной
эквимольной
смеси
пас1
_
кс|
[з{ь:]
й"й$'е
.р"'олятся
}
табл.
13
для
0,6
и_5,0
вес.о/о
|т ъ
расплаве.
!."'{"а"
,'о""оё'"
тока
не
превь]1пала
0,|
а|см2,
чтобь1
свести
к
мини_
муму
влияние
ко|-]центрашионйой
поляри3ации.
Б параллельнь]х
опь1тах'
п!оБодимьтх
в тех
х(е
условиях,
но
бе3
электролиза'
определяли
ко-рро-
3и}о'
на которую
вводили
по|травку
при
раснеФ
вь1хода
по
току
и3
убьтли
веса
титано"'.'
','д{
и
дан"йх
химйческого
анали3а
электролита'
€ред-
няя валентность
титана
и3 анодного
вь|хода
по току
рассчитана
по
урав-
нению
Фаралея
п,,:
А|
26,8ц,
где
А
-
атомнь:й
вес
металла'
т|
-
вь}ход
по
току'
,[1ля
сопоставления
в
таблице
даньт
значения
условной
константь1
равновест4я
и вь1численнь|е
и3
них
доли
ионов
1|2+
и средняя
валентность
титана
при
указаннь|х
т€мпеРатурах
и кон1{ентрациях-
3
ра6Ёлавленном
|!с1
[50]
18
|(*
:
-4,234+6351,
|т.
119
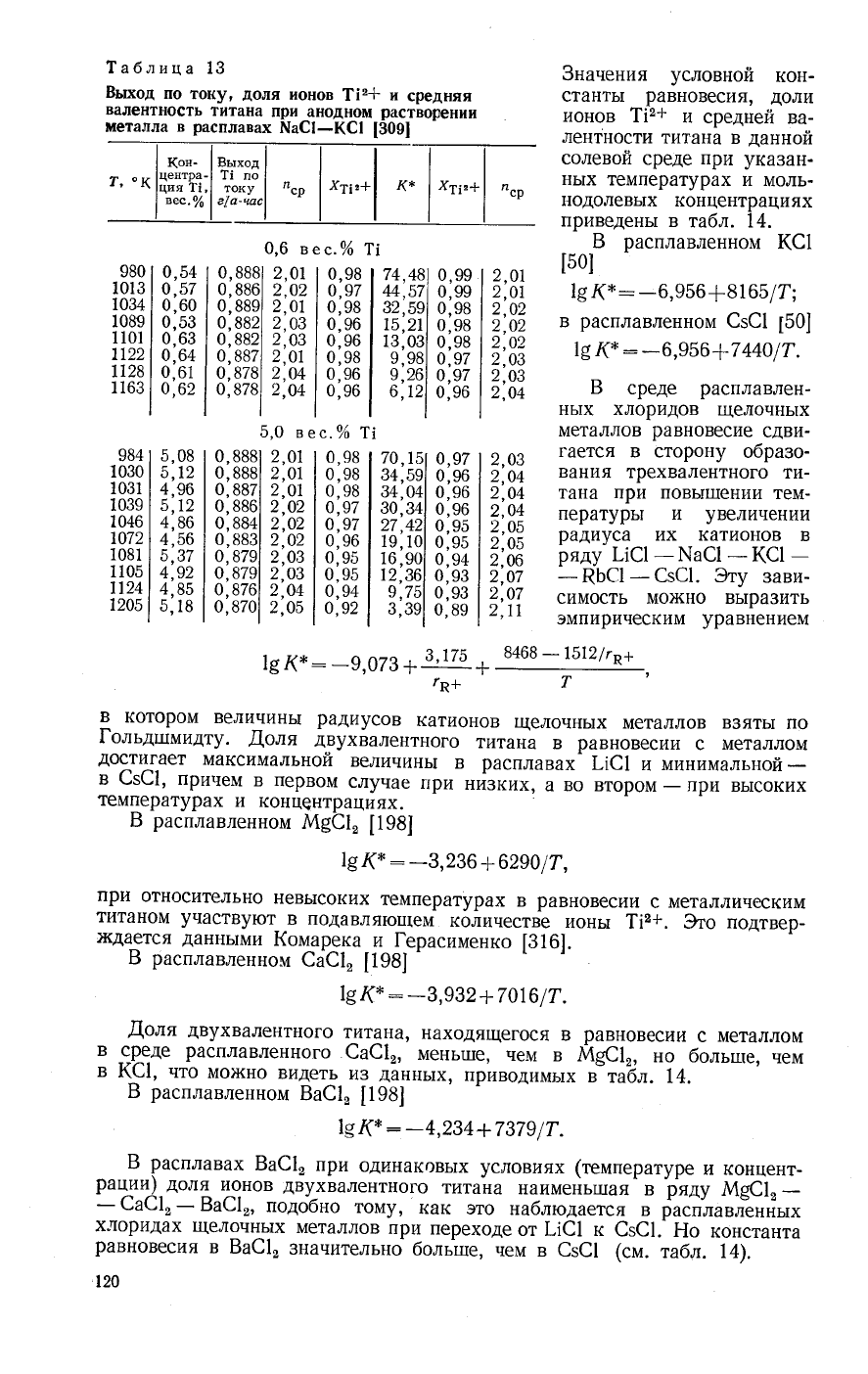
\а6лица
13
Бь:ход
по
току'
доля
ионов
1|2*
и
средняя
валентность
титана
при анодном
растворении
металла
в
распдав:1х
{п{а€|-(€|
|309|
3начения
условной
кон_
станть1
равновесия'
доли
ионов
||2+
и
средней
ва-
лентности
титана в
данной
солевой
среде
при
ука3а[1-
нь1х температурах
и
моль-
нодолевьтх
концентрациях
приведень1
в
табл. 74.
в
расплавленном
кс1
[50]
13.(*:
-6,956{3165/7;
в
расплавлен};ом
€з61
150]
18к*:
_6'956+7440|т.
в
среде
расплавлен-
нь1х хлоридов
щелочнь!х
металлов
равновесие
сдви-
гается
в сторону
образо_
вания
трехвалентного
ти-
тана при повьт1пен,{и
тем_
пературьт
и
увеличении
радиуса
их катионов
в
ряду
!|€1
-
!х1а€1
-
кс1
-
-
&ьс1
-
€з€1. 3ту
зави_
симость мох(но вьтра3ить
эмпирическим
уравнением
8468
-
7512|гр+
0,6
вес.о/о
\|
980
1013
1034
1089
1 101
7122
1
128
1 163
984
1030
1031
1039
1046
1072
1081
1 105
1124
1205
0,54
о,57
0,60
0,53
0,63
0,64
0,61
о
'в2
5,08
5,12
4,96
5,12
4,86
4,56
5,37
4,92
4,
85
5,18
0,888
0,886
0,889
0,882
0,882
0,887
0,878
0,878
0,888
0,
888
0,887
0,886
0,884
0,883
0,879
0,879
0, 876
0,870
2,01
2,02
2,01
2,03
2,о3
2,01
2,о4
2,04
5,0
ве
2,01
2,01
2,01
2,02
2'о2
2,02
2,03
2,03
2,о4
2,05
0,98
о,97
0,98
0,96
0,96
0,98
0,96
0.96
с.о/о
|]
0,98
0,98
0, 98
о,97
о,97
0,96
0,95
0,95
о'94
0,92
2,01
2,о1
2,02
2,02
2,о2
2,03
2,03
2'о4
2,03
2,о4
2,о4
2,04
2,05
2,05
2,06
2,07
2,07
2,11
74,481
0.99
44,57|
о'99
32,591
0,98
15,211
0,98
13,031
0,08
9,9в1
0.97
э,261
0,э7
6,121
0,06
!
7о
'|5|
о
'97
34,591
0,96
34,041
0,96
30,341
0.96
27
'42|
о.95
19,101
0,05
16,901
0.94
12.361
0.93
э;751
о,03
3,301
0,80
181(*:-9,073+
3'175
+
/&*
в
котором
величинь!
радиусов
катионов
щелочнь|х
металлов
в3ятьт
по
|'ольдшмидту.
!,оля
д-вухвалентного
титана
в
равновесии
с
металлом
достигает
максимальной
величиг{ь|
в
расплавах^
!1€1
и
минимальной
_
в €з€1, причем
в первом
случае
г]ри
ни3ких'
а во втором
-
при
вь1соких
температурах
и
концентрациях.
Б
расплавленном
м9с1,
[19в]
18(*-
-3,236+629017,
при
относительно
невь1соких
температурах
в
равновесии
с
металлическим
титаном
участвуют-
в подавляюп1ем
количестве
ионь1
1|2+.
,}то
подтвер-
,(дается
даннь[ми
(омарека
и [ерасименко
[316].
Б
расплавленном
с,с1,
[19в]
^
18
(*:
_3,932
+
70|6|т.
!,оля
двухвалентного
щт4ча,
находящегося
в
равновесии
с металлом
в
-с!еде
расплавленного
'€а€1'' мень1пе,
чем
в й8€1',
но больште,
тем
в
1(€1,
что
мох(но
видет-ь
и3
даннь1х'
приводимь!х
в'табл.
|4.
Б
расплавленном
Ба61,
[196]
1е(*:
-4,234+7379|7.
Б
расплавах
3а€1,
при
одинаковь1х
условиях
(температуре
и концент_
рашии)-доля
ионов
двухвалентного
титана
наимень1пая
в
р"ду
}[€!'_
_
€а€1,
_
3а€1',
подобно
тому,
как
это
наблюдается
в
расплавленнь1х
хлоридах
щелочн-ь1х
металлов
при
переходе
от [1€1 к
€з€1.
Ёо
константа
равновесия
в Ба€1,
значительно
болйе,
чем в €з€1
(см.
табл.
14).
\20
