Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


мы
э.д.с.
реальнь|х
ячеек
с
подобнь|ми
электродам[1'
2Р;|^,
й'ы,
п1';]н|
и'"
ть4+,'
11'а+/1}л
при'
1000"
(
оси
потенциалов
на
величину
сопз1
:
вм"с12
4распл1
-
0,992
|9
|(*
12
в сторону
более
полох(ительнь1х
значений.
Ф|кл6нение
и3отерм
от
прямолинейного
хода
умень1пается
по мере
того'
как
су11{ивается
концентрационнь:й
интер-вал'
в котором
они
опре_
дел"ю'с".
Ёогда
концентрации
меняются
не
более
чем
в
четыре
ра3а'
отре3ки
и3отерм
мох(но
считать_
прямолинейнь1ми
в
пределах
разброса
экёпериментальнь|х
точек
Ё
10_з
с.
3мпиринеские
уравнения
таких
пря_
молинейньтх
отре3ков
и3отерм
е:А_в19[ме]
(2)
н*е
являются
урав*нениями
Ёернста'
так
как
постоянная
А
не
равна
ни
.€ме6|г:
(раепл)'
Ё!{
€ц961-
(распл)'
а
величина
предлогарифмине9кого
коэфи_
циента'
если
его
вь|ра3ить
в виде
Б:2,3Р7
|эл_
1'984
'\0_4т,
отвечает
при соответствующих
""",",'''!,ах
очень
часто
нецелочисленнь1м
:3начениям
валентности
потенциалопределяющих
ионов
в электролите'
причем
п>2>/п,
'
,[|егко
пока3ать'
что величина
?
равна
сред!{ей
валентности
ионов
}1ещ*
и
.&1е'*
в
их
равновесной
с
металлом
смеси
в
том
интервале
йо'п"'1р'ший,
в
каком
и3отерма
принимается
прямолинейной
при
данной
температуре.
[йя'спрямленного
отре3ка
и3о1€рмь|'
опись|ваемого
эмпирическим
линейньтм
уравнением
(2), оневидно'
справедливо
в.'пределах
точности
йзмерений
э.
д.
с.
более'о6щее
уравнение
и3отермьт
(1)'
14скому',',1",'*];
мость
2 от
1т!
и
а
мо)кно
получить'
если
приравнять
прои3воднь!е
ао|а|1у|е]
от
этих
уравнений.
для
!йф4юренцирования
уравнения
(1)
введем
обозначения:
у:+({;+_
1),
$/:|+$,,"
у:+1/т_+
6е
_11е.ау
ау:_д1.
1.к*
.1_:_з|.+.]=,
а|м4_
ау
аш
'
цме7-
тпР
у
4ут
к*
гпР
у
т||у
или
например'
7тц+,
смещень1
вдоль
упР
2
[^{е]
_.х
[ме]
4"
:-
4
[|'4е]
&г
дг
&г
!иффренширование
уравнения
(2)
лает
4"
:
ёе
.41п[1у1е|__
&г.
1
4
[|т{е]
4
1п
[|у1е]
а
[А4е]
аР
[|у1е]
||риравнивая
прои3водньте'
имеем:
дг.
1
пъР
[ме]
(2_ х)
аР
1
'ша'
откуда
э:(2
_
\) гп.
Ёй']-*:|',
то т|:2
тц э:2_8:8+2(1
_х).
Ёсли
по:2,
|Ф 0:4
т4
э:4_2х:2х+4(1
'
х).
-
т'*йй
образом,
из
вёличинь|
предлогарифминеского
коэффициента
в
эмпирических
уравнениях
пРямолинейньтх
отре3ков
и3отерм
мо'(но
оценить
6
м. в.
6мирнов
81

средн}ою
валентность ионов'
находящихся
в
равновесии
с
исследуемь|м
металлическим
электродом
[48,
52-55,
\в7, 194_196,
200,
207-209,
2\\_214],
а и3 нее
_
среднюю
долю
ионов ни3шей
валентности
для
иссле-
дован!{ого
интервала концентраций:
е:
А
_
;д95
.
|0-4т 19
[ме].
(2-
\)
гп
Фневидно, чем
у>ке
концентрационньтй
интервал' тем бли>ке
к истиннь1м
значения .{,,
находимь1е
таким путем.
йз
равенства
л
1,984
1^_4гг|^]]\л^1 _*
1,984'.
(2-
х)
-'10_4т
19
[ме]:
€}"с!-
(распл)
'#''х
[ме]
следует
вь1рах(ение
для
постоянной
.4
в
уравнении
(2):
/:
е?л"сл,',,'",,,
+!
+
10_4т
19
[ме]
-
+
10_ц! |9
*,
которое
для
прямолинейньтх
отре3ков
изотерм в конечнь]х
интервалах_
коншентраший
дает
среднее 3начение
А
для
средней
концентрации
[&1е}
и средней
доли
{ ионов низтпей
валентности.
14стинньте
3наче|1ия
А
и
/
получаются
тогда'
когда линейное
уравнение
опись1вает касательную
к
изотерме
в точке'
соответствующей
данному
значению
концентрации
[ме].
Ёо
полунить
его
в точном виде
и3 экспе-
риментальньтх
даннь!х
очень
трудно и3-3а
малой
кривизньт
изотер_м.
!,ля
6того требуется вь]сокая
точность
измерений,
превосходящая
10_3
в.
Более точно величиньт .{ мо>кно
рассчитать
методом'
которьтй
описан в,
$
2
главьл
!1.
!

|лава
у1
ус^овнь!Ё,
стАндАРтнь!Б,
э^вктРоднь!в
потвнциА^ь[
в
РАсп^Ав^вннь!х
х^оРиднь!х
э^в,ктРо^итАх
Ё
:
Ё0
+
\
|,
7
^''
'+
{
:'
[.|!1е'+]'
(1)
гАе
|*.'-р
-
коэффишт1ент
активности
ионов
,&1е'+
в
расплаве
данного
со_
ста"а.
}(огда
)кидкие
солевь1е
смеси
блпзки
по
своему
поведению
$
1.8ьпбор
стандартного
состояния
.для
вь!ра'(ения
конце[{трацшонной
зависимости
равновеснь|х
э^ектРоднь[х
потенциа^ов
Расплавленнь1е
галогенидь| щелочньтх
и
щелочно3емельньтх
металлов'
а
так)ке
растворьт
в
них
галогенидов других
металлов___:_р'дт:'::::ч:
собой
ионйьте
>кидкости
с
дальнодействующим
кулоновским
в3аимодеи_
ствием
части1('
в которь1х
отсутствуют
границьт
"'ет+у__
не-йщальнь|ми
группировками
типа
отдельнь:х
молекул'
_нз1Р#"9Р:'.'ш191'
(€1
и
т'
д'
Фдин
и
тот
)ке
расплав,
например,
сфр>кащйа
иоч1)31:^-1]'91:'.'ч
Бг],
мо)кно
по!унить
сплавлением
двух
ра3нь|х
смесей
твердь1х
солеи:
й'ё:
й 1(3г
или"\аБг
и
(€1.
||оэтому
в
случае
расплавлег'ньтх
солевь1х
сй"еа шелесообра3но
оперировать
с активностями
не
индивидуальнь1х
солей,
а
ионов,
которь1е
находятся
в
таких
расплавах'
в*оор
стандартного
состояния
^ля
вь1ра)кения
концентрациондой
за_
висимости
активцостей
ионов
и
свя3аннь[х
с
ними
уравнением
Ёер-н-ста
равновеснь1х
электроднь1х
потенциалов
совертпенно
прои3волен
[151]'
Ёо
""е*
хлориднь]х
расплавах
мольнодолевая
концентрация
ионов
хлора
Б'"й'-.,'*''|де.
в.''
поло}кить
условно
их
активность
равной
такх(е
ёйй"йц"',ри
любой
температуре
независимо
от
состава
катионов
в
рас_
плавах'
то
мьт
получаем
йкалу
для_
численного
вьтра)кения
активностей
отдельнь1х
ионов
Ё
этих
сре'ах.
14х мо>кно
рассчитать
и3
и3меряемьтх
поотно1шениюкхлорномуэлектродусравненияпотенциаловэлектродов'
которь1е
обратимьт
к
этим
ионам:
Ё:Ёо+ч1пс*",4.
'пР
3десь
80
_
стандартньте
электроднь1е
потенциаль|'
равнь1е
взятьтм
с об-
ратнь1м
3наком
э.
д.
с.
ячеек'
составленнь|х
из хлорного
и исследуемь|х
металлических,
кар6идньтх'
нитриднь|х'
охс-иднь|х
или оксидно-угольных
электродов
в
чистом
}кидком
хлориде.'
&1е61',
в
котором
активность
ка_
тионов
$е"+
условно
считается
равнои
единице.
||ереходя
от
активностей
к
мольнодолевь1м
концентрациям
катионов'
[?!1е'+1'
получаем
вь1рах(ение
для
концентрацио}1ной
зависимости
элек-
тродньтх
потенциалов'
и3мереннь1х
по отношению
к хлорному
электроду
сравнения
при
Р61,:\
агпм:
6*
83

к идеальнь]м
растворам'
например
расплавьт
А9€1_|т|а61-кс1
[115,
116],'
коэфициенть1
активности катионов
равнь1
единице
и
Ё: Б\9т1я9+91,[Ав*].
г
Рсли >ке
катионь|
значительно
ра3личаются
своими
ионнь!ми.
момен_
тами'
ра3мерами
и.3арядами'
то
расплавленньте
солевьте смеси
ведут-
себя не идеально.
(атионьт
с наибольшими
ионнь|ми
момецтами'
а
и3
них
с
наибольгшими
размерами
стягивают вокруг себя
легко
поляризуемые.
анионьт
хлора
и
образуют комплекснь|е
ионь1. €вязь
частиц' которые
входят
в их
состав'..
упрочняется
за
счет
нало}кения
на ион-ионное
ку-
лоновское
взаимодействие
ион-дипольного
[215].
9астичное
перекрь|тие'
электроннь1х
оболочек
мох(ет приводить
так)ке
к появлению
ковалентной,
связи.
(оэфишиенть1
активности таких
катионов
вследствие
этого
ста_
новятся
3начительно
мень1пе единиць|.
(атионьг
с
меньшими
ионнь1ми
моментами (к
ним, в
первую
очередь' относятся
катионь1
щелочнь1х
ме-
таллов)
при
комплексообразовании
вь1тесняются
во
вторь1е коорди}{аци_
оннь1е сфрьт,
где их свя3ь
с
анионами ослаблена
по сравнению
с
чис_-
тьтми
солями'
и
их
коэффициентьт
активности
больт'пе
единиць1.
(оффишиенть!
активности катионов являются
слох{нь:ми
функциями
состава
солевь|х
смесей. Фни меняются
как с
концентрацией,
так
и с-
компо3ицией
расплавов.
1еория строения
реальнь!х
ионнь|х
х<идкостей
в настоящее
время
разработана
еще
далеко
не
достаточно
для
того,
'ттобы,
мох(но бь:ло
унесть
вс}о
специфику
многообразия
мех(частичньтх
взаимо_
действий
в солевь1х
расплавах
и получить наде)кнь1е
теоретические
фор-
муль1
для
расчета
коффициентов
активност1! их
компонентов.
|1оэтому'
они
определяются
экспериментально
ра3личнь1ми
методами'
и3 которь]х
чаще
всего исполь3уется
метод э.
д.
с.
(оэффипиент
активности
вь]чис_
ляется и3
равновесного
потенциала Ё
металлического
электрода'
и3ме_'
щнной
по
отно!пению к хлорному электроду
сравнения'
по
уравнению
1п|*',4
:#с,
_
€!,",*/*")
_
:,
[}1е,*],
в
которое
входит стандартнь!й потенциа д
Ё0'.,'1у".
Ёепосредственнь1м
и3мерениям
в ячейках типа
}1е
!
.д}1е€1,
<*>
]!
€1,
(г),
с'
достпнь]
стандартнь1е потенциаль!'
ли1шь тех
металлов' в
равновесии
с
которь1ми
могут находиться
в преобладающем количестве их
жидкие.
хлоридьт
каких-либо
одних
валентностей.
1огда
долей
их хлоридов
других
валентностей
мох<но без
большой
отлибт<и пренебрень' как
это
делается'
напрпмер,
в
системах
РБ/Р5€121*1, А9/А9€11*1, 7п| 7п(|2
61.
Бсли
х<е-
концентрац}|и хлоридов вь:сп:ей
и низшей
валентности сои3меримь{
друг
с
другом'
то
для
расчета
стандартнь|х
потег{циалоъ,
Ё0^.'1,ц- и Ё'!д".+7ц",
по
и3меряемой величине
равновесного
эле1(тродного потенциала'
равного.
Ё: в\".+/м"+чА
|*..1+\1п
[}1е-+]:Ё|т",+:м"*81
[п
|*",1+
+ч
1,
[}1е"+],
'пР.
необходимо
3нать
не
только
мольнодолевь|е
концентрации ионов' но так)!(е'
их
коэффициенть1
активности
в
солевом
расплаве.
3 качестве примера мо}кно
привести
ячейки
с
электродами и3 метал-
лического лантана
или
церия
(/!1е:[а,
€е):
.1!1е
1(1
-
ш).1!1е€1'*/{.]!1ё€12
1рд6ц,1
||
.]!1е€1з
с*:
!
€1э
(г),
€.
}становлено' что металли11еский
лантан частично восстанавливает свой
трихлорид
до
дихлорида.
|!ри 860
'1060"
равновес}1ая
с
металлом
рас-
84

плавленная
солевая
смесь
содер}кит
около
86 мол.
%
[-а€1,
и
|4 мо.л.%^о,
[а(|'.
|1о своему
поведению
она
близка
к
идеальному
раствору
[2|о|-
Анал]огичньтм
образом
ведет
себ_я^цериевь:й
электрод
в
расплаве
его
три-
хлорида.
Б инте}вале
370-970'€
в
равновесной
с металлом
расплавлен_
ной'смеси
хлоридов
содер}кится
около
89 мол.%
€е€1,
и
11 мол.%о
с,ес|2
|2|7].
||о,!ти
идеально
велут
себя_та|оке^расплавленнь1е
смеси
три_
хлори!а
шерия
с
дихлоридом
кальция
[218].
3ная
состав
и активность
смеёей
ди-
й
трихлорида
лантана
и
церия
в электролитах
ука3аннь1х
ячеек'
мох(нопоизмеряемь|мвеличинамихэ.д.с.рассчитатьстандарт!|ые
электроднь1е
потенциаль1
по отно1]]ению
к
хлорному
электРоду
сравнения:
Ё|.'+1у'
:
_3,47
+ц3.
10-4г
в
и
Ё!,'"+1у'
:
-3,49*9,9.
10_4т
с
[219];
Ё|""+1с.-_3,55
+7,7.10_4г
в и Ё|,""+.16"
:-3,64+8,5.10_4
!
в
|220|
1аким
путем
удается
и3мерить
ли1шь относительно
неболь1цое
число
ста!{дартнь1х
электродньтх
потенциалов.
3о многих
случаях'
особенно
;ь;
^аь';йй
лет$нести
хлоридов
вь|сшей
валентностй
1вес1',
7т(|,,
нтс14,
1[€1'
и т.
;.), оче!{ь
трудно
наде)кно
определить
не
только
актив*
ности'
но
дах(е
концентрации
хлоридов
вь1с1ших
и
ни31ших
валентностей
в их
равновеснь1х
с
металлами-
расплавленнь1х
смесях'
3т6
затруднение
мо)кно
обойти
в- случае
электроднь1х
потенциалов
металлов
по отношению
к
их
ионам
обьтнйьтх,
устойнивь:х
валентностей'
если
и3вестны
и3менения
стандартной
энергии
[иббса
для
реакций
обра_
3ования
их
в х(идком
состоян|1и
из элементов:
!н1ле+1
|
2п(12 6:
^0
\6о
0эю|моль
!ме4+/ме
96 496п
1акие
расчеть1
бьтли
сделань1
в
1956
г.
{амером,
.&1альбергом
и Рубинь!м
|22||
н-а
основании
известнь1х
в
то
время
термодинамических даннь1х'
не;
ё:бход"м"'х для
вь1числения
стандартнь|х
и3менений
энергии
|иббса
при
оеакциях
образования
твердь1х
и
>1<идк|4х
хлоридов
в
3ависимости
от
;;;;;;ур,|'д'"
хлоридоъ
больгпинства
металлов
они
очень
|1р''!бл|4'
)кеннь]е'
так
как
кроме
стандартнь1х
энтальпий
образован|4я
п
энтропий
необходимо
точно
3г1ать
энтальл\4и
и
температурьт
плавления
солей и
и3_
менение
их
теплоемкостей
в
1пироких
температурных
интервалах
в-плоть
;;'
;;;;';;ия.
Фгпибки
в
экспер;ментальной
определении
ил|4
какой-либо'
!олуэмп'рической
оценке
этих
величин
в
сумме
могут
пРивести
к 3на-
чительньтм
отклонениям
рассчитаннь1х
величин
от
истинных
3начений
стандартнь1х
потенциалов.
|]оэтому
их
мох(но
исполь3овать
только
для
гоубь:х'
качественнь1х
оценок
значений
коэффициентов
активности'
'"йр!,й"й'"
1:1
неудобно
для
расчетов
концентрацио!!ной
3ависимости
электъоднь{х
потенциалов'
потому
что
кроме
стандартнь1х
потенциалов
необходимо
3нать
коэффит{иенть:
активности
потенциалопределяют|\их
ионов
в
электролите.
нь
его
мо}кно
преобр"3овать
в
случае
разбав-
ленньтх
солевь;х
растворов
и таким
обра3ом
обойти
это 3атруднение.
[лориднь1е
раъплавь1
исполь3утотся для
получения'-
рфиниро2ануя
и оа3деления
таких
металлов,
как
титан' ширконий,
гафний,
торий,
Ф_
;";";};"-;
;.
,.
Ё'.,''вленнь|е
хлоридь1
этих
металлов
обь1чнь!х
валент_
ностей
очень
летучи'
поэтому
насто
работа1от
с
их
достатонно
разбав_
леннь1ми
растворами
в
расплавах
хлоридов
щелочнъ1\-"'"
щелочнозе-
мельнь|х
металлов'
вь!деляю111,ихся
на
катоде
при
более
электроотрица-
тельнь}х
поте}|циалах.
Растворение
хлоридов
с
п!ного3аряднь1ми
катионами
в
расплавленнь]х
хлоридах
щелочньтх
А'{еталлов
сопРово]кдается
образованием
комплекснь1х
гру|]пирово.
р,.''й,,*
конфифраший,
нацримеР
тетраэдрической'
йЁс:!,
|_":_,
октаэдринеской,
}1е€1[6
_">_
\222_223].
Анионь:
хлора
стя_
86
!!1е€11*1!
Б6о
кал|моль
23062п
#
|
.А
-+-2-
'/
,/
э
^,/
'-_у
-?
=
Ф
ё-4
гиваются
вокруг
много3аряднь|х
ка-
тионов
под
во3действием
их
более
сильного
электрического
поля.
Б
ре-
3ультате
деформации
электронных
о0олочек
на
анионах
индуцируются
д|4пол|4'
что
усиливает
их
связь
с
катионами
3а
счет
нало}кения
на
ион-ионное
ион-дипольного
в3аимо-
действия.
|1ри
знани18,,1БЁБ::<
дефор-
мациях электроннь1е
оболочки
в3аимо-
деиствующих
ионов
в
комплексах
перекрь]ваются
и
связь
становится
частично
ковалентной.
Фдновалентньте
катионь|
щелочнь1х
металлов
рас_
полагаются
во
вторь]х
координацион-
нь1х
сферах (где
теряется
даль\1ий
порядок
во
в3аимном
располох{ении
ионов)
ме}кду
|{омг{лекснь]м'1
анио11а-
ми' с
которь|ми
они в3аимодействуют
э'пектростатически.
[1ерестройка
свя3ей
}1е,+_€1_,
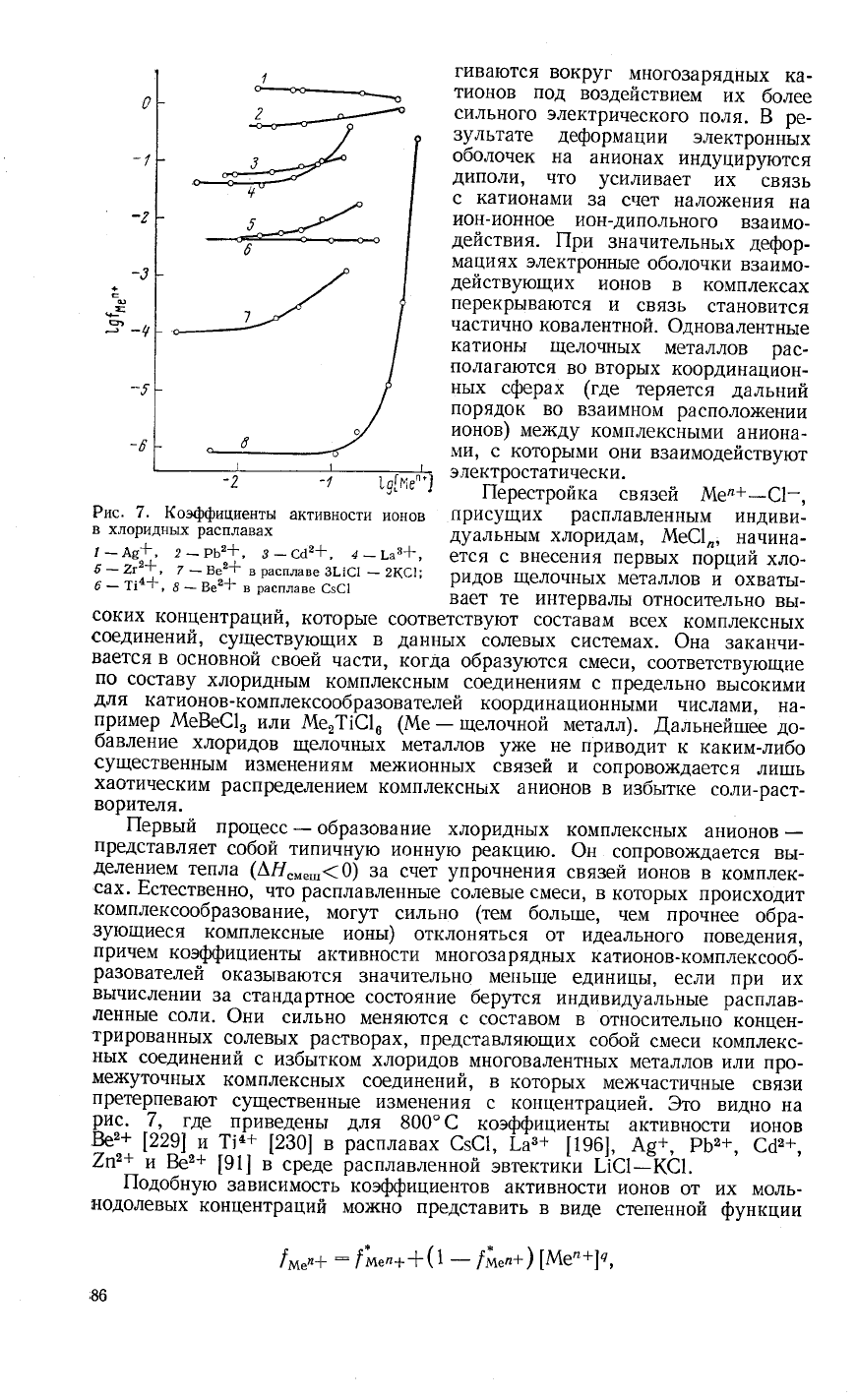
Рпс. 7.
(оффишиенты
активности
ионов
лрисущих
расплавленнь|м
индиви-
в
хлориднь|х
расплавах
дуальнь{м
хлоридам'
А{е€1',
начина-
''
-2*'',
_#'
";;",.:"-1,.'.1
:',^^*
;
;;ъ;
;ж}:,}
;т*;;
6!%}#}.
о
_
тз|*
'
в
-
8е2*
в
расплаве
€з€1
5]"'
," интерваль]
относительно
вьт-
соких
конт.т,ентраций,
которьте
соответствуют
составам
всех
комплекснь1х
соединений,
су|ществующих
в
даннь1х
солевь1х
системах.
Фна
заканчи-
вается
в
основной
своей
части'
когда
образутотся
смеси'
соответствующие
по
составу
хлориднь|м
комплекснь|м
соединениям
с предельно
вь]сокими
для
катионов-комплексообр-азовате,тей
координационнь1ми
числами'
на_
:Рзу.р
йеБе€1,
или ,&1е'1|(1'
(}1е
-
щелочной
металл).
Аальнейтпее
до-
оавление
хлоридов
щелочнь1х
металлов
ух(е
не приводит
к каким-либо
существеннь1м
и3менениям
мех{ионньтх
связей
и
сог{рово)кдается
ли1пь
хаотическим
распределением
комплекснь!х
анионов
в избьттке
соли-раст-
ворителя.
|1ервь:й
процесс
_
образование
хлоридньтх
комплекс!{ь|х
анионов
_
представляет
собой
типичную
ионную
реакцию.
Фн
сопрово>кдается
вьг
делением
тепла
(^н"""-<0)
за
снет
упрочнения
связей йонов
в
комплек_
сах'
естественно'
что
расплавленнь1е
солевь]е
смеси'
в
которь!х
происходит
комплексообразование'
могут
сильно
(тем
больтше,
нем^ пронйее
обра_
'3ующиеся
комплекснь1е
ионьт)
отклоняться
от идеального
поведения'
причем
коэфициентьт
активности
много3аряднь1х
катионов-комплексооб_
разователей
ока3ь]ваются
3начительно
мепь1пе
единиць1'
если
при
их
вьтчислении
3а стандартное
состояние
берутся
|1ндиву\дуальнь1е
расплав-
леннь|е
соли.
Фни
сильно
меняются
с составом
в
относительно
концен_
трирова}{нь1х
солевь|х
растворах'
представляющих
собой
смеси
комплекс-
нь1х
соединений
с
избьттком
хлоридов..многовалентньтх
металлов
или
про-
ме}куточнь|х
комплекснь]х
соединений,
в
которь!х
ме}кчастичньте
связи
претер-певают
существеннь1е
изменения
с концентрацией.
3то
видно
на
Ри9:
-{'^^-.де
приведень1
для
в00'с
коэффициентьт
активности
ионов
ве'?+
[22Р]_у
!^'::
[230]
в
расплавах
€з€1,
[Аз+
[196],
А8+,
Рь2+, с62+,
/п2+
и 3"э+
[91]
в
среде
расплавленной
эвтектит!и г]ст--к€:.
11одобную
3ависимость
коэффициентов
активности
ионов
от их 1\,1оль_
}1одолевь!х
концентраций
мох<но
представить
в
виде
степенной
функции
;86
|
*"'+
:|}.",*
+
(
1
-
|й",* )
[&1е'+]с,

где
|]1*и+
|4
ч
-
постояннь1е
величинь|'
3ависящие
от
природьт
ионов'
и солЁБой
средь(,
а
так)ке
от
температурьт'
3
разбавленнь1х
растворах'
когда
[ме2|1-*0,'
|м"'+*|]д",+.
6ледовательно,
|}",;
является
предель-
нь1м
минимальнь1м
3наче!1ием
коэффишиента
активности'
к которому
он
стремится
при
ра3бавлении.
'
}равненйе
равновесного
электродного
потенциала
Ё-
Ё0^.,+,^.+\тла*"'1:Ё0^.,+ум"**1п
{
;}"'1
+(1
-|}"+)
[&1е"+]с}
+
+ч
1п
[&1е"+1
п!
для
разбавленнь1х
растворов,
где
мольнодолевь1е
концентрации
[}4е'+](1'
пр1-1нимают
вид
Ё
:
Ё0м.,+
|м.+
ч1п
||"';
+
\
тл[йе'+1'
[(огда
потенциаль1
и3меряются
с
точность1о
до
+1
$8'
изменения
коэф-
фициентов
активности
потенциалопределяющих
ионов
менее
чем
в
+А|
раз
становятся
неощутимь1ми
на опьтте.
7ньтми
словами,
коэфи-
циенть|активностивоспринимаютсянамикакпостояннь!евеличинь|впре.
делах
точност1-1
,.*ере"йй
э.
д.
с.
3ти
значеншя
\|
при
ука3аннь1х
тем-
пепятуоах и вале,тностях
ионов
приведеньт
в
та6л'
4'
__-г__,
г__
(ак
пока3ь]вают
многочисленнь!е
и3менения
э'
д'
с'
гальванических
элементов'
электро'цить1
которь|х
представляют
-собой
разбавленнь!е
раст-
ворь|
хлоридов
многовалентнь1х
металлов
(3е€1-:'
|_'9р'
_€*1''
т1с12'
1"1ё[,
|'ё\^'2'ст;;'ЁЁй;н|ё1.,
тпё:',
тьс1;,
шс]3,
'мос|,,
Ре€1,
и
т.
п.)
врасплаваххлоридовщелочнь1хметаллов,коэфи{иентьтактивности
ионов
йе,+
имею''Б?"й.;;;
]"
пределах
точности
измерений
+|
мв}
г{остояннь,е
"е'",'*"!
(меняюшиеёя
менее
чем
в
*А|
раз)
при мольно_
долевь|х
*о"'{""'р'ш""*
ниже
(3_5)'10_а'
3то
о3нанает'
что
величина
(
т
-
,*"'+) 1ме'+],<(|'"'+.
]аким
образом'
уравнение
равновесного
электродного
потенциала
еш1е
более
упрощается:
Ё:
Ё]ц,+щ"+ч
1п
[&1е'+|'
где
8'}"'+7м"
:
Ё!1",+7ц"
+
{
м
[1'.'
*'
Белииину
Ё\.п+1м.мо}кно
рассматривать
как
стандартнь1й
электрод_
ньтй
потенциал
металла
по отно1пению
к
его
ионам'
}1е,*'
в
данной
со-
левой
среде.
Бсли
Ё}"'+7м"
-
величина'
не
3авися1цая
от
соли-раствори-
1аблиу\а
4
}!зменение
коэффишиентов
актив-
ности'
приводящее
к
и3менению
потенциалана+\;шв
теля
и
характери3ующая
только
рас-
плавленньтй
хлорид
йе€1',
то
Ёц"л+7де,
наоборот,
имеет
ра3/1ичнь1е
3начения
для
хлоридньтх
расплавов
с
ра3ньтм
составом
катйонов.
Фна
унитьтвает
не
только
при_
роду
электр'д,'й
реакции
йе*&1е[$"",.
1
*
'+''_,
но
и характер
взаимодействия
ка-
тионов
.&1еп+
с солевой
средой,
опреде'/1я-
ющий
предельную
величину
их
коэфи_
циента
активности,
|{ц"'+,
в
разбавлен_
нь|х
растворах.
воо ! :.о:ь!
т'о:э!
:,оць|
:,шо
900 !
1.о:з!:'о:о|
т'039|
1'05-
1000 |
1.о::!
т
'о24!
1'036|
1'049
1100 | 1.о:: !
:
'0221
1'032|
1'04ч
1200
|
1,о:о|
т;010|
1,029|
1'033
воо ! 1.0151
1.0291
1,0451
1,060
ооо ! т.отз! т.026!
1.0391
1.05^
9
87

€тандартньтй
электроднь:й
потенциал'
Ё}",1,/ме'
в
данной
солевой
среде
,формально
равен
потенциалу
электрода
при
мольнодолевой
ко!]центра-
,1,"й
"о"о"
[ме,+]:1.
Фднайо
это
_
математическая
фикция,
поскольку
такое
состояние
невозмох(но
осуществить
на опь1те'
так
как
тогда
мь'
перешли
бь: от
сме1панного^-хло!идного
расплава
к
индивидуальному
раёплавленному
хлорилу
&1е€1'.
||оэтому,
следуя
определению
некоторь1х
}""'р',
[231-233],
Ё]''+,м'.
мо}кно
на3вать
ка}ку1||имся
|1л|1'
луч!.пе'
условным
стандартным
электродньтм
потенциалом.
1акое
определение
не о3начает'
что это
_
некая
_фиктивная
величина.
Б
действительности
она
является
постоянной
в
уравнении
Ёернста,
когда
оно
применяется
к
ра3бавлен|{ым
растворам'
где
коэффициенть{
активности
потенциал-
определяющих
ионов
|]ц''+
:
сопз1.
14
в слунае
(истиннь|х)
стандартнь1х
элек-
троднь1х
потенциалов,
Ё!1",+7м"'
далеко
не
всегда
мо}кно
реали3овать
на
опь|те
ячейки,
в
которь|х
металлические
электродь1-
находились
бь:
в их
чисть|х
хлоридах
дан;ой
валентности
и
приним али
6ьт
потенциальт'_
РР1}е
по
величине
стандартнь!м.
примером
мьгут
слух(ить
системь|
т!/т1с14,
ш/шс|4,
шь/шьс16'
7т|7т(|^
и
др'
:нь1е
по отно11]е-
Фчевидно,
условнь|е
стандартнь|е
потенциальт'
и3мерен
ниюкхлорномуэлектродусравнения'равнь1напрях(ениямра3ло}кения
хлоридов
йе€1,
в их
разбавленнь|х
растворах
в
расплавах
хлоридов
дру;их
металлов'
в3ятьтм
с
обратнь|м
3наком:
.*
Ё
м.'|
1м.:
-0]у1е61л
(распл)
.
$
2.
14вмеренше
ус^овшь[х
стандартнь[х
алектродвь[х
потенцпа^ов
}словньте
стандартньте
электродные
потенциаль|
металлов
по отноше_
нию
к
ра3бавленнь1м
растворам
их
ионов
в-
расплавах
хлоридов
1целоч-
ных
и
щелочно3емельньтх
металлов
могут
бь!ть
легко
определень1
непо_
средственно.
€ этой
целью
ну)к!{о
при
3аданной
температуре
и3мерить
равновеснь:е
потенциалы
исследуемого
электрода
по
отно1пению
к
хлор_
ному
электроду
сравнения
для
нескольких
концентраций
его ионов
в
элейтролите.
всли они
преобладают
в
равновесии
с
металлом,
то
их кон-
центрацию
мо)кно
считать
р4РцоЁ
аналитически
определяемому
содер}ка_
нию
металла
в электролите'
[&1е].
3кспериментальнь1е
3т{ачения
д,
отло_
х(еннь]е
по отно1пению
к
мольнодолевой
концентрации'
дают
прямые'
отвечающие
уравнениям
_'
'
',!1'10_.г
19
[ме].
Ё:
Ёу.п*рм
&личина
условного
стандартного
потецциа.па
вычисляется
и3
равенств:
Ё'11"'+
1
'ц:
Б'
-
#'
1 0_4г
1в
[ме]'
:
&
_#
1 0-4т
19
[:!1е]'
:
где
л1'
Ё', ...
_
равновеснь|е
потенциаль1
металла
в
расплавах
с
кон_
шентрЁшией
его
ио;ов
[]!1е].,
[.|!1е]',
. ..
Б
разбавленнь|х
растворах
с
моль_
нодолевой
концентрацией
[&1е]ч{(2_3).
10_2,
где
|ц"'+
:сопз[,
и3отермь1
электроднь1*
'''",ц"алов
прямолинейнь|
и
отвечают
в пределах
ошибок
измерън;й
целочисленнь1м
3начен'{ям
валентности
ионов'
преобладающих
в
равновесии
с
металлом.
'Б
качестве
примера
мо}кно
привести-изотермьт
потенциалов
уранового
электрода
при
1о00,_1100
и
1200'к.^.3кспериментальнь1е
точки
во всем
исследованном
интервале
конце}{траций
урана
в эквимольной
расплавлен_
.88

ной
смеси
хлоридов
натрия
и
калия
(от 0,098
до
т,|
мол.%)
хоро1по
укладьг
вались
на
прямь|х'
отвеча-
ющих
эмпирическим
уравне_
ниям
[2!
1]:
т'
"к
1000
1100
1200
3десь
,].",+
_
предельная
-с,6
2,в5
3,05
с'в
-2.345+0,066
|в
[0]
_2,279+о,о73
1€
[ш|
_2,212+о'079
|9
[|-]]
|1редлогарифминеские
коэф-
фишиентьл
близки
по
_в€'/[|'1-
_я'
чине
к
значениям
2'38т
,
'4}
пР
уравнении
Ёернста
при
со-
ответствующих
температурах
2,0
т,л
п:3.
3то
явилось
экспе-
риментальнь[м
доказательст_
вом
того'
что
при
равнове-
2,4
с!4|4
с
металлом
в
хлорид-
ных
расплавах
подавляющая
часть
урана
находится
в
трехвалетттном
состоянии.
||о_
добньте
наклоньт
имели
и3о_
Рис.
8.
йзотермы
равновесных
потенциалов
те
р
мь1
п
оте
нци
а ло"
.
^у^Р?'1'"]";
Ё1ё11&Ё;
!,)
тт#,##'
;:]*#;ъ:ё1
]ъ]
го
электрода,.
и3мереннь1х
в
;;;'
"?,
'_900,
2_850,
3_800,
4_750'
5-
расплавленной
эквимольной
7бц|[:э^о-з-;
смеси
хлоридов
".щ''""['*'_:
!ц;;;:;
1а]\'&ъ{
_
1100'
3
_
|000'
4
_
900'
лАя
[234]'
в
расплавленной
эвтектике
хлоридов
лития
|4
кал|1я
по
отно1цен].{ю
к_серебряному
элект_
й;;'Б;;ййй
!:зь-:зэ1
и
в
расплаве
&19^€-1,_1х{ас1_кс1
по
отно-
шени1о
к
платиновому
элейтроду
сравнения
[240]'
|1ри коншентрашийх
потенциалопределяющих
ионов
вь1111е
10
мол.
%о
и3отермь1электродныхпотенциаловмноговалентнь|хметалловотклоняются
от
линейного
хода
;_;;фь;'
б'",""
полох{ительнь1х
потенциалов
(рис'
8)'
(огда
неи3вестна
величина
стандартно!'о
электрод[{ого
потенциала'
д'&*;
в
уравнение
для
электродного
потенциала'
в
которое
входит
условньтй
стандартнь1й
электроднь:й
потенциал,
Ё},,'.'+676.,
нух(но
ввести
относительньтй
коффициент
активности,
[*''*'
потенциалопределяющих
ионов:
Ё
:
Ё},''+
1м.+
ч:п
|*"'+*$
1п
[!!1е'+|'
чтобьт
исполь3овать
его
для
расчетов
в
случае
более
концентрированных
солевь1х
расплавов.
Фтносйтельнь:й
коэффипиент
активности
ионов
в
данной
солевой
среде
связан
с
их
кбэфйциентом
активности,
[ц"п{
(когда
3а
стандартное
состояние
Фрется
расплавленная
индивидуальная
соль,
1т1е€1,),
соотногшением
с'
|*"л+
/м"'*
:
-
-'/м",+
минимальная
величина
коффициента
актив-
ности
ионов
в
их
разбавленнь|х
растворах
в
данном
ски
(в
пределах
точности
и3мерений
э'
д'
с'
+
1
расплаве'
практиче-
лс)
постоянная
при
89,

концентрациях ни)ке 2_3
мол. %о и
характеризующая
взаимодействие
потенциалопределяющих ионов с солевой
средой. 9ем проннее хлориднь]е
комплексьт' которь1е они образуют' тем
мень1ше величина
|й'"'+.
Б подоб_
нь{х
хлориднь]х
расг{лавах |*""+-{/*",*-{1,
т.
е. относительнь1е
коэффи-
циенть1
активности
[^"'+>-|.
|1ри
идеальном
смешении
расплавленньтх
хлоридов
ра3нь1х
металлов'
как
например
в
случае
смесей
А9€1_
_\а€1-(€1
[115,
1[6],
|ц"л1:|й",*
:|^.,+:7
и
Ё*",*7ме:Ё{ц",*/м".
(огда
хлориднь]е
расг{лавь1'
находящиеся
в
равновесии
с металличе-
,ским
электродом'
содер}кат
в
сои3меримь1х концентрациях
ионь1
металла
ра3ньтх
валентностей, наклон и3отерм
равновеснь|х
потенциалов'
построен-
ных по
отно1пению к их суммарной,
аналитически
определяемой
концен-
трации'
у)ке
не
отвечает
целочисленнь]м
3начениям
валентностей
гп
или
п.
(ак
бь:ло
установлено'
и3отермь]
равновеснь|х
потенциалов
цир-
.кония
в
расплавленной
эквимольной
смеси \а€1-(€1
имеют
небольтпой
изгиб в
сторону
менее
отрицательнь|х потенциалов.
Ёаклон
касательнь|х
к и3отермам
соответствует 3начениям предлогарифминеского
коэффици-
ента
в эмпирических
уравненутях
Ё:"'ц511}35г
А
[7т|,
где
2
-средняя
валентность
ионов
циркония'
7г2+
и
7тц+'
Б
их
равновесной
с
металлом
смеси'
равная
э:28.+4(1
-
х):4
-
2х (х
-
доля
ионов 7т'+)
[207].
|!одоб-ньте экспериментальнь|е и3отермь{
не
представля{от
собой
уравне-
ния Ёернста.
Рсли
отлох{ить
измеряемь|е
потенциаль1
п.э отно1пенито
к
логарифму концентрации
ионов
]у\е'+
или
.&'[е
.+,
а
не
их
суммарной
концентрации'
только
тогда
получаются
и3отермь]'
соответствующие
уравнениям
}{ернста:
Ё
:
Ё}"*у,
^"
*
#1
п
[А4еа,+;
:
Ё!*.'*
т
м"
+
ч
п[А4е,+
1.
Раздельное
количественное
определение
концентраций
ионов
разнь1х
валентностей
одного и
того х(е
элемента'
присутствующих
совместно
в
хлориднь|х
расплавах
при вь1соких
температур3{,
-
довольно
слох(ная
в экспериментальном
отношении 3адача
[241'
242]. |!оэтому
обьтнно
при-
бегают к анали3у
охла}(деннь1х
до
комнатной
температурь1
солевь1х пла-
вов. Фднако
да'(е
3акалка
(бьтстрое
охлах(дение)
не
йо>*<ет полностьто
исключить
сдвиг
равновесия
реакции:
.&1е['*"",.:
+=
!у\е=!йе|?*.,.:
во время
охлах{дения
и 3асть1вания
расплавов.
н#*''д"'''''с"
такх(е
оп:ибки
за счет вторичнь1х
реакший
ок|.|сления
ионов
ни31]]их
валент-
ностей
при аналитических
операциях' производимь1х
в водньтх
растворах.
(
определению
условнь|х
стандартнь1х электродньтх
потенциалов
ме-
таллов по
отнот1]ению к их ионам вьтсгшей
и низшей
валентности
в
ра3-
бавленньлх
солевь1х
растворах
мо}кнс)
подойти
чисто
электрохимическим
путем'
не требуюш1им
ра3дельного
определения концентраций
отдельных
ионов.
3тот метод
сводится
к
во3мо)кно
более точньтм
и3]!{ерениям
э.
д.
с.
ячеек
типа
&1е|А4е'+, &1е$"+"",1
|]
ша€1-(€11р'с,,)
|с12("),
с
при
нескольких
температурах и хотя
бьт
двух
ра3нь1х
суммарнь1х кон-
центрациях
ионов металла в
электролите'
которь1е
легко и вполне на_
де}кно
находятся
аналитически.
Фбозначим
нерез
.{
долю
ионов металла
низшей
валентности
от
их
общей
концентрации
[А/1е]:
90
