Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


аргона
при
700"€
в молибденовом
тигле'
[аблица
20
которьтй
слух{ил
(21ФАФй:
получался
рас-
€кщост-ь- к-о.рро3и]|_тория-
в
рас_
плав; обла{ающий
сильно
восстановитель-
цлавах-|^(€|(|):л
[(€|{3'4
вес'9[;
;;;;
;;;й;йй__тз1ь:.
Фк
реагировал
с
|!т(1,(\\|
по
|244|'
'ша|сло2'цос
кварцем'
стеклом'
фарфром
и алундом'
-цтмосфера
Ёе
|
Атмосфра Ё,
дейётвовал
на
платину
и
тантал'
99ч1?:
''
''|
:
_[_п
|;-т;
отрицают
во3мох(ность
восстановления
те-
999 ! _!:9 !
-9;?
! !;9 !
?^'?
трахлорида
металлическим
торием
на
ос_
911
|
12,5
|
14'0
!
7
'5
1
9'3
;-^
962
1
эквим61ьной смеси
[а61_(€1,
с6дерх<ащей
до
4 вес.96
тьс14,
якобьт
со-
храняли свой
вес
неи3мен|{ь1м
в
пределах
десятых
долей
миллиграмма
в течение
длительнь1х
вьтдер'{ек'
до
48 цас.
|{
сожалению'
авторь1
не
приводят никаких
количественньтх
даннь]х'
а
так>ке
анали3ов
расплавов
на
содер'(ание
тория
после
опь!тов'
ограничиваясь
ли1пь
3амечаниями'
что они не
пРоявляли
восстановительнь1х
свойств.
.[!остоверность
этих
исследований
€ринивасана
и
Фленгаса
вь]3ь1вает
больтшое сомнение'
так
как
их
ре3ультатьт
противоречат
многим экспе_
риментальнь:м
фактам'
пока3ь]ваю'щчщ
что
не только
_1акце
электроот_
рицательнь|е
металль|,
как
торий
[292],
ширконий--ш^23'.^3з6|.^ма|}1у
[347,
3481, но
и
более
благоролные,
к6к серебро
[120-|22,349,350|,
]келезо
[351,
352], мель
[353],
молибден
[354]'
корродируют
в хлор[!днь1х
расплавах
дах(е
в
отсутствие
каких-либо
посторонних
окислителей за
счет
в3аимодействия
с
катионами
щелочнь1х
металлов'
которь|е
восста_
навливаются
при
этом
до
субионов'
,{,ействительно'^
в
их
опь{тах
потен_
циал
тория менялся
в
пределах-от
_2,6
до
-2,4
в
по
отно1'пению
к
хлорному
электроду сравнения.
||ри таких
отрицательнь1х
потенциалах
концентрация
щелочнь{х
металлов^-в
расплавленной
эквимольнои
смеси
}х1а€|_&1
достигает
0,4-1,0
мол.%
в
интервале
температур
700-950'€
]355].
!т1еталлический
торий
дол}кен
3аметньтм
образом
корродировать'
особённо
в неи3отермической
ячейке,
где
щелочнь|е
металлы
во3гоняются
и3
солевого
расплава.
9то
подтверх(дается
исследованиями
корро3ии
тория
в
расплавленном
спектрал^ьно-
чистом
хлор}1де
калия
под атмосф-
ро!а
нист6го гелия
и во.||орода
[244|.
1Аеталл
сильно
корродировал
не3а-
Бисимо
от
газовой
атмосфёрьт.
€кор-ость-
корро3ии
во3растала
при
добав'
лении
тетрахлорида
тория
(до
3,4 вес.%),
что
мох(но
видеть
и3
даннь1х'
приводимь|х
в табл.
20.
-
|1оследний экспериментальнь:й
факт
подтвер}кдает'
что тетрахлорид
вь1ступает
в
роли
окислителя
металла.
.[!ействительно'
если
бьт торий
переходил
в хлоридные
расплавь|
только
в
четьтрехвалентном
состоянии'
то скорость
коррозии
дол}кна
умень!паться
при
добавлении
тетрахлорида
из.3асмещенияпотенциаламеталлавсторонуменееэлектроотри11атель.
нь1х 3начений.
ЁаблюАаемое
х(е на опь!те
ее
увеличение
вь|звано
тем' что
на
реакцию
окисления
катионами щелочнь|х
металлов
(Р+):
1[:1'1*2а(+:ть,++а&}
накладь1вается
реакция
окисления
катионами
четь|рехвалентного
тория:
1[,'1*
1}:{+:21}л2+-
Ф взаимодействии
четь]рехвалентного
тория с
металлом
в
хлориднь|х
расплавах
говорят
так}|(е 3начения
его средней
валентности'
отвечаюцие
наклонам
и3отерм
равновесного
электродного
потенциала.
Б
разбавлен-
нь!х солевь!х,
растворах
они
всегда
1\{ень1пе
четьтрех и
меняются
в
до_
9*
131

1100
1150
1200
1250
| аб
ллца 27
}словная
константа
равновесия реакции
[!111{[[{*
=2ть'+'
доля
ионов ][:э*
п
средняя
валентность
тория
в
хлоридах
щелочных
металлов
!!
,-
вольно 1широких
пределах
в
3а-
висимости от
температурь1' кон-
центрации
и соли-растворителя.
1ак,
например,
в
расплавах
эквимольной
смеси 1\1а€1-(€1'
содер}(ащих
0,6-2, 1 мол.уоть,
сред}!яя
валентность тория
в
равновесии
с
металлом
равна
3,46; 3,38 и
3,11
соответствен-
но
при
953,
1023
и 1173'1(.
Ёи>ке
приводятся эмпириче-
ские
уравнения
температурной
3ависимости
условной
ко!{станть|
равновесия
реакции
1[1'1*1}:д+
+2|\т2+
к*:цц!]1:
*?,'*
[ть|.
[ть4+]
1-{1,+'
'
Фни
полутень|
на основании
ре-
3ультатов
измерений
равновес-
ньтх электроднь|х
потенциалов
тория
в 3ависимости от
темпера-
турш
и кон1(ентрации
в
ука3ан-
нь1х
солевьтх
средах
[192]:
]т{а€1
19:(
*:0,202
-
3024|т'
}.]а€1-(€1
181{
*:
-2853|т.
||ри
840'€
в
расплаве,
со-
дер)кащем
0,4 мол. %
тп,
сРед-
няя
валентность тория'
перехо-
дящего
и3 металлической
фа3ь|
19
д*
пьс1
1'оо8-4234|т
ъс1
1'008_4435/г
2,84.10-3
3
,73.
10-3
4,
!*
1 10-3
6,07.10-3
асплавле
смеси
! |ть]: !! {ть]:
|
:ь'о.то_,
!!
:э,о.:о_,
|
0,52
|
2,02
!!
0,31
|
3,38
|
0,57
|
2,86
|!
0,35
|
3,30
10,61 12.78 !!
0,38
13,24
|
0'65
|
2'7о
||
0'42
|
3'16
нной эквимольной
\а]1*;(с!
[192]
Бр
950
1000
1050
1 100
1 150
1200
1050
!100
1150
12ш
1250
[ть]:
:2,0.10-,
:1гт1:
!!
:5.0.10_з
!!
0.36
|
3,28
[!
0,41
|
3,18
![
3;33
!
3:33
![
3:в3
|
3:33
||
ленном
(€1
|ть]: !!
:5.0.10_з
!!
0,38
|
3,24
!!
0,41
|
3,18
!!
!,Ё?[!,!Ё||
0,20
о,23
0,26
0,30
0,33
0,36
[2ц!
3,60
3,54
3,48
3,40
3,34
3,28
!:
.10-2
3,62
3,54
3,46
3,38
3,30
[ть
:2,0
в солевую'
творению
получается
коррозией
лов
|244|.
Б
расплавленном
кс1
[244]
19/{
*:0,806
_
4032|т.
Равновесие
смещается
в
сторону
образования ионов четь|рехвалент-
Ё|ого
тория
в
среде
расплавленньтх'хлоридов
щелочнь1х
металлов по
мере
увеличения
радиуса
их катионов и пони)кения температурьт' как
и в
слу-
чае
циркония
и гафния.
14з эксперименталь}1ь1х
даннь1х
для
расплавов
|д[а€1,
}:]а€1-кс1
и
(€1
следует'
что логарифм
условной
константь1
рав-
новесия
меняется
линейно
с
обратньтми
величинами температурьт и
ра-
диуса
катиона солевой
средь1
(табл.
21).
3то
по3воляет
оценить ее 3наче-
ния в
среде
расплавленнь1х
хлоридов
других
щелочнь1х
металлов:
близка к
трем.
Аз
ре3ультатов
длительнь|х
опь1тов
по
рас-
металла в
расплаве
].]а61
+
кс1+
1,4 вес. %
тьс14
[344]
она
равной
примерно
двум.
3то
расхох<дение
свя3ано
с
больгшой
тория
3а
счет окисления
его
катионами
щелочнь|х
метал'
0,19
о,23
о'27
0,31
0,35
|€
к*
-
0
'806-16137
г
|-1с1
3!!с1_
2кс1
-2823|т
Равновесше
реакц!|ш
&1о1"1
*
2йо3+ :.! 3мо2+
в сре0е
расплавленных
хло-
рш0ов
щелоцнь!х
ме,т!аллов.
Быход по току
при анодном
растворе|{ии
металла
и наклонь1 и3отерм
равновесного
электродного
потенциала
пока-
3ь1вают'
что молибден
обменивается с хлориднь|ми
расплавами
наряду
с
.&1о3+ также
ионами
'[4о2+.
Б
результате
этого его средняя
валентность
132

при
переходе
и3 металлической в
солевую
фазу
становится мень1пе
трех.
Фна
возрастает
3а счет
умень1шения
доли
ионов
двухвалентного
молиб-
дена
с
увеличением
радиуса
катионов
щелочнь1х
металлов
и
пони)кешием
темг1ературь1.
14з экспериментальнь|х
даннь1х
г!о и3мерению
равновеснь]х
электрод_
нь|х
потенциалов
в
3ависимости
от
температурь|
и концентрации
бьтли
вь|веденьт
уравнения
для
температурной
3ависимости
условной
константь!
равновесия реакции
&1о1,1
*2.д}1о3+
:3}1о2+
)([',+
[гт1о].
11
_
{ц',+)2
Фни
приводятся ни)ке
для
ука3аннь1х
солевь|х
расплавов:
16
д*
_
3'538+1058/г.
_
0'605-4839/г
|,155-7923|т
о
'877_9о|2|т
Б
расплавленном
хлориде л|7тия'
находящемся
в
равновеси!.т
с метал-
лом,
молибден имеет
наимень1пую среднюю
валентность
по
сравнению
с
расплавами
хлоридов всех остальнь1х
щелочнь|х
металлов
и их
смесей
(табл. 22).
\оля
ионов &1о2+
достигает
3десь наибольп:ей
велининьт.
1ак,
в
расплавах'
содер)кащих
около
1
пдол.%о
!т|о,
она состав.пя€т
-0,1.
,
в
расг1лавленнь!х
хлоридах
щелочнь}х
металлов
по
мере
\ аб лттца 22
увеличения радиуса
их катио_
}словная
константа
равновесия реакции
нов
константа
равновесия]}[ок.:*2]}1оз*;]3]}1оа*, доля
ионов1}1о2*
умень1шается.
Б
расплавах
с5с1
и
с!:1:дняя валентность
молибдена
в
хлоридах
доля
ионов
.]\4о2+
становится на-
щелочнь!х
металлов
д*-!]!1о9*]3-
{мо3+]'
!-1с1
[53]
[!с!-кс]
[243]
кс|
[194]
€в€!
[52]
'столько
малой' что средняя
ва-
] ! ! !!._ !
лентность
молибдена,
переходя-
'''*|
к*
|хм.'+1
"".
!!'*"'*|
,"р
щего
в
солевую
фазу
при
анод-
чается
равной
трем в пределах
точности определений вьйода
по
! !:'!}$]й_,!!
:'$3]п-'
току.
€
повь|11]ением температу-
900
|
1,93.10_5
|о,:] 1э'тэ !!
о'1'[1
э,вэ
рь1
и понижение1\1
концентра-
.9!9 ! ?'?9.]9-: [9'?? !?'19 !!
0'1?
!?'99
ции
равновесие
сдвигается в
1яРя ! ?:* 19-1 !9'39 !?'1т'! я'1? {3'99
стороЁу образо"а"}""^^-;;';",:
]?33
!
3;?3:|3:3
!
3:33
\''''т2\!3:|3 !
3:31
лентного молибдена.
1150
|
3;4в.16_'
|
о,:6
|
у','тц
||
о'1з
|
:]вт
ном
растворен_ии
металла'
полу-
8
расплавленном
!|с1
[53]
Равновесше
реокцшш
Ре1,1*
!
!
!
!|
*Реа++2Ре+^
в спф
расплав-
Б
расплавленном
кс|
[195]
Ре€1''
растворенного
в
расплав_
леннь!х
хлоридах
щелочнь1х
и
в
расплавленном
€з€1
[52]
леннь!х хлорн0ов
флоиньсх
ме-
! !
|1т1о]:
!! {мо]:
!т!аллов'
(юнль
и
Безенбрух
! !
:з',эь]19-'
||
:т''эг!|:о-'
{266]'
анализ|4руя
ре3ультать! ]919 ! 4.99.19-: !9'91 !?'96 !!
0'02
|2,98
;ж"жтЁжЁ#'#"ж';ЁЁ
113!
!],#.1Ё-: |Ё,!! ||''в||[,!! |3,#
*:дт",у:1"^.5:'.^_^ т11::"-.^}
1250
|
6'56.:о-'
|
0'11
|
2'89
||
0'07
|
2'93
щелочноземельнь|х
металлов'
! ! _{мр]: !!
{мо]:
предполагают во3мох{ность
о6-
1000
| |
:3'16'10_3
!!
:9'42'10-'
ра3ования
монохлорида х{еле3а
;'''
|
1:3? 13-:
!
3:3?'| 3:33'!! 3:33}| 3:333
в этих
расплавах'
находящихся
1100
|
4'83.19-в
|0,02 |2'98 ||
0'008] 2'992
в контакте
с
металлом. |]озднее
1150
|
1,10.10_?
|0'03 |2'97 ||
0,01
|2,99
бь:ло
показано прямь|ми
экспе_
1200
|
2'33'19-т
|0'0{
!2'9'

риментами
[357]'
нто
чистое
металлическое
}(елезо
растворяется
при
вь1-
соких
температуРах
в
расплавленном
дихлориде
по
реакции
Ре1'1*Ре€12
+
2Ре€|.
1емпературная
3ависимость
константьт
равновесия
этой
реакции
выра-
я(ается
эмпирическим
уравнением
1в
^к
*::в
-.[!ес].]1
:
1,в37
-
5*7
+
о,озв.
-'
дРес|'1
т
€ повыштением
температурь]
равновесие
смещается
в сторону образования
монохлорида.
1ак,
например'
его
равновесная
концентраци!^
Р
расплав-
ленной
ёмеси
с
дихлорйдом
составляет
1,99
мол.%
при 710'€
и
дости-
гает
7,69
мол.%о
при
1000"6.
Фсобый
интерес
эта
реакция
представляет
в
расплавленнь|х
хлоридах
щелочнь|х
металлов'
так
как
присутствие
ионов
Ре+
дах<е
в
небольш:их
количествах
мо}кет
вь]звать
фстоковьтй
перенос
х(еле3а чере3
хлориднь|е
расплавь|
на
дРугие
металль!'
с
которымй
оно
обра3ует
сплавьг.
3
ре_
3ультате
реакции
диспРопорционирования
2Ре+:Ре2++Ре
х(еле3о
3агря3няет
осах(даемь|е
на кат0де
металль|'
когда
электролит
находится
в
контакте
со
стенками
|4л\4
какими_либо
деталями
электро-
ли3ера'
сделанными
и3
}(еле3а
или его
сплавов
[195|.
Быход
по
току
при
анодном
растворении
металла
и
наклоньт
и3отерм
равновесного
электродного
потенциала
показь1вают'
что
х{еле3о
переходит
в хлориднь1е
рас,Ёа'ы
со
средней
валентностью
меньтшей
двух
[1{6]:
,'р
из
выхода
по
току
1
,80
1
,89
1,92
Ёа
основании
ре3ультатов
измерения
равновеснь|х
электр0днь1х
по-
тенциалов
)1{елеза
в соответствующих
солевь|х
средах
вь1ведень|
уравнения
для
температурной
3ависимости
условной
константь1
равновесия:
д*_
[Ре*}'
:
*3"*
[г"].
[Рез*]
1_{,р3+'
'
Б табл.
23
даньт
значения
константы'
доли
ионов
Ре2+
и средней
валент-
ности
х(еле3а
при
ука3анных
температурах:
!'
"с
810
860
860
[ве]
1
,15.10-'
5,97.10-'
6'81.10-в
из
наклона
изотерм
1,94
1,92
|,92
}:]а€1
[146]
|'{а€|
-
кс|
[146]
|8
к*
о
'323-4738|т
о,12|-4718|т
!д
д*
кс1
|146|
0'292-4950|т
с5с|
[268]
0'937-5820/г
7157
-262\/гр+
Бо
всех
исследованнь!х
хлориднь|х
расплавах
доля
ионов одновалент-
ного
}(елеза
в
равновесии
с
металлом
во3растает
при повь11пении
темпе_
ратурь|
и пони}кении
концентрации.
Фна
умень!пается
по
мере
увеличе-
|лия
радиуса
катиона
щелочного
металла.
14з экспериментальнь1х
даннь|х
мо}к;о
полунить
общее
уравнение
для
зависимости
условной
константь|
равновесия
от
температурь!
и
радиуса
катионов
щелочнь!х
металлов:
|в
'(
*:
1,653
-
1'492
гР*
Ровновесше
реакцц!|
Ре1'1*2Ре3+
=
3Ре2+
в
сре0е
распловленнь!х
хло'
ршаов
щелоцнь|1
ме/паллов.
1емпературную
3ависимость
услов!|ой
кон-
ста}1ть1
равновесия
этой
реакции
мо}кно
найти
и3 экспериментальнь1х
134

1аблица 23
}словная константа
раввовесия
ре!кции
Ре1'1{геа*
;]
2Ре*'
доля
ионов
Ре*
и
средняя
валентность
)келе3а в
хлорид:ш(
щело[!нь|х
металлов
1
|1461
8
расплавленном
кс1
[146]
расплавленном
\а€
| [ге]: !|
|
:3'о':о_';1
1.04.10-4
|
0,17
|
1,83!!
1
,60.10-4 |
0,21
|
1,79
!!
2.37.|о_4
|
0'25
|
1'75
||
3,41.10_4
|
0,29
|
1,71
|[
[146]
[Ре
:1,с
0,04
0,05
0,06
0,08
0,10
0,12
0,14
[Ре]
:3,0.
[ге]:
:1
,0.10-'
0,10
|
1,90
0,12
11,88
0,14
|
1,86
0,17
11,83
[Ре}: !
:3.0.10-';
0,11
11,891
0,13
1
1.87
1
0,16
11,841
0.20
1
1,80
!
о'е3
|\
'77
|
[ве|:
:1,0.10-,
! 100
1 150
1200
1250
в
950
1ф0
1050
1
100
1
150
12ш
1250
0,07
0,09
0,11
0,14
0,17
о'2о
0,24
_:о_,
1,93
1,91
1
,89
1
,86
1
,83
1,80
|,76
1050
11ш
1 150
1200
1250
950
1000
1050
1 100
1 150
1200
0,06
0,08
0'ш
0,11
0,14
1,96
1,92
1,91
1,89
1,86
3
,78.
10-6
6,19.10-6
9,73.10-6
7
,47.10-4
2,15.10-4
расплавленной
экв
ной
смеси }.,1а€1
_(€1
1
,
43. 10-5
2, 53. 10-5
4,25.10-6
6,
79.
10-6
1,04.10-4
1
,55.10-4
2.22.
\0-4
е]
0.
,10-2
1
,96
1,95
|,94
1,92
1,90
!
,88
1
,86
8
расплавленном
ъс1
[268]
[Ре]:
-1.0.10-'
6,47.1о-в
1
'31.10_б
2,48.10-5
4,43.10-5
7,52'1о-5
1,22.\о_4
0,03
|
1,97
0,04
|
1,96
0,05
|
1,05
0.06
!
1.94
0,08
11.92
0.10
|
1,90
[Ре]: !!
:3'0.10_з||
0,05
|
1,э5[!
0,06
|
1,$4!!
0,08
11,э2!!
о,11
|
1,8э
!!
3:1Ё
|
1:3в
[|
даннь1х
по
равновеснь|м
электродньтм потенциалам
х(еле3а
и
редокс-по-
тенциалам
системь'
!'9з+/!'3я+, исполь3уя
равенство
18
(*
:
1в
-!ге
]ц:
:=
(Ё}",+7р",+
_
ЁЁ",+:г"
).
"
[ге'+;'
2,3дг
'
Фна
вь:ра>кается
следующими
уравнениям\4
цля
ука3аннь|х
солевь1х
рас-
плавов:
16
д* |8
1(*
ша€1
[146'
358]
_8'523+21876|т
кс!
[146,
358]
_7,944+2|563|т
\а€1-кс1
[146'
358]
-8,035+2|4о2|т
€з€|
[268,
358]
-8'559+22249|т
9словная
константа
равновесия
почти
одинаково
умень1пается
с по-
вь1шением
темг,ературь[ в
распл:|влен!{ь'х
хлоридах
щелочнь!х
металлов
и
мало
меняется
при замене
одной соли
на
другую.
Равновесие
реакции
смещено практически
полностью
в сторону
образования
двухвалент!{ого
)[(еле3а'
которое
преобладает
в
равновесной
с металлом
смеси 16+,
['92+
и Ре3+. 1ак,
например'
при 727"с
в
расплаве
эквимольной
смеси
|х]а€1_(€1,
содер)кащем
1
мол.%
Ре, в
равновесии
с
металлическим >ке-
ле3ом
находится
0,05 мол.%
Ре+,
0,95 мол.о/оРе2+
ц
1,92.
10_6
мол.% Ре3+.
$
3. }словнь[е
стандартнь|е
э^ектроднь[е потенцпаль[
не!(оторь!х
мета^^ов в
х^оРиднь[х
Расп^авах
|словньсе
споан0аргпньсе элекгпро0нь|е
потпенцшальс
бершллшя
по
о1т|но!11енцю
к
!|онам Бе+
и Бе2+
а сре0е
расплсвленнь!х
хлорш0ов
щелочных
меп!аллов.
Р1х
мо>кно
рассчитать
непосредственно
и3
ре3ультатов
измерений
равно-
весных
электроднь|х потенциа{'оР_
б9Рцллия в
зависимости
от
температурь1
ц-к9уце_ц1Ра|!цц^Р
расплавах
[|с1,
кс1,
€з€1
[186]
и эвтектической
сйеси
3[!с1_кс1
[213].
1емпературная
3ависимость
условнь|х
стандартнь!х
электроднь|х потенциалов
Фриллия вь1ражается
следующими
уравнениям!!
135

для
ука3анньтх
солевь|х сред по
отно1'шению
к хлорному электроду
срав-
нения
[48]:
л{+7в"
,'
е}э+р",в
!.
'с
!1с|
_2'5о+7
'6.10-4
г
_2'б3+5,4.70_4т
620-880
!|с1
_
кс1
-
2'49+6
'5.10_4
г
-
2'72+6
'3.10-4
г
..4ш-900
кс1
_2'37+5'0.10_1г
_2'70+4'6.10-4т
780-1020
€з€1
-2'55+6'9.10_4г
-2'80+5'3.10-4
г 666-950
||о
двухвалентному
бериллию в
[!€1-(€1
нагпи
ре3ультать|
согласуются
с
даннь1ми
Анга
и [удсона
[91]:
при
800'к Ё$."+1в.:_2,22 в.
€тандартньте
потенциальт
Фриллия
становятся
более электроотрица-
тельными
при
поних(ении
температурьт
и
увеличении
радиуса
катиона
||1елочного
металла.
3ту
3ависимость
для
ще+7Бе
]\{о}кно
вь|ра3ить
с
вполне
удовлетворительньтм
приблих<ениепл
общим
уравнением
Ё$",+1в.:-3,01
***+ (+,ьт +
*)
.\0-ц
[ в,
гд|
\
.л*
7
если
3начения
радиусов
брать по
1'ольдгпмидту.
3ьтчисленнь:е по
этому
равенству
величинь1
Ё!",+7в"
расходятся
с
полученнь1ми
экспериментально
не более
чем
на +0,04
в
(та6л. 24).
Б табл.
24
приведеньт
так)ке
3начения
Ё]",+7в"
в
расплавах
1',1а€1,
эк-
вимольной
смеси
\1а€1-(€1
и
&ьс1,
для
которь1х нет экспериментальных
даннь|х.
Фни вьтчислень|
по
обшему
уравне}:ию:
},1а€1
}.{а€1
-
((1
пьс1
ь*2+
1в"
''
-
2'65+5'5.70-4
т
-2'71+5'4.10_4
г
_2'78+5'2.10-{
г
3начения
8!"+7в"
получень1 со значительно
меньш]ей точностью
из-3а
относительно
больтших
оцлибок
в определен|1и
дол|1
одновалентного
ф-
рилл14я'
когда он
участвует
в
равновесии
с
металлом в
небольтпих
коли-
чествах
1!о
сравнени1о
с
двухвалентнь1м
(в
слунае низких температур}
ософнно
в
расплавах
(61
и
€з€1).
|1оэтому
не представляется во3мо>кнь!м
вь|вести
подобное общее
уравнение
для
3ависимости
ё!"+,,3*
от температу-
ры
и
радиуса
катиона
щелочного
металла.
_
Бсли
доля
ионов
Бе+
значительна'
т. е.
[ве'+]{[Бе],
то
3ависимость
равновесного
потенциала
Фриллиевого
электрода
от общей
моль|тодоле-
| аблица
24
3начения
Ё|.,-г1ве
(в),
расснитаннь|е
по Фщему
уравнени:о
(|)
и
определеннь|е
экспериментально
(||)
солевая
среда
!!с1
\а€1
[!с1- кс1
\а€1
-
(€1
кс1
&ьс1
€з€1
-1,88
-1,96
-ц'ь
-2,16,
=1-;'1-|''|-{'А']-::1=2*|1-}
вой концентрации
бериллия
[Бе]
в электролите
вьтра}|(ается
довольно
сло)кнь1м
уравнением
Ё3.: Ё}",+1в"
*0,992.
10-4т:9{
1в"1
-
+
({;+_'
)},
где
(*
_
условная
константа
равновесия реакции
3ч'1
{
3е1'?$,'1
32
Бе]р,спл1
.
(огда
[ве])+({;#-
1),
т.
е.
доля
ионов
Бе+
пренебрех(имо
мала и
[ве]
=
[Бея+;,
уравнение
элек-
тродного потенциала принимает
обь:вньтй
вид:
Ё
в":
ЁБ."+
]в"
*
0,992. 10-4т 19
[ве].
€ледует
помнить'
что им
мо)кно поль3оваться без
больтпих огпибок
лиш:ь
в тех
случаях' когда
расплавь|
содерх{ат
не более 10 мол.%о
Бе€1"
и
ко-
эффициейт
активности' бериллпя
*е""е'с" не3начительно
[229|.
€птан0арптнь!е
элек/т!ро0ньсе
поптенцшаль!
лан,т!ана в
хлорсл0ньсх
расплавах.
€тандартньте
электроднь!е потенциаль!
лантана по
отно1шению
к его ионам
\а2+
п \ав+ бьтли измереньт при 377-977'
непосредственно
в
равновес-
ной
с
металлом
расплавленной
смеси 0,86[а€1'+0,\4[а(1,
]216'
2|9]'
Фни
-меняются с
температурой
согласно
эмпирическим
уравнениям:
Б!.',+1ьа
:
-3,47
+
в,3.
\0-ц7
в,
Ё!'"+1ъ^:
_3,49+9,0.
10_д7
в,
относительно
хлорного
электрода
сравнения.
3
среде
расплавленной
эвтектики
!1€1-(€1,
да>ке
г|ри ни3ких кон-
цештрациях
лантана'
в
равновесии
с
металлом
преобладают
ионьт
[а3*.
!4з экспериментальнь|х
даннь1х
по
равновеснь1м
потенц|\алам
лантанового
электрода
при
400-650"
с
в
расплавах
11с1-кс1' содерх(ащих
до
5
мол. %
[а, получено вь|ра}кение
для
температурной
зависимости
условного
стандартного
электродного
потеншиала
[196]:
Ё{'"+
1у':
-3,60*6,9'
!0-ц[ в
"так)ке
относительно хлорного электрода сравнения.
3еличиньт Ё{,"+1т-. 3начительно отрицательнее
Ё|'"+1ь^'
что
связано
с
образованием
довольно
прочнь]х
хлориднь!х комплексов
трехвалентного
.дантана
(ьас:;
или [а€1}_) в
среле
расплавленнь1х
хлоридов
щелочнь1х
металлов.
3тим,
_в
частности, объясняется очень
больш.тое смещение
влево
равковесия
реакции
ъа+2ьа|$,,1Ё3[а12р*",,1
при переходе
от
х(идких
смесей
[а€1'+[а€1,
к
разбавленнь!м
растворам
[а€1, в
расплавах
]-!с1_кс1, в которь1х его
коффициент активности
достигает
величины
порядка
(3_5).10-э.
€гпан0арптнь!е
элек/про0ньсе
по/пенцшаль|
цершя
в хлорш0ньсх
расплавах.
1{з
результатов
и3мерений электроднь!х
потен!1иалов-
церия
в
равновесной
с
металлом
расплавленной
смеси
0,89€е€1'10,11€е61,
|2\7|
бьтли
получе-
нь[ вырах(ения
для
температурной 3ависимости
нацря)кения
ра3ло)кения
ци-
и
трихлорида
[220],
другими
словами'
стандартнь1х
электродньтх
потен-
диалов
церия
по
отно1пению
к
ионам €е2+ и
6е9+:
Ё['""+1с.:
-3,53+7,6.
10-д7 с.
Ё$",+7с"
:
_3,56+в
,5.\0-ц!
в.
137

3ведение
катионов
щелочных
металлов в хлориднь|е
расплавь1
не
сдви-
гает
равновесие реакции
€е+2€е|$"'
1*3€е12$"''1
столь сильно
в
сторо-
ну
образования
ионов трехвалентного
церия'
как
это происходит в случае
лантана.
|1оэтому и3 величин
равновеснь1х
потенциалов
церия'
и3мерен-
нь1х
при
400-700"
с
в
расплавах
эвтектики !1€1-(€1,
содерх(ащих
о,3*2,4
мол.о/о €е, мох<но вь|вести
уравнения
для
условнь|х
стандарт-
нь|х
электроднь!х
потенциалов
церия
по
отно!пению к
ионам
6е9+ и
6"з+
[197]:
Ё[."+1с.:-3,36+5,8.10-д7
в,
ё|",+7с*
:_3'61
+7,4.\0_ц7
в.
€ледовательно'
ионы €е3+ в
расплавленной
эвтектике !!€1-(61
образуют
менее
прочнь|е
хлориднь1е комплексь'' чем катионь:
[-а3+.
!словньсе сгпан0аргпнь!е
элек/про0ньсе
погпенццаль! 1т|!11т|ана по
оп!но|/!енцю
к цонам
1|2+, т!3+ и т'4+ в
сре0е
расплавленньсх
хлортл0ов
щелоцнь!х
ш
щелоцно3емельнь!х
ме1т!аллов. Б}7'-+1тл
от
Ё}7"+1тл
можно найти
непосред-
ственно
и3
ре3ультатов
и3мерений
равновеснь1х
потенциалов
титана
отно-
сительно
хлорного электрода
сравнения.
Фни
меняются
с температурой
в
ука3аннь|х
интервалах
согласно следующим
эмпирическим
уравнениям:
в}'э+р|' в
Ё|1з+7т;' в
|,
'с
т-|с!
[56]
_2'25+4'4.1о-4т _2'04+3'0.10-4
г 700-1000
}.{а€!_кс1
[187]
_2'38+4'8.1о_4т
-2'16+3'2.70-4т
7оо-975
.кс|
{56]
-
2,60+6'0.\о-4т
_2,33+3,7.10-4
г 820-1010
с$с1
[56]
-2,67+6'2.10_4
т
-2'43+3,9'
10_4 г
710_910
!словньте стандартнь1е
потенциа'.' 11а+/?| , 11з+/1|
становятся
более
электроотрицательнь1ми
в
расплавленных
хлоридах
щелочнь1х
металлов
при
увелич|4п
Рад|4уса
их
катионов и пони'(ении
температурь|'
что
мо)кно
вь|ра3ить общими
уравнениями:
Ё\7"+1т::'_3,07
+
0
,64|г^+*
(7,9
_
2,7
|/\+).
\0_ц[
в
Ё{;,+7т;:
-2,79+о,59/г*+*(4,9
-
1,5//п+)
.\0_ц!
в
по отношению
к хлорному электроду сравнения.
Аля
эквимольной смеси
\а€1-(€1
расхо)кдение
достигает
0,04_
0,05 а.
@но, вероятно' свя3ано с
тем'
что
при
определении
равновесного
потенциала титана
бь:ли
допущеньт
ош:ибки, в частности'
из-3а неполной
и3оляции ячейки от окислителей
[137].
!,ействительно,
Фленгас
в
одной
и3
своих
работ
[233]
приводит 3начения Ё);,+1-1:-_1,115 в
и Ё}л"+/тп:
:_1,046
8
по
отношению
к
серебряному
электроду
сравнен}|я
в
рас-
плавленной эквимольной
смеси
}..1а€|-|(€1 при
670'с. Бсли снитать,
что потенциал серебряного
электрода
относительно
хлорного
в
этой соле-
вой
среде
равен
2,Ае:
1,088+2,5.\0_4
т
в
[116]'
то в
пересчете на
него
Ё\9,+117:_\
,97
в и Ё};"+1т|:_1,90
в.
3ти величиньт очень
хоро|'по
со-
гласуются с
полученнь1ми и3
общих
уравнений
(-1,98 и
_1,91
6 соот-
ветственно)'
которь1е
для
расплавов
\а€!_[(€1 принимают
вид:
Ё}р+;т::
_2,5\+5,6.
\0_ц|
в.
Ё!1,+7т::
_2,24
+
3,5. \0_ц7
в.
1аким
обра3ом,
установленнь!е
3акономерности
по3воляют
с
дос}аточно
удовлетворительным
пргтблит<ением
(примерно
ло
сотой
доли
вольта)
по-
лучить
вырах(ения
температурной
3ависимости
условнь]х
стандартнь1х
электроднь|х потенциалов
в тех
солевых средах'
для
которь|х они
еще
138
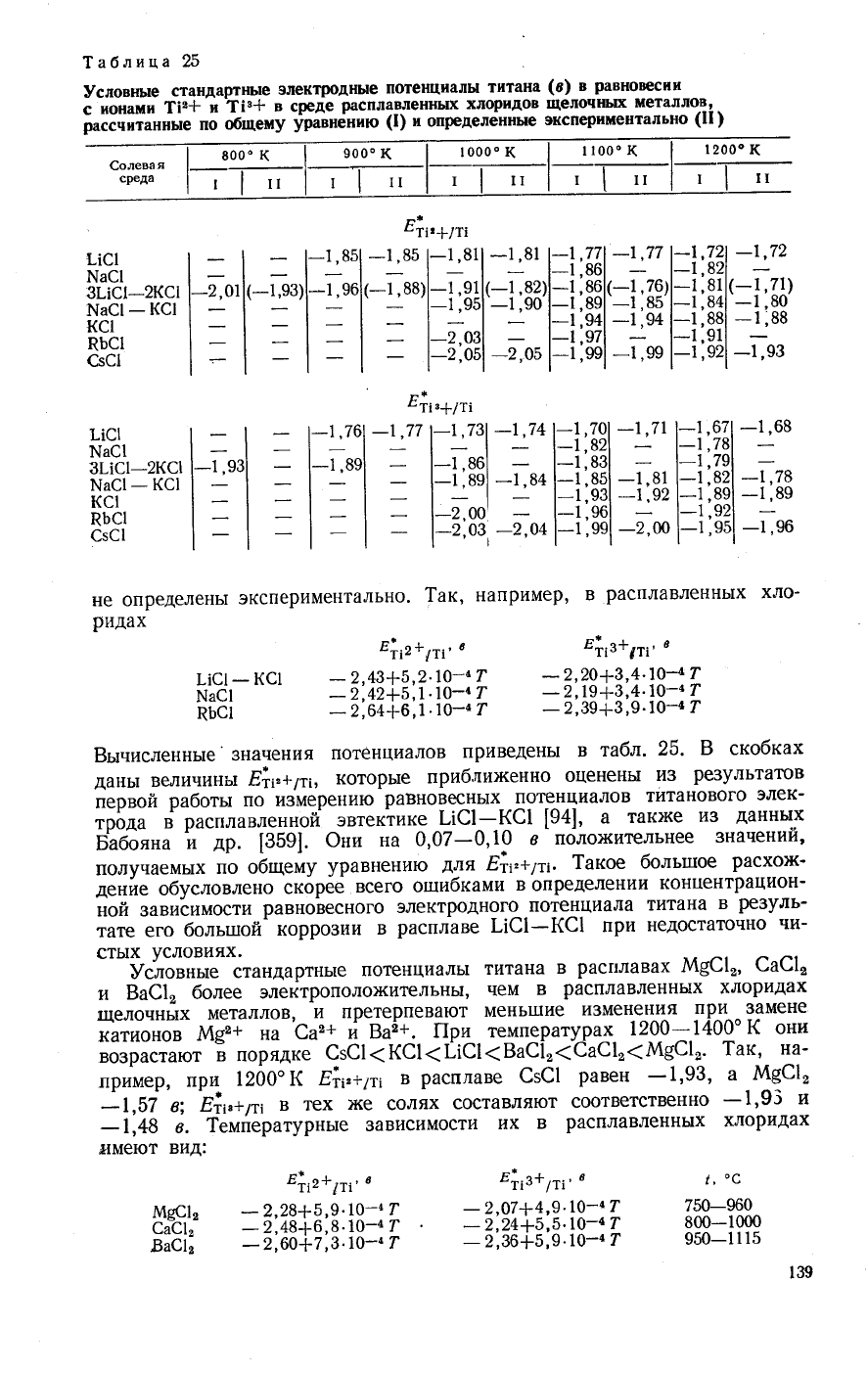
900"
к
'т
"
1аблица
25
5['словные
стандартнь1е
9лектродные
потенцпалы
титаша
(о) в
равновесши
с
понами
?!д*
и
[!3*
в
сРде
расплавленных
хлорпдов
щелочны'(
металлов'
й;;;;ййе
,'
йщ*"у
$фйнЁнию
(|)
п
опРделенные
9кспфпнентально
([!
)
|000'к
1
200о
к
€олевая
среда
[1с1
}х]а€1
31-!с!_2кс1
$а(|
_
((|
кс1
пьс1
€з€1
-1
,85
*1,96
в{'
-у'!
(-1
,
вв)!
!
:1
2+]т1
Ё'}1,47т;
&!?,
1:1
ц!;{'-т& [-'-|
-
[:-1
=
1.!*|_1,84
|_|:331:|:!
Ёът;-^''|=
|
=
|-
|
-
|-{вз'
-э'оц[|:33[
-;:[-|,!?1
-:;
в)',:+
рт'
в
мрс!'
_
2'28+5'9.\о-4
т
с]ё1"_
-
2,48+6,8.10_4
г
3а€|я
_2,60+7
,3'1о_4
т
л{,з+7т:,6
-2'07+4'9'
10_4
т
_2'24+5'5'
10_4
г
-
2,36+5'9.10_4
г
|'
"с
750-960
8Ф-1000
950-1115
|-1''|
_1
'в1
|-1
'.[ъ!-'-'
|-\''$31-|
'72
|.|
:3А!'-гвз'!-|,!!!'-],
6!'!_1
:
Ё*|'-1
:!Ё'
[3:33| -аоь |-|:36|
_цоэ
|-|:3}[_:,эз
не определень1
экспериментально.
[ак'
например'
в
расплавленнь!х
хло_
ридах
Ё}7э+6л,
в
Ё|,з+1т:'
,
!!с1-
кс1
-2,43+5,2.10_4
г
_?'?9+1,+'10_4
г
!.{а6|
_2',42+5'/д'10_1г
_э-'т^9+1'*'10-4
г
пБс'
_2',64+6,|'10_4т
_2,39+3'9'1о-4т
Бычислекнь:е'
3начения
поте!{циалов
приведень[
в
та6л.
25.
в скобках
дань|
величины
Ё|1,+711,
(Ф1Ф!Б|ё
приблих<енно
оценены
из
ре3ультатов
первой
работь:
по
и3мерению
равновес^нь!х
потенциалов
титанового
элек_
трода
в
расплавленной
эвтектике
!-1с1-кс1
[94]'
а
такх(е
из
данных
Б}бо"*а
й
др.
[359].
Фни
на
0,07_0,10
8
поло}!{ительнее
3начении'
получаемь|х
,' о6ше"у
уравнению
для
Ё,}7.+11:.
[акое
больп:ое
расхо}к'
денйе
обусловлено
скорее
всего ошибками
в
определении
концентрацион-
ной завиёимости
равновесного
электродного
потенциала
титана
в
ре3уль_
тате
его
больтпой'
корро3ии
в
расплаве
!!с1_кс1
при
недостаточ}!о
чи-
сть1х
условиях.
}словньте
стандартнь1е
потенциаль1
титана
в
расг|лавах
.&19€1',
€а€1,
|4
8а€1,
более
электрополо>кительнь1'
чем
в
расплавленных
хлоРидах
щелочнь1х
металлов'
и претерпевают
мень1пие
и3менени^я
пр_и
^
3амене
й1"1й'"
м9'*
на
|а2+
й ваЁ*-.
|!рц тедп9Рату!ч
1200_1400'(
они
возрастают
в порядке
€з€1<(€1<||€1<Ба€1'4€а€1'4й9€1'.
1ак,
на-
,рй*р,
при
12о0"к
Ё;|,+/т|
в
расплаве
€з61
равен
_1,93,
а
й9€1,
_т,ь'/
в1
Ё}р+ттт
в тех
х(е
солях
составляют
соответственно
_1,93
14
_1,48
в.
1емйературнь:е
3ависимости
их
в
расплавленных
хлоридах
*|меют
вид:
139

1 аб лица
26
}словньпе
стандартнь|е
электроднь|е
?!2* и
[!з* в среде
расплавленнь|х
таннь|е
по
общему
уравнениго
(|)
и
потенциаль|
титана
(в)
в
равновесии
с
ионам|!
хлоридов
щелочно3емельнь!х
металлов'
рассчи_
определенпь|е
экспериментально
([!)
€олевая
среда
|-
'000.к
|-
!|00.к
|
1200"к
|-
'300.к
|-_]100.к
|-т;!_т;[;т!-т;[т;
:\49612
€а€|2
5г€|д
Ба(1а
Б\''*
|'
А49€|2
|
-1
'
58
|
-1
'
58
|
-1
,
53
|
-1
,53 |
-1
,48 |
-1
,48 !
-1
'
43
!
-1
.43 !
-1
'
38
!
-1
'
3&
€а€|:
|
_
|
-
|
-1'64
|-1,64 |-т,ьв |-1,5в |-1,521-т
'ьэ1-т 'цт
1
-т
'цт
5г€!э
!- |-
|- !- |-1'63!
-
|-т'ьт!
--^|-1'91!
.-^
Ба(|2
|
- | -
!
!
!
! [-';',|-:'ьэ|-:!ьз|-:,ээ
Б
ряду
:}!3€1'-€а€1'-Ба€1,
условнь|е
стандартнь1е электроднь1е
по-
тенциаль|
меняются
линейно
с обратной величиной
радиусов
катионов_
|1остоянньте
А
ц
6
в
равенствах
Ё}{+7тт
:АуБ|гц,+
имеют
другие
3на_
чения'
чем-в
среде
расплавленнь!х
хлоридов
щелочнь1х
металлов.
1{х
мох(но
найти !1з
экспериментальнь1х
даннь|х.
Бсли
величинь1
радиусов
брать
по [ольдгшмидту'
то получаются
следующие
общие
уравнения:
Б}лу*ттт:
-2,98+0,,55/г*,1*(3
,9
_
2,33| гд.+).
10_{7 в,
Ё{:3*:т;
:
-2,7|40,50/г*.++(7,1
-
|,7!,|гр"+). 10_ц7
в.
по отно1пени1о к хлорному
электроду
сравнения.
Рассчитаннь]е по
этим
уравнениям
величинь|
потенциалов совпадают
Р- цРеде]а]
+0,01^ в
с
экспериментально
найденньтми
для
расплавов
й8€1', €а€1,
и Ба€1,
(табл.
26).
!,ля
расплава
5г€|',
в котоРом
равно-
веснь]е
электроднь{е
потенциаль1
титана не
и3мерялись'
они
вь1числе]{ы.
из
общих
уравнений:
Ё};,+1тл:
-2,57
+7,0.
10_д7
в,
Ё};,+7т;:
-2,3|
+5,7
.
\0_ц7
в.
.&1еталлический
титан практически
полностью
(ни>ке
чувствительностш
всех
и3вестнь|х
методов
определения) восстанавливает
тетрахлорид
до ди_
и_
трихлорида
в
расплавленнь!х
хлоридах
щелочнь1х
металлов.
.[!оля
.{,1;+* Б
равновесной
с
металлом
смеси
ионов т|4+'
т13+ 14 т|2+
настолько
мала' что и3 измеряемь1х
на
опь|те
равновесньтх
потенциалов нево3мо}кнФ
рассчитать
условнь:й
стандартнь!й
электроднь:й
потенциал
г* 11
Р7'
Ё77.+1тэ:в
_:::
1п.{',.+
[1|!,
как это
делается
в
случае т3а+|||
"
11з+/?|. Фднако
его мох(но найти'
косвеннь1м
путем'
определяя_-и3менение
энергии [иббса
при
реакции
образования
из
элементов
1!€1*
или и3меряя
окислительно-восстанови-
тельньте потенциаль|
т|4+/т!2+
в
исследуемь|х
солевь|х
расплавах.
Ёа
основании
пря}[ь]х
экспериментальнь]х
определений
полутеньг
уравнения
температурной
зависимости
условной
константь1
растворимости
тетрахлорида
титана
в
расплавленнь1х
хлоридах
и
рассчитана
условная
140
