Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.


|,1змеренше
равновеснь!х
попенцшалов меп!алл1)цескцх
элекпро0ов, обра-
!пшмь!х к свошм цонам вь!сц1!/-х ш
нца!)/цх валенп1носп!ей.
\огда
в
равнове_
сии
с
металлом
участвуют
ионь1
вь:стлей и низтпей валентности'
его
равно-
весньтй электроднь1й потенциал
равен
Ём-
:
Ё!ц", +
ш"
+
+
1п ау"п
у
:
р,^"*
у
;'"
+
$
|п
ау./п *
:
Ё!д*'
+/м'*+
*
,
д?
,--
4м',*
т.@-п1г'";**'
14з
этого
обя3ательного
условия
термодинамического
равновесия
мех(ду
металлической
и солевой
фазами
следует соотно1пение
ме}кду
формальньтм
окислифльно_восстановительнь|м
потенциалом
системь|
ионов &1еа*/}{9гп+
и
стандартнь|ми
электроднь!ми
потенциалами
металла
по
отнош]е}{ию к
этим
ионам:
Ё$"'*,д"'*:*Ёо1'6''+1м"--!-п-п|Ё0ц"*+';м'.
Б слунае
разбавленньтх
растворов'
где
вместо
активностей
мох<тто
оперировать
непосредственно
мольнодолевьтми
концентрацияп,{и
ионов
(когда
они
не превь11пают
(2:3).10_2),
это вьтра>кение преобразуется
в
равенство
.
сй",*!м'-|:'!--Ё{д",+7м"
_
*Ё{1",+;м"
п-!п
1аким
образом,
3ная
условнь1е
стандартные
электроднь|е
потенциальт ме-
талла по отно1пению к его
ионам
ра3нь]х
валентностей,
очень
просто
расститать условньтй
фрмальньтй
окислительно-восстановительнь|й
потен-
циал
систе''
ц*л+/!!1е'+.
&1етодика определения
условных
стандартнь]х
электроднь|х
потенциалов
подробно
описана
в
$
2
главьт
!1.
€ледует
ли1шь
напомнить' что этот
метод приемлем только
для
тех
систем'
у
ко-
торь]х
в
равновесии
с
металлической
фазой
ионы вьтсгцей и низтшей
ва-
лентности
участвуют
в
сои3меримь|х
концентрациях.
1ак,
например' в
расплавленном
хлориде калия
условнь1е
стандарт-
ньте элецтроднь!е
потенциаль1
х<елеза
[146]:
'
ЁЁ"+,,г":
_1,32+3,8'
10_0[ в ут €|",+7г"
:_1,81+4,1'
|0-ц[ в;
титана
[56]:
Б}л,+ттл:
_2,60
+
6,0.
10_4г
в и Ё\р+ут;:
-2,33
+3,7
.70_47
в;
ширкония
[2091:
Ё)1,+уъ:
_2,77
+8,|,19_,т
в п Ё|',+7а':
_2,82+7,7.70_ц[
в.
}словные
фрмальнь:е
окислительно-восстановительнь1е
потен11иаль1
систем
!'9а+/['9+,
т,з+/т|в+ ц
|{+
|/уа+
получаются
равнь1ми:
п*
.еР;'+/ге+:
2Ё}",+1в"_
Ё$"+7г"
:
_2,30
+
3,5.
|0-ц7 в,
Ё}7"+17;,+:3Ё{1,+7т;
-
2Ё\у"+:тл:
-1,79
_
0;9'
70_ц7
в,
Ё|7,+
121"+
:2Ё)',+
1а,
_
Ё}'"+12':
_2,87
+7
,3
'|0-ц7.
в.
1рямое шз;перент;е ок|!слц|т!ельно-восс!т!ановц1т|ельнь!х
по1т!е|{ц!/алов
в
хло-
рн0ньсх
расплавах.
Фкислительно-восстановительнь1е
потенциальт
измеряют
в
гальванических элементах' составленнь|х
и3 электродов сравнения:
хлорного
|247,
248,317, 355,
370, 37\,374|,
серебряного
1126,
|37,2\2,
233,
234,
236, 375,376],
платинового
[130,
131, 134-136,
240,359,3621,
которьте' как правило' капсулируются'
и полуэлементов с
индикаторнь|-
11
м. в. 6мирнов
161

ми электродами'
погру}кеннь1ми
в исследуемь|е
со4евьте
расплавь1
с из-
вестными
концентрациями
потенциалопределяющих ионов
вь1сших и
ни3ших валентностей.
Б
конструкционном отно1пении
они
не отличаются
принципиально
от вьтсокотемпературньтх ячеек'
которь1е опись|ваются
в
$
1 главь:
1||,
и
дол}кны
отвечать
тем
>ке
требованиям.
Фсновное
у|з
них
_
обеспечение
неи3менности
отно1пения
концентраший
окисленной
и
восстановленной
форм
компонента электролита во время измерений.
}того мо)кно
добиться,
ёсли
исключить
или
свести к минимуму во3гонь1
и3
расплава
более летучих
хлоридов вь|сших валентностей,
окисление
ни31пих хлоридов и
образование оксихлоридов
вь|сших валентностей под
воздействием
кислорода
атмосфрь]' в3аимодействие потенциалолределяю-
щих
ионов с
материалами
индикаторного
электрода' контейнера
(тигля,
стакана
или пробирки) и
диафрагмьт,
отделяющей
электрод
сравне-
ния.
14ндикаторнь|е электроды' которь|е
функционируют
только
как
пере-
датчики
(акшепторьт
или
донорь|)
электронов,
необходимо и3готовлять и3
индиффрентных материалов' имеющих
электронную
проводимость.
Ан-
диферентность
о3начает минимальное
участие
материала электрода в
происходящей на нем электрохимической
реакции
13771.
|7ри
вь1соких
температурах
в
расплавленнь|х
хлоридах'
близких по характеру
в3аимо_
действия
частиц к ионнь1м )кидкостям'
отсутствуют какие-либо
сущест-
веннь|е 3атруднения
в
пере3аряде
и
ра3ряде
ионов'
а
так}ке
иони3а1{ии
металлов.
Б
результате
этого
ме}кду
электродом и прилегающим
к нему
слоем
электролита
бьтстро
устанавливается
состояние термодинамического
равновесия'
которое характери3уется
равенством
окислительно-восстано_
вительного
потенциала
средь! в
этом слое и
электродного потенциала
ме-
талла
по
отно1пению к
его ионам:
с\",+
щ"*
$1п
[йе,+]
:
Ё!*^"т
*"*
*1"
#
!(огда
Ё{ц"'+7м"
)
Ё]*""/"'",
концентрация ионов металла
в
приэлектрод-
ном слое электролита ничтох(но п{ала'
т. е.
равновесие
достигается
прак-
тически
без
растворения
(за
счет окисления)
металла в
солевом
расплаве
и электрод принимает
редокс_потенциал
среды.
1ак, например'
равновес_
ная
мольнодолевая концентрация
молибдена
(.г!1оа+
и &1о8+)
в
среде
рас_
плавленнь|х хлоридов
щелочньтх
металлов
при
1100"к
становится
менее
10_6,
когда поте[|циал
достигает
_1,5
с
!то
отношению
к хлорному элек_
троду
сравнения.
€ледовательно,
-молибденовь:й
электрод
мох([{о исполь-
3овать
в качестве индикато!ного
для
и3мерения
окислительт{о_восстано_
вительньтх
потенциалов
отрицательнее
-1,5
в.
Фднако
да)ке
в
области
отрицательньтх потен1{иалов
могут
во3никнуть
осло}кнения в
ре3ультате реакции
диспропорционирования
ионов
ни31ших
валентностей
с образованием
сплавов
с
металлом индикаторпого.
элек-
трода. .[1иш:ь в тех случаях'
когда
диффузия
в
твердь1х
фазах
ёильно
3атормо>кена'
ме}кду
поверхностнь1м
слоем
электрода
и электролитом
бь:стро
достигается
равновесие
и электродньтй
потенциал принимает
ве_
личину
редокс-потен|{иала
окру)кающей
солевой
средь].
}|о
такой электрод'
помещеннь1й затем
в
расплав
с более
полох(ительным
окислитель}{о-восста_
новительньтм
потенциалом'
пока3ь1вает
вначале более электроотрицатель-
нь1е
потенциалы' пока
его поверхностнь:й
слой
вновь
не
придет в
равно_
весие
с
солевой
фазой.
Бсли Ё{."''17м"
((
Ё]**":вос
'
потенциал
электродА в первьтй
момент
ока3ы-
вается 3начительно
отрицательнее
редокс-потенциала
средь1
и
металл
начинает окисляться'
а
окислитель восстанавливаться
(процесс
коррозии).
Б
этом
случае на электроде
устанавливается
некоторьтй
стационарт:ь:й
потенциал' отличньтй
от
окислительно-восстановительного потенциала
в
\62
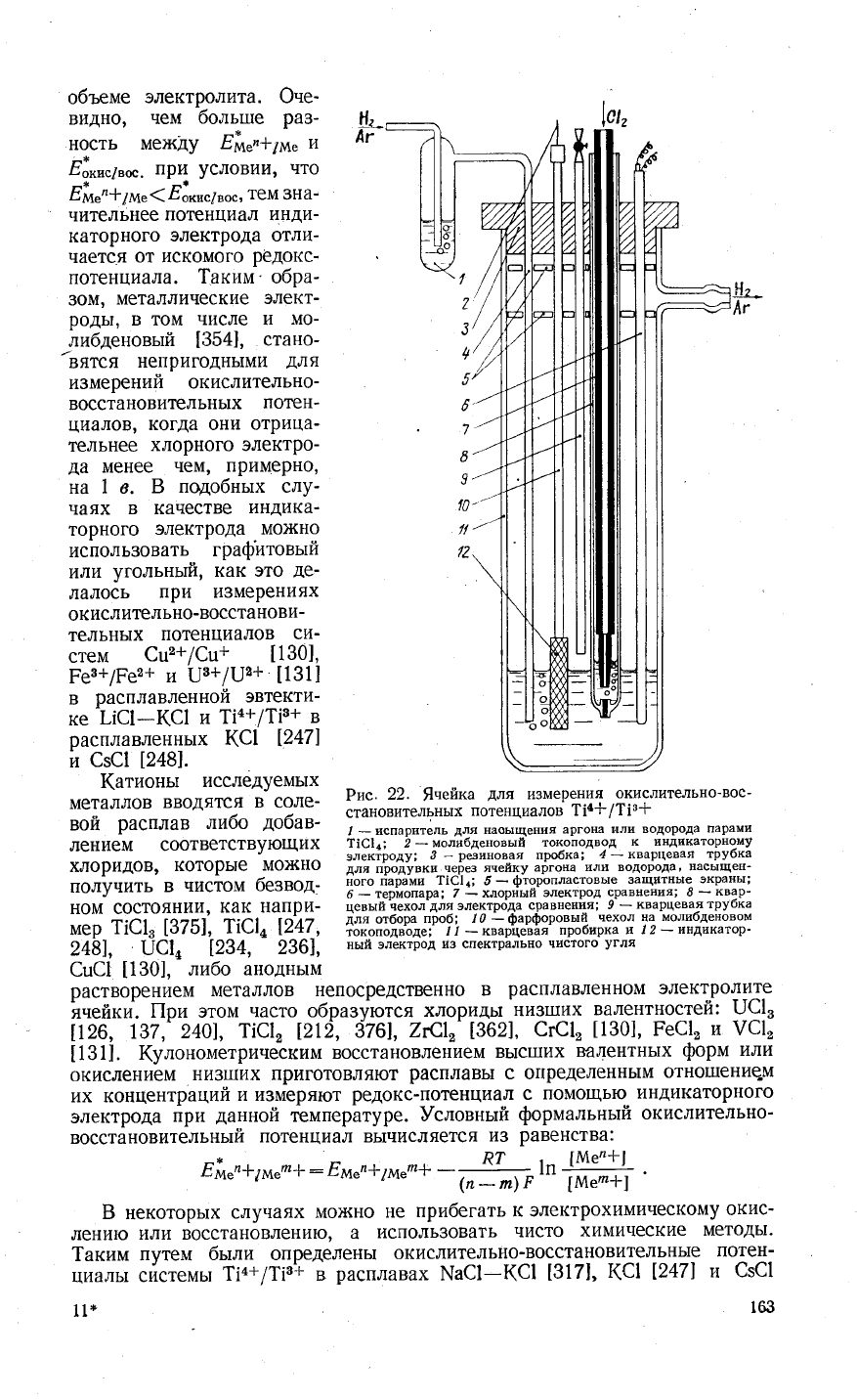
объеме
электролита. Фче-
видно'
чем
больтпе
ра3-
"
'-*
ность
между
Ёц9п*7де
|4
6]*,"/"*.
при
условии'
что
Ё},л.' +
:
м.
<
Ё1кис]вос
:
тем
3н
а-
читель}|ее
потенциал инди-
каторного
электрода отли-
чается
от
искомого
редокс-
потенциала.
1аким' обра-
зом'
металлические
элект-
родь!'
в том
числе и
мо-
_/|ибденовь1й
[354]'
стано-
вятся
нег!ригоднь1ми
для
и3мерений
окислительно-
восстановительнь|х
потен-
циалов'
когда они отрица-
тельнее
хлорного электро-
да
менее
чем'
примерно'
на 1 6.
3
поцобньтх слу-
чаях
в качестве
индика-
торного
электрода
мо}кно
использовать
графйтовьтй
или
угольнь1й'
как это
де-
лалось
при измерениях
окислительно-восстанови-
тельнь|х
потенциалов
си-
стем
(цэ+/(,ц+
[130],
Ре3+/ге2+
и
|)3+|ц2+
1131]
в
расплавленной
эвтекти-
ке
[|с1_к61
"
[1с+/1!з+
в
оасплавленнь1х кс1 1247|
!а
свс:
г:+в].
}!а-
Аг
(атионьт
исследуемь|х
-
металлов
вводятся
в' соле-
|,#"3,1"##}"{Ёа,?нуЁЁ}
/?1уу"'ельно-вос-
вой
расплав
либо
добав-
;:;;;;;;]'|
,"'
наоыщения
аргона или
водорода
парами
лением
соответствующих
1|6['; 2_моли6деновый
токоподвод
к индикаторному
хло
ридов'
которь}е
;ьй;
Ёт;":}'й-*_;ЁЁ"{-"""#-!
;##''"1,
;&"#]!??,#{*:
полунить
в
чистом
безвод-
Ёт'Ё1ъж,;'9':9;9,]Р3!#;3;ъ":}нг#:;]*#:
ном состоянии'
как напри-
цевьтй
чехол'для
электр6да
сравненй.я;
9
_
кварцевая
трубка
;;;
т;ё',"1ъ?вт],
тё["-т{ц],
ёЁ#;я:ъ}д*!;
]'";'ф-'ъв*'""ъъЁ",т}ч
|',
у#;я+Ё'"Ёт
248!,
шс|4
|234,
236],
ный электрод
и3 спектрально
чистого
угля
€ш€1
[130],
либо
аноднь:м
растворением
металлов
непосредственно
в
расплавленном
электролите
'ячеикй.
||ри этом
насто образуются
хлориды
ни31пих
валентнос_тей:
!-!1,
1126,
737,'2401,
т1с12,2\,, 5т61,7ю\,'|362]'
сю1,
|130],
Ре€1,
и 9€1,
!131].
1(улонометрическим
восстановлением
вь|сших
в{|лентньтх
форм
или
окислением
ни3ших приготовляют
расплавь[
с ог!ределеннь|м
отно1'пениед
их концентраший
и и3меряют
редокс-потенциал
с
помощью
индикаторного
электрода
йри
данной
ймпературе.
}словнь:й
формальньтй
окислительно_
восстановительнь1й
потенциал вь1числяется
и3
равенства:
Б|ц.,*7у.**:
Ём'':.!м.*+
_
.
&?
,
=
1д
!щ{1!
'
(п-тп)Р
[1т1еи*]
3
некоторь:х
случаях
мох(но
не
приФгать
к электрохимическому
окис-
лению
или восстановлению'
а
исполь3овать
чисто
химические
методь|.
1аким
путем
6ьтлтц определень]
окислительно-восстановительньте
потен-
циаль1
сйс'ем,'
т]4+/т|а'+ в
расплавах
1.{а€1-(€1 [317|,
кс\
|2471
и
€з€1
11*
163

;
;=
*;
Р
цвэ
[248].
йзмере1{ия
прово-
дились
в
ячейке'
уст_
ройство
которой
схема-
тически
изобрах(ено
на
р14с.
22.
1рихлорид
ти_
тана
получали
непо-
средствекно
в
ячейке'
пропуская
чере3
соле-
вой
расплав
парь!
т|с|4
1200
да:
т'с14
1"1*
1/2Ё,
1"1
:
Рис'
23.
?емпературная
зависимост,
у.'',,'1:'''9^'3^_
-[|€1з
с,"*';+нё1с]:.
т?#)?]ьчт*#::Ё"Ё.т'тановительного
потенциала,
|-1осле
ьъ;
;-;Ёы;"'-
т|4+/т13+
в
расплаве
}(€1
вали
чисть]м
водордом,
влаги
аргон' нась|щеннь[й
па
т|с14
в
испарителе'
температура
чтобь|
удалить
остатки т|с14, и
анализировали
электролит
на
содер-
)кание
трехвалентного
титана.
3атем
через
солевой
расплав
непрь-
рь1вно
пропускали
тщательно
очи'|(еннь!й
от
следов
кислорода
и
влаги
аргон' нась|щеннь[и
п-а-р_а_мц
11с|4
в
испарителе'
температура
которого менялась
от 70
до
136'с,
и и3меряли
рйзность
потенциалов
мех{ду хлорнь|м
и
индикаторнь1м
угольньтм
электродами.
|]осле
того
как
она
достигала
постюянной (в
пределах
_*2-
'')
величинь|
при
задан-
'ных температуре
и
парциальном
давлении
1|€!*,
электролит
снова
ана_
ли3ировали
на содерх(ание
титана.
Ёа
основании
резуйьтатов
первого
и
второго
анали3ов
ра9считьтвали
мольнодолевь!е
концентрации
трех-
и че_
ть1рехвалентного
титана. }словнь:й
формальный
окис]тительно-восстано-
вительньтй
потенциал
системьт
т'4+7т!3+
вь1числяли
по
равенству:
Ё|1о+111,+
:ё1;с*111а* _
1,984.
10-д7]п
Ё#
|1роизводя
и3мерения
при
ра3нь1х
температурах
в ячейке,
по'ун',
п л|1-
нейную
температурную
зависимость
Ё{1.+711,+'
Ёа
рис.
23
прЁдставлень|
|Р1фи^ч9![1
ре3ультать|
опь1тов
в среде
раёплавленн6го
(€1
Ё
'й"йр"а'е
810-983"
с.
|7
о гпенцшо
ме п1р !]ц.е ское
опре0е
ленше
окцс
л!1,пе
льно-вос
с
[пановц
1т!е л
ьн
ь!
х
по-
!пенцшалов
в хлорш0ньсх
расплавах.
3гот
мет0д
сводится
к наблюдению
3а
и3менением
потенциала
индикаторного
электрода
в
ходе
восстановления
или
окисления
исследуемой
системь|
каким-либо
веществом.
Ёа
рис.24
в
качестве
примера
пока3а!{о'
как
меняется
пот€нциал
системь1
ш4+/ш9+
по.мере
восстановления
1-'}{+
до
[_]3+,
т.
е.
увеличения доли
ионов
ни3-
ш'тей
валентности.
[!отенциометрические
$Ривые
подобно:о
рода
имеют
изги6ьт
при
потенц|4алах,
рав-нь!х
по
своей_1еличине
'услбвнй
формйь-
нь|м'
та}(.
как
в этих
то1!'ках
[окис]:[вос]. €пособ
по}енциометрического
титрования
на1.пел
1пиРокое
применение
для
воднь]х
растворов.
Ёго
мой-
но
исполь3овать
в несколько
преобразованном
виде
и
д"тя
|''!
/
солевьтх
оасплавов. 1 ,/
БосстаЁовителями
окис-
-ц|
-/
ленньтх
фрм
могут
слух(ить
"
] :----
й€18,1а'|Б1,
€€а-1}1-
8
равновесии
,
с ними
преобладагот
ионьт
Р---;'-
ни31пих
валентностей.
|1отен-
'0/г
,{
циал
индикаторного
электро-
! /
да
ог|ределяется
отно[пением
коншентраций
'окисленной
|т
0,2
цц
ц0
ца
!
,з+
восстагтовленной
форм
не
8
Рис. 24.
||отенциометрическая
кривая
системы
объеме,
а
в прилегающем
к
|.л;+:шъ{'ййй_]666;к"*""^^'
164
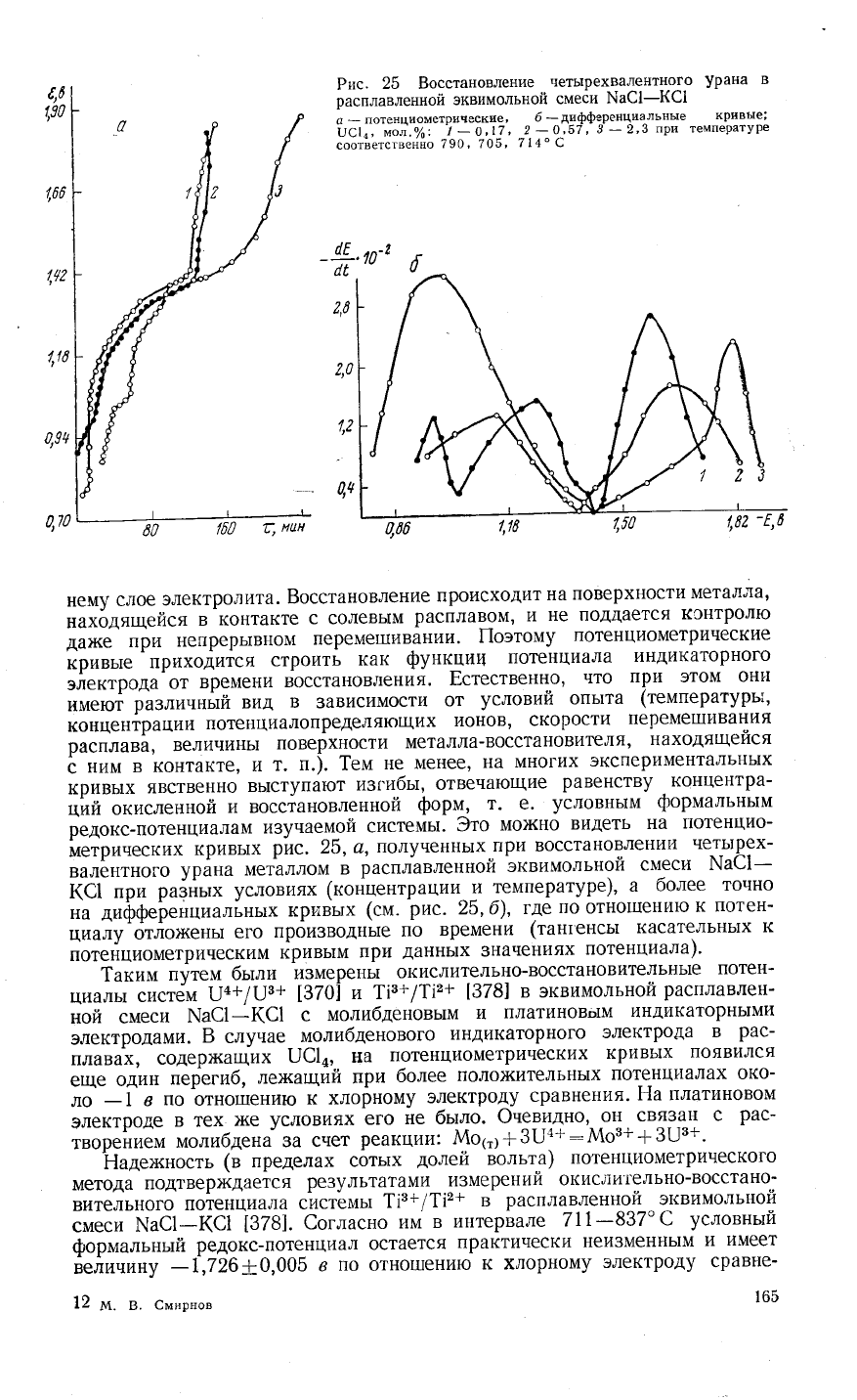
€,6
1,30
Рис.
25 8осстановление
четь|рехвалентного
урана
в
расплавленной
эквимольно:]
смеёи
]\1а€1-(€1
а
*
лотенциометрические,
б
_дифференциальньге
кр'{вьте;
0с|,'
мол.о/':
!
-0'\7'
2_0'57'
3_2'3
при температуре
соотЁетсгвеййо
79о' 705'
7 14" с
'
60
160
ц
нцн
ц00
\7б
ь'](
нему
слое
электролита.
восстановление
происходит
на
поверхности
металла'
нах6дящейся
в контакте
с солевь1м
расплавом,
и
не поддается
контролю
да)ке
при
непрерьтвном
переме111ивании.
|1оэтому
потенциометрические
кривь1е
приходится
строить
как
функшии
потенциала
индикаторного
э}ектрода_от
вре}1ени
восстановления.
Рстественно,
что
при этом
он}|
имеют
ра3личнь1и
вид
в
3ависимости
от
условий
о[ь1та
(температурь:,
концен+рации
потенциалопределяющих
ионов'
скорости
,"р"*:ч:ч-ч'11
расплава,
величинь|
поверхности
металла-восстановителя'
находящеися
с
ним
в
контакте,
[
1.
п.). 1ем
не
менее'
на
многих
экспериментальнь|х
кривь1х
явственно
вь]стуг{ают
и3гибь1,
отвечающие
равенству
-
концентра-
цйа
'*"-'"нной
и восс;ановленной
форм,
т. е.
условнь1м
формальньтм
редокс-потенциалам
и3учаемой
системь|.
3то
мо>кно
видеть
на
потенцио-
йетринеских
кривь1х
рис.
25, а'
полученнь|х
при восстановлени1{
четь1рех-
валентного
урана
металлом
в
расплавленной
эквимольной
смеси \а€1-
(-;
'ргт
ра;5Ёьтх
условиях
(коншентрациу1^у
температуре)'
а более
точно
на
диффеьейциальньтх
крР]вьтх
(см.
рис.
25,б)'
где
по
отно1пению
к
потен-
циалу
отло}кень1
его
прои3воднь1е
по
времени
(тант'енсьт
касательньтх
к
поте|{циометрическим
т!ривьтм
при
даннь|х
значениях
потенциала).
1аким
путем
бьтли
и3меренц
^окис.лительно-восстановительнь1е
потен_
циаль|
сист6м
ц4+
|
|)в+
|370|
и т13+/т12+
[378]
в эквимольной
расплавлен_
ной смеси
!ч]а€1_(61
с
молибденовь1м
1'1 ||"т1а1Р[!|ФБо1й
индикаторньтми
электродами.
в
случае
молибденового
индикаторного
электрода
в
рас-
плавах'
содер}кащих
0с14, на
потенциометрических
кривь1х
появился
еще
один
перегиб'
ле}кащий при
более
положительнь!х
потенц!1алах
око-
ло
-1
в
по
отнош:ению
к хлорному
электроду
сравнения.
Ёа платиновом
электроде
в тех
}ке
условиях
его
не бьтло.
Фчевидно'
он
св131н
с
рас-
йБ'Б.!""*
молибдена
3а
счет
реакции:
&1о1,1*30{+:мо3++3[-]3+'
Ёаде,<"ос'ь
(в
пределах
соть1х
долей
вольта)
потенциометрического
метода
подтвер)кдается
ре3ультатами-
и3мерений
окисли'гельно-восстано_
вительного
потенциала
с1тстёмьт
т]3+
|т|2+
в
расплавленной
эквимольной
;й;
*а€1-(61
[373].
€огласно
им
в
интервале
7|1-в37"с
условнь|й
формальньтй редокс-потенциал
остается
практически
неи3меннь|м
и
имеет
Ёейин"ну
-[,726+0,005
с
по
отношению
к хлорному
электроду
сравне-
12
м.
в.
€мирнов
165
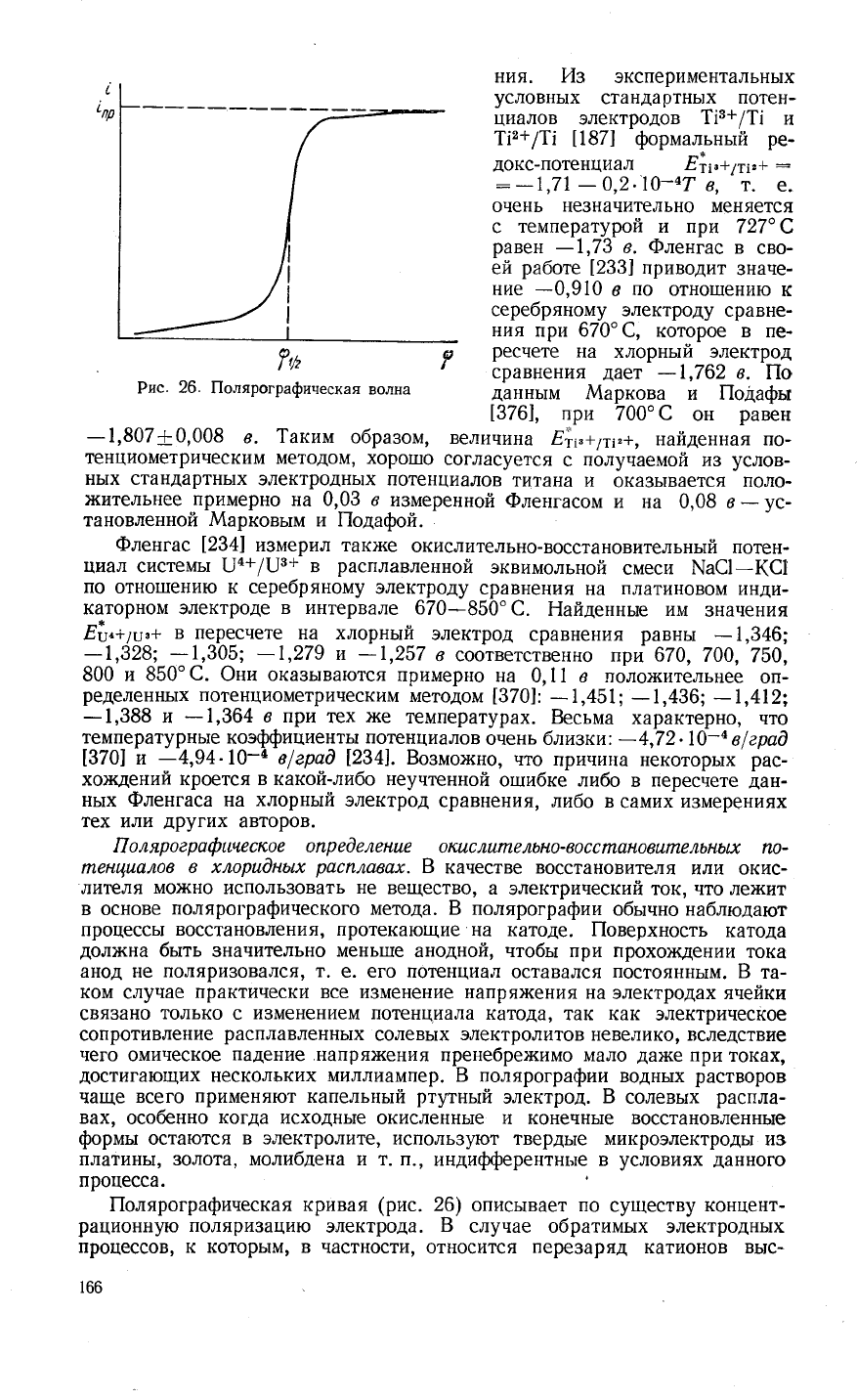
7,п
Р
Рис.
26.
|1олярографическая
волна
ния. Аз
экспериментальнь]х
условнь1х
стандартнь]х
потен-
циалов
электродов
11з+/1|
|\
17э+
11|
|187]
формальньтй
ре_
докс-потенциал
Ё\7,+117"+
:
:-\,71-0,2.'\0_47
в, т.
е.
очень незначительно меняется
с
температурой и при
727'с
равен
-\,73
в. Фленгас
в
сво_
ей
работе
[2331
приводит
3наче_
ние
-0,910
с
по
отно1пению
к
серебряному электроду
сравне_
ния
при 670'с,
которое в пе-
ресчете
на хлорньтй электрод
сравнения
дает
-\,762
в.
|[о
данньтм
&1аркова
и |-[одафьп
[376],
при
700" с
он
равен
-1,807+0,008
в.
1аким
образом,
величина
Ё17"+1тл"\,
найденная по-
тенциометрическим методом' хоро|по
согласуется
с
получаемой
из
услов-
нь1х стандартнь|х
электроднь]х потенциалов
титана
и
ока3ь1вается
поло_
х(ительнее пр_имерно
на 0,03 6
и3меренной
Фленгасом
и
на 0,08 с
_
ус-
тановленной йарковьтм и [1одафой.
Фленгас
[234!
измерил такх{е
окислительно-восстановительньтй
потен_
циал
системьт 1]4+/1]3+ в
расплавленной
эквимольной
смеси \а€1_(€1
по отно!пению к серебряному
электроду
сравнения
на
платиновом
инди-
каторном электроде
в
интервале 670-_850'€.
Ёайденнь:е
и1\,|
3начения
Ё|1,+1ц"+
в пересчете
на_ хлорнь1й
электрод
сравнения
равнь!
_1,346;
-1,328;
-!'305;
-|,279
и
-7,257
6 соответстве}{но
прй 670, 700,
75о,
800
и 850'с. Фни оказь:ваются
примерно
на
0,11 а полох{ительнее
оп-
ределеннь|х
потенциометрическим
методом
[370]:
-
1,451;
_
1,436;
_\,412;
_1,388
и
_1,364
в лр\4
тех
>*(е
температурах.
3есьма
характерно'
что
температурньте
коэфициентц
потенциалов
очень близки:
_
4,7
2.
!0-ц
в
|
ера0
13701
и
-4,94.\0_&
в|ера0
[234].
3озмох(но'
что
причина некоторь!х
рас-
хох<дений кроется
в
какой_либо
неучтенной
оп:ибке либо
в
пересчете
дан_
ньтх Фленгаса на
хлорньтй
электрод
сравнения' либо
в
самих
и3мерениях
тех
или
других
авторов.
1оляроераф![цеское
опре0еленше
-
окшсл!!1т|ельно-восс1/!анов!|/пельнь|х
по-
!пенцшалов
в хлорш0ньсх
распла1}ах.
Б
качестве восстановителя
или
окис-
лителя
мо'(но
исполь3овать
не
вещество'
а
электрический ток' что ле)кит
в основе
полярографического метода. Б
полярографии
обьтнно наблюдают
процессьт
восстановления' протекающие
на
катоде.
|[оверхность
катода
дол}кна
бьтть
значительно меньше анодной, чтобьт при прохо)кдении
тока
анод не
поляри3овался' т.
е. его ||Фтё[[}|8;]1
оставался
постояннь|м.
Б
та-
ком
случае
практически все и3менение напря)кения
на
электродах янейки
свя3ано
только
с
и3менением
потенциала катода'
так как
электрическое
сопротивление
расплавленнь1х
солевь|х
электролитов
невелико' вследствие
чего омическое
падение
'напря}кения
пренебре}кимо мало
да}ке
при токах'
достигающих
нескольких миллиампер. Б полярографии
водньтх
растворов
чаще всего
применяют
капельньтй
ртутньтй
электрод.
3
солевь:х
распла-
вах,
осоФнно
когда исходнь!е
окисленньте и конечнь1е восстановленнь1е
формы
остаются
в электролите'
используют твердьте микроэлектродь|
и3
платиньт' 3олота, молибдена и т. п.,
индиферентнь]е в
условиях
данного
процесса.
|1олярографическая кривая
(рис.
26)
описьтвает по
существу
концент-
рационную
поляри3ацию
электрода.
в
случае обратимьтх
электроднь!х
процессов'
к
которь1м'
в частности' относится пере3аряд катионов вь'с_
166

1ших
валентностей
до
ни31ших
в хлоридных
расплавах
при
высоких
тем-
пературах'
ей отвечает
аналитическое
уравнение
3ависимости
потенциала
9
индикаторного
электрода
от
тока |:
9:Ё&",*:м
.**+.Р--:'].'**
[
Рм'^+
\'/2
'щ,
(п_п)!
7""^4
\
о*-
)
!
'
г
де
Ё%"'+
умеп*
_
стандартнь1й
окислительно-восстановительный
потенциал
протекаюшей
на
электроде
реакции:
!!1е?р!"',>*(п_
гп)е-
(электрол)=
:,|[е6*.,'л,
|_коффициенть|
активности,
А
|
__.коффичиент
дифузии
указаннь:х
ионов'
|,'
_
предельньтй
дифузионнь:й
ток. в
разбавленных
растворах,
где
коэфициентьт..
активности ионов
достигают
своих
пре-
дельнь:х
постояннь1х
знанений,
а
коэфициенты
дифузии
практически
не 3ависят
от
концентрации'
уравнение
полярографической
волнь1
имеет
вид
дт
9
:
9
у
;
у
*
{,
-
*7
.|п'',,|'
.
8ходящая
в
него постоянная
величина
91!2
равна
г0
'^-++__$-
1,
|й"'+
+
Рт
1,
!*"'*:
9
',
':
Ё
м",+
1
м.'',
т -г
|
-
тп-'1
Р
','
п;*,
@
-
.Ё
',,
'*",*
:
Б!,ц{+
;м"**
+
т#
^п''
#
.
Фна
отвечает
потет{циалу точки
переги6а
полярографической
кривой
(р
_
!),
которая
ле}кит на
половине
вь1соть1
полярографической волнь].
|1оэтому
р--^
на3ь1вается
поте[{циалом
полуволнь|.
' '\/2
(ак
видно
и3
последнего вь1рах(ения'
потенциал полуволньт
3ависит
от
условного
фрмального
окислительно-восстановительного
потенциала
системь!
}19'+!\:!9гп+
и
отношения
коэффишиентов
диффузии
ее ионов.
|1оследнее не
превы1пает 10,
потому
что в хлориднь1х
расплавах
коффи-
циенть1
дифузии
ионов имеют
величиньт
одного
порядка
(70_6
см2|сек),
а катионь|
ни3ших
валентностей
диффундируют'
как правило'
бьтстрее,
чем вь!с1пих'
в
ре3ультате
более
слабьтх
связей с анионами хлора
[379!.
|1оэтому
условнь|е
формальньте редокс-потенциалы
отрицательнее
опРде-
ляемь]х на
опь|те
потенциалов
полуволнь}
подярографинеских кривь1х
на
величину
не
больтпе
1'984
.\0_ц7
в.
Расхох<дение
мех(ду
ними тем
мень-
1ше'
чем них(е
темпе{.''!^, больтпе
''с'о
п_г/'
электронов'
участвую-
щих
в
реакции
окисления-восстановления'
и блих<е
к единице отно|пение
#
(огда
оно
равно
1,
91р:Ё'у"'+4]т1еп*.
|м.'*
3десь
нет
надобности более
полробно останавливаться на методиче-
ских
и
теоретических
вопросах полярографии
в
расплавленнь1х
солевь1х
средах'
поскольку
они
детально
рассмотрень|
в книге
.[.елимарского,
[ородь:ского
[330].
€.педует ли1пь отметить'
что в настоящее время |1Ф-
лярографивеский
метод исполь3уется
для
определения
числа электронов'
участвующих
в соответству.юшей
реакции
окисления-восстановления'
и3
наклона
графика
9
-18
'"';'
и приблих<енной оценки
условных фр-
мальньтх
редокс-потенциалов'б",
'',р''ки
на
ра3ницу
в
скоростях
диф-
фузии
ионов
вь1с1ших
и ни3|пих валентностей.
1ак,
Бабоян, }илл и
Бейли
исполь3овали
полярографинеский
метод
для
изучения электРохимического
поведения
титана
[зьэ], циркония
и гафния
[362]
в
расплаЁленной
эвтек-
тике
!!(1_((1
при 450-550'€.
14м не
удалось
получить на поляро-'
12* 167

граммах
волны, отвечающие
восстановлению н14+
до
н|2+ и
да>ке
7гц+
Ёо
7г2+
при 450'€, хотя эти электроднь1е
реакции
отмечень1
другими
исследователями.
[илл с сотрудниками
1137,240!
исследовали
поляро-
графинески
электрохимическое
поведение
ура1|а
и тория
в
расплавленнь|х
эБтектиках
1м19€1'_}.,1ас1_кс1
и ||€!-(€1.
Фпре0еленшё
окшслшпоельно-восс[т!ановш/пельнь|х
по/пенццалов
хлори0ньсх
расплавов
по
равновесному
0авленшю
хлора
на0 ншмш.
Редокс-потенциал
любой
системь1
11':[9и+/}:[9пз+
в среде
хлориднь1х
расплавов
дол)кен
бьпь
равен
ее окислительно-восстановительному
потенциалу:
Ёу1п*7уеп*:
Ёст"|ст-,
или
Ё!;6''+
7
у.*| +
#и
#
:
Ё3т,тст-
+
#'"
ъ
Ёсли
полох<ить
условно
потенциал
хлорного
электрода
в любь:х хлорид-
ных
расплавах
при всех температурах
и
давлении
хлора
в
газовой
фазе
\ агп'м
равным
нулю,
а активность
его
ионов
1су-:|, то получается
выра)кение
для
формального
окислительно-восстановительного
потен-
циала
Ё!;1",*1р1"-*
:
+
\п
рст,
-'%'^
#.
Б
расплавах'
где
мольнодолевые
концентрации
ионов
йе'+ и /у1е-+
|{е
превь|шают
(2:3).10_2,
их коэффишиентьт
активности остаются
постоян-
нь1ми
в пределах
точности
и3мерения
потенциалов
до
ть1сячных
долей
вольта.
[1оэтому
полученное
вь|ше
уравнение
преобразуется в
равенство:
Ё|,ц.'*ууу.-*:+1прс:,
-
'+'т,$|
,
которое
мо>к1|о
исполь3овать
д/|я
эксперимента,/1ьного
определения
ус/юв-
ных'формальных
редокс-потенциалов.
6
этой
целью
необходимо 3нать
равновесное
давление
(Рст",
агпм)
хлора
_над
хлориднь|м
расплавом
с
дан-
ным мольным
отно1пенйем-окисленной
(йе'+1
и
восстановленной
(?!1е-+1
форм
металла.
Ёа опьтте
3цачительно
проще
задавать
и поддерх(ивать
неизменнь1м
давление
хлора
в его
смесях
с аргоном
и находить
аналитически
отно-
шение
[&1е,+):
[йеп+].
9тобьт обеспечить
наиболее
быстрое
и ]]олное
установление
равновеёия
мокду
газовой
и солевой
фазами,
смесь
€1'+Аг
пропускают
чере3
расплав'
контро{цруя
парциальное
давление
хлора
в^ней
на входо
и
Ёыходе
ячейки.
(огда
оно
становится оди|{аковым'
т. е.
поглощение
или
вь|деление
хлора
прекращается'
продувание
га3о-
вой смеси
прекращают'
расплав
быстро
охла}кдают
и
анали3ируют
на
содер}кание
йе,+
и
&1е*+.
1ак
как
в
расчет
входит
отно1пение
их кон-
центьаций,
уменьшение
общего
содерх(ания
метадла
в
ре3ультате
частич_
ного
уноса
паров его
хлоридов_
га3овым
потоком
не ска3ь|вается
на
точ'
ности
ре3ультатов
и3мерений.
Бпкно,
чтобь:
бьтло
достигнуто
равновесие
реакции
йе,+
*(п
_
гп)(1_+йеи+
*=€1,
<".л.
|!арциальное
давление
хлора
подбирают
таким'
при
котором-
мольное
отнош6ние
[&1е,+]:[&1е'+]
полунается
во3мо}!{но
близким
(
1,
чтобь:
свести
к
минимуму
отшибки,
свя3аннь|е
с
неточностями
в аналитическом
опоеделении
содерх<ания
окисленной
и
восстановленной
форм
в
солевом
р|ё,!,ве.
Ёстествённо'
чт0 оно
долх(но
бьтть
достаточно
вь|соким'.
чтобь:
офспечить
вполце
наде}|шую
до3ировку
хлора в га3овой
смеси
€1'+Аг.
168

?аким
о6разом,
этот
метод
измерения.
применим
для
т91(
систем'
редокс'
потеншиаль1
*'''р,,}
;;й;_;
;у'.
(л&ат
в
интервале
от
0
до
-0,3
а
по
отно1пению
к хлорному
электроду
сравнения)'
к
ним'
в
частности'
относятся
окислительно_восстано""'-'''й'е
сис{рмы
р9в+/!'е2+ 1358]
||
р,с+7Рш3+.
$
2.
}словнь[е
форма^ьнь[е
окис^ите^ьно'
восстановительнь[е
потенцпа^ь[
спстем
катиовов
вь|с|цих
и
низ[цих
ва^е[|тностеи
в хлоРиднь[х
расп^авах
3авуссшмоспь
цсловнь!х
формальньсх
ре0окс-погпенццалов
о/п
ра0шцса
кап1шоно
,,',-р''*"Бр)й''"
'
в'
хлорцань!х
расплава.и.
Фкислительно-восста-
!'"""*'"'"'й
йотенцйал
чисто
хлориднь!х
расплавов
определяется
0т[1о-
;;;ъ;;*;ивностей
катионов
вьтс1пих
и
нйзш:их
валентностей,
входящих
в
их
состав.
Б слунае
разбавленнь1х
растворов
в
уравнение
Ё
м"'*
|
м"^+
:
Ё?в",*
|
м.**
+
+%'
0_
ц
т
тв
9_
вместо
активностей
мох<но
непосредственно
подставлять
их мольнодолевые
концентрации
[йел+]
и
[&1е'+],
так
как
$'
г0
+
,',98.,
.1о_4т:9-1д"'-1
:Ё'м"'*|м.п.1
:сФп51
Ём.'*|м.п*
'
@_по)
-
|1'"-*
д}е.-
'
/!||е
для данной
температурь!
и солевой
средьт:
Ё
м.'+
|
м.^+
:
Ё'^"п
+
1
у"п*
+
++.
1 0_4т
:в
$.
(огдавкачествесолей-растворителейберутрасплавленнь1ехлориды
щелочнь1х
металлов'
многозарядные
катионы'
как
правило'
образуют
с
анионами
хлора
комплекснь|е,
обьтчно
анионнь1е
группировки'
относи_
тельнаяпрочностькоторь1хво3растаетпомереувеличениярадиусакати-
она
щелочного
металла.
йменно
этим
объясняется
смещение
р1"19:_':е}
потенциалов
металлов
в сторону
более
электроотрицательньтх
3начении
в
ряду
|1с1
_
1'{а€1
-
кс1
-
-'&ьс1
_
€з€|.
}словньтй
формальнь:й
окислительно-
восста
новительнь]й
потенциал
Ё"м"'*|м'**
зависит
от
от_
но1цения
коэффишиентов
ак_
тивности
катионов
вьтсш:ей
и
низтцей
валентности
в
разбав-
леннь|х
растворах.
Ёсли
бьл
они
менялись
одинаково
с
и3менением
радиуса
катионов
щелочнь1х
металлов'
то
Ё'м"'*/м"^*
не
3ависел
бьт
от
компо3иции
солевой
средь1.
Ба
самом
деле
хлориднь1е
комплексь]'
образуемьте
поли-
Рпс'
27.
3ависимость
условнь|х
формальных
окислительно-восстановительнь|х
потенциалов
й;;т7м',+
(1).
Ре,*/Ре+
(3),
т|3+/т19+
(4).
нт4+/н|*'(ф'
2гц*
|7г2*
(6), 8е2+/8е+
(;),
тьд+:ть'+
(8) от
обратной
величинц
радиусов
катионов
щело,нь'х,
а||3*|\|2*
(2|
йелочноземельных
металлов
в
расплавах
их
хлоридов
е
*
Ё''"
\
!
валентнь|ми
катионами'
упрочняются
с
увеличением
радиуса
катиона
соли_раство-
рителя
тем
сильнее'
чем
вь11|]е
их
ионнь1и
момент'
169

т.
е.
чем
больще
их 3аряд и ме!|ь1пе
радиус.
1аким образом,
от!!о1цение
коэффишиентов
активности,
|!^-'4|й'^*,
уме}!ьтшается
в
ряду
от
!!€1 к
€в61
и окислите/|ьно-восстановительные
потенциаль| становятся
более
электроотрицательными.
(ак
и в случае
условных
стандартнь!х
электродных
потен1[иалов
в
пределах
ош:ибок экспериментальных
определений
наблюдается линей-
ная зависимость
между
условными
формальньтми
редокс-потенциалами
и
обратными
величинами
радиусов
катионов солей-растворителей
(рас_
плавленных
хлоридов
щелочнь|х
п{еталлов
и их смесей).
3то
мо}кно видеть
на
рис.
27, где
приведены
экспериментальньте
значения
при 1100"(
для
систем
}:[9з+/]г:[6я+, Ре2+/Р9+,
113+/1|2.
(пля
расплавленной
эквимольной
смеси
|ч1а€!
-
(€1
точка
в3ята
из
работьт
&1аркова и
|{одафьт
[376],
7!1++|7гь+, н[4+/н[8+,
}99+/$9+
и
1[:4+/1[а+.
|-|рямь:е отвечают
следу-
ющим эмпирическим
уравнениям
потенциалов
по
отно1пению
к
хлорно]{у
электроду сравнения]
Ё]ц',+4м',+
:
_2,15+0,84|
г^+ в; Ё]1'17,1'1:
-2,60+0,66|г6
в;
8}.я17р-+:
_2,22у0,54|
г*у в;
Ё]",*/в"+:
-3,18+0,84|г*+
в;
Р\'"+тт:2*:_2,3640,60/г*4
в; Ё},,17','1_-2,93+0,45|г*4
в.
Ё),,4
1
','1
:
_2,42+
0,48/г*1
с;
Бысшие
валентнь1е
фэрмы
катионов
3начительно
стабили3ируются
в
ре3ультате
комплексообразования.
!,ействительно'
при
переходе от
[-161 к
€з€! смещение
окислительно-восстановительнь1х
потенциалов
до-
ходит
до
0,3_0,4
в. €толь существенньтй
эффект следует
учить|вать
при
подборе
компо3иции
расплавленных
солевь1х
электролитов,
особенно
для
электролитического
рафинирован!1я
металлов'
где электроли3
по-
ряду
принйн
(вьлход по току' структура
катодного
осадка)
целесообра3нее
проволить
в средах
с
преобладанием
г!и3к1.1х
валентнь1х
форм
катионов.
€
этой
точки
зрения
особого внимания
з-1слу>кивают
р.асплавь|
хлоридов
щелочно3емельных
металлов. Ёа
рис.
27
пунктирной
линией
пока3ан
условнь:й формальный
редокс_потенциал
т1а+/т|2+
в
расплавленнь!х
Ба€1',
€а€1,
и й9€1'.
Бго значения
более
электрополо}кительны,_
_че}-
в
распла-
вах хлоридов
щелочнь|х
металлов:
примерно
на
0,2
в
^Р
щвс1,
по
срав'
нению
о !1с1
и на
0,4
с в
Ба€1, по
сравнению
с
€з€1.
3ависимость от
обратной
величины
радиуса
катионов
двухвалентнь|х
металлов 3десь
так>ке
линейная'
однако
менее
вь|ра}кена'
чем
в случае
щелочнь1х:
Ё},,17.,'д:
-1,7||$,26|
г"ау
в,
что объясняется
более
слабым
комплексообразованием
в
расплавах
хло_
ридов
щелочно3емельных
1!1еталлов.
Б
ряде
случаев-катионь|
солей-рас-
}ворителей
могут сами
вь|ступать
в
роли
комплексообра3ователей
в соче_
та}|ии
с солями'
катионь|
которых
имеют
мень!.пие
ионньте
моменты.
Ёа
примере системы
т18+/т12+
видно'
что вь|с1пие
валентнь1е
формь:
кати-
онов
восстанавливаются
до
ни31пих
легче
всего
(при
наименее
электро'
отрицательнь1х
потеншиалах)
в среде
расплавленного
м8с12^и
труднее
всёго
(при
наиболее
электроотрицательйь:х
потенциалах)
в
€з€1.
Фкйс)шпоельно4осс/пановшп!ельнь|е
по/пенцшаль[
п!ш1пана
в
хлорш0ньсх
рас-
|'лс|вах,
1итан
мо)кет существовать
в
двух-'
трех-
и четь1рехвалентном
состоянии.
!(атионы
1!2+,
т!3+ и
т14+ не существуют
в элементарном
состоя}{ии
в
хлоридных
расплавах'
а
обра3уют
с
анионами
хлора
комп_
лексы:
т|с1',
тёп?_,
т1с1?_,
т1с13_,
т!с1;
и
1!613-.
Б
двух
последних
преобладают
ковалентные
свя3и
и
равновесие'
цапример
2т!€13-+
+п+
=
2т1с14+&с11_
(где
&*
_
катион
щелочного
металла),
при вь1соких
|7о
