Смирнов М.В. Электродные потенциалы в расплавленных хлоридах
Подождите немного. Документ загружается.

'1
аблица
51
Фкислител
ьно-восстановительнь|е
потенциаль!
й-Б[асп-эк€1
и
давление
насьш{енного
пара
(о)
растворв
[(-[(€!,
(_!ц|а€|-(€!'
калия
над
ними
к_3ь[с|-2кс|
к_шас|_кс|
Р"'
хм
рт.
ст'
0-6
0-5
0-4
0-з
0-2
0-1
^4еп+
/ме|п+
!
1 100'к
!
1 200' к
эоо" к|:ооо"к
!
!-1,48
!-1.69
|-т.эт
|-:,тз
\-2,35
\-2.57
|-э'тв
!-3,00
\-3,22
0
00
-1
,16
-1,40
-1,63
-1,87
-2,11
-2,35
-2,59
-2,82
-3,06
-1,82
-2,о2
_, 9,
-2,42
-2,62
-2,82
-3,01
-3,21
-3,41
-1,51
-1,72
-1,94
-2,17
-2
,38
-2,60
-2,81
-3,03
-3,25
-1,20
-1,44
-1,67
-1,91
-2,15
-2,39
-2,63
-2,
86
-3,10
-2,31
-2,19
-2,11
-2,06
-1
,89
-1,69
-\,75
-1,68
-1,68
-1,72
-\,67
-1,69
-1,60
-1,59
-1,52
-1
,38
-1,06
-1,08
-1,04
-0,73
-о
'7\
-0,69
-0,49
-0,58
+0,03
0,ф
о
о
-2,94
-3,1
-о'
-3,41
-3.57
-2,15
-2,33
-2,51
-2,68
-2,86
-3,04
-3,22
-3,40
-3,58
-1
,84
_2,о4
_9 94
-2,44
-2,64
-2,83
-3,03
-3,23
-3,43
-1,52
-1,73
-1,95
-2,17
-2,39
-2,61
-2,82
-3,04
-3,26
-2,59
-2,43
-2,33
-2,28
-2,17
-2,11
-2,06
-2,02
-1,97
-1,94
-1,93
-1,91
-1,88
-1,91
-1,82
-1,67
-1,53
-1,36
-1,34
-1,05
-0,94
-0,89
-0,
89
-0,82
-0,09
0'ф
-\,21
-1,45
-1,68
-\,92
-2,16
-2,40
-2,64
-2,87
-3,
11
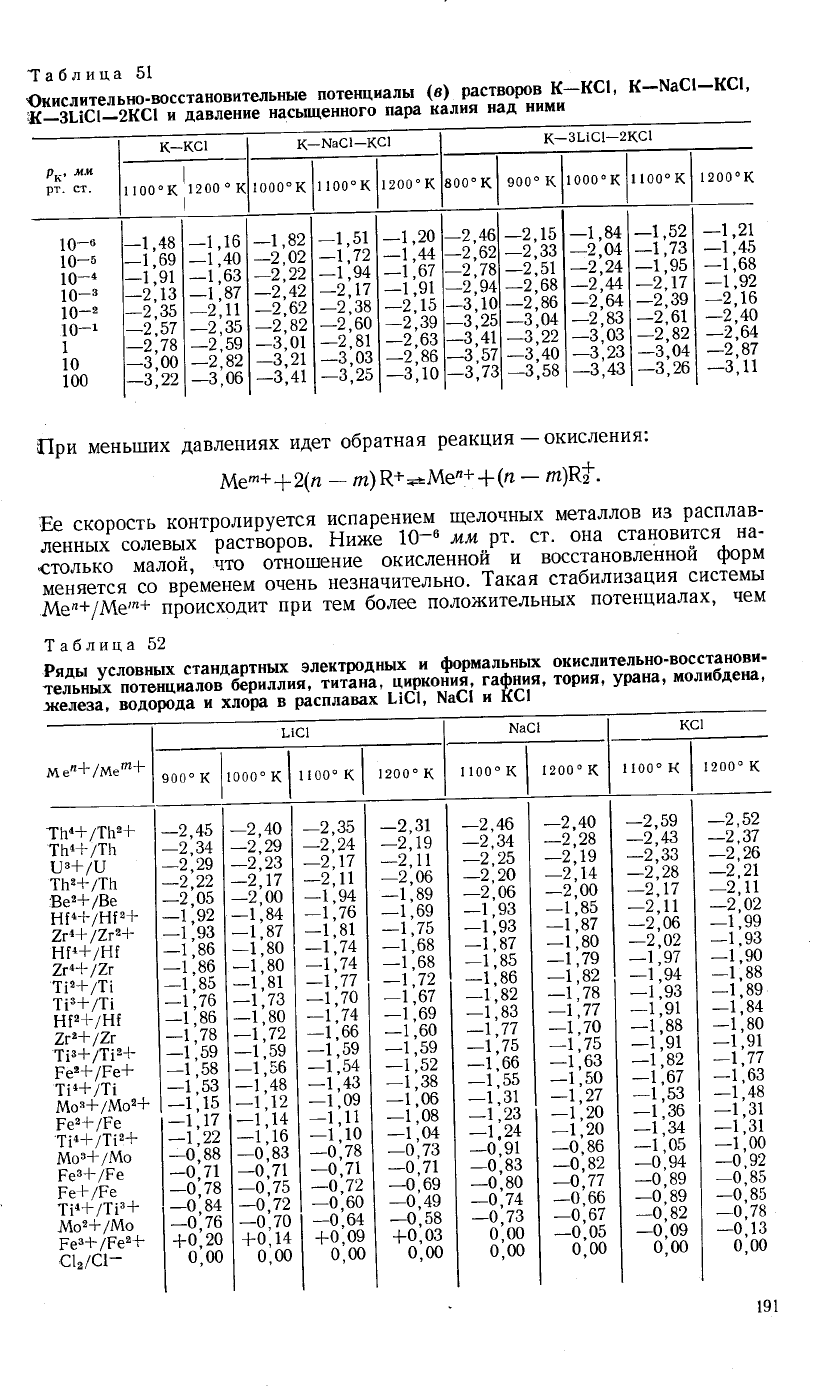
[ри
меньш:их
давлениях
идет
обратная
реакция
-
окисления:
ц"сп+
1
2(п
-
гз) Р+
=..&1
е'+
*
(п
_
и)к*.
€е
скорость
контролируется
испарени^ем щелочнь|х
металлов
и3
расплав-
леннь1х
солевь1х
р'с'Б6ро,.
Ёийе
7|-6
мм..рт'
ст'
она
становится
на_
столько
малой,
что
отно1пение
окисленной'
и
восстановленной
форм
меняется
со
временем
очень
не3начительно.
1акая
стабилизация
системь|
й"фм"-*
про"с*одит
при
тем
более
полох(ительньтх
потенциалах'
чем
1 а6
лица
52
.Рядь:
условнь|х
стандартнь1х
электрод,ч__т
фрмальнь:х
окислптельно'БФ€€1анФБи'
тельнь[х
потонциалов
бёриллия,
титана' шцгкоЁй,
!афния,
тория'
урана'
молибдена,
]келе3а,
водорода
,
*й'Б"
Б
р1','а."*
!-!с|'
шас|
и кс|
ь1с1
1200"
к
|!00ок
1200"
к
1200" к
тп4+/тн,+
тп4+/ть
{_13+/(-,
тп!+/тп
8е'*/Бе
н|4+/н|?+
7гц\
/7г2*
н|{+/н!
7[4+
/7г
т|2+/т!
т13+/т|
н|!+/н{
2г2*
/7г
т!3+/т|,+
Ре'*/Ре*
т|4+ /т|
мо3+/мо2+
Ре2*/Ре
т!4+/т|'9+
[4оз*/&1о
Ре3+/Ре
Ре*/Ре
т!4+/т!3+
.]!1о2*/.1!1о
Рез*/Ре2*
,с127с1_
-2,45
-2,34
_9 ,9
_, 9,
_2'о5
-\,92
-1,93
-1
,86
-1,86
-1
,85
-1,76
-1
,86
-1,78
-1,59
-1
,58
-1
,53
-1
,15
-\,17
-1,22
-0,88
_о,7\
-0,78
-0
84
-о:76
+0,20
0,Ф
-2,35
_, ,[
-2,17
-2,11
-1,94
-1,76
-1
,81
-\,74
-\,74
-1
,77
-1,70
-1,74
-1,66
-1,59
-\,54
-1,43
-1
09
-1,::
-1
,10
-0,78
-0,71
-о,72
-2,46
-2,34
-2,25
-2,2о
-2
'о6
-1,93
-1,93
-1
,87
-1
,85
-1
,86
-1,82
-1
,83
-1,77
-1,75
-1,66
-1,55
-1,31
-1,23
-1"24
-0,91
-0,83
-0,80
-о,74
-0,73
0,00
0,00
-2,4о
-2,28
-2,19
-2,14
-2,00
-1
,85
-1
,87
-1
,80
-1,79
-1,82
-1,78
-1,77
-|
'7о
-1,75
-1,63
-1,50
-1,27
-1,20
-1,20
-0,в6
-0,
82
-о,77
-0,66
-о,67
-0,05
0,00
-2,52
-2,37
-2,26
-2,21
-2,11
-2,02
-1,99
-1.93
-1,90
-1
,88
-1,89
-1,84
-1
,80
-1,91
-1,77
-1,63
-1,48
-1
,31
-1,31
-1
,00
-0,92
-0,85
-0,85
-0,78
-0,13
0,00
-0,60
-0.64
+0,09
0,ш
19|
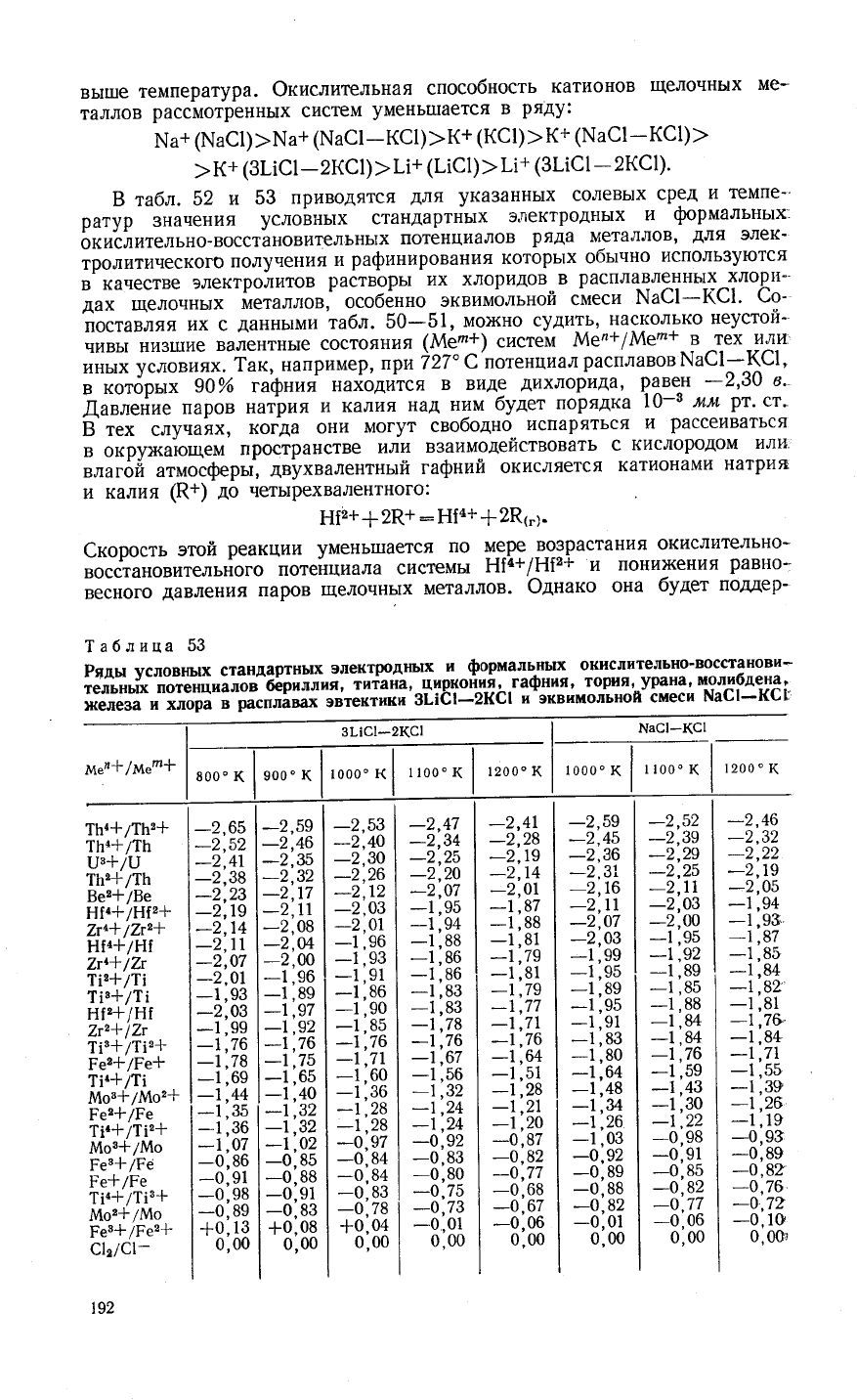
вь1ше
температура.
Фкислительная
способность
катионов щелочнь|х
ме-
таллов
рассмотренных
систем
умень|пается
в
ряду:
ц2+
(\а€1)
)
ц2+
(!х1а€1
-кс1)
>
к+
(кс1)
>
к+
(1'{а€1
-
(€1)
>
>к+
(3!1с1-2кс1)>||+
(!|с1)>|1+
(3!|с1-2кс1).
3 табл.
52
и 53
приводятся
для
ука3аннь|х
солевь|х
сред
и
темпе-'
ратур
3начения
услов|{ьтх
стандартньтх
электроднь|х
и
фрмальньтх
окислительно-восстановительнь]х
потенциалов
ряда
металлов'
для
элек_
тролитическог0
получения
и
рафинирования
которь1х
обь:чно
исполь3уются
в
качестве
электролитов
!''астворь1
их хлоридов..в
расплавле-ннь1х
тлори-
дах
щелочнь,х
*"'''д'",
особ6нно-эквимольной
смеси
}х{а€1_(€1.
€о_
поставляя
их с
даннь1ми
табл.
50_51,
мох(но
судить'
насколько
неустой_
чивьт
низ|'пие
валентнь]е
состояния
(&1е'+) систем
.,[:]9л+/}:1ег2+
в тех
или'
;;;;
й;;"х.
так,
"айрй*ер,
,ри )
27' €'потенциал
расплавов
1']а€1_1(€1'
;'йы;;;-
эбй
''р""я
на*оди1ся
в виде
дихлорида'
Р1ве]
_2,30
в.
,|1авлеЁие
паров
натрия
|1
кал|1я
над ним
булет
порядка
|0_3
мм
рт'
ст''
Б тех слунаях,
когда
они
могут
свободно
испаряться
и
рассеиваться
в окрух(ающем
пространстве
или
в3аимодействовать
с
кислородом
ил|\
влаг6й
атмосфрьт,
двухвалентнь:й
гафний
окисляется
катионами
натрия
14
кал||я
(&+)
до
четь1рехвалентного:
ц1я+42&+:Ё|ц+{2Р1"1.
€корость
этой
реак:]ии
умень1шается
по
у_е_ре.-в_99Растания
окислительно*
восстановительного
потенциала
системы
н|4+/-н12+
и
пони)кения
!8вно1
весного
давления
паров
щелочнь!х
металлов.
@днако
она
булет
поддер-
?аблица
53
Ряды
условнь:х
стандартнь|х
9лектрднь|х
л
формальнъпх
о-кис_лительно'Б@€€!8нФБи*
т#Ё"*;1};ъ{"1'Ё#*#*###',11вт:у*ё[}ф###:11'ъ'*ук:3;'1.?*ёРЁ3;
йеии*
!__
/м.^*
|
,'..
^
31 |с!_2кс1
ть4+/ть'з+
ть4+/ть
|-'3+/1,
тьз+/ти
3е2*/Бе
н'{+/н{2+
7гц*
/7г2*
н|4+/н|
7г.*
/7г
т1!+/т!
т1з+/т|
н"+/н|
7г2*
|7г
т;8+/т|,+
Ре9*/Ре*
т!{+/т|
,1!1ов*/йо2*
Ре2*/Ре
т|1+
/т|2+
1!1о3*/1!1о
Рез*/Рё
Ре*7Ре
т!{+/т|з+
йо2*/.]!1о
Ре3*/Ре2*
с117с1-
-2,65
-2,52
*2,41
-2,38
-2,23
-2,19
*2,14
-2,11
-2,07
-2,01
-1,93
-2,03
-1,99
-1,76
-1,78
-1,69
-7,44
-1,35
-1,36
-1,07
-0,86
-0,91
-0,98
-0,89
+0,13
0,00
-2,59
-2,46
-2,35
-2,32
-2,17
-2,\\
-2,08
_2'о4
-2,00
-1,96
-1
,89
-1.,97
-1,92
-1
,76
-1,75
-1,65
-1,40
-2,53
_2,4о
-2,30
-2,26
-2,12
-2,03
-2,07
-1,96
-1
,93
-1,91
-1
,86
-1,90
-1
,85
-1,76
-1,71
_1,Ф
-1,36
-1,28
-1,28
-0,97
-0,84
-0,84
-0,83
-0,78
+0,04
0.00
-2,47
-2,34
-2,25
-2,20
-2,47
-1,95
-1
,94
-1
,88
-1
,86
-1,86
-1
,83
-1,83
-1,78
-1
,76
-1,67
-1,56
-1,32
-1,24
-1,24
-0,92
-0,83
-0,80
-0,75
-0,73
-0,01
0'ф
-2,41
-2,28
-2,19
-2,14
-2,01
-\,87
-1
,88
-1
,81
-1,79
-1,81
-\,79
-1,77
-1,71
-\,76
-1,64
-1,51
-1
,28
-1,21
-1'2о
-0,87
-0,82
-0,77
-0,68
-0,67
-0,06
0,00
-2,59
-2,45
-2,36
-2,31,
-2,16
-2,\\
-2,07
-2'о3
-1
,99
-1,95
-1
,89
-1,95
-1,91
-1
,83
-1,80
-1,64
-1,48
-1'и
-1,26
-1,03
-0,92
-0,89
-0,
88
-0,82
-0,01
0'ш
-2,52
-2,39
-'
'о
-2,25
-2,11
-2,03
-2,00
-1
,95
-1,92
-1
,89
-1,85
-1
,88
-1,84
-1
,84
-1,76
-1,59
-1,43
-1,30
-1.22
-0,98
-0,91
-0,85
-0,
82
-0,77
-0,06
0,00
-2,46
-2,32
_9 ,,
-2,19
-2,05
-1,94
-1,9&
-1,87
-1
,85
-1,84
-1,82
-1,81
-1,76
-1,84
-1,71
-1,55
-1,39
_|,2в
-1,19
-0,9&
-0,89
-0,82
-0,76
-0,72
-0,10
0,001
-1,32
-1,32
-\,02
-0,85
-0,88
-0,91
-0,83
+0,08
0,00
192

д(иваться
на
достаточно
высоком
уровне'
если
связывающие
их окисли_
тели
имеют
доступ
к самой
поверхности
расплава
Ёизшие
валеглтные
состояния
подобных
систем
более
устойкивы
:в
расплавах
[|€[ и
эвтектике
|!с1-кс1
по
сравнению
с
(€1,
|',1а61_(€!
и'
в
ософнности'
с ]:{а€1.
|4нтервалы
и3менения отно1цений
коншентраций
оки'сленной
Р| БФ€€1а:
яовленной
форм,
[^-ц9'1]/[ме'+],
ограничиваются'
с одной
стороны'
выделе'
.нием
металлической
фазы,
когда
редокс-потенциал
достигает
величинь[
равновесных
электродных
потенциалов:
Ё'м''*
]м.^++
("+1"
##
:
Ё]т",*,,м'
*{
:'
1м"'*]
:
Ё}-'9'..'
*
+{
1'
[;!1е'*],
п!1
с
лругой
_
улетучиванием
|13
расплава
хлора' когда
его
равновесное
_давление
становится
вь!ше
поддер'(иваемого
над
расплавом.
Редокс-потенциал
расплавов'
которь1е
содерх(ат
несколько
окисли-
'тельно-восстановительньтх
пар'
дол}кег{
удовлетвор
ять
равенству
Ё'*,"!'..:
0ме!:*/ме|:*
:
Ё
*';,*7
^'у,*:
Ё
ц",с*|
м"тс+:
еп+;в{'
}(акое-либо
и3менение
в отно1пении
концентраший
окисленной
и
восста_
яовленной
форм
любой
из
них вы3ывает
и3менения
в
отно1пениях
кон_
дентраций
остальньтх
пар'
так что
это
равенство
всегда сохраняется.
*
4. [ермодппамика
реакцшй
коррохгип
метад^ов
в хлорпдпь[х
расшдавах
&1еталль: самопроизвольно
растворяются
в хлоридных
расплавах
в
ре'
3ультате
в3аимодействия
с
их
компонентами'
способными
к
реакциям
окисления.
||о
своей
природе
окисле|{ие
представляет
собой
электрохи-
мический
процесс'
поскольку
металль[
переходят
в
р_асплавленную
соле_
вую
фа3у
! виде
ионов'
а
в качестве
окислителей
фполяризаторов)
выступают
катионы
водорода
или
других
металлов'
ософнно
более
элек-
трополох(ительных.
Б
рйде
случаей
окисление
происходит
под
во3дей_
ствием
растворенных
в
расплавах
кислорода^и
хл^ора'^
причем последний
мо)кет
6бразоЁ,тваться
1й 5!{ц
по
реакций:
4€1_*Фэ*2Фь_+2€|ь.
8,арактерной
особенностью
корро3ии
в
расплавле]{ных
хлоридах
при
вь!соких
температурах
является
отсутствие
каких-либо
заметнь:х
3атруд_
нений как
в
иони3ации
металлов'
так
и
пере3аряде
ионов
окислителеи
(Аеполяризаторов).
Бследствие
этого она
протекает
в
условиях,
бли3ких
к
равновесным'
а ее
скорость
контролируется'
в
основном,
дифузией
компонентов
соответствующих
электрохимических
реакший
мФкду
приле_
гающими
к
металлам
и
глубиннь1ми
слоями
расплавов.
1ермодинамика
корро3ии
металлов
в^
р_аспл^ав_леннь1х
хлоридах
иссле'
довал!сь
.[1иттлвулом с
сотрудшиками
[396_401].
Фни
рассмотрели
ряд
факторов,
могущих
ока3ь1вать
влияние
на
течение
процесса'
а
именно
электрохимическую
активность
(благородность)
металлов'
устойчивость
их
хлоридов'
прои3веде!|ие
растворимости
их
окислов
в
расплавах'
исходнь|и
окислитель!{о-восстановительный
потенциал
средь1'
присутствие
3агря3нений,
вклюная
воду.
'[{оррозшя
меп!аллов
в
роспловленнь!х
хлорш0ах
щелоцнь!х
по0
шйёрпной
агпмосферой.
металлы
корродиРучт
в
расплавах
д]\елоч1{ь!х
мегаллов
да>ке
в отсутствие
каких-либо
постоРонних
меп1аллов
хлоридов
окислите-
193

лей.
в
Роли
последних
вьтступают
['целочнь]е 1{атионы'
&+,
которые
при этом восстанавливаются
до
субионов,
&*:
ц9
1
2п&[,",*1
=*
1{е[$спл1
*
п&*1распл1
.
||одобньте
реакции
ид}т
с
любьтми металлами'
в том
числе и такими'
как
серебро
||20_!22|
и платина
[129].
Фни
прекращаются
ли!'|]ь
тогда}
когда
достигается
равновесие
мех{ду металлической
и солевой
фазами'
при котором электроднь1е потен'[иаль]
металлов
становятся
равнь1ми
окислительно-восстановительному потенциалу контактируюшцей
с ними
солевой
средьт
Ёд":Ёц+1ц*.
|1ри
мальтх концентрациях катионов корродирующего
металла и
субионов
щелочного
металла это
равенство
мо)кно
3аписать
в виде
Ё]'т"'+
/м'*{
1'
1м""*]
:
д!*:*Ё
+
$
:п
-+++
-- |''!
Р
[к}]
1ак как
в
подобньтх случаях
[&+]=1,
условнь[е
константь1
равновесия
этих
реакций
определяются
ра3ностью
ме}кду
стандарт}{ыми электроднь1-
мп, Ё},,1""+
1ц6,
}| Ф}(}|€./|ительно-восстановительнь]ми' Ё1*:п*,
потенциаламш
согласно
равенству
18
/{]",:
19
[&1еп+|
.
[к*1'
:#('1-,*г
-
дй""+:*)
.
}словнь:е станда
ртнь1е
электродньте
потенциаль|
меняются неодинаково
при
3амене
катионов одних
щелочнь|х
металлов
на
другие
в их
расплав_
леннь[х хлоридах.
Бследствие этого
расплавь1
хлоридов
щелочнь1х
метал_
лов не
располагаются
в какой-то
один
универсальнь:й
ряд
в
порядке
увеличения
или
умень1цения
их окислительного
действия.
Б
ка)кдом
от-
дельном
случае он
мох(ет бьтть
различнь1м.
}ак, например,
при 1100'к
окислительная
способность
расплавов
||€1,
|.{а€1, кс1, эвтектической
смеси
3!1с1_2кс! и эквимольной смеси
\а€1_(€|
умень1шается
в сле-
дующем
порядке
для
ука3аннь|х
ни)ке металлов:
?итан \а€1-(€1>311с1-2(€1)\а€1>кс1>!;с!
[ирконий
3[|с1-2кс1>\а€1_(€1)\а€1:кс1>[1с1
[-афний 3[|с1_2кс1)}\]а€1_(€1>\а€1)кс1>[1с1
1орий 1'{а€1
>
(€1
>
311с1_
2(€1
>
1\1а€1_ кс1
>
!1с1
}ран
(€1>$а€1>}.{а€1_(€1>3[|с1-2кс1>!|с1
йолибден
311с1-2кс1>(}.{а€1-(с1)>кс1>\а€1>[!€1
}(елезо
3[!с1_2кс1>\а€1_(€1>\а€1>кс1>1"|с1
[арактерно'
что
все
ука3аннь|е
металль|
окисляются
менее всего в
чистом
расплавленном
хлориде л14тпя' где в качестве окислителя
могут
вь1сту_
пать
только
его катионь1.
(€ледует
отметить'
что
в присутствии
дах(е
следов
кислорода
в
атмосфре над
расплавом
корро3ия
металлов в
||€1
резко
во3растает'
притом
наиболее сильно
по
сравне}{ию с
хлоридами'
всех остальнь1х
щелочнь]х
металлов. 3то является следствием
того''
что оксиднь|е
ионь1 связь|ваются
катионам\7 л|4т|4я
в
комплексь| типа
!]о_,
что
приводит
к
3начительному
повь11пению окислительно-восста_
новительного
поте|{циала
системь:
Ф'/Ф2_).
(оррозионные
рядь[
металлов в
одних
и
тех
)ке
расплавах
при оди-
наковых температурах
более постояннь1. 1ак,
например'
для
упомянутьтх
вьтше металлов в
ука3аннь1х
солевь|х
средах корро3ия
умень!паетс*
в
ряду
ть_ш_т]_Ё|_7г-Ре-,]!1о.
1и

(оррзияметалловумень!шается'когдаврасплавь|вводятсякаких
катионь1
в
виде
добав[:к
соответствующих
хлоридов,
так
и
щелочнь1е
металлы'
например'
на
катоде
при
электроли3е.
||оэтому
способ
катодной
3ащиты
мо)кно
исполь3овать
как
вполне
ффективное
средство
против
корро3ии
электроотрицательньтх
металлов
в этих
расплавах'
'ь
замкнуть{х
изотерминеских
системах
скорость
*'чц9:.11_ .Р-]:::
постепенно
падать
до
нуля
по мере
накопле!!ия
ее
продуктов
('1ч."
корродирующего
металла'
й9а+,
и субионов щелоч}{ь|х
металлов,
к.
)'
до
равнове-','*
*'"ц*"1р|ши*
во всем
объеме
солевого
расплава.
Бстест_
вегтйо,
что
это
мо}кет
происходить
лишь
в
тех
случаях'
когда
они
й!_Б!й""'д"йствуют
ни
с
материалами
контейнера
и ятейки,
ни с
атмо'
!'фр"а
"
!'Ба.
1о.да
убь:ль
Б весе
металла
бь'тл_а_
бу
пропорциональна
Ё!йй'Б".,'й
мольнодолевой
тонцентрации
ионов
&1е'+
и
количеству
рас-
;;;;;.
Ё
действительности
}{е
ионьт
металла
(обьтнно
низшей
валентности
и
вследствие
этого
обладающие
сильно
восстановительными
свойствами)
легко
вступают
во
вторичнь|е
реакции'
а
субионьт
щелочнь|х
металлов
распадаются
в
ре3ультате
улетучивания
их
и3
расплава
&*р'"',):
]&|'^.',,*Рс.>.
|1_о'то*у
равновесие
мех(ду
металлической
и со'певой
фа_
3ами
не
достигается,
а
устанавливается
стационар_ное
состояние'
когда
становятся
равнь!ми
скорост.и
диффузии
окислителей
из
объема
расплава
к
поверхности
металла
и
продуктов
реакции
(ме,+
".Р*)
в офатном
направле*'и.
}1еталл
при этом
принимает
стационарньтй
потенци8[,
9"'.'
величина
которого
определяется
коншентрашией
его
ионов'
[}4е'+]3".
,.
в
прилегающем
слое
солевого
раст1лава
...
ч",:
Ё-м",+
/^.+#1п
[А4е'+]3'.
8сли
конце1{трации
ионов
]!1е'+.
и
&*
в
объеме
электролита
равнь1
практически
нулю,
а
окислителей
(в
рассматриваемом
случае
катионов
щелочнь1х
"етал'оЁ;
поддер}киваются
постояннь1ми'
то
скорость
стацио_
н)рной
корро3ии
мёталла,
вь:рах<енная
в
виде
плотности^эл-"::ч:']*ъ?'"
тойа,
переносимого
его
ионами'
дол)кна
удовлетворять
равенству
[|2о]
[*6':
пРР^""*
$з
:пР0
*;
сй*
с$+
_с!*
-пРРц+
3десь
0
-
коэффициенть1 диффузии,
см2|сек,
а
€'-
концентрации'
е-йон|см",
указаннь:х
ио1!ов
в
прилегающем
к
металлу
€лое
!асплава;
а$;-
;;-йнтРация'
е-нон|
см9окислителей
(катионов
щелочньтх
металлов)
в_об"еме
распйава,
а
0_толщина
диффузион.ного
слоя'
_ _€
прат!тическоя
точки
3рения
наибольтпий
интерес
представляет
ра'
венство'
связьтвающее
скороёть
корро3ии
металла'
вь1ра)кенную
через
ток'
с величиной
ет'о
условного
стандартного
потец!1иала
,
Ё*^"'*/*"'14з
условий
стационарной
линейной
дифузии
следует'
чт0 стационарная
концентра-
ция
ионов
равна
6й-"*:й?
е-шон|
см3.
Фна
невелика
в случае
корро3ии
в среде
расплавленнь|х
х,1оридов
ще_
лочнь[х
металлов.
Ёсли
ик
молекулярньтй
вес
равен
7у]&с1,
8
плотность
7ц61,
тФ
мольнодолевую
концентрацию
корродирующего
металла
мо>кно
без
больгпой
оцлуц6ки
считать
равной
г*",-ь
:
1Ё!]
с'*""*
:
*
#*
195

|1одставляя
это
значение
в вь1ра}кение
для
стационарного
потенциала
и переходя
к
десятичнь!м
логарифмам'
получаем
искомое
уравнение:
4пс:
,''*''*
0кс:
6
(огда
мольнодолевая
концентрация
ионов
корродирующего
металла
в
объеме
расплава
становится
отличной
от
нуля и
достигает
величинь}
[!!1е,+1',
стационарньтй
потен:д,иал свя3ан
с
условнь|м
стандартт{ь|м
и
током.
корро3ии
равенством
Р",:
Ё]ц"'+
/,""
+
!Р
.
10_4г
:е
{1ме'*1'
-
#
#}}
|(оррозсля
ме!т!аллов
в хлорш0ньсх
расплавах
3а
сце!п сплавообразованця-
бдной
из
спешифических
ософнностей
хлориднь:х
расплавов
является
их
способность
переносить
электроотрицательнь!е
металльт на более электро-
поло)кительнь|е'
с
которь1ми
онта образуют
сплавы.
||ри этом
менее бла-
городнь:й
металл
растворяется
в солевой среде'
а более
благородньтй
сплавляется
с
ним
в
ре3ультате
обратного
вь!деления и3
€Фл€вФгФ
!8€з
плава
[402_408].
€ушность
такого фстокового
переноса
3аключается
в
том'
что
металл
и
его
сплав
не могут находиться
в
термодинамическом.
равновесии
с
электролитом
одного
и того х(е состава.
_
Равновесие
мех{ду
металлической
фазой
и
прилегающим к ней слоем:
расплава
достигается
бьтстро, особенно
в
условиях
вь|соких
температур.
||ри этом
ее
электроднь:й
потенциал становится
рав-нь1м
окислительцо-
восстановительному
потенциалу окрух{ающей
солевой
средь|.
1аким
об-
разом'
для
чистого
металла
усташавливается
равенство
Ём':
Б'м.'+/м.^++;зъ'.
[[е'+!!*""")
г* .
дг
(п
-тп)
Р
[|'1е-+11,,@:д!+:пЁ
-
#'"
[&*]|"'"""л'
а
для
его
сплава с
более
электрополо}китель|{ь|м
металлом
Ём"
("п'ав)
:
Ё'м"'+
/м"-*
+
к'.%п
[А{е'+]|",',")
:д]*,_+_
31
:,
[&Ё][""*":,
"п_|/п'
Р
"'
|_\;
.'
1с||,|ав''
где
[/м1е'+]",
[йе.+1"
,
[ц*]'
_
мольнодолевь1е
концентрации
ука3аннь|х
ионов
в
слоях
расплава'
находящихся
в
непосредств])нном
контакте со-
ответственно
с
чисть1м
металлом и его
сплавом.
1ак как
активность'
металла
в
сплаве'
4ме(сплав):
мень1ше
единишы'
то
Ёц"1"'''в1)Ёц".
€ледо-
вательно'
[]!1е'+||"''""т
"
[к}]с**":
{
[&Ё]к""'",,:.
[йе-+]|",',"")
[]}1еп+!|"-.'''1
Разность
в отно|пениях
концентраший
ионов
}1е'+
и йеп+
в
расплаве}
находящемся
в
одном
месте
в
равновесии
с
металлом,
8
8
другом
-
со сплавом'
во3растает
по мере
умень1ше!|ия
его активности
в
послч1нем-
9го
видно и3
термодинамического
равенства
{
[м",+]?"".''':}*
_
{
1м"-+||,,"',''1}"
где
4ме1сплав)(
| п
(п_гп)>-\.
196
{[м.,+
]?",',":
}-
[&1е,+]
?",''")
[[{е'*
]["""''')
{
1ме-
+
||"',,,"1}"
п_!п
4ме
(сплав);

1{асть
расплава'
находящегося
в
равновесии
с
металлом
и в контакте
с
флее
5.гюктрополох(ительнь1м
металлом'
способнь]м
к обра3ованию
сплава'
вступает
с
ним
во в3аимодействие.
|!ри этом
равновесие
реак_
ций
ме?#,""у
+
#
ме -'
*
йе$*',
1,
А4е
+
2п&[аспл1:с=
}:[9[$",'1
-|- /?&}1р'",'1,
ме
+
2га&6,..,,;+йе6]?,,1
*
га&}ср'".,1
смещается
влево. йеталл не
вьтделяется в свободном
состоянии'
а
пере-
ходит
в
сплав
с
более благородньтм. Расплав,
пригпедгпий в
равнове-
сие со
сплавом'
по|1адая
снова
на электроотрицательнь;й металл,
окисляет
его
в
ре3ультате
смещения
равновесия
вь]1пеука3аннь]х
реакций
вправо.
1аким
образом,
бестоковьлй
перенос
электроотрицательнь}х металлов
в
сплавы
с
более
'электрополо)кительнь1ми
чере3
расплавленнь|е
солевые
срецьт осуществляется
как ионами ни31пих
валентностей, так
и 3а счет
образования
субионов
(&*)
щ.'''нь1х
металлов. €корость процесса
3ави-
сит
от
многих
факторов [405-408].
Фна во3растает
с температурой,
величиной
поверхности в3аимодействующих
металлов'
умень||]ением
тол-
ш1инь1
ра3деляющей
их прослойки
солевого
расплава'
его
перемешиванием.
3начительное
влияние оказь|вает так)ке
дифузия
металлов в
сплаве.
Бсли скорость
диффузии
мала, то
поверхностньтй
слой последнего
бь:стро
нась]щается
переносимь1м на него электроотрицательнь|м метал-
лом' вследствие
чего его коррозия'
протекающая по
этому
механи3му'
сильно 3амедляется
и начинает
контролироваться
диффузией
в твердь|х
фазах.
Ёару:пение
равновесия
приведеннь|х вьтше
реакций
мох(ет
происхо-
дить
не только
в
ре3ультате
сплавообразования'
но и наличия
темпера-
турньтх
'градиентов.
Бсли
с
повь11пе}|ием
температурьт
равновесие
смещается
в сторону
растворения
металла' то
он вь1деляется в
более
холоднь1х
местах'
соприкасающихся
с солевь|м
расплавом.
!1ри обратной
температурной
зависимости
вь|деление металла происходит на более
горячих
участках.
Б том и
другом
случае нару1пается исходное
равнове-
сие.
Фно вновь
вс|сстанавливается'
когда
расплав
приходит в контакт
с
корродирующим металлом' нагреваясь
или
охла}(даясь
до
его
темпе-
ратурь1.
1у1еталл при этом частично
растворяется.
(оррозию,
свя3анную с
бестоковым
переносом
металлов как в
резуль-
тате сплавообра3ования' так
и наличия температурных
градиентов'
нуя{но
иметь в виду при вь:боре
конструкционнь1х материалов'
типов
электролизеров
и
реакторов
с
расплавленнь|ми
солями
и температурного
ре)кима
работьт.
}тот
про_цесс'
однако'
.
г]ель3я
рассматривать
только
с отрицательной
сторонь|.
Бестоковое полунение металлических сплавов
в среде
расплавленньтх
солей
представляет больтпой
практинеский
инте-
рес.
Бо многих
случаях
оно мо)[{ет конкурировать с га3одиффузионными
методами
покрь1тия металлами
и сплавами
не только металлических' но
и неметаллических
изделий.
|(оррозшя ме!т!аллов
в хлорш0ньсх
расплавах
по0 воз0ейсгпвшем кшслоро0а
апмосферьс. }(ислород'
растворяясь
в хлорид}|ь|х
расплавах'
частично
окисляет
анионь1
хлора' восстанавливаясь
при этом
до
оксидных
ионов:
Ф:
<":
*4€1-+2Ф2-+2€1э
(":.
Б
расплавленнь|х
хлоридах
щелочнь|х
металлов
это
равновесие
сильно
смещено
влево и
равновеснь|е
концентрации
ионов
Фа_
очень
мальт.
14х
мо)кно оценить
|13 имеющихся в литературе
[409]
термодинамических
даннь|х для
[!'Ф, |,1а'Ф
и
('Ф.
Без
учета
температурной
зависимости
энтальпий
и энтропий
реакший,
полагая' что
}!идкие хлоридь1
и окислы
\э7

щелочнь!х
металлов
дают
идеальньте
смеси'
получаем
следующие вь!ра-
жения
для
констант
равновесия:
Ф:
с">
*
4[!6|+2[]Р
+
2€1:
(.),
1д
:(*:
,,
[[1э@1"'р|л":4.306
_
26417
.
"
[!:с:1с.''"
'
т
Фэ
с":
*
4\а€1==2\ар+2с!
2(г),
!8
,(*
:'*
',|.':?1,;'ё',
:
1,798
_
'?"
,
"
[\а2€!]{.р',
т
Ф:'с")
*
4(€1'*2('Ф
$
2€12
1"1,
18(*:18#*:2,$э5-
1ак, например'
на во3духе (Р'":0,2\
огпм) при 1100"к п
Рс!,
:10_6
апм
равновесная
мольнодолевая концентрация
оксидных ионов
составляет
6,41.10_6
в
расплавленном
!|€1; 5,06.10-тя в $а€1 и 1,41
х
х
10_10 в
(€1.
Фкислительно_восстановительньтй
потенциал системы Ф'19ъ_ в
солевом
расплаве
равен
Ёо
"/о,_
:
Ё[
"т
'"
-
*'$
:,
_!э-
:
Ё3,:',_
*
{
т"
-_!э=-
.
+г
а'о"-
+г
["о,_ [о'-],
1ак как
концентрация ионов
кислорода очень мала'
их
коэфицие1|т
активности,
[9"-
'
имеет постоянную
величину'
|},-. тогда
Ё9"р,-
:
Ё3,76,_
{
0,496.
1 0_4г
:*'&,
50623
где
Б\;6"-:
Б3,р,_
_
0,992.
10_д719|},-
.
рно}|у
элек1роду
сравнения в
расг1лавах
!1с1,
\а€1
и
(61
мо)кно
оценить
и3 приводимь|х
вь|1пе вырахсений
для
констант
равновесия'
исполь3уя
равенство
Ё6"76,_:[с|,1с1_. 1м1ольнодолевые
концентрации
хлоридов
равнь1
практически
единице' а
рс\2:|
апом
в выбранной
систе-
ме отсчета
потенциалов. €ледовательно'
Ё[,19"_:0,496. 10_4г
19
а(*,
|1лу1
Ё3,рэ_'
"
||с1
_1,31+2,1.70_4т
\а€|
_
1,95+0,89.10_4г
кс1
_2,51+1,5.10_4т
(ак
видно,
окислительная
спосо6ность кислорода
в
срвде
расплавленных
хлоцидов
щелочнь1х
металлов
поних(ается
в
ряду
!|€1_\а61-кс1.
Фкислительно_восстановительнь:й
потенциал
кислорода при прочих
равньтх
условиях
во3растает
с
умень1пе[{ием
концентрации оксиднь|х
ионов в
солевой
среде.
3то
наблюдается'
в
частности' в хлоридньтх
рас-
плавах'
со4ер'(ащих много3аряднь1е
катионь[ .&1е'*,
имеющие больт'пие
ион}1ые
моменть1 (Беа+,
/,1ц+,
|]|ц+,1[:д+
и т.п.), которьте
образуют, как
правило'
тугоплавкие
окисль|
с очень низкой
растворимостью
в
солевой
фазе
при
относительно ни3ких
температурах
(ни>ке
1000'с).
Фни
сильно
!98

пон-ия(а*от
фзу {{10!:
концентРацию
анионов
кислорода'
переводя
их в твердую
2&1е[$".,1
*
аФ|!.',1
+!!1еРпкт).
[{огда
концентрация
поливалентнь]х
катионов
невелика'
их
коэффи-
циент
активности
остается
практически
неи3меннь|м'
[-^"'*,
и вь1ра_
}{(ение
для
прои3ведения
раствоРимости
окисла
йеР"
в
расплаве
[р:
:,'^.'*
.
а3,_
можно
преобра3овать'
переходя от
активностей
к
мольно_
долевым
концентрациям
ионов:
[-р*:
!р
:
[/т1е'+1а. [Фя_1'.
(
л}'",*)''
(
г3'_)'
||одставляя
находимое
отсюда
3начение
[о'_]
р
ур_авнение
для
окисли-
тельно-восстановительного
потенциала
системь|
0'| Ф'_,
получаем:
Ё619'_
:
ЁБ,то"
_
*0,496
.
1 0_4т
18
ро,
+
#
1о_4т19 -]щ{ц'
3то
термодинамическое
равенство
показь1вает'
что
редокс-потенциал
системь1
611о'_
в хлориднь1х
расплавах'
в
отличие
от
системьт
с12|с|_,
3ависит
не
только от
давления
кислорода
в газовой
фазе,
но
так}ке
от
прои3ведения
растворимости
окислов
поливалентнь|х
металлов и кон'
шентрашии
их
ионов
Б солевой
фазе.
Фн во3растает
при
повь1шении
давления'
умень1|]ении
растворимости
и
увеличении
концентрации.
1ак,
на1ример,
при'1100''к
в
расплавах
}'{а61, содерх{а1цих
\ мол.о/о
ионов четь|рехвалентнь:х
металлов
(йе'*.),
окислительно-восстановительный
потенциал'атмосферного
кислорода
(Р',:
0,2|
апм)
по отно1пению
к
хлорному
электроду
сравнения
меняется с
прои3ведением
растворимости'
[р* йх
двуокисей
(2!1еФ') следу}о!.цим
образом:
|р* .
,'"7.'-
(онт1ентрашия
оксиднь]х
ионов
в
хлориднь]х
расплавах
умень1пается
не
только
при образовании
малорастворимь]х
окислов'
но и
пр_и
]Ря1Рт.
вании
их
в прочнь]е
комплексньте
окёиионь1'
например'
катиоц61
}:[9@(п_э)+
[410,
411]:!!1ё"+.ь@а_.*}1ео(2-2')+.
8сли
константа
их неустойнивости
равна
д*
_
[]!1е'+]
х
[Ф'!-]
.
[м"о{
"_эт\1
'
то
Ё919,-
:
Р,'
о,
1о,_
*0,496'
1 0-4г
18 Ро,
_
0,992'
1
0_4т
:в
[м'9]=э,*'
*-'
[&1е'+1
|!овьтшение
окислительно-восстановительного
потенциала
солевой
средь1
усиливает
корро3ию
находяш1ихся
в
ней металл_ов.
3то
происходит
в
ре-
зультате
не
тольк0
непосредственного
взаимодействия
|4х с
раствореннь|м
в
расплаве
кислородом'
но и за
счет окисления
хлором'
образуемь:м
по
реакшии
Ф'+4€1-'е26э_у2(|а.
Ре
равновесие
смещается
вправо'
когда
оксиднь]е
ионьт
свя3ь|ваются
в нерастворимь]х
окислах
или
мало
диссо_
]{иируемь|х
комплекснь|х
оксиионах'
которь1е
являются
конечнь]ми
продук-
тами
корро3ии
поливалентных
металлов
в хлориднь|х
расплавах
под
воздейстЁйем
кислорода
атмосферь|.
Б отличие
от
окисления
|13 газовой
фазьт,
они
не покрь|вают
плотнь|м
слоем
поверхность
корродирующих
металлов'
а
вьтделяются
в объеме
расплава.
|(орро,зс;я
ме1паллов
в хлорт:0ньсх
расплавах
по0 воз0ейспвшем
влаец
атпмоёферьс.
Б хлориднь1х
расплавах
под
во3действием
паров
водь1
про-
10_10 10_20
10_3о
10_40 10_50
10_8о
10_?0
199

исходит
гидроли3
много3арядных катионов'
которь|е образуют
малорас-
творимь1е
окислы:
2
!у|еп+
+
пЁ'Ф
+
!!1
еР
пкт
у
*
2 пЁ+
или
устойнивь|е
комплекснь|е оксиионь|' например
]у[9@(в_э)*;
йе'+*ЁР*!