Степанов Б.И. Введение в химию и технологию органических красителей
Подождите немного. Документ загружается.

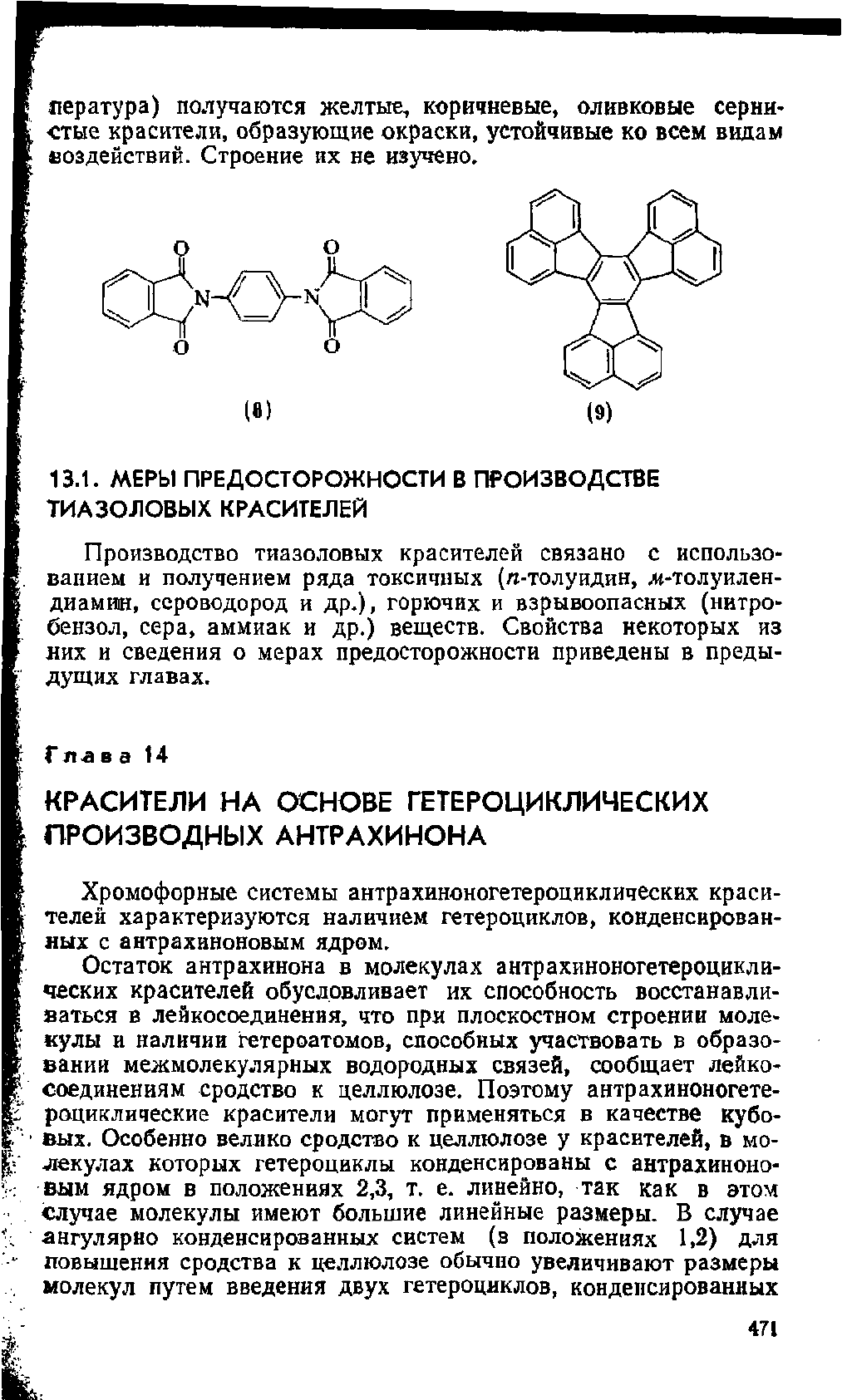
пература) получаются желтые, коричневые, оливковые серни-
стые красители, образующие окраски, устойчивые ко всем видам
воздействий. Строение их не изучено.
(8) (9)
13.1. МЕРЫ ПРЕДОСТОРОЖНОСТИ В ПРОИЗВОДСТВЕ
ТИАЗОЛОВЫХ КРАСИТЕЛЕЙ
Производство тиазоловых красителей связано с использо-
ванием и получением ряда токсичных (л-толуидин, л-толуилен-
диамин, сероводород и
др.),
горючих и взрывоопасных (нитро-
бензол, сера, аммиак и др.) веществ. Свойства некоторых из
них и сведения о мерах предосторожности приведены в преды-
дущих главах.
; Г л а в а 14
КРАСИТЕЛИ НА ОСНОВЕ ГЕТЕРОЦИКЛИЧЕСКИХ
ПРОИЗВОДНЫХ АНТРАХИНОНА
Хромофорные системы антрахиноногетероциклических краси-
телей характеризуются наличием гетероциклов, конденсирован-
ных с антрахиноновым ядром.
Остаток антрахинона в молекулах антрахиноногетероцикли-
ческих красителей обусловливает их способность восстанавли-
ваться в лейкосоединения, что при плоскостном строении моле-
кулы и наличии гетероатомов, способных участвовать в образо-
'. вании межмолекулярных водородных связей, сообщает лейко-
£ соединениям сродство к целлюлозе. Поэтому антрахиноногете-
роциклические красители могут применяться в качестве кубо-
вых.
Особенно велико сродство к целлюлозе у красителей, в мо-
|: лекулах которых гетероциклы конденсированы с антрахиноно-
'-. вым ядром в положениях 2,3, т. е. линейно, так как в этом
случае молекулы имеют большие линейные размеры. В случае
•• ангулярно конденсированных систем (в положениях 1,2) для
> повышения сродства к целлюлозе обычно увеличивают размеры
молекул путем введения двух гетероциклов, конденсированных
с антрахиноновым ядром, или двух антрахиноновых ядер, кон-
денсированных с гетероциклом.
В зависимости от природы гетероцикла, конденсированного
с ядром антрахинона, красители данного класса делятся на
следующие группы.
1. Антраазоловые (антрахиноназоловые) красители.
2.
Нафтоакридиновые (антрахинонопиридоновые, фталоил-
акридоновые) красители.
3. Нафтохиноксалиновые (фталоилхиноксалиновые, антрахи-
нонопиразиновые) красители.
4.
Динафтофеназиновые (антрахинонодигидроазиновые) кра-
сители.
14.1.
АНТРААЗОЛОВЫЕ (АНТРАХИНОНАЗОЛОВЫЕ) КРАСИТЕЛИ
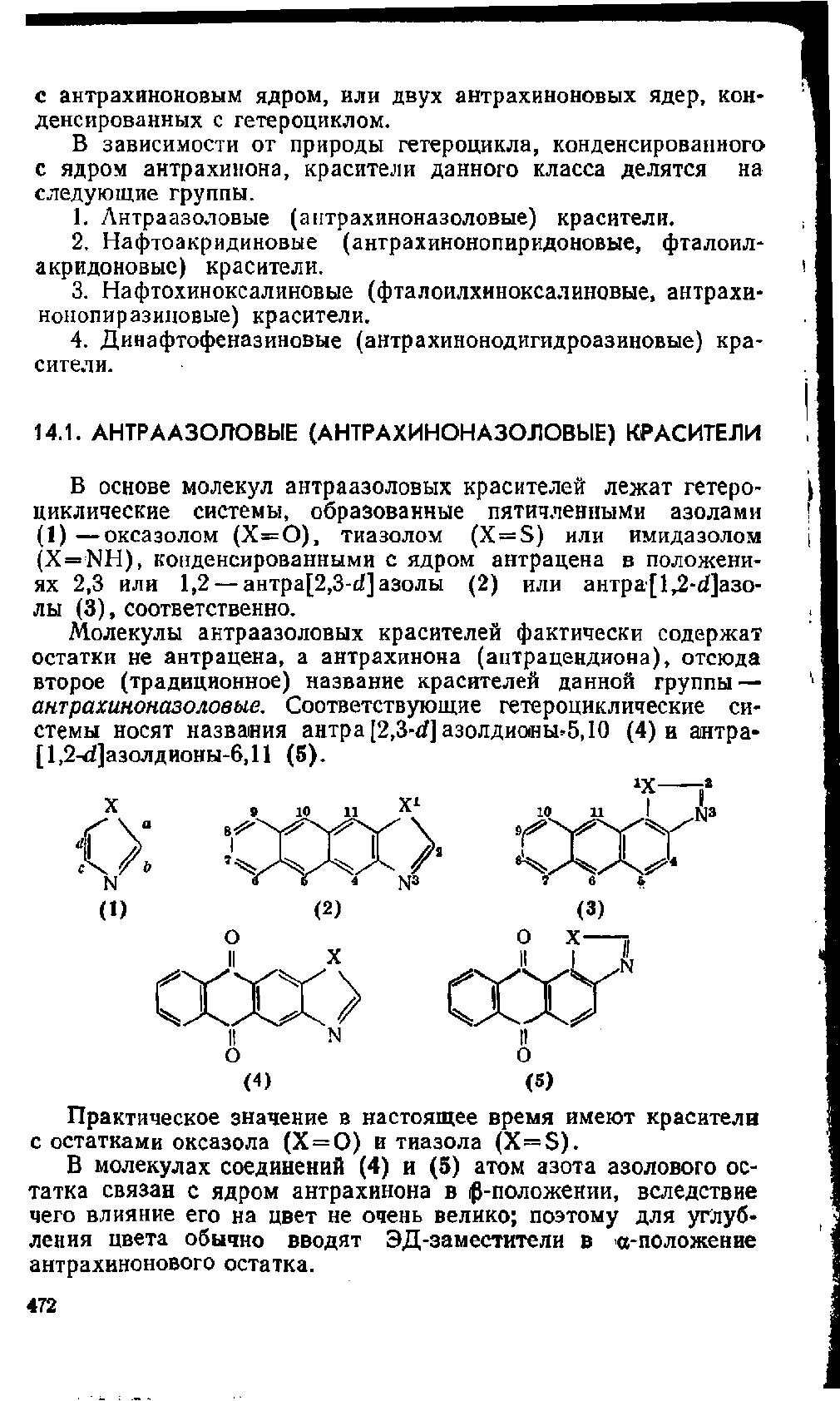
В основе молекул антраазоловых красителей лежат гетеро-
циклические системы, образованные пятичленными азолами
(1)—оксазолом
(Х=0),
тиазолом (X = S) или имидазолом
(X=NH),
конденсированными с ядром антрацена в положени-
ях 2,3 или 1,2 —
антра[2,3-еГ]
азолы (2) или аитра[1,2-^]азо-
лы
(3),
соответственно.
Молекулы антраазоловых красителей фактически содержат
остатки не антрацена, а антрахинона (антрацендиона), отсюда
второе (традиционное) название красителей данной группы —
антрахиноназоловые. Соответствующие гетероциклические си-
стемы носят названия антра[2,3-^] азолдиоеы*5,10 (4) и антра-
[1,2чфзолдионы-6,П (5).
Практическое значение в настоящее время имеют красители
с остатками оксазола (Х = 0) и тиазола
(X=S).
В молекулах соединений (4) и (5) атом азота азолового ос-
татка связан с ядром антрахинона в ^-положении, вследствие
чего влияние его на цвет не очень велико; поэтому для углуб-
ления цвета обычно вводят ЭД-заместители в о-положение
антрахинонового остатка.
472
14.1.1.
антраоксазоловые (антрахиноноксазоловые)
Красители
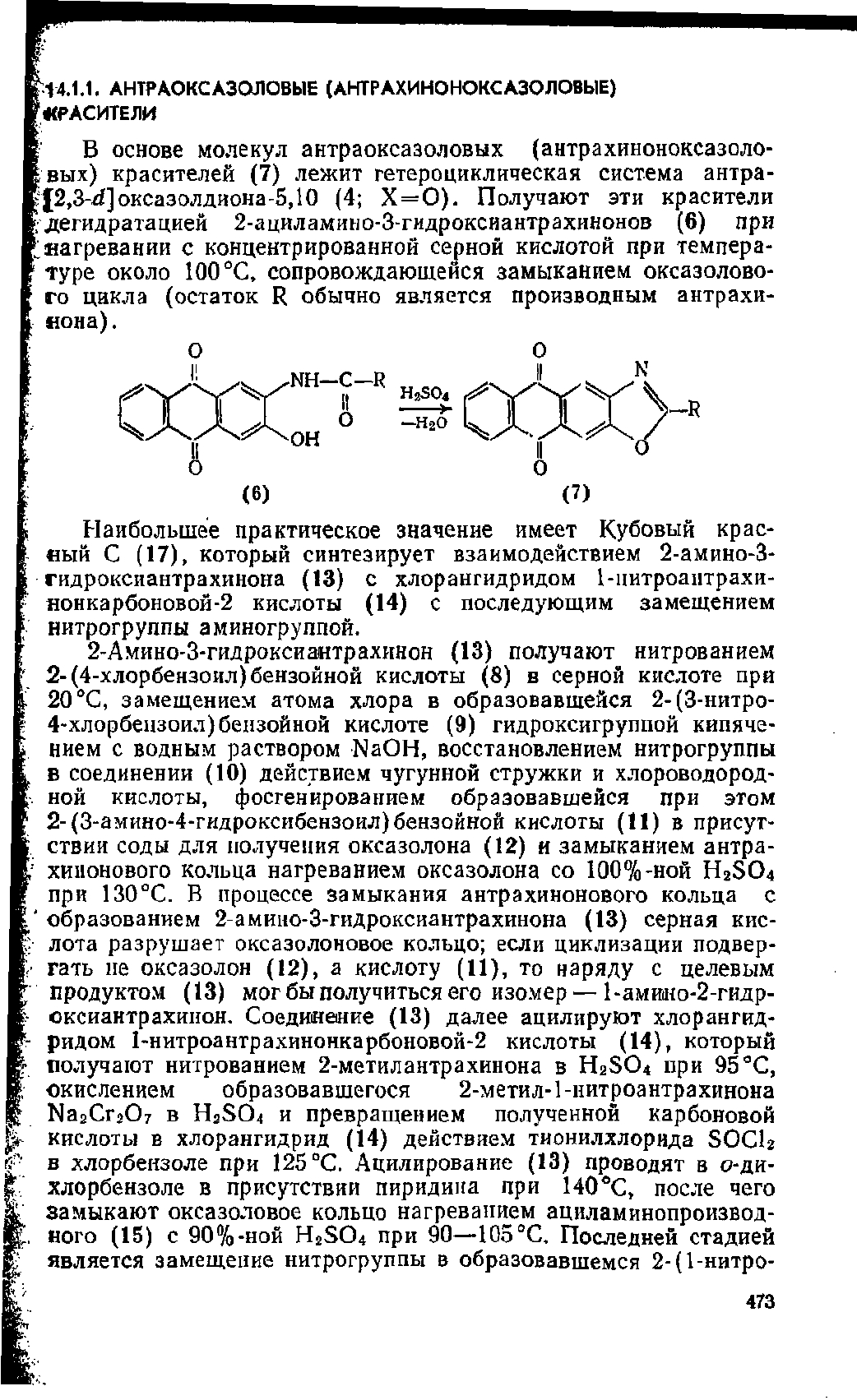
В основе молекул антраоксазоловых (антрахиноноксазоло-
вых) красителей (7) лежит гетероциклическая система антра-
^£2,3-й]оксазолдиона-5Д0 (4; Х =
0).
Получают эти красители
дегидратацией 2-ациламино-З-гидроксиантрахинонов (6) при
нагревании с концентрированной серной кислотой при темпера-
туре около 100
°С,
сопровождающейся замыканием оксазолово-
го цикла (остаток R обычно является производным антрахи-
яона).
О
NH-C—
R
О
—н2о
Наибольшее практическое значение имеет Кубовый крас-
ный С (17), который синтезирует взаимодействием 2-амино-З-
гидроксиантрахинона (13) с хлорангидридом 1-цитроантрахи-
яонкарбоновой-2 кислоты (14) с последующим замещением
нитрогруппы аминогруппой.
2-Амино-З-гидроксиантрахинон (13) получают нитрованием
2-(4-хлорбензоил)бензойной кислоты (8) в серной кислоте при
20
°С,
замещением атома хлора в образовавшейся 2-(3-нитро-
4-хлорбензоил)бензойной кислоте (9) гидроксигруппой кипяче-
нием с водным раствором NaOH, восстановлением нитрогруппы
в соединении (10) действием чугунной стружки и хлороводород-
ной кислоты, фосгенированием образовавшейся при этом
2-(З-амино-4-гидроксибензоил) бензойной кислоты (11) в присут-
ствии соды для получения оксазолона (12) и замыканием антра-
хинонового кольца нагреванием оксазолона со 100%-ной H2SO4
при 130°С. В процессе замыкания антрахинонового кольца с
образованием 2-амино-З-гидроксиантрахинона (13) серная кис-
лота разрушает оксазолоновое кольцо; если циклизации подвер-
гать не оксазолон (12), а кислоту (11), то наряду с целевым
продуктом (13) мог бы получиться его изомер—1-амино-2-гидр-
оксиантрахинон. Соединение (13) далее ацилируют хлорангид-
ридом 1-нитроантрахинонкарбоновой-2 кислоты (14), который
получают нитрованием 2-метилантрахинона в H2S04 при 95°С,
окислением образовавшегося 2-метил-1-нитроантрахинона
Na2Cr207 в H2S04 и превращением полученной карбоновой
кислоты в хлорангидрид (14) действием тионилхлорида SOCb
в хлорбензоле при 125
°С.
Ацилирование (13) проводят в о-ди-
хлорбензоле в присутствии пиридина при 140°С, после чего
замыкают оксазоловое кольцо нагреванием ациламинопроизвод-
ного (15) с 90%-ной H2S04 при 90—105°С. Последней стадией
является замещение нитрогруппы в образовавшемся 2-(1-нитро-
473
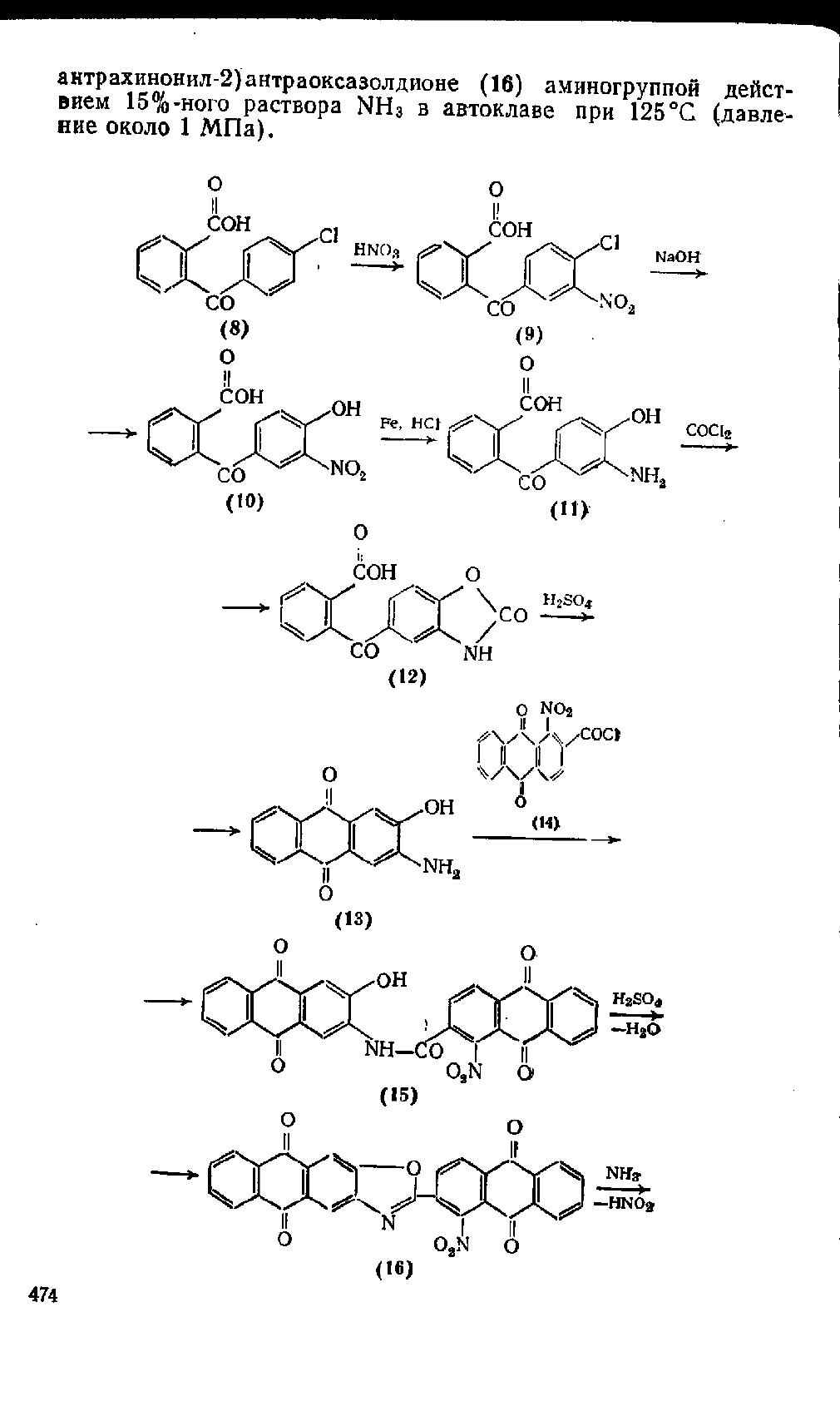
антрахинонил-2)антраоксазолдионе (16) аминогруппой дейст-
вием 15%-ного раствора NH3 в автоклаве при 125°С (давле-
ние около 1 МПа). v
О
СОН
hno3 ^
Y Г
V"
С1
NaOH
Ч/Ч /Ч^Ччо
СО ^°2
(9)
О
СОН
^•(^
СОС12
О
СОН О
. X)
СО NH
(12)
со -^Ша
(П>
H2SO*
СО £
О N02
S\/\/\/COCl
осхх
о
N
(16)
OaN О
474
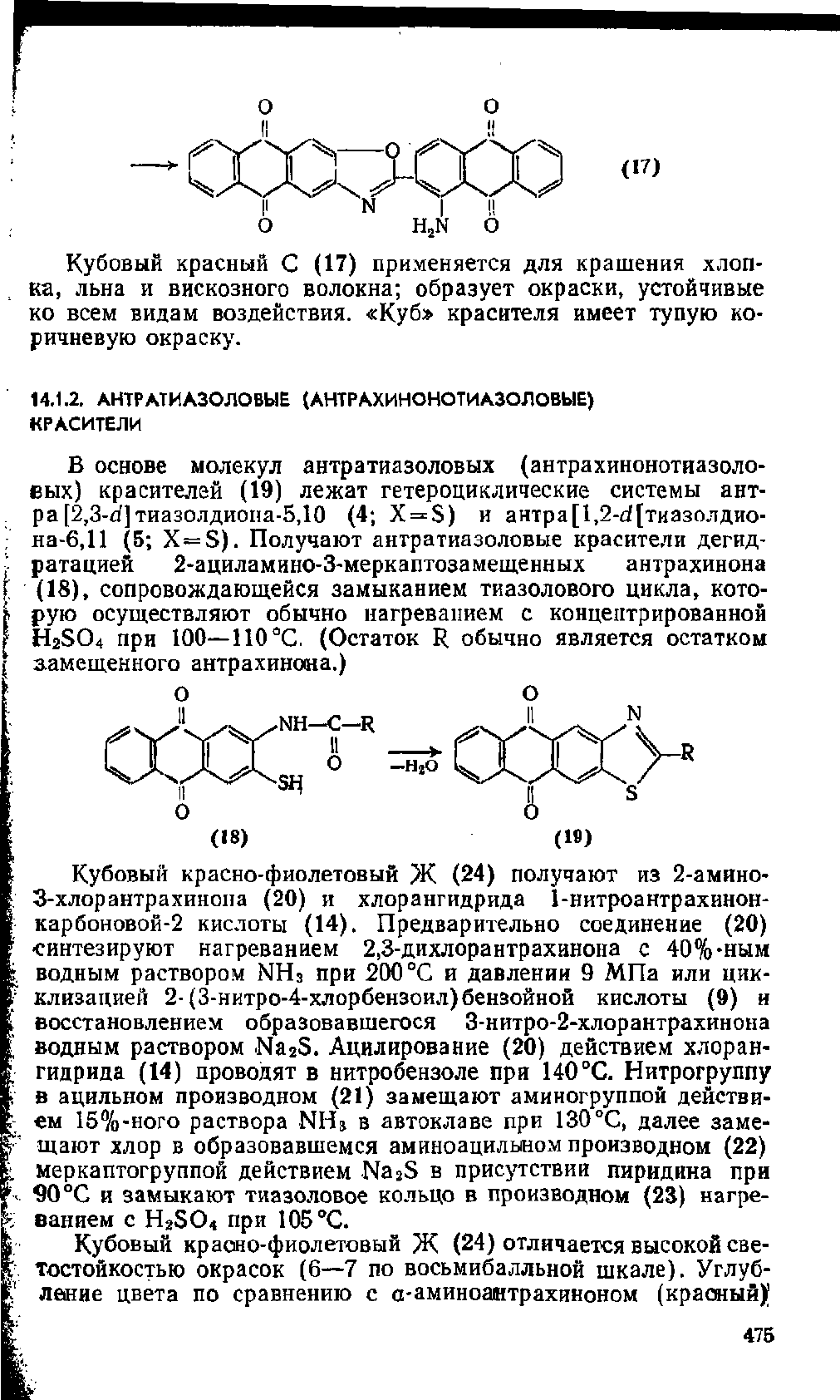
о
о
*г
>
N
-о ^
о
I
H2N
(17)
О
Кубовый красный С (17) применяется для крашения хлоп-
ка,
льна и вискозного волокна; образует окраски, устойчивые
ко всем видам воздействия. «Куб» красителя имеет тупую ко-
ричневую окраску.
14.1.2.
АНТРАТИАЗОЛОВЫЕ (АНТРАХИНОНОТИАЗОЛОВЫЕ)
КРАСИТЕЛИ
В основе молекул антратиазоловых (антрахинонотиазоло-
еых) красителей (19) лежат гетероциклические системы ант-
ра [2,3-^]тиазолдиона-5,10 (4; X = S) и антра[1,2-^[тиазолдио-
на-6,11 (5; X =
S).
Получают антратиазоловые красители дегид-
ратацией 2-ациламино-З-меркаптозамещенных антрахинона
(18),
сопровождающейся замыканием тиазолового цикла, кото-
рую осуществляют обычно нагреванием с концентрированной
H2SO4 при 100—110°С. (Остаток R обычно является остатком
замещенного антрахинона.)
О
,Ш—С—R
II
О
I
-н2о I,.
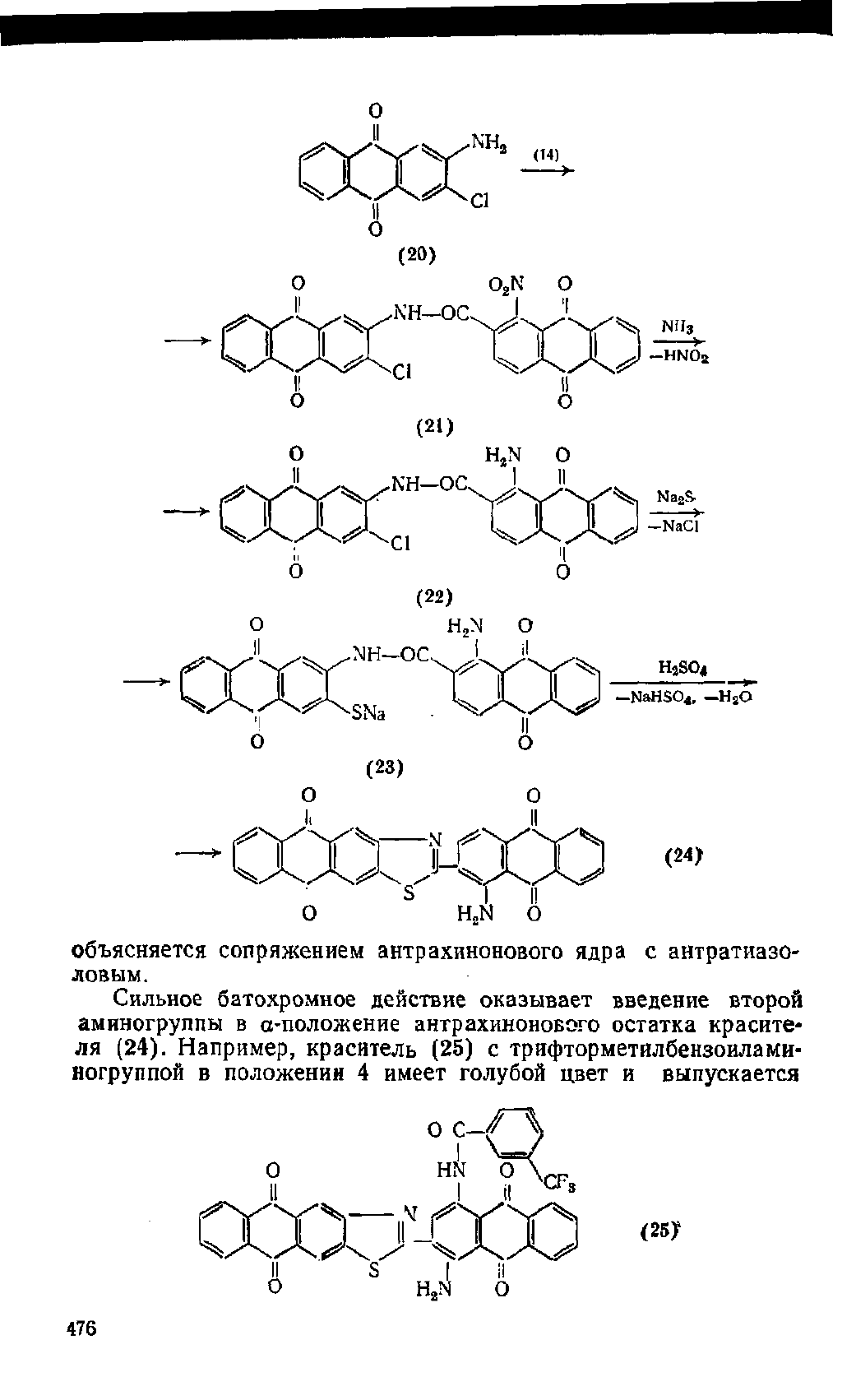
Кубовый красно-фиолетовый Ж (24) получают из 2-амино-
3-хлорантрахинона (20) и хлорангидрида 1-нитроантрахинон-
карбоновой-2 кислоты (14). Предварительно соединение (20)
•синтезируют нагреванием 2,3-дихлорантрахинона с 40%-ным
водным раствором NH3 при 200 °С и давлении 9 МПа или цик-
клизацией 2-(З-нитро-4-хлорбензоил)бензойной кислоты (9) и
восстановлением образовавшегося З-нитро-2-хлорантрахинона
водным раствором
Na2S.
Ацилирование (20) действием хлоран-
гидрида (14) проводят в нитробензоле при 140°С. Нитрогруппу
в ацильном производном (21) замещают аминогруппой действи-
ем 15%-ного раствора NHs в автоклаве при 130
°С,
далее заме-
щают хлор в образовавшемся аминоацилыном производном (22)
меркаптогруппой действием Na2S в присутствии пиридина при
90 °С и замыкают тиазоловое кольцо в производном (23) нагре-
ванием с H2S04 при 105 °С.
Кубовый красно-фиолетовый Ж (24) отличается высокой
све-
тостойкостью окрасок (6—7 по восьмибалльной
шкале).
Углуб-
ление цвета по сравнению с а-аминоантрахиноном (красный)
475
4j Nfl3
J -HN02
*Ч,
Na2S-
-NaCl
H2SO4
—NaHS04,
—H20
(24)
H2N О
объясняется сопряжением антрахинонового ядра с антратиазо-
ловым.
Сильное батохромное действие оказывает введение второй
аминогруппы в а-положение антрахинонового остатка красите-
ля (24). Например, краситель (25) с трифторметилбензоилами-
ногруппой в положений 4 имеет голубой цвет и выпускается
О
^
О
О С-
1
HN
|
ч^
I
H2N
W
Г^Т4!
KXJ
11
И
О
(25;
476
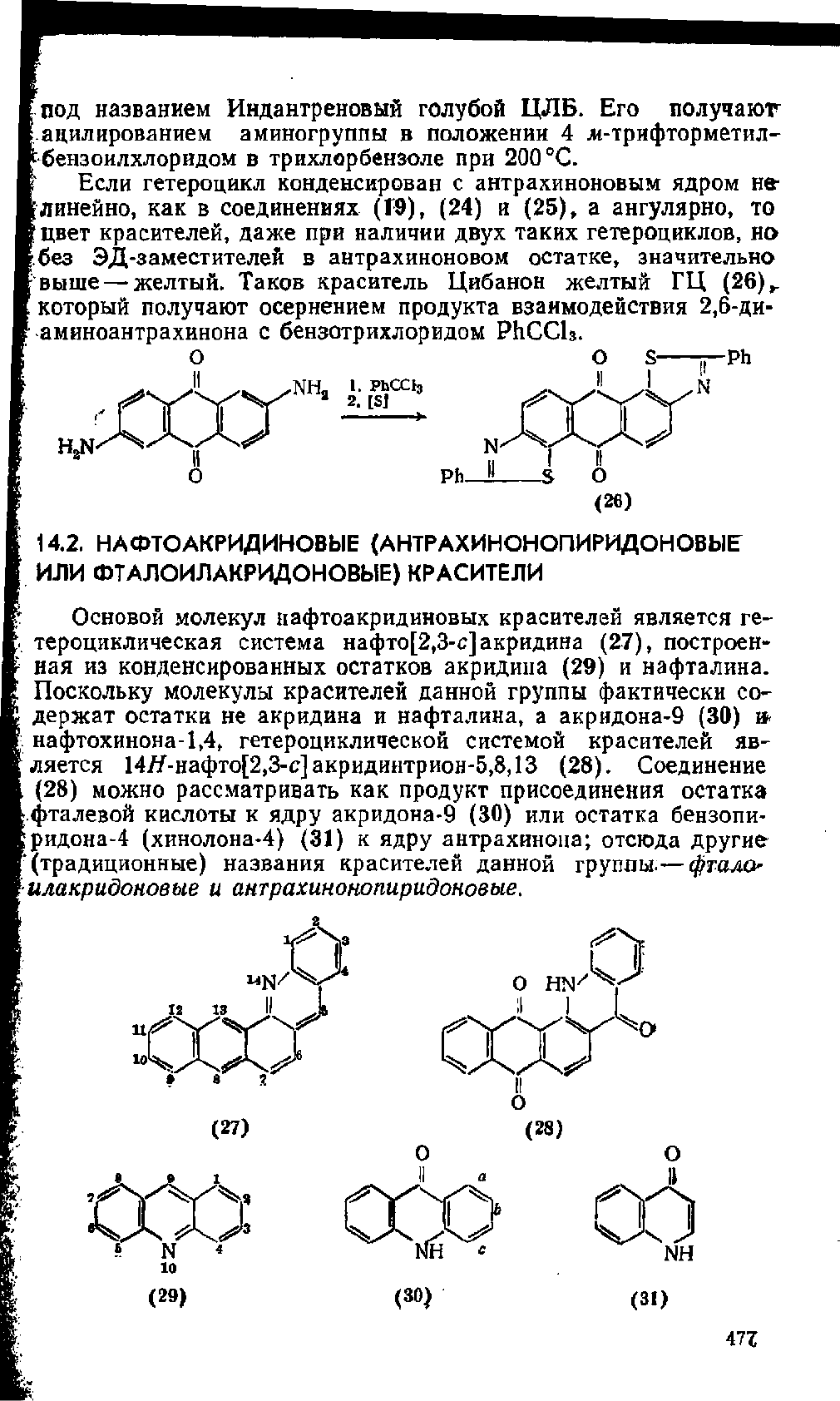
под названием Индантреновый голубой ЦЛБ. Его получаюг
ацилированием аминогруппы в положении 4 м-трифторметил-
-бензоилхлорндом в трихлорбензоле при 200 °С.
Если гетероцикл конденсирован с антрахиноновым ядром не-
линейно,
как в соединениях (19), (24) и (25), а ангулярно, то
цвет красителей, даже при наличии двух таких гетероциклов, но
без ЭД-заместителей в антрахиноновом остатке, значительно
выше — желтый. Таков краситель Цибанон желтый ГЦ
(26)
г
который получают осернением продукта взаимодействия 2,6-ди-
аминоантрахинона с бензотрихлоридом РЬССЬ.
О О S —Ph
II NH 1 PhCCb, II I N
\»ХХХУ ^ ХОУ
"*N II „ ! II
О Ph—!i S О
(26)
14.2. НАФТОАКРИДИНОВЫЕ (АНТРАХИНОНОПИРИДОНОВЫЕ
ИЛИ ФТАЛОИЛАКРИДОНОВЫЕ) КРАСИТЕЛИ
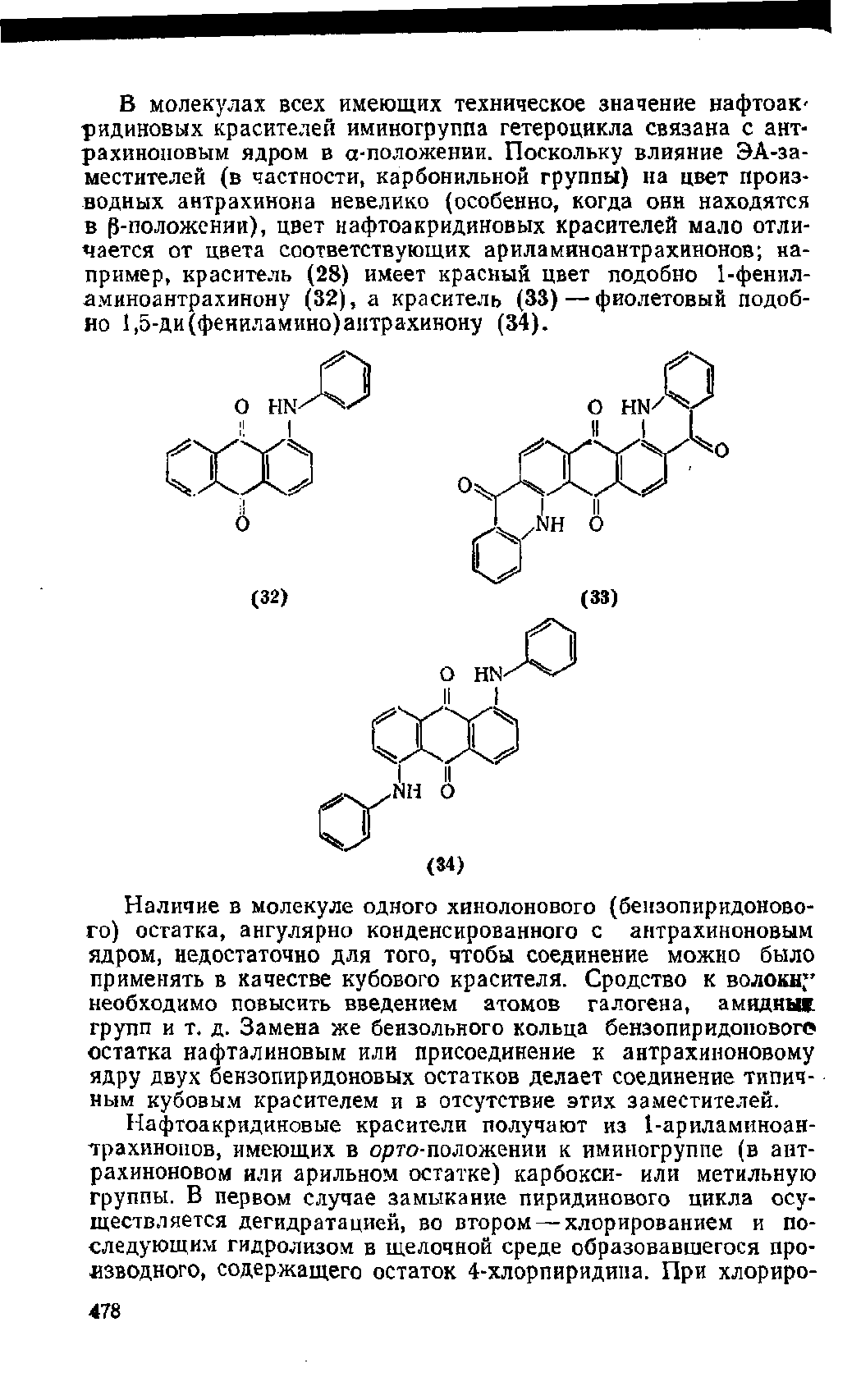
Основой молекул нафтоакридиновых красителей является ге-
тероциклическая система
нафто[2,3-<?]
акридина (27), построен-
' ная из конденсированных остатков акридина (29) и нафталина.
Поскольку молекулы красителей данной группы фактически со-
: держат остатки не акридина и нафталина, а акридона-9 (30) и*
) нафтохинона-1,4, гетероциклической системой красителей яв-
ляется 14#-нафто[2,3-с]акридинтрион-5,8,13 (28). Соединение
(28) можно рассматривать как продукт присоединения остатка
фталевой кислоты к ядру акридона-9 (30) или остатка бензопи-
ридона-4 (хинолона-4) (31) к ядру антрахиноиа; отсюда другие*
(традиционные) названия красителей данной группы.— фтало
илакридоновые и антрахинонопиридоновые.
(27) (28)
О О
(29) (30) (31)
477,
В молекулах всех имеющих техническое значение нафтоаК'
ридиновых красителей иминогруппа гетероцикла связана с
ант-
рахиноновым ядром в а-положении. Поскольку влияние ЭА-за-
местителей (в частности, карбонильной группы) на цвет произ-
водных антрахинона невелико (особенно, когда онн находятся
в
р-положении),
цвет нафтоакридиновых красителей мало отли-
чается от цвета соответствующих ариламиноантрахинонов; на-
пример,
краситель (28) имеет красный цвет подобно 1-фенил-
аминоантрахинону (32), а краситель (33)—фиолетовый подоб-
но 1,5-ди(фениламино)антрахинону (34).
1 I и
(32)
Наличие в молекуле одного хинолонового (бензопиридоново-
го) остатка, ангулярно конденсированного с антрахиноновым
ядром, недостаточно для того, чтобы соединение можно было
применять в качестве кубового красителя. Сродство к волоки"
необходимо повысить введением атомов галогена, амидны*
групп и т. д. Замена же бензольного кольца бензопиридоиовоге
остатка нафталиновым или присоединение к антрахиноновому
ядру двух бензопиридоновых остатков делает соединение типич-
ным кубовым красителем и в отсутствие этих заместителей.
Нафтоакридиновые красители получают из 1-ариламиноан-
трахинонов, имеющих в
орто-
пол ожени и к иминогруппе (в аит-
рахиноновом или арильном остатке) карбокси- или метильную
группы. В первом случае замыкание пиридинового цикла осу-
ществляется дегидратацией, во втором — хлорированием и по-
следующим гидролизом в щелочной среде образовавшегося
про-
изводного, содержащего остаток 4-хлорпиридина. При хлориро-
478
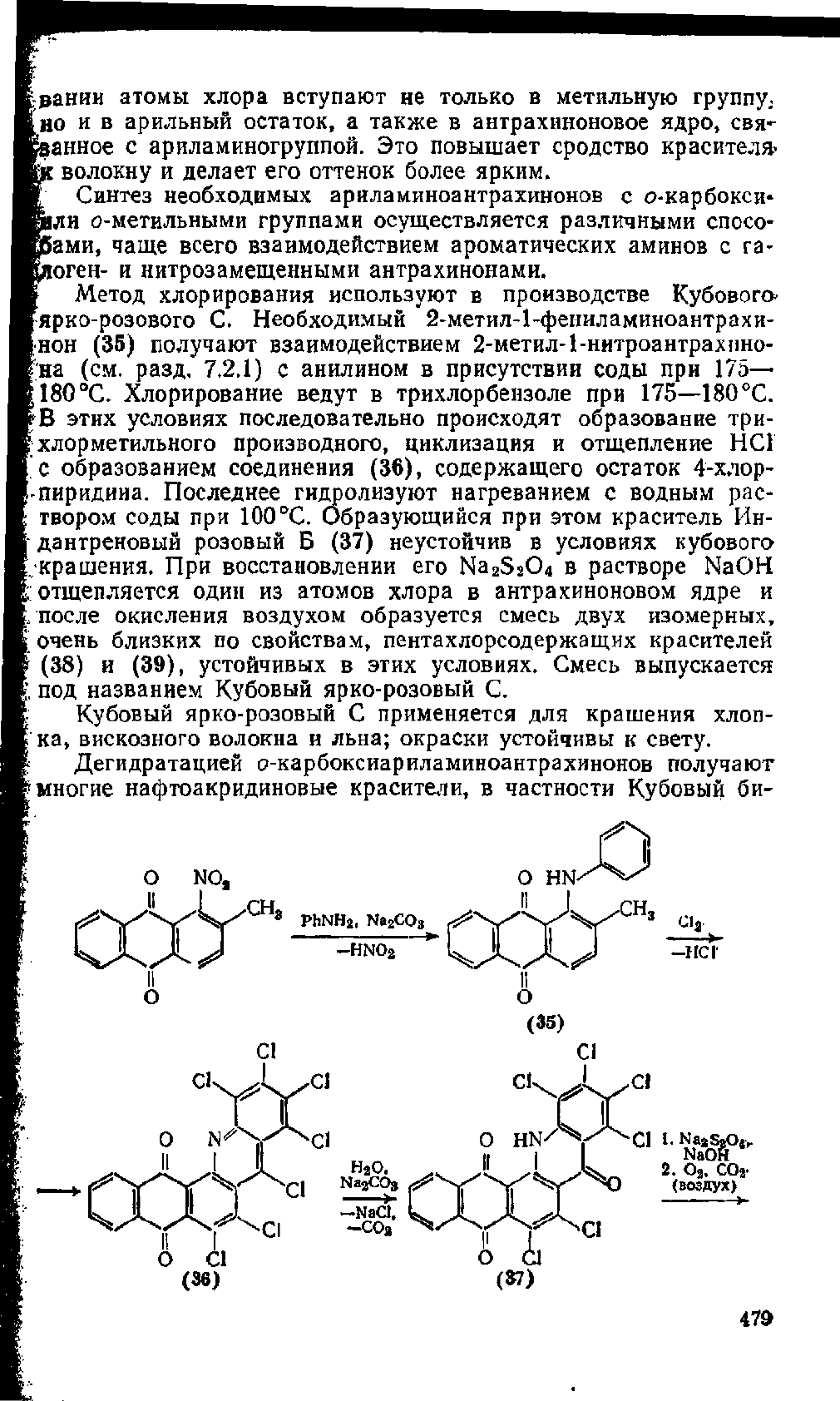
рании атомы хлора вступают не только в метильную группу;
но и в арильный остаток, а также в антрахиноновое ядро,
свя-
занное с ариламиногруппой. Это повышает сродство красителя»
волокну и делает его оттенок более ярким.
Синтез необходимых ариламиноантрахинонов с окарбокси*
ли о-метильными группами осуществляется различными спосо-
ами,
чаще всего взаимодействием ароматических аминов с га-
оген-
и нитрозамещенными антрахинонами.
Метод хлорирования используют в производстве Кубового-
ярко-розового С. Необходимый 2-метил-1-фениламиноантрахи-
•нон (35) получают взаимодействием 2-метил-1-нитроантрахпио-
на (см. разд.
7.2.1)
с анилином в присутствии соды при 175—-
180
°С.
Хлорирование ведут в трихлорбеизоле при 175—180 °С.
В этих условиях последовательно происходят образование три-
;
хлорметильного производного, циклизация и отщепление НСГ
с образованием соединения (36), содержащего остаток 4-хлор-
•
пиридииа. Последнее гидролизуют нагреванием с водным рас-
твором соды при 100
°С.
Образующийся при этом краситель Ин-
дантреновый розовый Б (37) неустойчив в условиях кубового
•крашения. При восстановлении его Na2S204 в растворе NaOH
£ отщепляется один из атомов хлора в антрахиноновом ядре и
/после окисления воздухом образуется смесь двух изомерных,
очень близких по свойствам, пентахлорсодержащих красителей
(38) и (39), устойчивых в этих условиях. Смесь выпускается
под названием Кубовый ярко-розовый С.
Кубовый ярко-розовый С применяется для крашения хлоп-
ка,
вискозного волокна и льна; окраски устойчивы к свету.
Дегидратацией о-карбоксиариламиноантрахинонов получают
многие нафтоакридиновые красители, в частности Кубовый би-
3
PhNH2,
Na2C03
-HN02
CI
CVVC1
Us
\ci
н2о.
pi Na2C03
—NaCl,
-co3
CI
i
—HC1
CI I.NatSyO*.
NaOH
2.
02.
C02'
(воздух)
>
479
Ci-
CI
!
CI
Ci
ci^^l ci
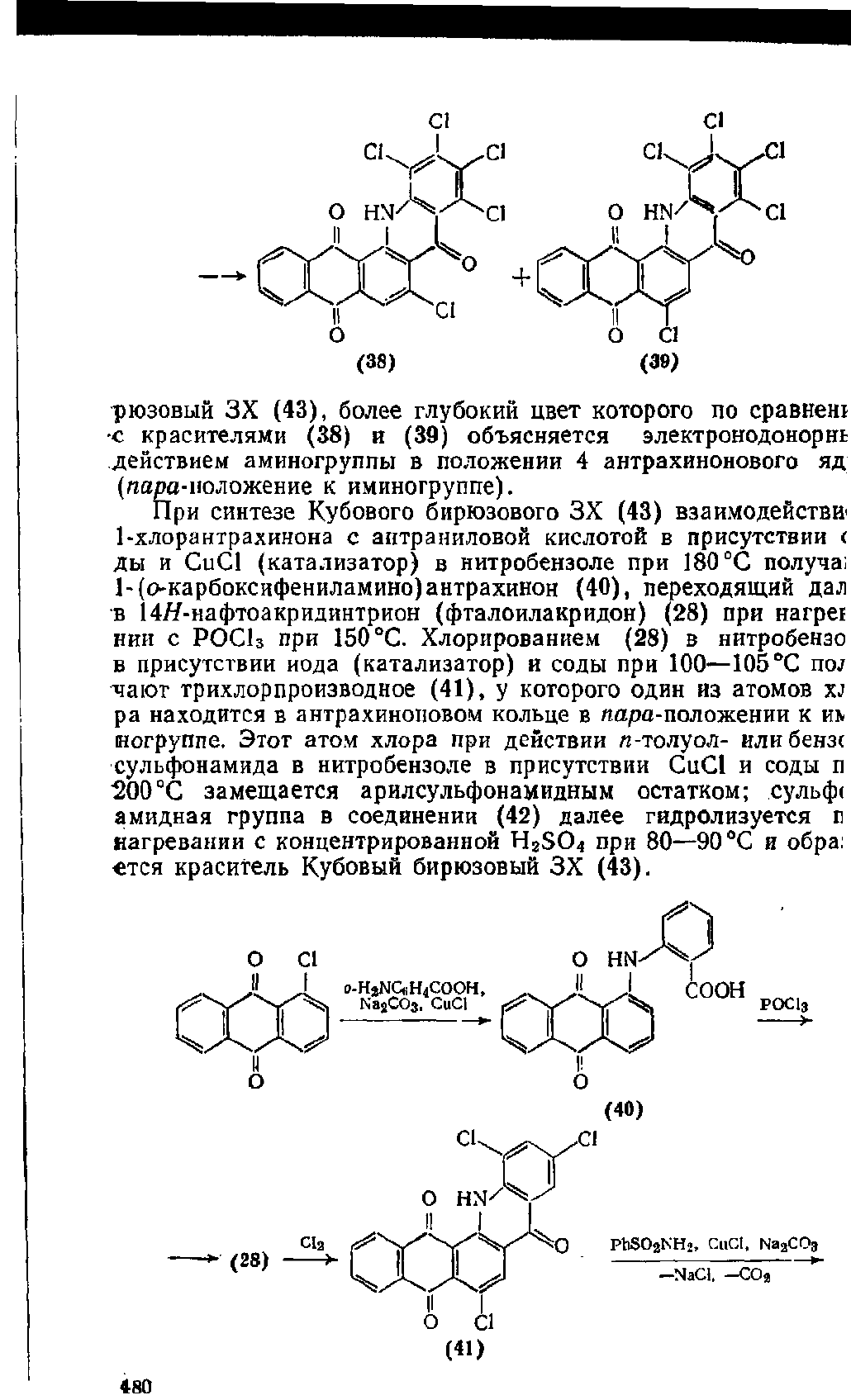
рюзовый ЗХ (43), более глубокий цвет которого по сравнен!
с красителями (38) и (39) объясняется электронодонорнь
действием аминогруппы в положении 4 антрахинонового яд
(яа/?а-ноложение к
иминогруппе).
При синтезе Кубового бирюзового ЗХ (43) взаимодействие
1-хлорантрахинона с антраниловой кислотой в присутствии <
ды и CuCl (катализатор) в нитробензоле при 180 °С получа;
1-(о-карбоксифениламино)антрахинон (40), переходящий дал
в 14#-нафтоакридинтрион (фталоилакридон) (28) при нагре!
нии с РОСЬ при 150 °С. Хлорированием (28) в нитробензо
в присутствии иода (катализатор) и соды при 100—105 °С noj
чают трихлорпроизводное (41), у которого один из атомов xj
pa находится в антрахиноновом кольце в лара-положении к т
еогруппе.
Этот атом хлора при действии я-толуол- или бензс
сульфонамида в нитробензоле в присутствии CuCl и соды п
"200 °С замещается арилсульфонамидным остатком; сульф<
амидная группа в соединении (42) далее гндролизуется г
нагревании с концентрированной H2S04 при 80—90 °С и обра:
егся краситель Кубовый бирюзовый ЗХ (43).
о-НгЫСцНдСООН,
Ка2СОз.
CuCl
^
CI2 (^
(28) >- Г
соон
РОС13
^
PhS02KH2,
CuCl,
Na2C03
»-
—NaCl,
—C02
480
