Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.

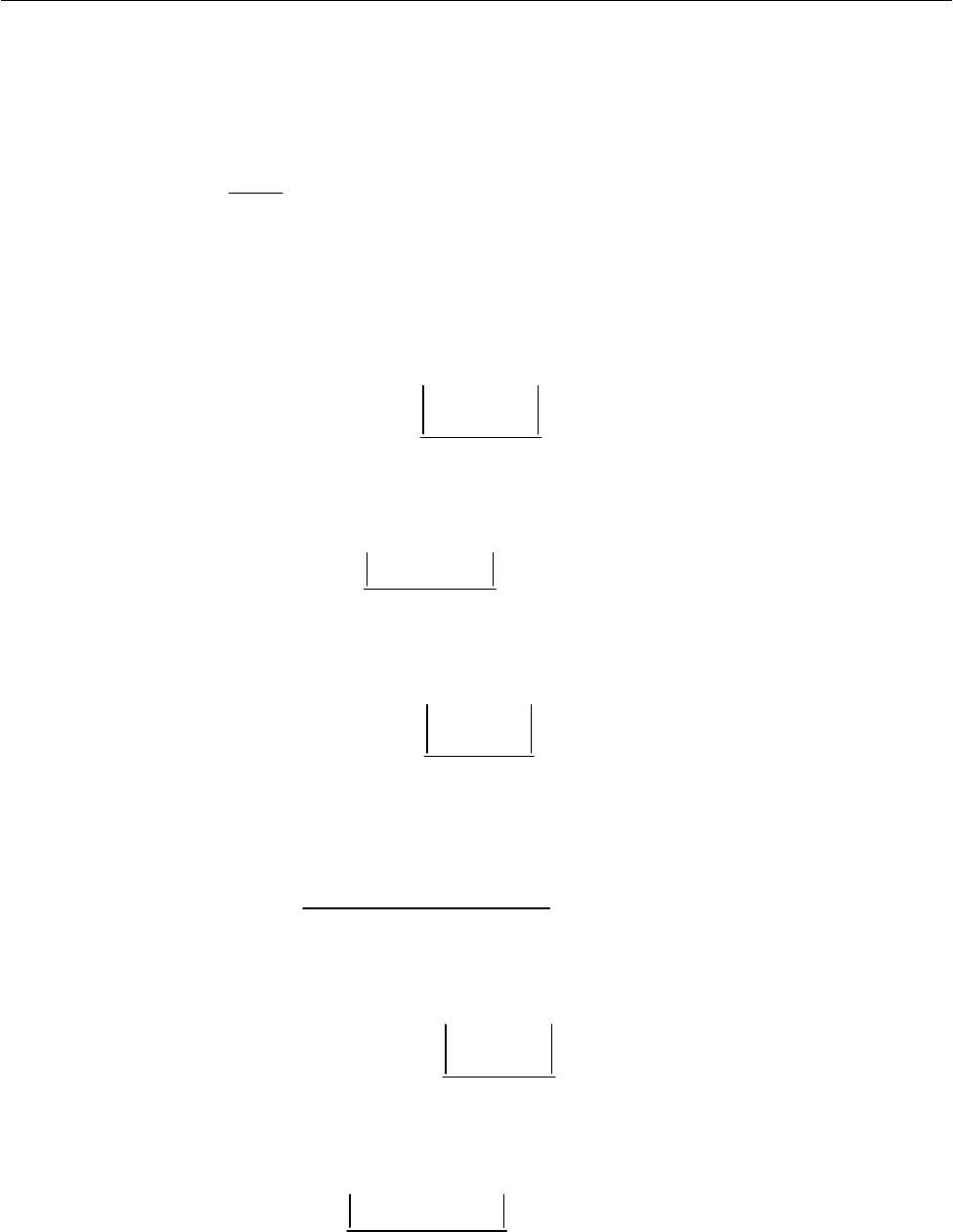
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
120
е) Определение константы скорости реакции
5
k и температуры
6
T по гра-
фику зависимости
(
)
lg 1/kf T= (рис.2.26).
Как видно из графика,
(
)
гр
5
lg 3,045k =− , а следовательно,
()
гр
1
5
89,1ck
−
= .
По графику имеем
()
31
гр
6
1
10 3,09 K
T
−
= , а следовательно,
(
)
гр
6
323,6 KT = .
ж) Расчет погрешности определения величин
56
, и
a
E
kT аналитическим
методом по сравнению с графическим.
Относительную погрешность определения
a
E
найдем по выражению
(
)
()
гр
гр
100
a
aa
E
a
EE
E
−
δ=
,
подставляя в которое конкретные значения величин, имеем
97,4 97,1
100 0,31%
97,4
a
E
−
δ= = .
Относительную погрешность определения
5
k найдем по выражению
(
)
()
5
гр
55
гр
5
100
k
kk
k
−
δ=
,
подставляя в которое конкретные значения величин, имеем
5
55
5
89,1 10 88,7 10
100 0,45 %
89,1 10
k
−
−
−
⋅−⋅
δ= =
⋅
.
Относительную погрешность определения
6
T
найдем по выражению
()
()
6
гр
66
гр
6
T
TT
T
−
δ=
,
подставляя в которое конкретные значения величин, имеем
6
323,6 323,3
100 0,09 %
323,6
T
−
δ= = .
Таким образом, для всех величин имеем удовлетворительное соответст-
вие значений, полученных аналитическим и графическим методами.
Х и м и ч е с к а я к и н е т и к а
121
В. Задачи для самостоятельного решения
Задача 1.
Скорость простой реакции второго порядка, уравнение которой
в общем виде
AB D+→, равна
7
2,7 10
−
⋅
(
)
моль/ лс
⋅
при концентрациях реа-
гентов А
и В соответственно
3
3.0 10 моль/л
−
⋅ и 2,0 моль/л. Рассчитайте кон-
станту скорости реакции.
Ответ: 4,5⋅
5
10
−
л/(моль⋅с).
Задача 2. В простой реакции второго порядка, уравнение которой в об-
щем виде AB 2D
+→ , начальные концентрации реагентов А и В равны по
1,5 моль/л. Скорость реакции равна 2,0
⋅
4
10
−
(
)
моль/ лс
⋅
при
A
1, 0 моль/лс = .
Рассчитайте константу скорости и скорость реакции при
B
0,2 моль/лc
=
.
Ответ:
4
2,0 10k
−
=⋅
()
л/ моль с
⋅
;
6
8,0 10
−
=⋅v
(
)
моль/ лс⋅ .
Задача 3. В простой реакции второго порядка, уравнение которой в об-
щем виде AB 2D+→ , начальные концентрации реагентов А
и В равны соот-
ветственно 0,5 и 2,5 моль/л. Во сколько раз скорость реакции при
A
с = 0,1 моль/л
меньше начальной скорости?
Ответ: в 6,0 раз.
Задача 4. Реакция первого порядка протекает на 30 % за 7 мин. Через ка-
кое время реакция завершится на 99 %?
Ответ: 90,4 мин.
Задача 5. Период полураспада радиоактивного изотопа
90
Sr
, который
попадает в атмосферу при ядерных испытаниях, – 28,1 года. Предположим, что
организм новорожденного ребенка поглотил 1,00 мг
этого изотопа. Сколько
стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он
не выводится из организма?
Ответ: а) 0,64 мг; б) 0,18 мг.
Задача 6. Константа скорости для реакции первого порядка, уравнение
которой
22 2 2
SO Cl SO Cl→+, равна
51
2,2 10 c
−
−
⋅ при 320
o
C. Какой процент
22
SO Cl разложится при выдерживании его в течение 2 ч при этой температуре?
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
122
Ответ: 14,6 %.
Задача 7. В некоторой реакции при изменении начальной концентрации
от 0,502 до 1,007 моль/л время полупревращения уменьшилось с 51 до 26 с
. Оп-
ределите порядок реакции и константу скорости.
Ответ: второй порядок, k = 0,039 л/(моль⋅с).
Задача 8. В некоторой реакции целого порядка n, уравнение которой в
общем виде AB
→ , концентрация реагента 1,0 моль/л была достигнута за
5,0 мин при начальной концентрации 3,0 моль/л и за 6,25 мин
при начальной
концентрации 6,0 моль/л
. Установите порядок реакции.
Ответ: 2n = .
Задача 9. При гомогенно-каталитическом разложении перекиси водорода
получены следующие данные:
2
10 , cτ⋅
0 5,00 8,40 12,48 19,50 31,08 39,30
22
HO
, моль/лc
0,350 0,227 0,160 0,110 0,061 0,025 0,0114
Определите порядок реакции и константу скорости.
Ответ: первый порядок,
31
1,12 10 ck
−
−
=⋅
.
Задача 10. Оксид азота(V) при 67
o
C разлагается по реакции, уравнение
которой
() () ()
25
г 2 г 2 г
2N O 4NO O→+
.
Зависимость концентрации реагента от времени описывается следующими дан-
ными:
, мин
τ
0 1 2 3 4 5
25
NO
, моль/лс
1,000 0,705 0,497 0,349 0,246 0,173
Определите порядок реакции, константу скорости и время полупревращения
25
NO.
Ответ: первый порядок,
31
1/2
5,83 10 c , 118,8 ck
−−
=⋅ τ=
.
Х и м и ч е с к а я к и н е т и к а
123
Задача 11. Радикал ClO
быстро распадается в результате реакции, урав-
нение которой
22
2ClO Cl O→+
.
Были получены следующие кинетические данные:
3
10 , cτ⋅
0,12 0,62 0,96 1,60 3,20 4,00 5,75
6
ClO
10 моль/лc ⋅
8,49 8,09 7,10 5,79 5,20 4,77 3,95
Определите константу скорости реакции.
Ответ:
7
2,42 10k =⋅
(
)
л/ моль с
⋅
.
Задача 12.
Скорость бактериального гидролиза мышц рыб удваивается
при переходе от температуры
o
1,1 C− к температуре
o
2,2 C+ . Оцените энергию
активации этой реакции.
Ответ: 130,8 кДж/моль.
Задача 13. В необратимой реакции первого порядка за 20 мин при 125
o
C
степень превращения реагента составила 60 %, а при 145
o
C такая же степень
превращения была достигнута за 5,5 мин. Найдите константы скорости и энер-
гию активации данной реакции.
Ответ:
41 31
12
7,63 10 c , 2,78 10 c , 89,2 кДж/моль
a
kk E
−− −−
=⋅ =⋅ = .
Задача 14. Реакция первого порядка при температуре 25
o
C
завершается
на 30 % за 30 мин
. При какой температуре реакция завершится на 60 % за
40 мин, если энергия активации равна 30 кДж/моль?
Ответ: 37,6
o
C
.
Задача 15. Реакция первого порядка при 25
o
C завершается на 70 % за
15 мин. При какой температуре реакция завершится на 50 % за 15 мин, если
энергия активации равна 50 кДж/моль?
Ответ: 17
o
C.
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
124
Задача 16. Константа скорости реакции первого порядка равна
41
4,02 10 c
−
−
⋅
при 393 K
и
31
1,98 10 c
−
−
⋅
при 413 K. Рассчитайте предэкспоненциальный мно-
житель для этой реакции.
Ответ:
10 1
8,0 10 cA
−−
=⋅ .
Задача 17. Для реакции, уравнение которой
22
HI 2HI
+
→ , константа
скорости при температуре 683 K
равна
4
10,98 10
−
⋅
(
)
л/ моль с
⋅
, а при темпера-
туре 716 K –
3
6,25 10
−
⋅
(
)
л/ моль с
⋅
. Найдите энергию активации этой реакции
и константу скорости при температуре 700 K.
Ответ: 214 кДж/моль
a
E = ,
3
2,75 10k
−
=⋅
(
)
л/ моль с
⋅
.
Задача 18. Трихлорацетат-ион в ионизирующих растворителях, содер-
жащих
+
H, разлагается по реакции, уравнение которой
323
H CCl COO CO CHCl
+−
+→+.
Стадией, определяющей скорость реакции, является мономолекулярный разрыв
связи CC
− в трихлорацетат-ионе. Реакция протекает по первому порядку.
Константы скорости имеют следующие значения:
41
3,11 10 ck
−−
=⋅ при 90
o
C,
51
7,62 10 ck
−−
=⋅ при 80
o
C. Рассчитайте а) энергию активации, б) константу
скорости при 60
o
C.
Ответ:
61
149,8 кДж/моль,3,5510c
a
Ek
−
−
==⋅.
Задача 19. Для реакции, уравнение которой
325 3 25
CH COOC H NaOH CH COONa C H OH+→ + ,
константа скорости при температуре 282,6 K равна
3
38,45 10
−
⋅
(
)
л/ моль с
⋅
, а
при температуре 318,1 K – 0,36 л/(моль
⋅с). Найдите энергию активации этой ре-
акции и константу скорости при температуре 343 K
.
Ответ:
(
)
47,1кДж/моль,1,32л/ моль с
a
Ek==⋅.
Х и м и ч е с к а я к и н е т и к а
125
2.2.2. Теоретические представления химической кинетики
Основная задача теорий химической кинетики – предложить способ рас-
чета константы скорости элементарной реакции и ее зависимости от темпера-
туры, используя различные представления о строении реагентов и пути реак-
ции. Предметом нашего рассмотрения являются две простейшие теории кине-
тики, а именно:
-
теория активных столкновений (соударений);
-
теория активированного комплекса (переходного состояния) и ее
приближенная математическая модель –
теория абсолютных скоростей ре-
акций
.
Изложение теорий химической кинетики требует, в свою очередь, вывода и
рассмотрения некоторых формул кинетической теории газов.
2.2.2.1. Некоторые элементы кинетической теории газов
1
Вывод основных уравнений кинетической теории газов основан на
законе
распределения Больцмана
– законе распределения молекул по энергиям
/
1
i i
T
i
Nge
B
−ε
=
k
, (2.227)
где
/
1
i
i
T
i
N
B
ge
−ε
=
∑
k
; N – общее число молекул;
i
N – число молекул, обладаю-
щих энергией
2
i
ε ;
i
g – степень (кратность) вырождения (вырожденность),
именуемая также
статистическим весом уровня или его априорной вероят-
1
При рассмотрении данного вопроса, как и в последующем изложении вопросов, касающих-
ся теорий химической кинетики, мы отказались от подробного рассмотрения определений,
законов и принципов, известных студентам из дисциплин «Общая и неорганическая химия»
и «Химия» (см., например, список литературы, рекомендованный в [18]). Так, в частности,
пояснения к понятию «степень вырождения», к принципу
неопределенности Гейзенберга
и т. д. имеют лишь характер напоминания, но не объяснения.
2
Обозначение ε использовано для энергии на молекулу, в отличие от E для энергии на
1 моль.
A
EN=ε , где
A
N – постоянная Авогадро.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
126
ностью, т. е. число состояний, соответствующих данному уровню энергии;
23
=1,381 10 Дж/K
−
⋅k – постоянная Больцмана
1
.
Закон распределения Больцмана, исходя из формулы (2.227), можно
сформулировать следующим образом:
для молекулярной системы, находя-
щейся в равновесии, число молекул, обладающих энергией
ε
i
, пропорцио-
нально множителю Больцмана
T
i
e
−
ε /k
.
Подставляя в выражение (2.227) вместо множителя 1/B его значение, за-
пишем закон Больцмана в виде
/
/
i
i
i
i
T
i
T
i
ge
NN
ge
−
ε
−ε
=
∑
k
k
(2.228)
или
/
i
i
T
i
ge
NN
Q
−
ε
=
k
. (2.229)
Важнейшая величина
/
i
i
T
i
Qge
−
ε
=
∑
k
(2.230)
называется молекулярной суммой по состояниям и представляет собой
сумму множителей Больцмана, записанных для всех возможных энергети-
ческих состояний молекулы.
В развернутом виде сумма по состояниям от-
дельной молекулы (молекулярная сумма по состояниям) записывается так:
3
2
12 3
/T
/
/
…
T
T
i
Qge ge ge
−ε
−
ε
−
ε
=+ + +
k
k
k
(2.231)
Если назвать состояние молекулы с наиболее низкой энергией нулевым состоя-
нием, а соответствующую энергию – нулевой энергией
0
ε
и вырожденность
нулевого уровня обозначить
0
g, то сумму по состояниям можно записать не-
сколько иначе
0
12
012
/
/
//
…
i
i
T
T
TT
i
Qge ge ge ge
−ε
−
ε
−
ε−ε
=+++=
∑
k
k
kk
, (2.232)
1
Постоянная Больцмана связана с универсальной газовой постоянной R соотношением
=/
A
R
Nk . Здесь и далее постоянная Больцмана обозначается через k в отличие от константы
скорости реакции
k.

Х и м и ч е с к а я к и н е т и к а
127
где суммирование распространено на все возможные энергетические состояния
молекулы.
Закон Больцмана, выражаемый формулой (2.229), можно представить в
виде соотношения
/
i
i
T
i
ge
Q
NN
−
ε
=
k
, (2.233)
согласно которому сумма по состояниям так относится к общему числу моле-
кул, как больцмановский множитель, взятый
i
g раз, к
i
N – числу молекул с
энергией
i
ε . Таким образом, сумму по состояниям можно рассматривать как
обобщенный множитель Больцмана, характеризующий полное число мо-
лекул данного вида в системе
.
Для вывода формул кинетической теории газов, используемых в теориях
химической кинетики, закон распределения молекул по энергиям Больцмана,
выражаемый формулой (2.229), удобнее записать в следующей форме:
/
ii
T
i
dN NA g e
−
ε
′
=
k
, (2.234)
отличающейся введением вместо суммы по состояниям
Q ее обратной величи-
ны
A
′
, а также заменой конечного числа молекул
i
N , обладающих энергией
i
ε
,
бесконечно малым
i
dN , что обусловлено фактической непрерывностью изме-
нения энергии поступательного движения. Что касается статистического веса
данного энергетического состояния молекулы
i
g , то в случае непрерывно из-
меняющейся энергии его можно получить, применяя принцип неопределенно-
сти Гейзенберга. Из этого принципа следует, что наименьшее определимое зна-
чение произведения приращений координаты
dq и сопряженного с ней им-
пульса
dp определяется условием
dpdq ≥ , (2.235)
где
34
1,055 10 Дж с
2
h
−
== ⋅ ⋅
π
– постоянная, иногда называемая постоянной
Планка – Дирака [13];
h = 6,626⋅
34
10
−
Дж⋅с – постоянная Планка. В квантовой
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
128
статистике объем элементарной ячейки фазового пространства
1
принимается
равным
()
2
s
s
hπ=
, где s – число степеней свободы движения.
Кратко рассмотрим одномерное движение. Пусть энергия поступательно-
го движения частицы массой
m вдоль координаты x составляет
2
/2
i
mxε=
(/
x
dx d=τ
– скорость), а «объем» элементарной ячейки равен h (s = 1, так как
движение одномерное). Отсюда статистический вес рассматриваемого энерге-
тического состояния молекулы с координатами между
x и
x
dx+ и скоростями
между и
x
xdx+
будет
i
mdxdx
g
h
=
. (2.236)
Следовательно, доля молекул, обладающих такими характеристиками, опреде-
ляется выражением
2
/2
mx T
dN mdxdx
Ae
Nh
−
′
=
k
. (2.237)
Интегрируя
2
выражение (2.237) по
x
от до
−
∞+∞ и по x от 0 до a, где a –
длина отрезка, на котором рассматривается движение, можно определить ко-
эффициент пропорциональности
A
′
. Интегрирование по x дает непосредствен-
но множитель
a, поэтому
2
/2
mx T
dN A am
edx
Nh
−
′
=
k
. (2.238)
В этом выражении доля молекул /
dN N отличается от доли молекул /dN N ,
определяемой выражением (2.237), хотя и записана в той же форме. Выражение
(2.238) определяет долю молекул, движущихся вдоль отрезка
a со скоростями в
пределах от до
x
xdx+
. Интегрирование уравнения (2.238) по скорости позво-
ляет получить выражению для
A
′
:
()
()
1/2
пост 1
1
2
h
A
Q
mT a
′
==
π
k
, (2.239)
1
Многомерного пространства координат и импульсов, в котором состояние молекулы или
системы молекул изображается точкой.
2
Рассмотрение конкретных способов проведения тех или иных математических действий
выходит за рамки настоящего изложения, так как является предметом высшей математики.
Х и м и ч е с к а я к и н е т и к а
129
где
()
пост 1
Q – величина, обратная
A
′
, – сумма по состояниям одномерного по-
ступательного движения. Подставляя значение
A
′
в уравнение (2.238), получим
выражение
1/2
2
/2
2
mx T
dN m
edx
NT
−
⎛⎞
=
⎜⎟
π
⎝⎠
k
k
, (2.240)
представляющее собой закон распределения молекул по скоростям при одно-
мерном движении. Отношение /
dN N в выражении (2.240) можно рассматри-
вать как вероятность того, что скорость наугад взятой молекулы будет лежать в
пределах от до
x
xdx
+
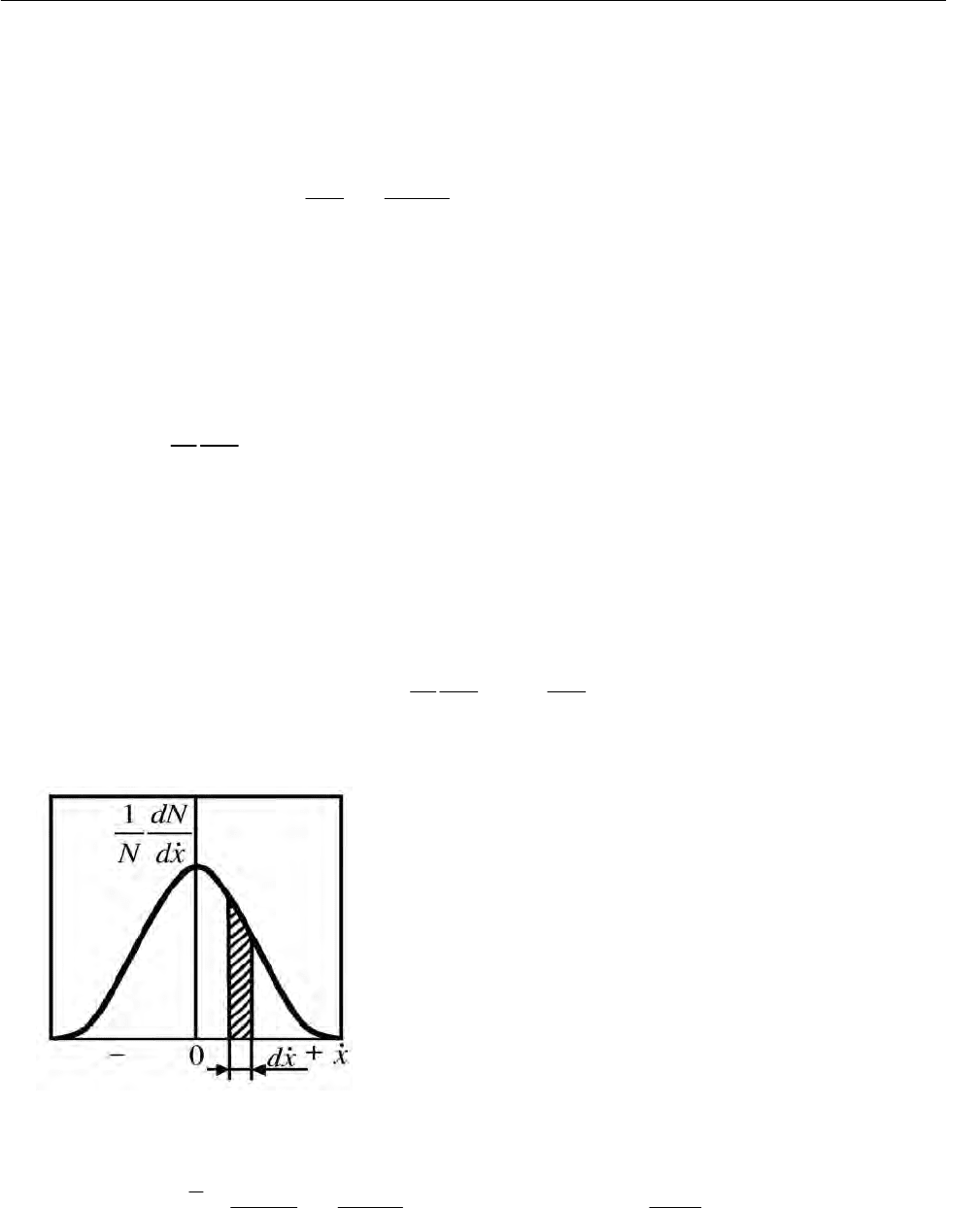
. На рис. 2.27 показан график функции (2.240), в виде
доли молекул
1 dN
Ndx
, скорость которых лежит в пределах от до 1
x
x +
.
Наиболее вероятная скорость равна нулю, и доля молекул уменьшается
симметрично с увеличением скорости в обе стороны. Доля молекул /
dN N со
скоростью, лежащей от до
x
xdx
+
, т.е., другими словами, в интервале dx
,
численно равна площади
ds заштрихованной криволинейной трапеции:
1 dN dN
ds dx
Ndx N
⎛⎞
==
⎜⎟
⎝⎠
. (2.241)
Закон распределения (2.240) позволяет оп-
ределить среднюю скорость движения молекул в
одном направлении. Она находится путем сум-
мирования абсолютных значений скоростей всех
молекул и деления суммы (интеграла) на общее
число молекул:
1/2 1/2
0
2
/2
22
mx T
xdN
mT
xxedx
NT m
∞
−
⎛⎞ ⎛⎞
== =
⎜⎟ ⎜⎟
ππ
⎝⎠ ⎝⎠
∫
∫
k
k
k
. (2.242)
Рис. 2.27. Распределение молекул по одной ком-
поненте скорости
x
