Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
140
3. Частицы (молекулы) имеют сферическую форму. Соударения между
ними
абсолютно упругие, т. е. общая поступательная кинетическая энергия
сталкивающейся пары одинакова до и после столкновения: энергия ни од-
ной из сталкивающихся частиц (молекул) не переходит во вращательную,
колебательную или другие виды энергии
.
Во всем предыдущем изложении мы неоднократно указывали условия,
необходимые для протекания химической реакции. Бимолекулярная реакция
может осуществляться только при «столкновении», т. е. достаточно тесном
сближении, двух молекул. При этом не всякое столкновение приводит к реак-
ции. Обобщим основные причины этого, т. е., другими словами, сформулируем
основные факторы, определяющие возможность осуществления
химической
реакции и влияющие на ее протекание.
1.
Необходимость соответствующей ориентации молекул в момент
столкновения
. Вероятно, более или менее сложные молекулы могут прореаги-
ровать, если в момент столкновения они ориентированы в пространстве надле-
жащим образом, т. е. образуют конфигурацию, наиболее подходящую для раз-
рыва одних связей и возникновения новых.
2.
Необходимость стабилизации молекулы. При бимолекулярной ассо-
циации атомов или простых радикалов необходима стабилизация образовав-
шейся колебательно-возбужденной молекулы. Энергия возбуждения, по мень-
шей мере, равна, а чаще превышает энергию разрыва связи и поэтому обра-
зующаяся квазимолекула существует только в течение одного полупериода ко-
лебания, т. е. приблизительно
14
10
−
с. Из всех мыслимых путей потери избы-
точной энергии реальным представляется стабилизация путем отдачи избыточ-
ной энергии третьему телу. Отмеченное имеет место, например, в цепных реак-
циях на стадии обрыва цепи (см. 2.2.1.7), когда атомы в газовой фазе рекомби-
нируют с частотой тройных соударений.
3.
Квантовые препятствия. Реакция при прочих равных условиях будет
медленной, если в реагирующей системе должно измениться электронное со-
стояние, например мультиплетность. Примером таких реакций, называемых
не-
адиабатическими
, могут служить некоторые процессы цис-транс-
изомеризации. Возможно, что в таких реакциях основное синглетное состояние
должно перейти в триплетное, а вероятности таких электронных переходов (за-
прещенных переходов) малы.
Х и м и ч е с к а я к и н е т и к а
141
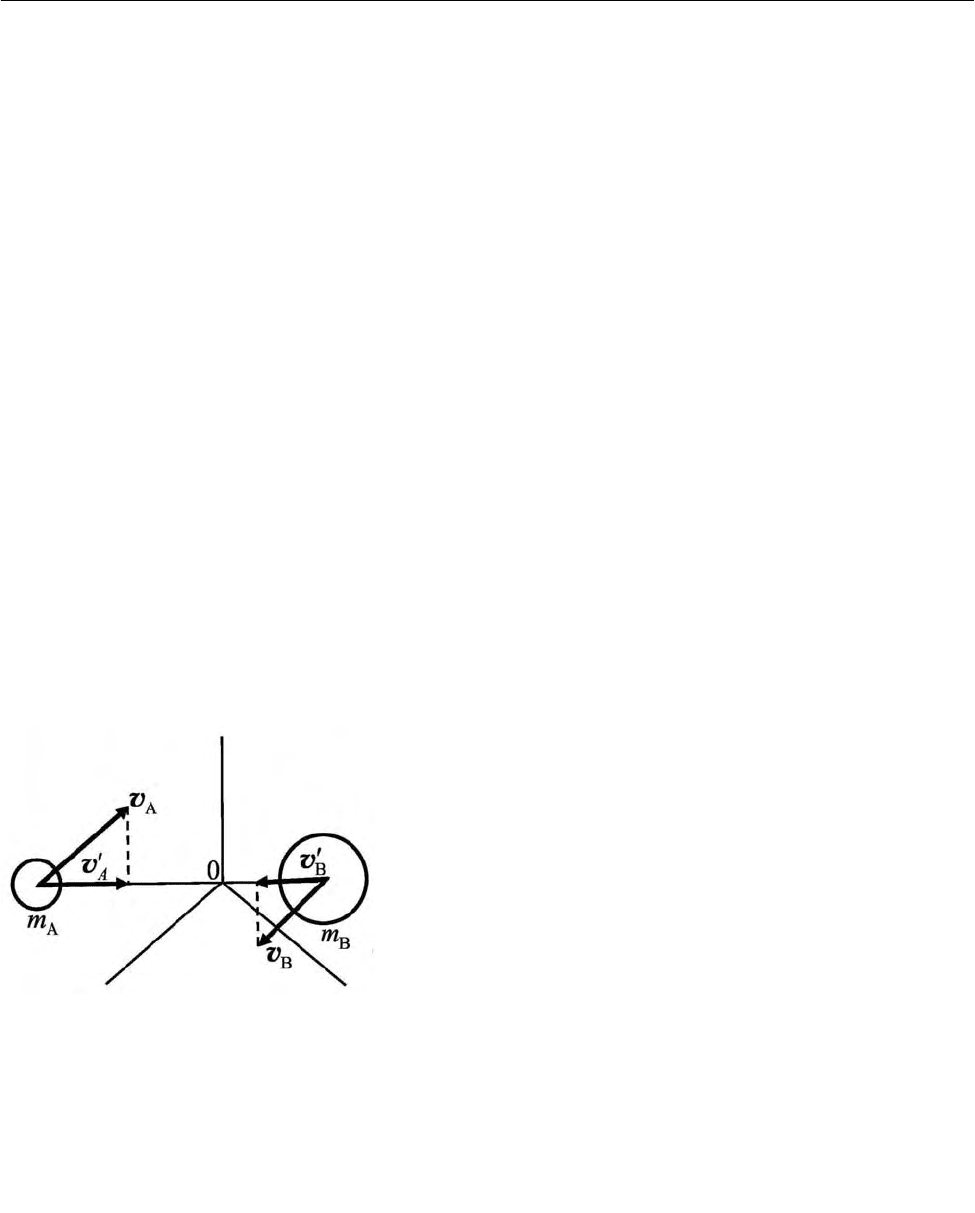
Рис. 2. 31. Скорость молекул
в момент столкновения:
0 – начало координат, по-
мещенное в центр массы со-
ударяющейся системы
4.
Энергия активации. Необходимое условие эффективности столкнове-
ния – это достаточная энергия столкновения (см. 2.2.2.2). Перечисленные в пер-
вых трех пунктах причины уменьшения числа эффективных столкновений дей-
ствуют в отдельных случаях. В то же время, еще со времен Аррениуса наиболее
важным считается соблюдение энергетического условия:
эффективным
столкновением является, в первую очередь, то столкновение, которое про-
исходит с достаточной энергией
.
Молекула в ходе соударения с другой молекулой должна быть значитель-
но деформирована, чтобы соответствующие атомы могли сблизиться и, образуя
новые связи, дать продукты. Для такой деформации необходима затрата значи-
тельной энергии –
энергии активации, которую с точки зрения теории столк-
новений можно определить как
минимально необходимую энергию, которой
должна обладать молекула в момент столкновения, чтобы прореагировать
.
Для подсчета числа таких активных столкновений, которое значительно
меньше общего числа столкновений (см. 2.2.2.1, 2.2.2.2), необходимо устано-
вить вид энергии, принимающей участие в активации. Однако на первом этапе
подсчета важен не сам вид энергии, а число квадратичных членов в выражении
энергии.
В простейшем варианте теории столкно-
вений бимолекулярных реакций рассматрива-
ется относительная
кинетическая энергия мо-
лекул вдоль линии, соединяющей их центры
(см. 2.2.2.1). При этом деформация молекул,
связанная, так сказать с «силой удара в лоб»,
будет определяться проекциями векторов
A
v и
B
v
на линию, соединяющую центры молекул,
т. е. относительными скоростями
A
′
v и
B
′
v
вдоль линии центров (рис. 2.31). В таком слу-
чае относительная кинетическая энергия
R
вдоль линии центров будет определяться выра-
жением (2.258), а условием эффективности
столкновения, т. е. осуществления реакции, будет соотношение
E
≥R , (2.268)
где
E – критическое значение энергии, т. е. энергия активации.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
142
Число двойных столкновений, удовлетворяющих условию (2.268), т. е.
эффективных столкновений
E
Z
, отвечает формуле (2.266). Полное число двой-
ных столкновений за 1 с в 1
3
м между одинаковыми молекулами рассчитываем
по уравнению(2.257), а для молекул двух разных видов – по уравнению (2.256).
На основании теории активных столкновений и молекулярно-кинетических
представлений получим выражения для константы скорости
1
элементарной бимо-
лекулярной реакции второго порядка применительно к более общему случаю, т. е. с
участием молекул двух видов. Кинетическое уравнение реакции, уравнение кото-
рой в общем виде
AB Продукты
+
→ ,
может быть выражено следующим образом:
AB
3
1
мс
k
⎛⎞
=νν
⎜⎟
⋅
⎝⎠
v или
AB
3
моль
мс
kсс
⎛⎞
=
⎜⎟
⋅
⎝⎠
v , (2.269)
где
k – константа скорости;
AB
иνν – частичные концентрации веществ А и В,
3
м
−
;
AA
/
A
с N=ν и
BB
/
A
с N=ν – молярные концентрации веществ А и В,
3
моль/м ;
A
N –постоянная Авогадро.
Число эффективных столкновений
E
Z
равно числу реагирующих моле-
кул, т. е. имеем
A
E
d
Z
d
ν
=−
τ
или
A
EA
dc
ZN
d
=−
τ
. (2.270)
Скорость реакции, как известно (см. 2.2.1.1), равна
A
3
1
мс
d
d
τ
ν
⎛⎞
=−
⎜⎟
⋅
⎝⎠
v или
A
3
моль
мс
dс
d
⎛⎞
=−
⎜⎟
τ
⋅
⎝⎠
v . Следовательно, можно заключить, что
E
Z = v
или
EA
Z
N
=
v
. (2.271)
1
Здесь параллельно будет приведен вывод выражений для константы скорости в двух случа-
ях, а именно: при использовании концентраций исходных веществ
33
, ми ,моль/м
ii
c
−
ν .
Скорости и константы скорости, получаемые в этих случаях, не идентичны, и для их разли-
чия (при сохранении одинаковых обозначений
v и k) у соответствующих выражений приво-
дятся единицы измерений в СИ. Для того чтобы не перегружать формулы индексами будем
обозначать константу скорости через
()
II
, а не kk, понимая при этом, что речь идет о констан-
те скорости бимолекулярной реакции второго порядка.

Х и м и ч е с к а я к и н е т и к а
143
Тогда выражение (2.266) перепишем в виде
3
/
1
мс
TER
Ze
−
⎛⎞
=
⎜⎟
⋅
⎝⎠
v или
3
/
1 моль
мс
A
ERT
Ze
N
−
⎛⎞
=
⎜⎟
⋅
⎝⎠
v . (2.272)
Приравнивая правые части уравнений (2.269) и (2.272), учитывая
/
iiA
с N=ν и решая относительно k, получаем
3
AB
/
1 м
с
ERT
kZe
−
⎛⎞
=
⎜⎟
νν
⎝⎠
или
3
AB
/
м
моль с
A
ERT
N
kZe
−
⎛⎞
=
⎜⎟
ν
ν⋅
⎝⎠
(2.273)
Подставляя в выражения (2.273) значение полного числа двойных столкнове-
ний
1
[выражение (2.256)], получаем уравнения для расчета константы скорости
реакции
или
1/2
3
2
AB
AB
1/2
3
2
AAB
AB
1/2 /
1/2 /
11 м
8
с
11 м
8,
моль с
ERT
ERT
kD R Te
MM
kND R Te
MM
−
−
⎡⎤
⎛⎞
⎛⎞
=π +
⎢⎥
⎜⎟
⎜⎟
⎝⎠
⎝⎠
⎣⎦
⎡⎤
⎛⎞
⎛⎞
=π+
⎢⎥
⎜⎟
⎜⎟
⋅
⎝⎠
⎝⎠
⎣⎦
(2.274)
где
или
3
2
AB 0
AB AB
3
2
AB 0
AB AB
1/2
1/2
1/2
1/2
11 м
8
с
11 м
8;
моль с
AA
Z
DR T Z
MM
Z
ND R T N Z
MM
π
⎡⎤
⎛⎞
⎛⎞
+==
⎢⎥
⎜⎟
⎜⎟
νν
⎝⎠
⎝⎠
⎣⎦
⎡⎤
⎛⎞
⎛⎞
π− = =
⎢⎥
⎜⎟
⎜⎟
ν
ν⋅
⎝⎠
⎝⎠
⎣⎦
(2.275)
а
0
Z
– частотный множитель теории столкновений.
Исходя из уравнений (2.274) и (2.275), можем записать общее теоретиче-
ское выражение для константы скорости бимолекулярной реакции второго по-
рядка:
0
/ERT
kZe
−
= . (2.276)
Введя обозначение
1
Для реакции с молекулами двух разных видов
AB
Z
Z
≡
. Поэтому, чтобы не перегружать
формулы индексами, мы будем далее при выводе использовать обозначение
Z.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
144
или
2
AB
AB
2
AB
AB
1/2
1/2
11
8
11
8,
A
BD R
MM
BND R
MM
⎡⎤
⎛⎞
=π +
⎢⎥
⎜⎟
⎝⎠
⎣⎦
⎡
⎤
⎛⎞
=π+
⎢
⎥
⎜⎟
⎝⎠
⎣
⎦
(2.277)
вместо уравнений (2.275) можно написать:
0
1/2
Z
BT= . (2.278)
Подставляя выражение (2.278) в формулу (2.276), получаем
1/2 /ERT
kBTe
−
=
. (2.279)
Входящая в выражения (2.276) и (2.279) величина Е называется
истин-
ной энергией активации
в отличие от опытной или аррениусовской
a
E
из
уравнений (2.211) и (2.215). Можно констатировать, что теоретическое уравне-
ние (2.276) по своей форме очень похоже на уравнение Аррениуса (2.215) и по-
зволяет выразить константу скорости в виде двух сомножителей: предэкспо-
ненциального множителя
0
Z
, который, как видно из выражения (2.278), мало
зависит от температуры (
0
Z
зависит от
1/2
T ) и экспоненциального множителя
/ERT
e
−
, который и выражает основную зависимость от kT. Поэтому уравне-
ние (2.276) можно рассматривать как теоретическое обоснование уравне-
ния Аррениуса на основе теории активных столкновений
.
Установим связь между опытной и истинной энергиями активации. Лога-
рифмирование уравнения (2.279) дает
1
ln ln ln
2
E
kB T
R
T
=+ −. (2.280)
Дифференцирование равенства (2.280) по Т (так как В приближенно не зависит
от температуры) приводит к соотношению
22
1
ln 1
2
2
E
RT
dk E
dT T
R
TRT
+
=+ = . (2.281)
Соотношение (2.281) следует сопоставить с дифференциальной формой урав-
нения Аррениуса (2.211). Ввиду тождественности производных находим

Х и м и ч е с к а я к и н е т и к а
145
1
2
a
E
ERT=+ . (2.282)
Истинная энергия активации
1
2
a
E
ERT=−
(2.283)
оказывается величиной, зависящей от температуры, если считать
a
E
постоян-
ной. Однако при 300 400 K 1/ 2 1,2 1,4 кДж/моль
R
T−=−, а поскольку значения
энергии активации химической реакции обычно составляют от 50 до
200 кДж/моль, то при практических расчетах можно считать, что
a
E
E≈
. По-
этому для приближенного расчета констант скоростей реакций вместо
Е можно
использовать энергию активации
a
E
, вычисленную по уравнению Аррениуса
на основании экспериментальных данных.
Энергия активации в теории активных столкновений не вычисляется, а
определяется опытным путем по зависимости скорости реакции от температу-
ры. Предэкспоненциальные множители для бимолекулярных элементарных ре-
акций рассчитывают по уравнению (2.275). Однако бимолекулярные реакции,
для которых предэкспоненциальные множители, найденные экспериментально
и путем расчета, совпадают,
встречаются сравнительно редко. Чаще всего пре-
дэкспоненциальные множители, рассчитанные теоретически, значительно пре-
вышают экспериментальные значения. Это связано со всеми упрощениями, до-
пущениями и предположениями, основные из которых как применительно к
самой теории активных столкновений, так и к кинетической теории газов, нами
были сформулированы выше. Исходя из этого, в уравнение (2.276) вводится
множитель
P, учитывающий отклонение теоретических расчетов от опытных
данных. В теории активных столкновений его называют
стерическим факто-
ром
или стерическим множителем. Уравнение (2.276) с учетом этого множи-
теля принимает вид
0
/ERT
kPZe
−
=
. (2.284)
Ранее мы уже отмечали, что одним из факторов, определяющих возмож-
ность осуществления химической реакции, является необходимость соответст-
вующей ориентации молекул в момент столкновения. Стерический фактор
P в
большинстве случаев и характеризует вероятность определенной геометриче-
ской конфигурации частиц при столкновении. Как вероятностная величина сте-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
146
рический фактор изменяется в довольно широких пределах. Для реакций ато-
мов и однородных молекул его значение близко к единице. В реакциях, связан-
ных с взаимодействием сложных молекул и радикалов, стерический фактор ле-
жит в интервале
63
10 10
−
−
− .Существуют реакции с очень низким значением
стерического фактора, равным
10 8
10 10
−
−
−
.
Есть и другие причины, приводящие к расхождению теории активных
столкновений с опытом, которые также учитываются стерическим фактором.
Вследствие
туннельного эффекта
1
элементарный акт может произойти при
значениях энергии активации, меньше
Е, что формально характеризуется вели-
чиной
P > 1.Вновь образующиеся молекулы могут быть сильно возбужденны-
ми и если не освободятся от избытка энергии после своего возникновения, то
могут вновь превратиться в молекулы реагента. В этом случае
P < 1. Экспери-
ментально определяемая константа скорости реакций, протекающих по цепно-
му механизму, значительно превышает значение, вычисленное по теории
столкновений. Стерический фактор при этом может быть значительно больше
единицы. Следовательно, в теории активных столкновений стерический фактор
представляет собой эмпирический поправочный коэффициент.
Теория активных столкновений с ее сравнительно простой трактовкой
проблем химической кинетики
объяснила много разнообразных факторов. Она
показала, что элементарная химическая реакция протекает через стадию акти-
вации реагирующих молекул, что константа скорости реакции определяется
частотным (число столкновений) и энергетическим (энергия активации) факто-
рами. Но одновременно из-за своей схематичности она привела к противоречи-
ям с опытом. Данная теория не объясняет влияния на скорость
реакции раство-
рителя, давления, добавок инертных газов и других факторов. Она не позволяет
сделать теоретическую оценку стерического фактора. Теория, опирающаяся
только на законы классической механики и молекулярно-кинетические пред-
ставления, не могла раскрыть природу активного состояния, а следовательно, и
определить пути теоретического расчета или оценки таких факторов, как энер-
гия
и энтропия активации. Теория элементарных реакций в дальнейшем разви-
валась на базе законов классической и квантовой механики.
1
Туннельным эффектом называется прохождение («просачивание») частиц сквозь потенци-
альный барьер. Туннельный эффект является чисто квантовомеханическим эффектом, не
имеющим аналогов в классической физике. Он указывает, в частности, на наличие опреде-
ленной вероятности химического взаимодействия между молекулами, когда их энергии
меньше энергии активации.

Х и м и ч е с к а я к и н е т и к а
147
2.2.2.4. Теория активированного комплекса или переходного
состояния. Теория абсолютных скоростей реакций
А. Общие положения
Основная идея теории активированного комплекса или переходного со-
стояния заключается в том, что элементарный акт химической реакции состоит
в постепенной перестройке химических связей, при которой начальная конфи-
гурация атомов в молекулах реагентов переходит в конечную у продуктов при
непрерывном изменении межатомных расстояний. Об этом методе и свойствах
активированного комплекса мы уже
говорили весьма подробно в 2.2.1.9.
Атомы, при которых происходит разрыв или образование химических
связей, могут рассматриваться как главные участники элементарного акта. Их
взаимное расположение наиболее существенно изменяется в ходе элементарно-
го акта, в частности при образовании активированного комплекса, и их можно
рассматривать как
реакционный центр активированного комплекса. Так, на-
пример, в реакции
33
СH I OH CH OH I
−
−
+
→+ (2.285)
разрывается связь С – I
и образуется связь С – О. Поэтому реакционный центр
активированного комплекса можно представить как I … С … О. Отмеченное
нельзя рассматривать как указание на то, что остальные связи не претерпевают
никаких изменений. Однако важнейшие изменения, связанные с перестройкой
системы химических связей, все же происходят в пределах реакционного цен-
тра.
Из вышесказанного становится понятно, что
элементарные реакции мож-
но классифицировать по типам реакционных центров активированных ком-
плексов. Эти центры могут содержать разное число атомов, т.е. активирован-
ные комплексы могут быть
двух-, трех-, четырехцентровыми
1
и т. д. Кроме
того, атомы, входящие в состав реакционного центра, содержащего три и более
атомов, могут образовать замкнутую или разомкнутую линию. В соответствии с
этим активированный комплекс может быть
циклическим или линейным.
1
Термины трех- и четырехцентровый активированный комплекс тождественны ранее ис-
пользованным (см. 2.2.1.7) терминам трех- и четырехчленный активированный комплекс.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
148
Через двухцентровый активированный комплекс проходят реакции обра-
зования и разрыва химических связей, а также взаимопревращение пространст-
венных изомеров. Известно (см., например, литературу, рекомендованную в
[18]), что при образовании связи энергия плавно падает по мере сближения
взаимодействующих атомов до некоторого минимального значения, соответст-
вующего устойчивой связи. Таким образом, образование химических связей не
сопряжено с преодолением энергетического барьера и для не слишком сложных
реакций осуществляется практически при каждом соударении. В соответствии с
формулой (2.226) обратная реакция разрыва химической связи имеет энергию
активации, равную тепловому эффекту реакции, т. е. энергии разрыва связи, что
позволяет оценить устойчивость химических соединений в зависимости от
энергии разрыва связей в них
.
Рассмотрение трехцентрового активированного комплекса ограничим ре-
акциями, идущими через линейный комплекс, примерами которых являются
реакции, уравнения которых (2.225), (2.285). В общем виде все эти реакции
можно представить как
A B D A…B…D A B D+−→ →−+.
В них атом или радикал D, связанный с атомом или радикалом В, замещается
на атом или радикал А. Такие реакции называются
реакциями замещения.
Существуют и некоторые другие типы реакций с линейным трехцентровым ак-
тивированным комплексом, например присоединения по кратной связи.
Во всех рассмотренных реакциях с линейным трехцентровым активиро-
ванным комплексом происходит разрыв одной химической связи. Если бы он
предшествовал образованию новой химической связи, то энергия активации ре-
акции была бы равна энергии разрыва
связи, а такие реакции могут идти лишь
при достаточно высоких температурах. Однако многочисленные реакции заме-
щения идут с измеримой скоростью при комнатной или, по крайней мере, при
умерено высоких температурах. Из этого следует, что новая связь А – В
начи-
нает образоваться при еще не разорванной связи В
– D.
Рассмотренный пример является наглядной иллюстрацией того, что
в хо-
де элементарного акта атомы, входящие в реакционный центр активиро-
ванного комплекса, перемещаются так, что система все время находится в
связанном состоянии – при ее
«движении» по координате реакции разрыв
старых связей сопровождается одновременным образованием новых. Это
важнейшая особенность всех элементарных актов с трех- и более центро-

Х и м и ч е с к а я к и н е т и к а
149
выми активированными комплексами, которая, по существу, и делает ве-
роятным их протекание
.
Примером реакции с циклическим четырехцентровым активированным
комплексом может служить реакция димеризации этилена с образованием цик-
лобутана, которую можно представить уравнением
22 2 2 22
22 2 2 22
CH CH CH CH CH CH
CH СH СHCH CHCH
=−
+→ →
=−
…
…
.
Синхронный разрыв двух существующих и образование двух новых свя-
зей в четрехцентровом циклическом активированном комплексе, в отличие от
линейного трехцентрового активированного комплекса, связан с очень значи-
тельным повышением энергии системы атомов. Действительно, как мы уже от-
мечали при рассмотрении сопряженных реакций (см. 2.2.1.7), в ряде случаев
(окисление бензола в фенол при
низкой температуре пероксидом водорода)
прямое взаимодействие компонентов, которое должно протекать через четы-
рехцентровый циклический комплекс практически не приводит к образованию
продуктов, что связано с необходимостью преодоления высокого энергетиче-
ского барьера. Данная реакция легко протекает только в присутствии индукто-
ра, когда она является многостадийной и реализуется через трехцентровый ли-
нейный активированный
комплекс.
При вычислении констант скорости элементарных реакций первой зада-
чей является определение потенциальной энергии взаимодействия сталкиваю-
щихся частиц. Потенциальная энергия взаимодействия в общем случае зависит
от набора координат электронов и координат ядер и должна содержать вклады
от электрон-электронных, электрон-ядерных и ядерно-ядерных взаимодейст-
вий. Данная задача чрезвычайно трудоемка, и
поэтому обычно пользуются
адиабатическим приближением. Оно основано на возможности разделения
движений по различным степеням свободы, если масштабы характеристиче-
ских времен этих движений существенно разные.
Масса любого ядра более чем в 10
3
раз превышает массу электронов.
Следовательно, характеристические времена движений электронной и ядерной
подсистем будут существенно различаться, т. е. изучение электронов можно
проводить при любом фиксированном положении ядер. При изменении поло-
жения ядер электронное движение как бы безынерционно следует за движени-
ем ядер, т. е. любому расположению ядер в молекуле отвечает определенное
