Мамаев Н.Н. Гематология: руководство для врачей
Подождите немного. Документ загружается.


Kyk К.
Л.,
RctfkumarS,
V.
Multiple
mydomi
// New
brig].
J. Med. --
2004.
- Vol. 351.
I'
1060 1077.
KyU
R. A. |et a(.(.
Prognostic markers
and
criteria
to
initiate therapy
in
Waldenstrom's
mecroglobuilnemU:
consensus panel recommendations from
the
Second Interanional Works-
hop
on
Waldenstrom's Macroglobulinemia
//
Semin. Oncol.
—
2003.
— Vol. 30. —
P.
116-120.
Nordquist
L. Г.,
Saba
H. I,
Moscilnski
L. С IgM
myeloma:
an IgM
gammopathy distinct
from
Waldenstrom's macroglobulinemia
//
Hematology.
— 2001. — Vol. 6. — P.
53—58.
Pmneri
G. )et al.j.
Translocation t(4;14)(pl6,3;q32)
is a
recurrent general lesion
in
prima-
ry amyloidosis
//
Amer.
J.
Pathol.
- 2001, - Vol. 158. - P.
1599-1600.
Reece
D. E. An
update
of the
management
of
multiple myeloma:
the
changing landscape
//
Hematology (Amer.
Soc.
Hematol. Educ. Program).
-
2005.
-- P.
353-359.
12
Зак. 45.14

Глава
14.
ЛИМФОМЫ
Лимфомы
— это группа злокачественных заболеваний, в
осно
ве которых лежит клональная экспансия лимфоидных клеток разной степени зре-
лости. Основным опухолевым субстратом являются лимфоциты, проходящие
дифференцировку
в периферических лимфоидных органах и тканях (лимфоузлах,
селезенке,
лимфоидной ткани слизистых оболочек, вилочковой железе). Исклю
чение составляют лимфобластные лимфомы, развивающиеся из клеток-предшест-
венников,
находящихся в
костном
мозге.
Все лимфомы делятся на две большие
категории:
лимфома Ходжкина (ЛХ) и неходжкинские лимфомы (НХЛ).
Эпидемиология.
Лимфомы встречаются относительно редко и составляют
4—6 % от
всех
онкологических заболеваний. За последние 20 лет в экономиче-
ски
развитых странах отмечено увеличение заболеваемости лимфомами прибли-
зительно в 2 раза. Причина этого явления не ясна. Определенный вклад внесла
эпидемия
СПИДа, так как иммунодефицитные состояния относятся к факторам
риска
развития лимфопролиферативных заболеваний. Увеличение продолжи-
тельности жизни и
общее
постарение
населения также
могут
быть причинами
повышения
частоты возникновения лимфом.
Возрастание заболеваемости коснулось
всех
гистологических типов, особенно
агрессивных и экстранодальных форм. Темп прироста количества
случаев
экстра-
нодальных НХЛ в США составляет
3,0—6,9
% в год по сравнению с
1,7—2,5
%
для нодальных вариантов заболевания. Частота первичных лимфом головного
мозга за 20 лет увеличилась в 10 раз, ежегодный прирост равняется 10 %.
В
2004
г. в США расчетная заболеваемость составила 62 250 человек, при этом на
долю
НХЛ пришлось 54 370 случаев, а остальные — на лимфому Ходжкина.
Летальность от лимфом также выросла за последние 20 лет, несмотря на ус-
пехи, достигнутые в лечении данной патологии. До 1970 г. в Европе, США и
Японии
этот показатель составлял 3 на 100 000 населения среди мужчин и 2 на
100 000 населения среди женщин; в 199S г. увеличился в Европе соответственно
до 4,4 и 2,8 на 100 000 населения, в то же время в США летальность среди муж-
чин
достигла 6 на 100 000, а среди женщин - 4 на 100 000. В 1997 г. в США
НХЛ были основной причиной смерти мужчин в возрасте от 20 до 39 лет среди
всех
смертей от злокачественных заболеваний.
В целом мужчины болеют чаще, чем женщины, приблизительно в 1,7—
1,8 раза. Средний возраст заболевших составляет 65 лет. Пик заболеваемости
приходится на
80—85
лет.
Существуют
географические различия в распределе-
нии
гистологических подтипов лимфом: эндемический тип лимфомы Беркитта
встречается в основном среди детей экваториальной Африки. Назальная Т-кле-

И.
.»,...,
„.„.. .„„,
ii.i\
it
Японии
и
странах
Карибского
бассейна,
iMi.ni распространенный
вид
лимфом
-
диффузная В-крупноклеточная
|и)ми.
Л<1лее
следует
фолликулярная лимфома. MALT-лимфома, ХЛЛ/лим-
• in
мелких лимфоцитов, лимфома
из
клеток зоны мантии
и
перифериче-
г клеточная лимфома встречаются приблизительно
с
одинаковой частотой
HIT
третье
место. Остальные виды неходжкинских лимфом встречаются
до-
II
.ип
редко (табл. 14.1).
Этиология
и
патогенез.
Благодаря стремительному развитию молекуляр-
.пологий
и
появлению полимеразной цепной реакции, флуоресцентной
гиб-
[шли.ищии
in
situ,
иммунофенотипирования, микроаррей
(ДНК чип) и
других
шческих подходов,
удалось
выяснить,
что
происхождение лимфом тесно
t
пи 1,1110 с
процессом созревания лимфоцитов
в
норме
(см.
главу
1).
Соплеменные молекулярно-генетические технологии позволяют достаточно
о охарактеризовать гены вариабельного участка иммуноглобулина В-кле-
Mi'ini.ix лимфом человека
и
определить,
на
каком этапе созревания В-лимфоци-
м>11 произошли генетические поломки, приведшие
к
клональному
росту.
Так,
от-
гут<
гвие
в
лимфомных клетках признаков соматической гипермутации свиде-
гглитвует
о том, что
злокачественный клон образован
из
клеток,
не
вошедших
I
п-рминомный центр.
К
таким заболеваниям относятся одна
из
наиболее агрес-
i
мимо протекающих лимфом
—
лимфома
из
клеток мантийной зоны
— и
часть
хронического лимфолейкоза/лимфомы
из
малых лимфоцитов,
как
было отмече-
но
ранее
(см. гл. 12).
Этот вариант хронического лимфолейкоза отличается
осо-
оо июкачественным течением.
Таблица 14.1
Частота встречаемости гистологических вариантов неходжкинских лимфом
Диагноз
Диффузная В-крупноклеточная лимфома
Фолликулярная лимфома
MALT-лимфома
11<>риферическая
Т-клеточная лимфома
Периферическая Т-клеточная лимфома, NOS
Назальная
T/Nk-клеточная лимфома
Ангиоиммунобластная Т-клеточная лимфома
Лимфома, ассоциированная с энтеропатией
Гепатолиенальная лимфома
Т-клеточная лимфома взрослых
ХЛЛ/лимфома из мелких лимфоцитов
Лимфома из клеток мантии
Медиастинальная
В-клеточная
крупноклеточная лимфома
Аналластическая крупноклетачная лимфома
Лимфома Беркитта
Нодальная
лимфома маргинальной зоны
Лимфобластная Т-клеточная лимфома
Лимфоплазмоцитарная лимфома
Другие
Процент от всех
неходжкинских
лимфом
30,0—35,0
11,0—22,0
7,0—9,0
7,0—9,0
3,0—4,0
1,0—1,5
1,0—1,3
<1,0
<
1,0
<1,0
6,0—12,0
6,0—10,0
2,0—3,0
2,0—3,0
2,0—3,0
1,0—2,0
1,0—2,0
1,0—1,5
7,0—10,0

Вторая
большая
группа
лимфом
характеризуется наличием
текущих
сомати
ческих мутаций
в
участках хромосом, кодирующих
вариабельный
участок имму
ноглобулина,
что
свидетельствует
о
происхождении этих лимфом
из
клеток
гер
миномного центра. Речь идет
о
фолликулярной лимфоме, лимфоплазмоцитар-
ной
лимфоме, лимфоме Беркитта, диффузной крупноклеточной лимфоме
I
MALT-лимфоме.
В
геноме злокачественных клеток третьей группы определяет
ся
фиксированная соматическая мутация, указывающая
на то, что
лимфомм
этой группы произошли
из
постгерминомных клеток.
Это
пролимфоцитарш.ш
лейкоз,
волосатоклеточный лейкоз, частично лимфолейкоз/лимфома
из
малых
лимфоцитов
и
миеломная болезнь.
Происхождение большинства В-клеточных лимфом
из
клеток, прошедших
стадию дифференцировки
в
зародышевом центре, позволяет предположить,
что
именно
там и
возникает злокачественная трансформация.
В
темной зоне наблю-
дается
ряд
событий (пролиферация клеток, разрывы ДНК, точечные мутации,
делеции, дупликации
и
др.). ассоциированных
с
повышенным риском случайной
потери противоопухолевого контроля.
В
результате
в
локусе генов иммуногло-
булинов образуются различные хромосомные транслокации. Например, транс-
локация
гена
с-тус
в
некоторых лимф'омах Беркитта, BCL-6
при
диффузной
крупноклеточной лимфоме
и
транслокация рецептора
3
фактора роста фибро-
бластов
при
миеломной болезни, которые связаны
с
изменениями, происходя-
щими
в
геноме тяжелых цепей иммуноглобулинов при смене класса иммуногло-
булина,
В
случае
транслокаций
с
участием BCL-2
при
фолликулярной лимфоме
и
BCL-1 при лимфоме
из
клеток мантийной зоны точки разрыва хромосомы
на-
ходятся
на
конце сегмента
J или D
гена тяжелой цепи. Предполагается,
что эти
транслокации образуются
в
результате
повторной
V(D)G
реаранжировки
в
В-клетках герминомного центра. Точечные перестройки генов, характерные
для
соматической гипермутации, также
могут
играть роль
в
процессе онкогенеза.
Соматическая гипермутация гена BCL-6 обнаруживается
не
только при различ-
ных типах неходжкинских лимфом,
но и в
нормальных клетках герминомного
центра
и
В-клетках памяти.
Следует
отметить,
что в
В-клетках здоровых людей
часто выявляется хромосомная транслокация
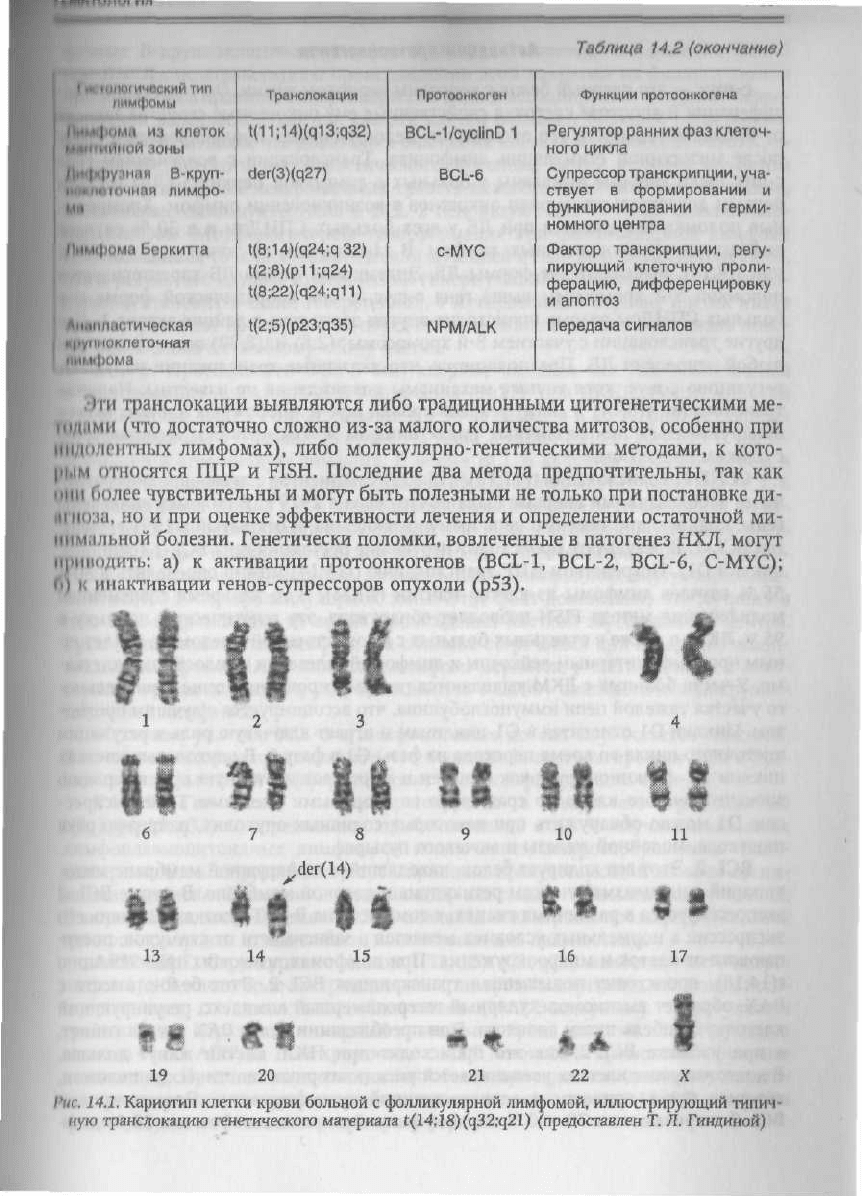
t(14;18)(q32;q21)
с
точкой
раз-
рыва
ДНК в
области гена BCL-2, характерная
для
фолликулярных лимфом
(рис.
14.1). Типичные хромосомные поломки
при
неходжкинских лимфомах
представлены ниже (табл. 14.2).
Таблица
14.2
Хромосомные
поломки
Гистологический
тип
лимфомы
Лимфоплазмоцитар-
ная лимфома
Фолликулярная
лим-
фома
MALT-лимфома
Транслокация
t(9;14)(pi3;q32)
t(14;18)(q32;q21)
t(2;18)(p11;q21)
t(18;22)(q21;q11)
t(11;18)(q21;q21)
t(1;14)(p22;q32)
при
неходжкинских
лимфомах
Протоонкоген
PAX-5
BCL-2
API2/MLT
Функции
протоонкогена
Фактор
транскрипции,
регу-
лирующий
В-клеточную
про-
лиферацию
и
дифференци-
ровку
Предотвращает
апоптоз
Предотвращает
апоптоз
IWI rm
Таблица
14.2 (окончание)
июгичмкий
тип
мимфомм
I
им» из
клоток
тной
лоны
фу
чин
В-круп-
• гочная пимфо-
ма Бсркитта
.(.^ммпклеточная
Транслокация
t(11;14)(q13;q32)
der(3)(q27)
t(8;14)(q24;q
32)
t(2;8)(p11;q24)
t(8;22)(q24;q11)
t(2;5)(p23;q35)
Протоонкоген
BCL-1/cyclinD
1
BCL-6
c-MYC
NPM/ALK
Функции протоонкогена
Регулятор ранних
фаз
клеточ-
ного
цикла
Супрессортранскрипции,уча-
ствует
в
формировании
и
функционировании
герми-
номного
центра
Фактор
транскрипции, регу-
лирующий клеточную проли-
ферацию, дифференцировку
и
апоптоз
Передача сигналов
Эти транслокации выявляются либо традиционными цитогенетическими ме-
|н.'ими
(что достаточно сложно из-за малого количества митозов, особенно при
ии'шпспшых лимфомах), либо молекулярно-генетическими методами, к кото-
рым относятся ПЦР и
FISH.
Последние два метода предпочтительны, так как
пни
hiijioe
чувствительны и
могут
быть полезными не только при постановке ди-
i:ia, но и при оценке эффективности лечения и определении остаточной ми-
нимальной болезни. Генетически поломки, вовлеченные в патогенез НХЛ,
могут
приводить: а) к активации протоонкогенов (BCL-1, BCL-2, BCL-6, C-MYC);
инактивации
генов-супрессоров опухоли (р53).
6 7 8 9 10 11
,der(14)
15
16 17
19 20 21 22
Рис.
14.1. Кариотип клетки крови больной с фолликулярной лимфомой, иллюстрирующий типич-
ную транслокацию генетического материала
t(14;18)(q32;q21)
(предоставлен Т. Л. Гиндиной)

Активация
протоонкогенов
c-myc
— это ядерный белок с коротким периодом жизни. Он
участвует
в про
лиферации
и апоптозе клеток, а свойственные ему онкогенные свойства зависят
от продолжительности его экспрессии. Белок начинает продуцироваться сразу
после митогенной стимуляции лимфоцита. Транслокации с вовлечением ген|
c-myc
были впервые выявлены у больных с лимфомой Беркитта (ЛБ) и стали
первым доказательством роли онкогенов в возникновении лимфом. Хромосом
ные
поломки встречаются при ЛБ у
всех
больных СПИДом и в 30 % случав!
диффузных крупноклеточных лимфом. В зависимости от точки разрыва ДНК
при
t(8;14), выделяют две формы ЛБ. Эндемичная форма ЛБ характеризуется
поломкой
8-й хромосомы выше гена c-myc, а при спорадической форме и у
больных СПИДом разрыв происходит внутри этого гена в районе экзона 1. Дм
другие
транслокации с участием 8-й хромосомы t(2;8) и t(8;22) встречаются при
любой этиологии ЛБ. Предполагается, что указанные транслокации нарушают
регуляцию c-myc, хотя точные механизмы повреждения не известны. Наличие
транслокации
t(8;14) и (или) реаранжировки туе в лимфомных клетках может
обнаруживаться при различных видах лимфом и, как правило, ассоциируется
с плохим прогнозом.
CCND1.
Транслокация
t(ll;14)(ql3;q32)
у пациентов с лимфопролифератив-
ными
заболеваниями впервые была обнаружена в 1979 г. В поломку вовлечены
гены, кодирующие тяжелую цепь иммуноглобулина, и открытый в 1991 г.
онко-
ген BCL-1. В
результате
происходит нарушение регуляция гена BCL-1 (синоним:
циклин
D1). Посредством ПЦР транслокацию
t(ll;14)
можно определить в 30—
55
% случаев лимфомы из клеток мантии
(ЛКМ).
В то же время современная
модификация
метода
FISH
позволяет обнаружить эту генетическую поломку в
95 % ЛКМ, а также у отдельных больных с множественной миеломой, В-клеточ-
ным
пролимфоцитарным лейкозом и лимфомой селезенки с волосатыми клетка-
ми.
У части больных с ЛКМ выявляются гипермутированные гены вариабельно-
го участка тяжелой цепи иммуноглобулина, что ассоциируется с лучшим прогно-
зом.
Циклин D1 относится к Gl-циклинам и играет ключевую роль в регуляции
клеточного цикла во время перехода из фазы G1 в фазу S. В опухолевых клетках
циклин
D1 функционирует как онкоген и усиливает клеточную пролиферацию
злокачественного клона по сравнению со здоровыми клетками. Гиперэкспрес-
сию D1 можно обнаружить при некоторых солидных опухолях, например раке
пищевода, молочной железы и мочевого пузыря.
BCL-2. Этот ген кодирует белок, находящийся на наружной мембране мито-
хондрий, эндоплазматическом ретикулуме и ядерной мембране. В норме BCL-2
экспрессируется в различных тканях, в том числе на В- и Т-клетках. Степень его
экспрессии
в нормальных условиях меняется в зависимости от стимулов, посту-
пающих от клеток и микроокружения. При лимфомах, имеющих транслокацию
t(14;18), происходит повышенная транскрипция BCL-2. Этот белок, вместе с
ВАХ, образует высокомолекулярный гетеродимерный комплекс, регулирующий
клеточную гибель путем апоптоза. При преобладании белка ВАХ клетка гибнет,
а при избытке BCL-2, как это происходит при НХЛ, клетки
живут
дольше.
В долгоживущих клетках увеличивается риск повторных генетических поломок,
которые
могут
привести к злокачественной трансформации. Реаранжировки
BCL-2 встречаются в
70—90
% случаев фолликулярных лимфом и в 20 % диф-

фушых В-крупноклеточных лимфом (ДККЛ)-
Считается, что
наличие BCL-2
при
ДККЛ
свидетельствует
о
происхождении этой лимфомы
из
фолликулярной
цимфимы. Как
правило, гиперэкспрессия BCL-2 ассоциируется
с
худшей
безре-
цилинной
выживаемостью,
так как эти
клетки
обладают
большей резистентно-
11
i.in к
цитостатикам,
что
доказано
в
опытах
на
клеточных линиях
in
vitro.
Kpo-
мг дн;м мистического
и
прогностического значения, BCL-2 является объектом
i
in
создания новых лекарственных средств целевого действия.
Так,
например,
ни
чиненые олигонуклеотиды
к
BCL-2 используют
для
лечения фолликуляр-
ных лимфом. Морфологическая трансформация
при
фолликулярной лимфоме
мшронпждается точечной соматической мутацией
в
гене BCL-2. Предполагается,
•но
и
результате
идущей соматической гипермутации опухолевая клеточная
по-
пуляция
становится более гетерогенной,
а
мутированный вариант клеток имеет
иршшферативное преимущество перед остальными клетками
и
дает
жизнь ново-
му.
Гюлее
злокачественному клону клеток.
BCL-6.
Протоонкоген BCL-6
был
впервые выявлен
как ген,
вовлеченный
и
ф.-шслокацию локуса
q27 3-й
хромосомы (3q27),
при
ДККЛ. Реаранжировки
i
шжлечением BCL-6 гена встречаются
в 50 %
ДККЛ
и в 60 %
фолликулярных
шшфом,
причем
в
последнем
случае
эта
транслокация
свидетельствует
о
транс-
формации
в
агрессивную лимфому.
В
норме BCL-6 является важным звеном
в
регуляции
развития
и
функционирования лимфоидных клеток. Протеин BCL-6
•м премируется только
в
В-клетках
зародышевого центра,
в то
время
как он от-
i
\
нтвует
в
В-клетках-предшественниках
и в
более дифференцированных клет-
папример
в
плазматических клетках. Среди Т-лимфоцитов BCL-6 определя-
ется
в
кортикальных тимоцитах,
а
также
в
CD4+-лимфоцитах внутризародыше-
'о центра
и
перифолликулярной зоны. Этот факт доказывает,
что
мутация
в
HIM-
BCL-6 происходит
во
время прохождения клеткой зародышевого центра.
Кроме
уже
упомянутых лимфом,
эта
поломка встречается
при
лимфоплазмоци-
гоидной лимфоме, MALT-лимфоме, лимфоме Беркитта,
у
части больных
с
воло-
I
.in жлеточным лейкозом
и у 30 %
пациентов
с
CD30+ анапластической крупно-
I.
ШТОЧНОЙ ЛИМфомОЙ.
Механизм участия BCL-6
в
лимфомогенезе
до сих пор
остается неясным.
И
качестве гипотезы предполагают,
что
постоянная гиперэкспрессия BCL-6
пре-
пятствует дальнейшей дифференцировке клеток зародышевого центра.
РАХ-5.
Ген
Pax-5 гиперэкспрессируется
в
результате
транслокации
t(9;
I4)(pl3;q32)
и
определяется приблизительно
в 50 %
случаев
нодальных
шшфоплазмоцитоидных лимфом,
за
исключением макроглобулинемии Валь-
/ннстрема.
Он
кодирует фактор транскрипции, присутствующий
на
всем протя-
жении развития В-клеток
и
исчезающий
на
стадии плазматических клеток.
И
норме
в
зрелых
В-клетках
РАХ-5
вовлечен
в
контроль пролиферации. Этот
ген
нроклонирован
и
может быть использован
для
диагностики.
API2-MLT.
Структурная поломка
t(ll;
18)(q21;
q21)
наиболее часто встре-
чается
при
В-клеточных экстранодальных лимфомах маргинальной зоны, ассо-
циированных
со
слизистыми оболочками (MALT-лимфомы).
В
результате
транслокации образуется химерный транскрипт
путем
слияния ингибирующего
.июптоз белка API2
на 11-й
хромосоме
с
MLT геном
18-й
хромосомы (функция
неизвестна).
Предполагают,
что
слитный белок приводит
к
подавлению апопто-
t;i,
что
способствует преимущественному выживанию клеток MALT-лимфомы
и
к
запуску антиген-независимой пролиферации.

Молекулярная
генетика Т-клпочиых
лимфом.
Молекулярная генетик^
Т-клеточных лимфом изучена гораздо меньше,
чем
В-клеточнмх лимфом.
При
чинами этого являются
их
большая гетерогенность
и
меньшая встречаемость
Исключение составляет анапластическая крупноклеточная лимфома (АККЛ),
или Ki-1-лимфома.
Эта
лимфома распознается
по
характерной морфологии
и
наличию CD30 антигена.
Для
АККЛ типична транслокация t(2;5), которой
встречается
в
20—60
%
наблюдений. Поломка приводит
к
появлению
нового
слитного гена ЫРМ/(нуклеофосмин)АЬК(анапластическая лимфомная киназа),
NPM
белок слитного гена является промотором активности ALK,
в то
время
как
ALK-ген кодирует новую тирозинкиназу.
В
норме ALK-белок
не
встречается.
С
диагностической точки зрения лучшим методом обнаружения поломки
явля
ется
РТ-ПЦР,
позволяющая выявить транскрипт
у
40—70
%
первичных
боль
ных
с
АККЛ. Среди
всех
ALK-позитивных лимфом
на
г(2;
5)
приходится
70
80
%,
также встречаются транслокации t(l;2)
- 10-20 %,
t(2;
3) - 2-5 %
и
t(2; 17) - 1-5 %, а
также инверсия
inv(2)
- 2-5 %.
Инактивация
генов-супрессоров
опухоли
р53
Ген супрессии опухоли
р53 — это
наиболее часто встречающийся мутирован-
ный
ген при
самых различных опухолях.
Он
находится
на
хромосоме
17р13 и
кодирует ядерный фосфопротеин
с
молекулярной массой
53 кДа,
который
во-
влечен
в
регуляцию транскрипции, клеточную гибель
и
регуляцию клеточного
цикла
в
точке G1S. Обычно происходят точечные мутации, которые приводят
к
продукции
не
функционирующего белка. Мутантный
р53
обнаруживается среди
лимфом высокой степени злокачественности
у 30 %, в то
время
как при
индо-
лентных лимфомах
он
почти
не
встречается,
а его
появление ассоциируется
с трансформацией
в
более злокачественную форму. Наиболее часто мутантный
р53 наблюдается
при
лимфоме Беркитта
(40
%), множественной миеломе
(5—
10 %), болезни Ходжкина
(20-30
%) и
Т-клеточных лимфомах
(10 %).
Таким образом, следствием транслокаций
могут
быть
три
основных момен-
та, важных
для
понимания лимфомогенеза:
— усиление пролиферации;
— торможение дифференцировки;
— появление антиапоптотической активности.
Тем
не
менее, чтобы клетка стала злокачественной, наличия транслокации
недостаточно. Например, транслокация BCL-2 обнаруживается
в
мононуклеар-
ных клетках периферической крови
у
16—45
%
здоровых людей,
и
лишь едини-
цы
из них в
последующем заболеют фолликулярной лимфомой. Этот факт
сви-
детельствует
о том, что для
развития лимфомы необходимы дополнительные
генетические
или
эпигенетические факторы. Показано,
что
стромальное микро-
окружение играет важную роль
в
пролиферации лимфомных клеток
при ФЛ.
Фолликулярные дендритные клетки
и
Т-лимфоциты путем выработки раствори-
мых факторов
и
посредством межклеточного взаимодействия поддерживают
рост злокачественного клона
в
пределах фолликулов.
При
лимфоме
из
клеток
мантии (МКЛ) транслокация затрагивает BCL-1 протоонкоген. Дополнительную
роль
в
онкогенезе
в
этом
случае
играет BCL-2, который
в
норме гиперэкспресси-
руется
во
всех
«наивных»
В-клетках, находящихся
в
мантийной зоне
в
GO-фазе
клеточного цикла, поскольку они должны оставаться живыми
до
встречи
с
анти-

(юльных
с
MALT-лимфомой
пролиферация опухолевого клона
поддер-
н
i! к
постоянной антигенной стимуляцией.
При
лимфоме Ходжкина клетки
ими
коп» Штернберга секретируют большое количество цитокинов
и хе-
iiKiii,
привлекающих различные клетки
в
опухолевый инфильтрат, который,
но
очередь, обеспечивает жизнеспособность лимфомных клеток.
Роль микроорганизмов
в
этиологии
и
патогенезе пимфом
связь вируса Эпстайна
—
Барр (ВЭБ)
с
опухолевым процессом была
у больных
с
лимфомой Беркитта.
В
норме
ВЭБ
определяется более
1
>()
%
взрослых людей. Инфицирование чаще происходит
в
раннем
детстве
н
подростковом возрасте
и
может протекать бессимптомно
или с
клиниче-
i <>и
картиной инфекционного мононуклеоза. После инфицирования человек
- пшовится носителем латентной инфекции
на всю
жизнь.
В
зависимости
от ген-
|ц
«it
экспрессии вируса различают
три
типа латентности:
I, II и
III.
Для
каждого
ним
характерен свой набор вирусных белков. Основным резервуаром
ВЭБ
явля-
ГГП1 В-клетка памяти. Вирусный гликопротеин взаимодействует
с
В-клеточным
рецептором CD21, захватывается клеткой
и
проникает
в
ядро. Затем происходит
i
и i ,|д
событий, приводящих
к
латентной экспрессии вирусных генов, которая
Может быть потенциально опасна. Продуктами генов вирусной
ДНК
является
|щ,'1 белков, которые
могут
играть роль
в
трансформации клетки (табл. 14.3).
С
ВЭБ
ассоциируется
ряд
лимфоидных
и
эпителиальных злокачественных
м1юлсваний.
Для
каждой опухоли характерен определенный
тип
латентности
|ЭБ
инфекции (табл. 14.4).
ОЭБ-белки
Таблица
14.3
ВЭБ-белки
и их
роль
в
трансформации клетки
Роль
в
трансформации клетки
I
UNA1
HBNA2
1DNA3
L-BNA-LP
LMP1
LMP2
ДНК-связанный
белок, участвует
в
репликации
и
поддержании генома ВЭБ
Участвует
в
В-клеточной
трансформации.
Является
активатором
клеточных
и
вирус-
ных
генов:
CD21, CD23, LMP1, LMP2, с-myc онкогена
Участвует
в
В-клеточной трансформации
Обеспечивает
размножение
трансформированных
В-клеток
Участвует
в
В-клеточной
трансформации,
активирует фактор
транскрипции
NF-kB
Поддерживает
латентность вируса
Таблица
14.4
Опухоли,
связанные
с
ВЭБ-инфекцией
Тип
латентности
и
белок
Латентность
I
EBNA1
Патентность
II
EBNA1,LMP1,LMP2
Латентность
III
EBNA1,
EBNA2, EBNA-LP, EBNA3, LMP1, LMP2
Заболевание
Лимфома
Беркитта
Недифференцированная
назофаринге-
альная
карцинома,
лимфома Ходжкина,
Т-клеточные лимфомы
Иммунобластная
лимфома, посттран-
сплантационная
лимфома

Существует
еще
целый
ряд микроорганизмов,
имеющих отношение
к
этиа
логин
и
патогенезу лимфом. Герпетический вирус человека
8-го
типа вызывает
лимфому
с
первичным выпотом. Криоглобулинемия
и
ассоциированная
с пси
лимфопролиферация,
вероятно, связана
с
вирусом гепатита
С.
Т-клеточный
ни
рус
I
типа лейкоза человека обнаруживается
у
больных
с
Т-клеточной лимфо
1
мой
взрослых.
Два
возбудителя
(Borrelia
burgdorferi
и
Helicobacter
pylori)
могут
быть причиной MALT-лимфомы. Первый
участвует
в
патогенезе MALT-лимф»
мы кожи,
а
второй
—
лимфомы
желудка.
К
факторам окружающей среды, возможно, способствующим возникновению
лимфом,
относят производственный контакт
с
различными пестицидами, произ-
водными бензола
и
источниками радиоактивного излучения. Кроме того, риск воз-
никновения
лимфопролиферативного заболевания повышают любые иммунодефи-
цитные
состояния. Так, например, после трансплантации костного мозга риск
раз-
вития
лимфомы возрастает
в
30—50
раз,
а у
больных СПИДом
— в 100 раз.
Классификации
лимфом. Большое количество молекулярно-генетических
событий, сопровождающих процесс созревания лимфоцитов,
и
возможность
фа-
тальной ошибки
на
любом
из
этих этапов объясняют
большую
гетерогенность
лимфом,
а
также трудности
их
классификации.
За
последние
30
лет,
по
крайней
мере,
7
классификаций сменили
друг
друга.
Первая классификация, предложен-
ная
V. L,
Rappoport
в 1966 г.,
сейчас имеет только историческое значение.
Она
основывалась
на
гистологической характеристике отдельных лимфом
—
харак-
тере
роста злокачественных клеток
в
лимфоузле
и
морфологических признаках
зрелости лимфоцитов.
Основной
задачей любой гистологической классификации является наиболее
детальная характеристика отдельных признаков заболевания
с
последующим
объединением
их в
подгруппы, сходные
по
характеру
течения
и
прогнозу. Исхо-
дя
из
этих соображений, были созданы пользующаяся большой популярностью
в
нашей стране Кильская классификация
(в
Европе)
и
классификация Льюка
и
Коллинза
(в
США),
в
которых учитывались
не
только морфологические призна-
ки
клетки,
их
функциональные способности,
но и
степень клеточнрй злокачест-
венности.
Последнее обстоятельство
для
клиницистов было особенно важным,
так
как позволило определять прогноз течения заболевания
и
лучше
ориентиро-
ваться
в
выборе терапевтической тактики.
Поскольку
в
мире существовало одновременно несколько классификаций,
для
лучшего
взаимопонимания была предложена классификация, получившая
название
«Рабочая формулировка*.
Ее
целью было разработать доступный спо-
соб перевода
из
одной классификации
в
другую,
что
облегчило взаимопонима-
ние
исследователей
и
врачей
в
разных странах.
Между
тем
быстрое развитие гематологии
и
иммунологии
дало
специали-
стам новые методы диагностики,
в том
числе иммунодиагностики.
Под
влияни-
ем этих веяний Кильская классификация
в 1992 г.
была переработана.
В
итоге
все лимфомы
по
происхождению были разделены
на В- и
Т-клеточные.
Для
по-
становки
диагноза стали использовать методы иммуногистохимии,
т. е.
окраску
с моноклональными антителами. Несмотря
на
это,
эта
классификация также
не
была лишена ряда недостатков.
В
самом деле, наряду
с
довольно однородными
по
клиническому течению лимфомами, каковыми являются лимфома Беркитта
и
анапластическая
крупно
клеточная лимфома,
в
этой группе объединялись
так-
же заболевания, чрезвычайно гетерогенные
и по
прогнозу
и по
ответу
на
тера-
