Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
180
ляет 3,55 Å , ее молярная масса – 26 г/моль , а стерический множитель для этой
реакции равен 0,019.
Ответ:
10
/8,7910;156,0кДж/моль
E
NN E
−
=⋅ = .
Задача 21.
Константа скорости бимолекулярной реакции второго поряд-
ка, уравнение которой
24 2 26
С HH CH
+
→ ,
равна
(
)
2
1, 77 10 л/ моль с
−
⋅⋅
при 782 K. Средний диаметр молекулы этилена –
2 Å , молекулы водорода – 1 Å , стерический множитель равен 0,05. Найти ис-
тинную энергию активации этой реакции.
Ответ:
166,1 кДж/моль .
Задача 22.
Для реакции разложения бромэтана, протекающей по первому
порядку, константа скорости при 500
o
C равна
10 1
7,3 10 c
−
⋅ .Оцените энтропию
активации этой реакции, если энергия активации равна 55 кДж/моль . Указание:
значение трансмиссионного коэффициента принять равным единице.
Ответ:
(
)
17,97 Дж/ моль К⋅ .
Задача 23.
Разложение перекиси ди-трет-бутила в газовой фазе пред-
ставляет собой реакцию первого порядка, константа скорости которой
(
)
1
в c
−
зависит от температуры следующим образом:
()
16
I
4700/
3, 2 10
T
ke
−
=⋅
.
Используя теорию активированного комплекса, рассчитайте энтальпию и эн-
тропию активации при температуре 200
o
C. Указание: значение трансмиссион-
ного коэффициента принять равным единице.
Ответ:
00
39,08 кДж/моль, 67,22HS
≠≠
∆= ∆=
(
)
Дж/ моль K⋅ .
Задача 24.
Изомеризация диизопропилового эфира в алилацетон в газо-
вой фазе представляет собой реакцию первого порядка, константа скорости ко-
торой
(
)
1
в c
−
зависит от температуры следующим образом:
Х и м и ч е с к а я к и н е т и к а
181
()
11 3520/
5, 4 10
I
T
ke
−
=⋅
.
Используя теорию активированного комплекса, рассчитайте энтальпию и эн-
тропию активации при температуре 400
o
C. Указание: значение трансмиссион-
ного коэффициента принять равным единице.
Ответ:
00
29,27 кДж/моль,27,08HS
≠≠
∆= ∆=−
(
)
Дж/ моль K⋅ .
Задача 25.
Зависимость константы скорости разложения винилового
эфира от температуры имеет вид
()
(
)
11 1
I
10200/
2,7 10 c
T
ke
−
−
=⋅ .
Рассчитайте энтропию активации при 530
o
C
. Указание: значение трансмисси-
онного коэффициента принять равным единице.
Ответ:
(
)
34,31Дж/ моль К−⋅.
2.3. Катализ
2.3.1. Катализаторы и каталитические реакции
Наиболее обобщенно
катализ следует определить как изменение ско-
рости химической реакции под действием веществ, называемых
катали-
заторами
, которые, участвуя в процессе, к концу реакции остаются неиз-
менными. Реакции в присутствии катализаторов называют
каталитиче-
скими
.
Катализ, увеличивающий скорость химических реакций, называется
по-
ложительным
катализом, а замедляющий – отрицательным. Термин «ката-
лиз» обычно относят лишь к положительному катализу. Отрицательный ката-
лиз называют
ингибированием, а вещества, вызывающие его – ингибиторами.
Энергетические профили пути реакции, проходящей в присутствии ката-
лизатора, без него и в присутствии ингибитора, приведены на рис. 2.36, из ко-
торого видно, что энергия активации реакции изменяется в ряду
кинг
aaa
EEE
<
< , (2.362)
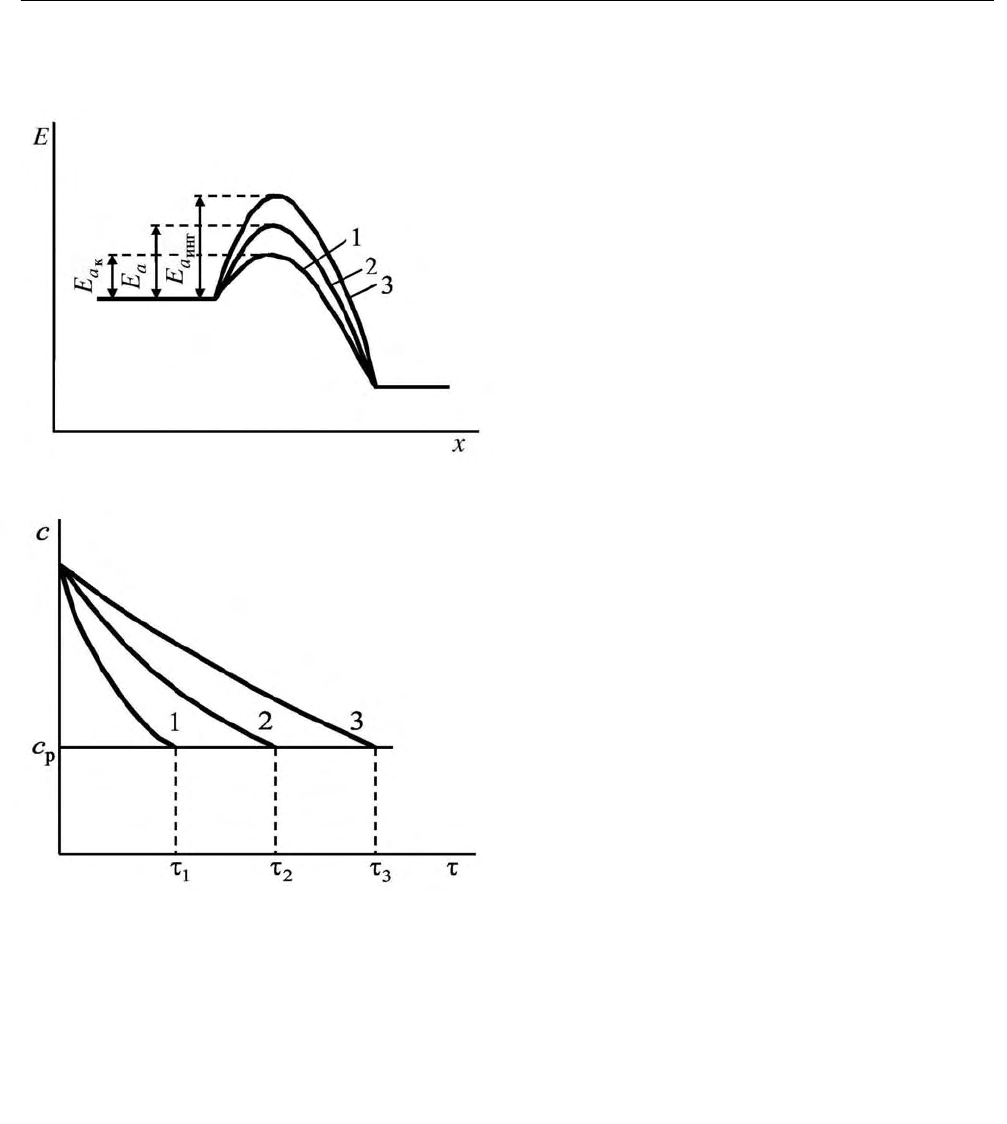
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
182
где
кинг
, и
aaa
EEE – энергии активации реакции при каталитическом, неката-
литическом процессах и при ингибировании соответственно.
Катализаторы не изменяют со-
стояния равновесия в системе, а
лишь облегчают его достижение.
Действительно, как видно из
рис. 2.37, по достижении определенного
времени в реакции, проходящей в при-
сутствии катализатора, без него и в при-
сутствии ингибитора достигается
одна и
та же равновесная концентрация реа-
гента
р
c , однако по сравнению с неката-
литическим процессом время ее дости-
жения снижается в случае каталитиче-
ского процесса и растет при ингибиро-
вании. Следовательно, присутствие
катализатора не изменяет константу
равновесия химической реакции, а ка-
тализатор не влияет на состояние рав-
новесия реагентов и продуктов. К ана-
логичному выводу приводит и анализ
уравнений (2.324), (2.327). Действи-
тельно, исходя из того, что энергия Гиббса является функцией состояния, изме-
нение энергии Гиббса для каталитической и некаталитической реакций, а также
для реакции, протекающей в присутствии ингибитора, будет одним и тем же, а
следовательно, и константа равновесия не будет изменяться.
Таким образом, в отличие от реакций с нетермической активацией реаги-
рующих веществ (см. 2.2.1.8), в результате катализа лишь ускоряется про-
Рис. 2.36. Энергетические профили
пути реакции, проходящей в присут-
ствии катализатора (1), без него (2) и
в присутствии ингибитора (x – коор-
дината реакции
Рис. 2.37. Кинетические кривые
расходования реагента в присутст-
вии катализатора (1), без него (2) и
в присутствии ингибитора (3) (
р
c –
равновесная концентрация)

Х и м и ч е с к а я к и н е т и к а
183
цесс достижения равновесных концентраций реагентов и продуктов, но не
обеспечивается получение сверхравновесных концентраций (сверхравно-
весного выхода) продуктов. Поэтому для каталитических реакций термоди-
намический подход всегда оправдан. В отличие от химической индукции
(см. 2.2.1.7) катализ не может вызвать протекания реакций, для которых в
данных условиях 0G∆>, а может лишь увеличить
скорость реакции в том
случае, если 0G<∆ . В состоянии равновесия
(
)
0G=∆
при катализе имеет
место в равной степени ускорение как прямой, так и обратной реакций.
Другими словами, катализатор может одновременно ускорять как прямую, так
и обратную реакции, но при этом константа равновесия [см. соотношение
(2.60)] остается постоянной. Иначе говоря, катализатор не может изменить рав-
новесие термодинамически невыгодных обратимых реакций, у которых
оно
сдвинуто в сторону реагентов.
Многочисленные наблюдения привели к двум важным обобщениям в об-
ласти катализа. Во-первых, уже отмечавшееся снижение энергии активации
(рис. 2.36) как наиболее отчетливое проявление активности катализатора. Во-
вторых, специально для гомогенного катализа в растворах
положение о про-
порциональности
между скоростью реакции и концентрацией катализатора.
Указанное позволяет заключить, что катализатор своим веществом участвует в
реакции, образуя некоторые неустойчивые промежуточные соединения или
комплексы и, таким образом, дает реакции возможность идти по иному, более
энергетически выгодному пути.
Катализ может быть как
гомогенным, так и гетерогенным. При гомоген-
ном катализе катализатор и реагенты находятся в одной фазе – жидкой или га-
зовой, а при гетерогенном – в разных фазах. Во втором случае химическая ре-
акция протекает на границе раздела фаз. При гетерогенном катализе наиболее
часто используется твердый катализатор, а реагенты находятся в газовой или
жидкой фазе. Реакция осуществляется
на поверхности твердого катализатора.
Примером гомогенного катализа может служить ускорение гидролиза уг-
леводов в водном растворе в присутствии кислот и окисление
2
CO до CO
в га-
зовой среде в присутствии паров воды. Примером гетерогенного катализа слу-
жит окисление аммиака на поверхности платины.
Возможен и
гетерогенно-гомогенный катализ, когда реакция начинает-
ся на поверхности твердого катализатора, а продолжается в объеме реакцион-
ной среды. Так, при окислении углеводородов RH на поверхности твердого ка-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
184
тализатора образуются активные частицы из свободных радикалов
22
HO и RO
,
которые затем переходят в газовую фазу и продолжают там цепную реакцию.
Среди различных видов катализа наибольшее распространение имеют
ки-
слотно-оснóвный, окислительно-восстановительный
и ферментативный.
Последний относят к гомогенному катализу. Роль катализаторов здесь выпол-
няют
ферменты или энзимы – биокатализаторы, под действием которых в жи-
вых организмах протекает синтез большинства веществ, необходимых для их
жизнедеятельности. Особое значение ферментов для понимания сущности ка-
талитического действия обусловливает самостоятельное рассмотрение фермен-
тативного катализа (см. 2.3.6).
В случае
кислотно-оснóвного катализа катализаторами служат вещест-
ва, способные передавать или принимать протон или имеющие акцептор элек-
тронной пары, например Al.
К типичным кислотно-оснóвным катализаторам относятся протонные ки-
слоты
(
)
24 3
H SO , CH COOH, HF , фосфаты, сульфаты, алюмосиликаты. Кислот-
но-оснóвный катализ лежит в основе крекинга, процессов гидратации и дегид-
ратации, гидролиза, некоторых реакций полимеризации и изомеризации.
В зависимости от природы частиц, выступающих в качестве катализато-
ра, все каталитические реакции кислотно-оснóвного типа можно подразделить
на четыре группы: 1. специфический кислотный катализ, включающий реакции,
катализируемые только ионами водорода [ионом гидроксония
3
HO
+
или лио-
ния SH
+
(например,
25 2
CHOH
+
), где S – молекула растворителя]; 2. специфиче-
ский оснóвный катализ, включающий реакции, катализируемые гидроксид-
ионами; 3. общий кислотно-оснóвный катализ, включающий реакции, катали-
зируемые любыми кислотами или основаниями Бренстеда, т. е. веществами
способными соответственно отдавать или принимать протон; 4. электрофильно-
нуклеофильный катализ, включающий реакции, катализируемые акцепторами
(электрофилами) или донорами (нуклеофилами) электронных пар, в
том числе
и апротонными кислотами Льюиса, типичными представителями которых яв-
ляются
(
)
33333 32
AlBr,AlCl,FeCl,SbCl,BF,AlCH Br.
При
окислительно-восстановительном катализе происходит ускоре-
ние реакций, в которых изменяется степень окисления атомов, входящих в мо-
лекулы реагентов. Катализаторами в этих реакциях выступают ионы переход-
ных металлов, например комплексные ионы меди
(
)
I, II , железа
(
)
II, III , молиб-

Х и м и ч е с к а я к и н е т и к а
185
дена
(
)
IV, V, VI , служащие эффективными посредниками реакций с переносом
электронов. При этом переход электронов от реагентов к катализатору осуще-
ствляется легче, чем от восстановителя к окислителю.
В силу того, что в реакции иона с молекулой при переносе электрона все-
гда возникает свободный радикал, такие окислительно-восстановителтьные
системы являются генераторами свободных радикалов. Они используются
для
инициирования реакций радикальной полимеризации, окисления, хлорирова-
ния. Помимо этого, к окислительно-восстановительным каталитическим реак-
циям относятся реакции восстановления, гидрирования, дегидрирования и кар-
боксилирования, а также разложения некоторых кислородсодержащих соеди-
нений. Исключительно важную роль оксилительно-восстановительные реакции
играют в живом организме, где они составляют основу ферментативных про-
цессов дыхания, фиксации азота
и удаления вредных для организма продуктов.
Значительная часть применяемых в промышленности катализаторов была
подобрана эмпирически, при этом были сформулированы
основные требова-
ния к катализатору
: он должен обладать каталитической активностью,
быть специфичным, селективным, а также механически прочным, термо-
стойким и способным к регенерации.
Каталитическая активность или просто активность, характеризует
способность катализатора ускорять химическую реакцию. Количественно ката-
литическую активность определяют (см. 2.3.3.) на основании кинетических экс-
периментов и представлений о механизме каталитических реакций (см. 2.3.2).
Как правило, каталитическая активность смеси катализаторов не адди-
тивна. Часто она значительно превосходит активность отдельно взятых катали-
заторов.
Увеличение каталитической активности наблюдается при добавлении к
катализатору
некоторых веществ, называемых промоторами, влияющих на
структуру поверхности катализатора и тем самым способствующих ускорению
каталитической реакции. Такой катализатор называют
смешанным, или про-
мотированным
. Примером сказанному может служить каталитическая реакция
окисления
2
SO
, скорость которой увеличивается в сотни раз, когда к катализа-
тору
25
VO добавляют небольшое количество промотора – сульфатов щелочных
металлов.
Вещества, снижающие при добавлении к катализатору его активность или
полностью исключающие каталитическое действие, называют
каталитиче-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
186
скими ядами. К ним относятся, например, соединения Sb,P,Pb,As,Hg. Ме-
таллические катализаторы отравляются соединениями кислорода (например,
2
HO,CO) и серы (например,
22
CS , H S). Эти яды образуют с катализаторами
более прочную химическую связь, чем реагенты. В ферментативном катализе
для обозначения этого явления применяют термины – ингибирование и ингиби-
тор, т. е. говорят об ингибировании катализатора.
Специфичность катализатора заключается в том, что реакции данного
типа ускоряются катализаторами лишь определенного химического состава не-
зависимо от того, являются они гомогенными или гетерогенными. Например,
кислотно-оснóвные реакции ускоряются кислотами и основаниями, а окисли-
тельно-восстановительные – переходными металлами или их соединениями.
Следует отметить, что даже в пределах одной группы периодической системы
элементов каталитические свойства меняются немонотонно. Например, из всех
переходных элементов восьмой группы лишь железо обладает достаточно вы-
сокой активностью в реакции синтеза аммиака. Специфичность свойственна в
той или иной мере всем катализаторам и обусловлена специфичностью химиче-
ских связей, возникающих между катализатором и реагентом. Лишь опреде-
ленные группы атомов катализатора, называемые
каталитическим или ак-
тивным центром
, участвуют в образовании химической связи с реагентом. В
гомогенном катализе каждая молекула катализатора может рассматриваться как
активный центр. В комплексных соединениях переходных металлов в качестве
активных центров может выступать «вакантное место» в координационной
сфере комплексного соединения иона металла. При гетерогенном катализе ак-
тивные центры находятся на поверхности твердого тела (катализатора)
и пред-
ставляют собой один или группу атомов, ионов кристаллической решетки. Бо-
лее сложное строение имеют активные центры ферментов. Специфичность ка-
талитического действия того или иного катализатора определяется химическим
составом, строением и структурой его активных центров. Специфичность ката-
лизатора проявляется по-разному: от способности изменять скорость превра-
щения нескольких классов соединений
до отдельных химических веществ. Так,
например, кислоты являются катализаторами для многих классов химических
соединений, в то время как ферменты ускоряют лишь определенный биохими-
ческий процесс, т. е. высокоспецифичны.
Селективность катализатора – это свойство катализатора ускорять
химическое превращение лишь в одном из нескольких возможных направле-

Х и м и ч е с к а я к и н е т и к а
187
ний. Так, например, в присутствии оксида алюминия при 700 K происходит
увеличение скорости дегидратации этилового спирта:
25 24 2
CHOH CH HO→+,
а в присутствии металлической меди – дегидрирования:
25 24 2
CHOH CHO H→+.
При этом следует заметить, что в отсутствие катализатора эти реакции являют-
ся параллельными.
Селективность катализатора может быть охарактеризована долей реаген-
та, превратившегося в целевой продукт (
интегральная селективность), или
отношением скорости образования целевого продукта к сумме скоростей хими-
ческого превращения реагентов по всем возможным направлениям (
дифферен-
циальная селективность
). Так, если в реакции, уравнение которой в общем
виде
AB QR
+
→+,
целевым продуктом является вещество Q, то дифференциальная селективность
катализатора равна
(
)
QAB
CK /
=
+vv v
, (2.363)
где
QA B
, и vv v – скорости каталитической реакции по компонентам Q, A и В.
Селективность обусловлена природой (составом) катализатора, а также
зависит от пористости, размеров зерен и их упаковки. Селективность катализа-
тора зависит от условий проведения и степени завершенности реакции. Селек-
тивность является важным технологическим свойством катализатора. Ее повы-
шение позволяет уменьшить количество побочных продуктов, а
значит, путем
подбора подходящего катализатора можно увеличить выход целевого (нужно-
го) продукта. Наибольшей селективностью (95–100 %) обладают ферменты и
некоторые катализаторы, используемые в гомогенном катализе. Катализаторы,
применяемые в гетерогенном катализе, как правило, обладают более низкой се-
лективностью (порядка 70 %).

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
188
2.3.2. Механизмы каталитических реакций
Увеличение скорости каталитических реакций может происходить за счет
снижения энергии активации и увеличения энтропии активации, что явствует из
теории абсолютных скоростей реакций [см., в частности, уравнения (2.351),
(2.359)].
Для оценки влияния катализатора на энергию реакции используют поня-
тие
степень компенсации. При химических реакциях образование новых хи-
мических связей требует разрыва определенных связей в реагентах, что требует
затраты энергии. Энергия активации обычно значительно меньше энергии, за-
трачиваемой на разрыв химических связей. Это обусловлено тем, что при дви-
жении по пути реакции (через переходное состояние) часть энергии, требуемой
для разрыва старых связей,
компенсируется энергией, освобожденной при об-
разовании новых. Степень компенсации
κ
определяет реакционную способ-
ность веществ в рассматриваемой реакции:
ia
i
DE
D
−
κ=
∑
∑
, (2.364)
где
i
D
∑
– сумма энергий разрываемых связей. При
0
a
E
=
получаем 1
κ
= и
степень компенсации полная. При 0
ai
ED
=
κ=
∑
, т. е. компенсация отсутст-
вует. Для реакций между стабильными молекулами (без участия свободных ра-
дикалов или атомов) степень компенсации обычно не превышает 70 %. Взаи-
модействуя с реагентами, входя в состав активированного комплекса, катализа-
тор увеличивает степень компенсации, снижает энергию активации и тем са-
мым увеличивает скорость химического превращения.
Рассмотрим указанные причины
увеличения скорости каталитических ре-
акций применительно к их двум механизмам –
стадийному и слитному.
Стадийный (раздельный, диссоциативный) механизм каталитических
реакций заключается в замене одной каталитической реакции на несколько ста-
дий последовательного взаимодействия реагентов с катализатором с возмож-
ным образованием на каждой стадии активированного комплекса.
При катализе бимолекулярная реакция, уравнение которой в общем виде
AB QR
+
→+, (2.365)
может протекать в две стадии, уравнения которых

Х и м и ч е с к а я к и н е т и к а
189
() ( )
A K AK AK, AK B ABK Q R K
≠
≠
+→ → +→ →++
, (2.366)
где AK – устойчивое промежуточное соединение с катализатором;
()
AK
≠
,
()
ABK
≠
– промежуточные активированные комплексы.
Согласно
слитному (ассоциативному, синхронному) механизму в про-
цессе реакции происходит одновременное взаимодействие с катализатором
всех реагентов и образование одного активированного комплекса, что схемати-
чески можно представить следующим образом:
()
ABK ABK QRK
≠
++→ →++
. (2.367)
Таким образом, если в стадийных каталитических реакциях, уравнения
стадий которых, например (2.366), образуется, по крайней мере, не меньше
двух активированных комплексов, то в слитных каталитических реакциях, на-
пример выраженных схематически уравнением (2.367), невозможно возникно-
вение более одного активированного комплекса.
Профили ППЭ вдоль координаты реакции в каталитических реакциях,
идущих по стадийному и слитному
механизму, представлены на рис. 2.38. В
случае слитного механизма (рис. 2.38, а) как некаталитическая, так и каталити-
ческая реакции (кривые 1 и 2 соответственно) идут с преодолением одного по-
тенциального барьера, но с существенным снижением энергии активации для
каталитической реакции
(
)
к
aa
E
E< . Таким образом, фактором, определяющим
увеличение скорости реакции при слитном механизме, является уменьшение
энергии активации и соответственно повышение степени компенсации при хи-
мическом взаимодействии реагентов с катализатором. Энтропия активации в
каталитической реакции по слитному механизму уменьшается, способствуя по-
нижению константы скорости реакции. Однако превалирующим фактором ос-
тается понижение энергии активации, определяющее,
как уже отмечалось, уве-
личение скорости реакции.
В случае стадийного механизма каждая стадия реакции (рис. 2.38, б) име-
ет свою энергию активации
кк
и
aa
E
E
′′′
. Для реакции, протекающей по механиз-
му, схематически представленному уравнениями (2.366), профиль ППЭ (кривая
3) характеризуется наличием двух максимумов, соответствующих активиро-
ванным комплексам отдельных стадий
()
AK
≠
,
()
ABK
≠
, и минимума, соответ-
